Główne pozycje MTKS. Dowód istnienia cząsteczek
Główne postanowienia teorii kinetycznej molekularnej.
jeden). Każda substancja ma strukturę dyskretną (przerywaną). Składa się z najmniejszych cząstek - cząsteczek i atomów oddzielonych odstępami. Cząsteczki są najmniejszymi cząstkami o właściwościach chemicznych tej substancji. Atomy to najmniejsze cząstki o właściwościach elementów chemicznych, które są częścią tej substancji.
2). Cząsteczki są w stanie ciągłym ruchu chaotycznego, zwanego termicznym. Gdy substancja jest ogrzewana, prędkość ruchu ciepła i energii kinetycznej jego cząstek wzrośnie i podczas chłodzenia - zmniejszenie. Stopień ogrzewanego korpusu charakteryzuje się jego temperaturą, która jest miarą średniej energii kinetycznej ruchu translacyjnego cząsteczek tego ciała.
3). Między cząsteczkami w procesie ich interakcji pojawiają się siły przyciągania i odpychania.
^ Uzasadnienie eksperymentalne dla molekularnej teorii kinetycznej
Obecność przepuszczalności, ściśliwości i rozpuszczalności w substancjach wskazuje, że nie są one solidne i składają się z oddzielnych cząstek oddzielonych odstępstw. Z pomocą nowoczesnych metod badawczych (elektronicznych i mikroskopów elektronicznych i jonowych) możliwe było uzyskanie obrazów największych cząsteczek.
Obserwacje Ruchu Browna i dyfuzji cząstek wykazały, że cząsteczki są w ciągłym ruchu.
Obecność siły i elastyczności ciał, zwilżalność, przyczepność, napięcie powierzchniowe w płynach itp. - Wszystko to dowodzi istnieniem oddziaływania między cząsteczkami.
^ Ruch Brown.
W 1827 r. Angielski botanistyczny brązowy, obserwujący pyłek kwiatowy w mikroskopie w wodzie, odkrył, że ziarna pyłku były stale chaotycznie ruchome. Nieuporządkowane zawieszone w ciekłych stałych cząstkach stałych i otrzymał nazwę ruchu Browna. Stwierdzono, że ruch brownów występuje w nieskończoność przez długi czas. Intensywność ruchu cząstek ważona w cieczy nie zależy od substancji tych cząstek i zależy od ich wielkości. Duże cząstki pozostają nieruchomo. Intensywność ruchu brownów wzrasta wraz ze wzrostem temperatury płynów i zmniejsza się wraz ze spadkiem. Cząstki ważone w ruchu płynów pod działaniem cząsteczek płynów, które stoją z nimi. Cząsteczki poruszają się chaotyczne, więc siły, z którymi działają na cząstki zawieszone, są stale zmieniane przez moduł i kierunek. Prowadzi to do błędnego ruchu zawieszonych cząstek. W ten sposób ruch Brownowy wizualnie potwierdza istnienie cząsteczek i chaotycznego charakteru ruchu termicznego. (Ilościowa teoria ruchu Browniego opracowanego w 1905 Einstein.)
Dyfuzjanazywają się zjawiskiem spontanicznej wzajemnej penetracji cząsteczek graniczących wśród nich substancji do siebie w innych odstępach międzyczasowych. (Dyfuzja występująca przez partycje półprzepuszczalne, nazywana jest osmozą.) Przykładem dyfuzji w gazach jest rozprzestrzenianie się zapachów. W płynie, wizualna manifestacja dyfuzji miesza się przed grawitacją grawitacji cieczy o różnej gęstości (z cięższych cząsteczek płynów wznoszą się i łatwiejsze - opuścił się). Dyfuzja występuje w stałych. Dowodzi to takie doświadczenie: dwa polerowane płaskie płyty złota i ołów, umieścić się na siebie, były przechowywane w temperaturze pokojowej przez 5 lat. W tym czasie płytki wzrosły, tworząc jedną całość, a cząsteczki złota wniknęły do \u200b\u200bołów i cząsteczki ołowiu - w złoto na głębokość 1 cm. 1 szybkość dyfuzji zależy od zagregowanego stanu substancji i temperatury. Wraz ze wzrostem temperatury zwiększa się szybkość dyfuzji i zmniejsza się wraz ze spadkiem.
^ Wymiary i waga cząsteczek
Rozmiar cząsteczki jest wartością warunkową. Jest oceniany w następujący sposób. Istnieją również odpychające siły między cząsteczkami wraz z siłami przyciągania, dlatego cząsteczki mogą zbliżyć się tylko do pewnej odległości. Odległość maksymalnego zbliżenia centrów dwóch cząsteczek nazywana jest efektywną średnicą cząsteczki i oznaczono o (jednocześnie konwencjonalnie uważa się, że cząsteczki mają kształt sferyczny). Z wyjątkiem substancji organicznych cząsteczki zawierające bardzo dużą liczbę atomów, większość cząsteczek w kolejności wielkości ma średnicę 10-10 m i masę 10 -26 kg.
^ Względna masa cząsteczkowa
Ponieważ masie atomów i cząsteczek są bardzo małe, w obliczeniach zwykle nie są absolutne, a względne wartości mas otrzymywanych przez porównanie mas atomów i cząsteczek z jednostką masy atomową, która jest wybrana 1/12 części masę atomu węgla (tj. Stosowaną skalę węgla mas atomowych). Molekularny (lub atomowy) Masa M. r. (lub ALE r.) Substancje Zadzwoń do wartości równej stosunku masy cząsteczki (lub atomu) tej substancji do 1/12 masy atomu węgla 12 C. Względna masa molekularna (atomowa) jest wartością, która nie ma wymiaru. Względna masa atomowa każdego elementu chemicznego jest wskazana w tabeli MendeleEV. Jeśli substancja składa się z cząsteczek utworzonych z atomów różnych elementów chemicznych, względna masa cząsteczkowa tej substancji jest równa sumie względnych mas atomowych elementów, które są częścią tej substancji.
^ Liczba substancji
Ilość substancji zawartej w organizmie jest określona przez liczbę cząsteczek w tym korpusie (lub przez liczbę atomów). Ponieważ liczba cząsteczek w organach makroskopowych jest bardzo duża, w celu określenia ilości substancji w organizmie porównują liczbę cząsteczek w tym korpusie z liczbą atomów w 0,012 kg węgla. Innymi słowy, ilość substancji v. Nazywają wartością równą stosunku liczby cząsteczek (lub atomów) N w tym korpusie do liczby atomów N w 12 g węgla, tj.
v. \u003d N / N ZA. . Ilość substancji wyraża się w moli. MOL jest równy liczbie substancji układu zawierającego jak wiele elementów strukturalnych (atomy, cząsteczki, jony), jak zawierające atomy w węgle-12 o wadze 0,012 kg.
^ Stałe avogadro. Masa cząsteczkowa
Zgodnie z definicją koncepcji MOL, w 1 moli dowolnej substancji zawiera taką samą liczbę cząsteczek lub atomów. Jest to numer N A, równa liczbie atomów w 0,012 kg (tj. W 1 mol) węgla nazywana jest stałym avogadro. Masowa molowa M o dowolnej substancji nazywana jest masa 1 mola tej substancji. Masa molowa substancji jest wyrażona w kilogramach na kret.
Ilość substancji można znaleźć jako 
Masa jednej cząsteczki można znaleźć jako  Lub biorąc pod uwagę, że względna masa cząsteczkowa liczbowa jest równa masy jednej cząsteczki wyrażonej w A.M. (1 am. \u003d 1,66 € 10 -27 kg).
Lub biorąc pod uwagę, że względna masa cząsteczkowa liczbowa jest równa masy jednej cząsteczki wyrażonej w A.M. (1 am. \u003d 1,66 € 10 -27 kg).
^ 2. Struktura gazu, cieczy i stałych
Istnieją cztery sumy substancji - stałe, ciekłe, gazowe i plazma.
Jeżeli minimalna potencjalna energia W p of substancja cząsteczki jest znacznie mniejsza niż średnia energia kinetyczna ich ruchu termicznego w k (I. W p\u003e W K, wtedy substancja jest w stanie stałym.
W gazach bez wysokich ciśnienia, a nie niskie temperatury cząsteczka pochodzi od siebie na odległościach, wiele razy wyższa niż ich wymiary. W takich warunkach cząsteczka gazowa nie jest związana z siłami międzycząsteczkowymi przyciągania. Są chaotycznie poruszające się w całym objętości zajmowanym przez gaz. Interakcja cząsteczek gazu występuje tylko w ich kolizji i ze ścianami naczynia, w którym znajduje się gaz. Przekładnia impulsowa w ramach tych kolizji powoduje ciśnienie wytwarzane przez gaz. Odległość, na której cząsteczka przechodzi między dwie kolejne starcia nazywane są długością swobodnego przebiegu cząsteczek. Jeśli cząsteczki gazu składają się z dwóch lub kilku atomów, wtedy, gdy zderzają się, nabywają ruch obrotowy. Tak więc, w gazach cząsteczki tworzą głównie ruch postępowy i rotacyjny.
W cieczach odległość między cząsteczkami jest porównywalna z ich efektywną średnicą. Siły interakcji cząsteczek ze sobą są wystarczająco duże. Cząsteczki płynne wahają się w pobliżu równowagowych pozycji czasowych. Jednak w płynie w P ~ W K, zatem uzyskane przez chaotyczne kolizje przekraczające energię kinetyczną, poszczególne cząsteczki pokonują atrakcyjność sąsiednich cząsteczek i przejść do nowych pozycji równowagi, wokół którego ruchu oscylacyjnego ponownie. Czas cząsteczek płynu płynnego w pobliżu pozycji równowagi jest bardzo mała (około 10 -10 - 10 -12 C), po czym cząsteczki dokonują przejścia na nowe pozycje. W związku z tym cząsteczki płynów tworzą ruch oscylacyjny wokół ośrodków czasowych równowagi i skakają z niektórych pozycji równowagi do innych (z powodu takich ruchów płyn ma płyn i przyjmuje formę naczynia, w którym znajduje się). Cericznie składa się z wielu obszarów mikroskopowych, w których istnieje pewien porządek w lokalizacji pobliskich cząsteczek, które nie jest powtarzane w całym objętości płynu i zmiennych w czasie. Ten rodzaj partycjonowania cząstek jest nazywany w pobliżu.
W stałych odległość między cząsteczkami wynosi nawet mniej niż w cieczach. Siły interakcji cząsteczek stałych między sobą są tak wielkie, że cząsteczki są utrzymywane względem siebie w pewnych stanowiskach i wahani wokół stałych centrów równowagowych. Korpusy stałe są podzielone na krystaliczny i amorficzny. W przypadku korpusów krystalicznych tak zwane kraty krystaliczne są charakterystyczne - zamówione i okresowo powtarzane w układzie przestrzeni cząsteczek, atomów lub jonów. Jeśli spędzasz bezpośrednio w dowolnym kierunku przez dowolnego węzła krystalicznej kraty, wówczas można spełnić inne węzły tej sieci wraz z równą odległością, tj. Struktura ta jest powtarzana w całym objętości korpusu krystalicznego. Ten rodzaj porządku cząstek nazywany jest kolejnością długoterminową. W korpusach amorficznych (szkło, żywica i wiele innych substancji) nie ma sieci dalekości i krystalicznie, co łączy właściwości amorficznych ciał cieczy. Jednakże w amorficznych korpusach cząsteczki wahani w pobliżu tymczasowych pozycji równowagi jest znacznie dłuższy niż w cieczach. W stałych, cząsteczka sprawia, że \u200b\u200bprzeważnie porusza się przewiduje się (choć istnieją również poszczególne cząsteczki poruszające się stopniowo, o czym świadczy zjawisko dyfuzyjne).
^ 3. Doświadcz Stern. Dystrybucja cząsteczek
Cząsteczki gazowe poruszają się z dużymi prędkościami bezpośrednio przed zderzeniem. W temperaturze pokojowej prędkość cząsteczek powietrza osiąga kilkaset metrów na sekundę. Odległość, którą cząsteczki działają średnio z jednego kolizji do drugiego, nazywane jest średnia wolna ścieżka cząsteczek. W cząsteczkach powietrza w temperaturze pokojowej, średnia długość swobodnego przebiegu wynosi około 10-7 m. Ze względu na chaotyczny ruch cząsteczki mają najbardziej różne prędkości. Ale w tej temperaturze można określić prędkość blisko, którą ma największa liczba cząsteczek.
Prędkość , w której znajduje się największa liczba cząsteczek nazywana jest najbardziej prawdopodobną prędkością.
Tylko bardzo mała ilość cząsteczek ma prędkość blisko zera, lub blisko nieskończenie dużej wielkości, wiele razy lepsza od najbardziej prawdopodobnej prędkości. I oczywiście nie ma cząsteczek, których prędkość jest zerowa lub nieskończenie duża. Ale większość cząsteczek ma szybkość blisko najbardziej prawdopodobnych.
Ze wzrostem temperatury wzrostu cząsteczek. Ale ilość cząsteczek z prędkością zbliżoną do najprawdopodobniej maleje, ponieważ rozprzestrzenianie się zwiększa prędkości, ilość cząsteczek wzrasta, których prędkość różnią się znacząco od najbardziej prawdopodobnych. Liczba cząsteczek poruszających się o wysokich prędkościach wzrasta i mniejsza - zmniejsza się. I  z-dla ogromnej ilości cząsteczek w dowolnej objętości gazu ich kierunku ruchu wzdłuż każdej osi współrzędnych jest równie, nawet jeśli gaz jest w stanie równowagi, tj. Nie ma strumieni. Oznacza to, że każdy kierunkowy ruch jednej cząsteczki odpowiada przed skierowanym kierowanym ruchem innej cząsteczki przy tej samej prędkości, tj. Jeśli jedna cząsteczka porusza się na przykład, do przodu, wówczas istnieje inna cząsteczka, która porusza się z taką samą prędkością. Dlatego szybkość ruchu cząsteczek, biorąc pod uwagę ich kierunki, nie można scharakteryzować średnią szybkością wszystkich cząsteczek, zawsze będzie zero, ponieważ prędkość dodatnia, współrzędna, jest skoordynowana z jedną z osi współrzędnych, z negatywny szybkość przeciwznałej tej osi. Jeśli wartości prędkości wszystkich cząsteczek zostaną wzniesione na kwadrat, a następnie wszystkie minusy zniknie. Jeśli, następnie złożyć kwadraty szybkości wszystkich cząsteczek, a następnie podzielone przez liczbę cząsteczek N, tj. Określ średnią, wielkość kwadratów wszystkich cząsteczek, a następnie usunąć pierwiastek kwadratowy z tej wartości, a następnie nie będzie zero i będzie to możliwe opisać szybkość ruchu cząsteczek. Korzeń kwadratowy z średnich wartości prędkości wszystkich cząsteczek nazywany jest ich średnia prędkość kwadratowa.
z-dla ogromnej ilości cząsteczek w dowolnej objętości gazu ich kierunku ruchu wzdłuż każdej osi współrzędnych jest równie, nawet jeśli gaz jest w stanie równowagi, tj. Nie ma strumieni. Oznacza to, że każdy kierunkowy ruch jednej cząsteczki odpowiada przed skierowanym kierowanym ruchem innej cząsteczki przy tej samej prędkości, tj. Jeśli jedna cząsteczka porusza się na przykład, do przodu, wówczas istnieje inna cząsteczka, która porusza się z taką samą prędkością. Dlatego szybkość ruchu cząsteczek, biorąc pod uwagę ich kierunki, nie można scharakteryzować średnią szybkością wszystkich cząsteczek, zawsze będzie zero, ponieważ prędkość dodatnia, współrzędna, jest skoordynowana z jedną z osi współrzędnych, z negatywny szybkość przeciwznałej tej osi. Jeśli wartości prędkości wszystkich cząsteczek zostaną wzniesione na kwadrat, a następnie wszystkie minusy zniknie. Jeśli, następnie złożyć kwadraty szybkości wszystkich cząsteczek, a następnie podzielone przez liczbę cząsteczek N, tj. Określ średnią, wielkość kwadratów wszystkich cząsteczek, a następnie usunąć pierwiastek kwadratowy z tej wartości, a następnie nie będzie zero i będzie to możliwe opisać szybkość ruchu cząsteczek. Korzeń kwadratowy z średnich wartości prędkości wszystkich cząsteczek nazywany jest ich średnia prędkość kwadratowa.  . Z równań fizyki molekularnej wynika z tego
. Z równań fizyki molekularnej wynika z tego  .
.
^ Stern Doświadczenie.
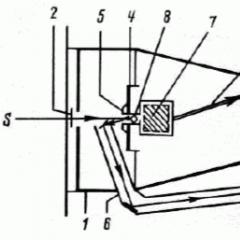
Pierwsze eksperymentalne określenie prędkości cząsteczek przeprowadzono w 1920 r. Przez niemieckiego fizyka O. Stern. Określiła średnią prędkość atomów. Schemat eksperymentalny jest pokazany na FIG.
Dwie koncentryczne powierzchnie cylindryczne 1 i 2 są zamocowane na płaskiej podstawie poziomej, które wraz z podstawą może obracać się wokół osi pionowej OO 1. Powierzchnia 1 Solidna i P  pokonuje 2 ma wąski gniazdo 4, axis równolegle OO 1. Oś ta jest Platinum Posrebrzana drutem 3, przez którą prąd elektryczny jest przekazywany. Cały system znajduje się w komorze, z której powietrze jest porzucane (tj. W próżni). Drut ogrzewany do wysokiej temperatury. Atomy srebrne, odparowanie z jego powierzchni, wypełnij wewnętrzny cylinder 2. Wąska wiązka tych atomów, która przeszła przez szczelinę 4 w ścianie cylindra 2, leci do wewnętrznej powierzchni cylindra 1. Jeśli cylindry są nadal, Atomy srebrne są osadzane na tej powierzchni jako wąski łupnik równoległy (punkt b), (przekrój cylindryczny z płaszczyzną poziomą).
pokonuje 2 ma wąski gniazdo 4, axis równolegle OO 1. Oś ta jest Platinum Posrebrzana drutem 3, przez którą prąd elektryczny jest przekazywany. Cały system znajduje się w komorze, z której powietrze jest porzucane (tj. W próżni). Drut ogrzewany do wysokiej temperatury. Atomy srebrne, odparowanie z jego powierzchni, wypełnij wewnętrzny cylinder 2. Wąska wiązka tych atomów, która przeszła przez szczelinę 4 w ścianie cylindra 2, leci do wewnętrznej powierzchni cylindra 1. Jeśli cylindry są nadal, Atomy srebrne są osadzane na tej powierzchni jako wąski łupnik równoległy (punkt b), (przekrój cylindryczny z płaszczyzną poziomą).
Gdy cylindry prowadzą do obrotu ze stałą prędkością kątową wokół osi OO 1 dla T, podczas których atomy latają z szczeliny do powierzchni cylindra zewnętrznego (tj. Istnieje odległość AV, równa różnica  Promień tych cylindrów) cylindry obracają się do kąta , a atomy są osadzane w postaci paska w innym miejscu (pkt C, fig. B). Odległość między miejscami osadzania atomów w pierwszym iw drugim przypadkach jest s.
Promień tych cylindrów) cylindry obracają się do kąta , a atomy są osadzane w postaci paska w innym miejscu (pkt C, fig. B). Odległość między miejscami osadzania atomów w pierwszym iw drugim przypadkach jest s.
Oznaczać  Średnia prędkość atomów, a V \u003d r jest prędkością liniową cylindra zewnętrznego. Następnie
Średnia prędkość atomów, a V \u003d r jest prędkością liniową cylindra zewnętrznego. Następnie  . Znając parametry instalacji i pomiaru doświadczalnie S, średnia prędkość atomów może być określona średnio. W eksperymencie stwierdzono, że średnia prędkość atomów srebra wynosi 650 m / s.
. Znając parametry instalacji i pomiaru doświadczalnie S, średnia prędkość atomów może być określona średnio. W eksperymencie stwierdzono, że średnia prędkość atomów srebra wynosi 650 m / s.
Góry, gwiazdy, ludzie są wszystkim, co widzimy, składa się z małych atomów. Atomy są małe. Bardzo i bardzo. Od dzieciństwa wiemy, że wszystkie substancje składa się z klastrów tych małych rzeczy. Wiemy również, że nie można ich zobaczyć gołym okiem. Jesteśmy zmuszeni do ślepego uwierz w te stwierdzenia bez konieczności czeku. Atomy współdziałają ze sobą i na cegły stanowią nasz świat. Jak to wiemy? Wielu nie lubi adoptować naukowców czystych monet. Chodźmy, wraz z nauką, przekazuje ścieżkę ze świadomości atomów do najbliższego dowodu ich istnienia.
Może się wydawać, że istnieje łatwy sposób, aby udowodnić istnienie atomów: wepchnij je pod mikroskopem. Ale to podejście nie będzie działać. Nawet najpotężniejsze mikroskopy koncentrujące światło może wizualizować jeden atom. Obiekt staje się widoczny, ponieważ odzwierciedla fale świetlne. Atomy są tak mniejsze niż długość fali widocznego światła, w której nie współdziałają. Innymi słowy, atomy są niewidoczne nawet na światło. Jednak atomy nadal obserwowały wpływ na niektóre rzeczy, które możemy zobaczyć.

Setki lat temu, w 1785 r. Holenderski naukowiec Yang Ingenhauz studiował dziwne zjawisko, które nie mogło zrozumieć. Najmniejsze cząstki pyłu węglowego wkradają się na powierzchni niektórych alkoholu w swoim laboratorium.
50 lat później, w 1827 r., Szkocki botanik Robert Brown opisał coś zaskakująco podobnego. Studiowanie granulek pyłkowych pod mikroskopem, brąz stwierdził, że niektóre granulki emitują małe cząstki - które następnie usunięto z pyłku w losowym tańcu nerwowym.
Początkowo Browney pomyślał, że cząstki były pewnym nieznanym organizmem. Powtórzył eksperyment z innymi substancjami, jak kamienny pył, który był wyraźnie inanger, a znowu zobaczył dziwny ruch.
Trwało prawie sto lat, więc nauka znajdzie wyjaśnienie. Einstein przyszedł i opracował formułę matematyczną, która przewidział bardzo specjalny rodzaj ruchu - następnie zwany ruchem Brown, na cześć Roberta Browna. Teoria Einsteina polegała na tym, że cząstki granulek pyłkowych były stale poruszane, ponieważ miliony maleńkich cząsteczek wody zostały usunięte w nich - cząsteczki składające się z atomów.
"Wyjaśnił, że jest to ruch nerwowy, który obserwujesz, faktycznie spowodował wpływ poszczególnych cząsteczek wody na cząstkach pyłu lub tego, co masz," wyjaśnia Harry Cliff z University of Cambridge, także kurator Muzeum Nauki w Londynie .
Do 1908, obserwacje, wspierane przez obliczenia, pokazały, że atomy są prawdziwe. Od dziesięciu lat fizyka została znacznie zaawansowana. Rozciąganie indywidualnych atomów, zaczęli rozumieć ich wewnętrzną strukturę.
Niespodziło to, że atomy można podzielić - zwłaszcza w świetle faktu, że nazwa "atom" wyszła z greckiego "atomu", co oznacza "niepodzielny". Ale fizycy wiedzą teraz, że atomy są dalekie od podstawowych cegieł. Składają się z trzech głównych części: protonów, neutronów i elektronów. Wyobraź sobie, że protony i neutrony razem tworzą "słońce" lub jądro, w środku systemu. Elektrony znajdują się w orbicie tego jądra, jak planety.

Jeśli niewyobrażalne atomy są małe, a te subultomiczne cząstki są w ogóle. To zabawne, ale pierwszy znaleziono najmniejszą cząstkę trzech elektronów. Aby zrozumieć różnicę w rozmiarach, pamiętaj, że protony w jądrze są 1830 razy więcej elektronów. Wyobraź sobie Chup Chups w orbicie balonu powietrza - rozbieżność będzie w przybliżeniu.
Ale jak dowiedzieliśmy się, że te cząstki są tam? Odpowiedź jest to, że są mała, ale mają świetny wpływ. Brytyjski fizyk Thomson, który otworzył elektrony, wykorzystał doskonałą metodę udowodnienia ich istnienia w 1897 roku.
Miał rurkę Crox - kawałek szklanki śmiesznej formy, z której samochód został zasysany prawie wszystkie powietrze. Do jednego końca rury podsumowano negatywny ładunek elektryczny. Opłata ta wystarczyła, aby znokautować część elektronów w lewo w rurze gazowej w cząsteczkach. Elektrony są naliczane negatywnie, więc polecieć na inny koniec rury. Dzięki częściowej próżni elektrony poleciały przez rurkę bez napotykania dużych atomów w drodze.
Ładowanie elektryczne doprowadziło do faktu, że elektrony przemieszczały się bardzo szybko - około 59 500 kilometrów na sekundę - dopóki nie rozbili się do szkła na drugim końcu, znokautowali jeszcze więcej elektronów, które ukrywały się w swoich atomach. Zaskakująco, kolizja między tymi zapierającymi się drobnymi cząstkami wytwarzała tyle energii, że dał początek fantastycznej zielono-żółtej blasku.

"W pewnym sensie był jeden z pierwszych akceleratorów cząstek" - mówi Cliff. - Przyspiesza elektrony na jednym końcu rury do drugiego, a oni są rozbijane do ekranu na drugim końcu, wytwarzając blask fosforyzujący. "
Ponieważ Thomson odkrył, że mógł kontrolować belki elektronowe z magnesami i polami elektrycznymi, wiedział, że nie było to tylko dziwne promienie światła, były one naładowane cząstki.
A jeśli jesteś zainteresowany tym, jak te elektrony mogą latać niezależnie od ich atomów, jest to spowodowane procesem jonizacji, w którym - w tym przypadku ładunek elektryczny zmienia strukturę atomu, pukając elektrony w przestrzeń w pobliżu.
W szczególności, ze względu na fakt, że elektrony są tak łatwe do manipulowania i poruszania, obwody elektryczne stały się możliwe. Elektrony w drucie miedzianym poruszają się jak pociąg z jednego atomu miedzianego do drugiego - dlatego drut jest przesyłany przez drut. Atomy, jak już powiedzieliśmy, nie są to solidne kawałki substancji, ale systemy, które można modyfikować lub zdemontować na elementach strukturalnych.

Otwarcie elektronów pokazało, że musisz dowiedzieć się o atomach bardziej. Praca Thomsona wykazała, że \u200b\u200belektrony są naładowane naładowane - ale wiedział, że same atomy nie mają wspólnego opłat. Zasugerował, że powinny zawierać tajemnicze pozytywnie naładowane cząstki, aby zrekompensować niekorzystnie naładowane elektrony.
Początek XX wieku ujawnił te pozytywnie naładowane cząstki, a jednocześnie ujawniły wewnętrzną strukturę atomu - podobny do układu słonecznego.
Ernest Rutherford i jego koledzy wzięli bardzo cienką metalową folię i umieścili go pod wiązką pozytywnie naładowanego promieniowania - przepływ drobnych cząstek. Większość potężnych promieniowania przepływała, jak uważa, że \u200b\u200brefordford, biorąc pod uwagę grubość folii. Ale do zaskoczenia naukowców część go odbiła.
Rutherford zasugerował, że atomy w metalowej folii powinny zawierać małe gęste obszary o ładunku dodatnim - nic innego nie miałoby wystarczającego potencjału, aby odzwierciedlić takie potężne promieniowanie. Odkrył pozytywne opłaty w atomie - i jednocześnie udowodniono, że wszystkie są one połączone w gęstej mszy, w przeciwieństwie do elektronów. Innymi słowy, wykazał istnienie gęstego jądra w atomie.
Był problem. Zanim móc już obliczyć masę atomu. Ale biorąc pod uwagę dane, co poważnie powinno być cząsteczki jądra, idea tego, co wszyscy byli dodatnio oskarżani nie miały sensu.
"Węgiel ma sześć elektronów i sześć protonów w jądrze - sześć dodatnich ładunków i sześciu ładunków ujemnych", wyjaśnia klif. - ale rdzeń węglowy nie waży sześć protonów, waży równowartość 12 protonów. "
Początkowo sugerowali, że istnieje sześć innych cząstek jądrowych w rdzeniu z masą protonową, ale naładowaniem: neutrony. Ale nikt nie mógł tego udowodnić. W rzeczywistości neutrony nie można znaleźć do lat 30. XX wieku.

Cambridge fizyk James Chadwick rozpaczliwie próbował otworzyć neutron. Przez wiele lat pracował nad tą teorią. W 1932 r. Udało mu się przeprowadzić przełom.
Kilka lat przed tym, inni fizycy eksperymentowali z promieniowaniem. Uruchomili pozytywnie naładowany promieniowanie - typ, który bootford stosowany w poszukiwaniu jądra - w atomach berylowych. Beryl emitował swój własny promieniowanie: promieniowanie, które nie było pobierane pozytywnie ani negatywnie i może przeniknąć głęboko w materiale.
Do tego czasu inni stwierdzili, że promieniowanie gamma było neutralne i penetrowane głęboko, więc fizycy wierzyli, że były emitowane atomy berylowe. Ale Chadwick tak nie myślał.
Niezależnie odbył nowe promieniowanie i wysłał go do substancji, która, jak wiedział, był bogaty w protony. Nagle okazało się, że protony zostały wynagrane z materiału, jak gdyby cząsteczki z identyczną masową kulą dla billiardów z innymi kulkami.
Promieniowanie gamma nie może odzwierciedlać protonów w ten sposób, dlatego Cedwick zdecydował, że pożądane cząstki powinny mieć masę protonową, ale kolejny ładunek elektryczny: i są one neutrony.
Znaleziono wszystkie główne cząstki atomu, ale na tej historii się nie kończy.
Chociaż dowiedzieliśmy się o atomach o wiele więcej niż wiedział wcześniej, było trudne do ich wizualizacji. W latach 30. XX wieku nikt nie miał zdjęć swoich zdjęć - a wielu ludzi chciało zobaczyć ich, aby wziąć ich istnienie.
Ważne jest jednak, aby zauważyć, że metody stosowane przez naukowców, takich jak Thomson, Rutherford i Chadwick, położyli drogę do nowego sprzętu, które ostatecznie pomogły nam zrobić te zdjęcia. Belki elektronowe, które Thomson generowane w eksperymencie z rurką Crox, okazały się szczególnie przydatne.
Obecnie takie wiązki są generowane przez mikroskopy elektronowe, a najpotężniejszy z takich mikroskopów może robić zdjęcia indywidualnych atomów. Dzieje się tak dlatego, że belka elektronowa ma długość fali w tysiącach razy krótsza z wiązki światła jest tak krótka, w rzeczywistości, fale elektronów można odzwierdzić od małych atomów i podać obraz, które wiązki światła nie mogą.
Neil Skipper z University College w Londynie mówi, że takie obrazy są przydatne dla osób, które chcą zbadać strukturę atomową substancji specjalnych - takich jak na przykład stosowane w produkcji baterii pojazdów elektrycznych, na przykład. Im więcej wiemy o swojej strukturze atomowej, tym lepiej możemy zaprojektować baterie, sprawiają, że są skuteczne i niezawodne.
Możesz również zrozumieć, jak wyglądają atomy, po prostu pompując je do nich. Tak, w rzeczywistości działa mikroskopia siły atomowej.

Ideą jest doprowadzenie końcówki niezwykle małej sondy do powierzchni cząsteczki lub substancji. Wraz z wystarczającą bliskość sonda będzie wrażliwa na strukturę chemiczną tego, co wskazuje, a zmiana oporu jako ruch sondy pozwoli naukowcom wykonać zdjęcia, na przykład oddzielną cząsteczkę.
Skipper dodaje, że wiele naukowców jądrowych zbadających, w jaki sposób zmienia się struktura rzeczy po wystawieniu na wysoki ciśnienie lub temperaturę. Większość ludzi wie, że gdy substancja jest ogrzewana, często się rozszerza. Teraz można znaleźć zmiany atomowe, które występują w tym samym czasie, co często okazują się przydatne.
"Gdy płyn jest ogrzewany, można zauważyć, że jego atomy podejmują nieuporządkowaną konfigurację", mówi Skipper. - Możesz go zobaczyć bezpośrednio z karty strukturalnej. "
Skipper i inni fizycy mogą również pracować z atomami za pomocą belek neutronów, najpierw odkryty przez próbkę w latach trzydziestych.
"Uruchamiamy wiele wiązek neutronów do próbek materiałów, a od powstałego wzoru rozproszenia, możesz zrozumieć, że rozpraszasz neutrony w jądrach", mówi. - Możesz z grubsza oszacować masę i rozmiar obiektu, który jest tłumaczony. "
Ale atomy nie zawsze są tam, w stabilnym stanie, czekając na nich, dopóki się nie studiują. Czasami rozpadają się - to znaczy, są radioaktywne.
Istnieje wiele naturalnych elementów radioaktywnych. Proces ten generuje energię, która utworzyła podstawę mocy jądrowej - i bomb jądrowych. Producenci fizyki-jądrowych starają się lepiej zrozumieć reakcje, w których jądro przechodzi przez podstawowe zmiany takich.

Laura Harches-Brennan z Uniwersytetu Liverpoolu specjalizuje się w nauce promieni gamma - rodzaj promieniowania emitowanego przez rozkładające atomy. Radioaktywny atom pewnego typu emituje specjalną formę belki gamma. Oznacza to, że możesz zidentyfikować atomy, tylko poprzez rejestrację energii promieni gamma - w rzeczywistości Harkness Brennan i jest zaangażowany w jego laboratorium.
"Rodzaje detektorów, których potrzebujesz, są reprezentowane przez detektorów, które pozwolą Ci zmierzyć obecność promieniowania i energii promieniowania jednocześnie, co zostało przełożone", mówi. "Wszystko, ponieważ wszystkie rdzenie mają specjalny nadruk".
Ponieważ w obszarze, w którym wykryto promieniowanie, wszystkie rodzaje atomów mogą być obecne, zwłaszcza po poważnej reakcji jądrowej, ważne jest, aby dokładnie wiedzieć, które radioaktywne izotopy są obecne. Takie wykrywanie jest zwykle prowadzone na stacjach jądrowych lub w strefach, w których wystąpiła katastrofa nuklearna.
Harkness Brennan i jej koledzy pracują obecnie nad systemami Discovery, które można umieścić w miejscach, aby pokazać w trzech wymiarach, w których może być obecna promieniowanie w danym pokoju. "Potrzebujesz techników i narzędzi, które pozwalają na wykonanie trójwymiarowej mapy przestrzeni i monitu, gdzie w tym pokoju, w tym promieniowaniu rur", mówi.
Możesz także wizualizować promieniowanie w aparacie Wilson. W ramach tego specjalnego eksperymentu chłodzone do -40 stopni Celsjusza para alkoholowa jest rozpylana chmurą na źródła radioaktywnego. Naładowane cząstki promieniowania pływające z źródła promieniowania są znokautowane elektrony z cząsteczek alkoholowych. Alkohol jest skondensowany do cieczy obok ścieżki emitowanych cząstek. Wyniki tego rodzaju wykrywania są imponujące.
Niewiele pracowaliśmy bezpośrednio z atomami - z wyjątkiem tego, że są to piękne złożone struktury, które mogą przejść niesamowite zmiany, z których wiele występuje w naturze. Studiowanie atomów w ten sposób ulepszamy własne technologie, usuwamy energię z reakcji jądrowych i lepiej zrozumieć naturalny świat wokół nas. Dostaliśmy również możliwość ochrony przed promieniowaniem i badaniem, jak zmieniają się substancje w ekstremalnych warunkach.
"Biorąc pod uwagę, jak mała atmosfera jest po prostu niesamowita, jak najwięcej fizyki możemy z niego wyodrębnić" Harkness-Brennan jest niczym. Wszystko, co widzimy wokół siebie, składa się z tych najmniejszych cząstek. I dobrze jest wiedzieć, że są tam, ponieważ było to dzięki ich wokół, stała się możliwa.
Zgodnie z BBC.
Teoria J. Dalton
Pierwsze prawdziwie naukowe uzasadnienie teorii atomistycznej, przekonująco wykazującą racjonalność i prostotę hipotezy, że każdy element chemiczny składa się z najmniejszych cząstek, które przyszły prace nauczyciela szkolnego w języku Matematyki J. Dalton (1766-1844), Artykuł na ten problem pojawił się w 1803 r. Postulaty atomowe Daltona miały przewagę nad abstrakcyjnymi argumentami starożytnych greckich atomów, że jego prawa pozwoliły wyjaśnić i łączyć wyniki rzeczywistych eksperymentów, a także przewiduje wyniki nowych eksperymentów. Postułował, że: 1) Wszystkie atomy tego samego elementu są identyczne pod każdym względem, w szczególności ich mas; 2) atomy różnych elementów mają nierówne właściwości, w szczególności ich masę; 3) do związku, w przeciwieństwie do elementu, zawiera pewne atomy całkowite każdego ze składników elementów; 4) W reakcjach chemicznych może wystąpić redystrybucja atomów, ale żaden atom nie zostanie zniszczony i nie jest ponownie utworzony. (W rzeczywistości, jak okazało się na początku XX wieku, postulaty te nie są dość ściśle przeprowadzane, ponieważ atomy tego samego elementu mogą mieć różne masy, na przykład, wodór ma trzy takie typy, zwane izotopami; dodatkowo , Atomy mogą przejść transformacje radioaktywne, a nawet całkowicie zawalić się, ale nie w reakcjach chemicznych uważanych za Dalton.) Teoria atomowa Dalton na podstawie tych czterech skoczków dała najłatwiejszym wyjaśnieniem praw stałych i wielu stosunków. Jednak nie dała żadnych pomysłów na temat struktury samej atomu.
Ruch Brown
Scottish Nerd Robert Brown w 1827 r. Przeprowadził pyłek roślin. W szczególności był zainteresowany tym, jak pyłek uczestniczy w procesie zapłodnienia. W jakiś sposób spojrzał na mikroskopu odizolowane z komórek pyłku ważonego w podłużnej wodzie ziarna cytoplazmatyczne. Niespodziewanie, brązowy zobaczył, że najmniejsze solidne ziarna, które trudno widać w kropli wody, stale drżą i przenieśli się z miejsca na miejsce. Odkrył, że te ruchy, zgodnie z nim, "nie są związane z żadnym płynem w cieczy, ani ze stopniowym parowaniem, ale nieodłącznymi cząstkami." Zjawisko obserwowane w ruchu Brownie nazwie "Ruch Browna". Wyjaśnienie ruchu Browniego przez ruch niewidzialnych cząsteczek zostało udzielane tylko w ostatnim kwartale XIX wieku, ale nie natychmiast zabrano przez wszystkich naukowców. W 1863 r. Nauczyciel geometrii opisowej Ludwig Chrześcijański Wiener (1826-1896) zasugerował, że zjawisko jest związane z przemianami oscylacyjnymi niewidzialnych cząstek.
Otwieranie elektronu.
Prawdziwe istnienie cząsteczek zostało ostatecznie potwierdzone w 1906 r. Przez eksperymenty na badaniu wzorców Ruchu Browna Physics Figlish Jean Pereren.
W okresie, w którym Perren przeprowadził swoje badania katody i rentgenowskie, nie było jeszcze jednej opinii na temat charakteru promieni katodowych emitowanych przez negatywną elektrodę (katoda) w rurze próżniowej z wyładowanią elektryczną. Niektórzy naukowcy uważali, że promienie te są rodzajem promieniowania światła, jednak w 1895 r. Badania Perenna wykazały, że są one przepływem naładowało naładowanych cząstek. Teoria atomowa argumentowała, że \u200b\u200belementy składają się z dyskretnych cząstek zwanych atomami, a związki chemiczne składają się z cząsteczek, cząstki większego rozmiaru zawierającego dwa lub więcej atomów. Do końca XIX wieku. Teoria atomowa zdobyła szerokie uznanie wśród naukowców, zwłaszcza wśród chemików. Jednak niektórzy fizycy uważali, że atomy i cząsteczki to nie więcej niż fikcyjne obiekty, które są wprowadzane z rozważań wygody i są przydatne w numerycznym przetwarzaniu wyników reakcji chemicznych.
Joseph John Thomson, modyfikując eksperyment z piór, potwierdził jego wnioski, aw 1897 r. Określono najważniejszą cechę tych cząstek, pomiaru stosunku ich ładunku do masy do odstępstwa w polach elektrycznych i magnetycznych. Msza okazała się około 2 tysięcy razy mniej niż masa atomu wodoru, najlżejsza wśród wszystkich atomów. Wkrótce przekonano, że te negatywne cząstki zwane elektronami były integralną częścią atomów.
Proces wiedzy rozwija się w taki sposób, że genialne domysły i wspaniałe teorie, pojawienie się, z którymi jesteśmy zobowiązani do kreatywnych geniuszy, po pewnym czasie nie stają się trywialne fakty, że większość ludzi jest brana na wiarę. Wielu z nas może samodzielnie, na podstawie obserwacji i refleksji, zgadnij, że ziemia jest okrągła lub że ziemia obraca się wokół słońca, a nie odwrotnie, a wreszcie, że istnieją atomy i cząsteczki? Z wysokości nowoczesnej nauki główne stanowiska teorii molekularnej atomowej wyglądają z prawdami kapitałowymi. Jednak rozprasza się od dawnych wyników naukowych, umieścić się do miejsca naukowców przeszłości i próbować odpowiedzieć na dwie główne kwestie. Po pierwsze, jaka jest substancja? Po drugie, dlaczego substancje są różne i dlaczego niektóre substancje mogą zamienić się w innych? Aby rozwiązać te złożone kwestie, nauka wydała już ponad 2000 lat. W rezultacie pojawił się atomowa teoria molekularna, główne przepisy można sformułować w następujący sposób.
- 1. Wszystkie substancje składają się z cząsteczek. Cząsteczka jest najmniejszą cząstką substancji o jego właściwościach chemicznych.
- 2. Cząsteczki składają się z atomów. Atom jest najmniejszą cząstką elementu związków chemicznych. Różne elementy odpowiadają różnym atomom.
- 3. Cząsteczki i atomy są w ciągłym ruchu.
- 4. W przypadku reakcji chemicznych cząsteczki samych substancji są przekształcane w cząsteczki innych substancji. Atomy podczas reakcji chemicznych nie zmieniają się.
Jak naukowcy odgadli istnienie atomów?
Atomy zostały wymyślone w Grecji w V C. pne mi. Filozofer Levkipp (500-440 pne) zastanawiał się, czy każdy kawałek materii może być, niezależnie od tego, co było, podzielone na jeszcze mniejsze cząstki. Levkipp wierzył, że w wyniku tego podziału możliwe jest uzyskanie tak małej cząstki, że dalszy podział stanie się niemożliwy.
Student Philozofera Filozofa Lewkipp (460-370 pne ER) nazywane tymi drobnymi cząstkami "atomami" (Atom - niepodzielny). Uważał, że atomy każdego elementu są szczególnie wymiarami i formą i że wyjaśniono różnice w nieruchomościach substancji. Substancje, które widzimy i odczuwamy, są utworzone, gdy atomy są połączone między atomami różnych elementów, a przez zmianę charakteru tego związku, jedna substancja może być przekształcona w inny.
Demokrytu stworzył teorię atomową prawie w nowoczesnej formie. Jednak ta teoria była jedynie owocami refleksji filozoficznych, które nie są związane z naturalnymi zjawiskami i procesami. Nie został potwierdzony eksperymentalnie, ponieważ starożytni Grecy w ogóle nie przeprowadzili eksperymentów, ustawiają refleksje nad obserwacjami.
Pierwszy eksperyment potwierdzający atomowy charakter substancji przeprowadzono dopiero po 2000 roku. W 1662 r. Irlandzki chemik Robert Boyle'a (1627-1691) przy ściskaniu powietrza w probówce w kształcie litery U pod ciśnieniem kolumny rtęci stwierdzono, że objętość powietrza w rurze jest odwrotnie proporcjonalna do ciśnienia:
Francuski fizyk EDM Mariott (1620-1684) potwierdził ten stosunek 14 lat po kotle i zauważył, że przeprowadzono tylko w stałej temperaturze.
Wyniki uzyskane przez kotła i Mariott można wyjaśnić tylko wtedy, gdy rozpoznają, że powietrze składa się z atomów między których istnieje pusta przestrzeń. Kompresja powietrza wynika ze zbliżenia atomów i zmniejszenie ilości pustej przestrzeni.
Jeśli gazy składają się z atomów, można założyć, że ciała stałe i ciecze składają się również z atomów. Na przykład, woda z ogrzewaniem wrzenia i zamienia się w parę, która, jak powietrze, może być skompresowany. Więc para wodna składa się z atomów. Ale jeśli para wodna składa się z atomów, dlaczego płynna woda i lód nie mogą składać się z atomów? A jeśli jest to prawdą dla wody, może to być prawdą dla innych substancji.
Tak więc eksperymenty Boyle'a i Mariotty potwierdziły istnienie najmniejszych cząstek substancji. Pozostało to, aby dowiedzieć się, co są te cząstki.
W ciągu najbliższych 150 lat wysiłki chemików skierowano głównie do ustanowienia składu różnych substancji. Substancje, które rozmieszczone mniej złożone substancje zostały wymienione związki (złożone substancje), takie jak woda, dwutlenek węgla, skala żelaza. Substancje, których nie można rozłożyć, nazywane są pierwiastkami (proste substancje), takie jak wodór, tlen, miedź, złoto.
W 1789 r. Wielki francuski chemik Antoine Laurent Lavoisier (1743-1794) opublikował słynną książkę "Kurs Elemental Chemistry" (Traite Elementeaire de Chimie), w którym ulegała nam się zgromadzona przez czas chemii. W szczególności poprowadził listę wszystkich znanych elementów, które zawierały 33 substancje. Dwie nazwy na tej liście były zasadniczo błędne (lekkie i cieplne), a osiem były następnie wyrafinowanych substancji (wapno, krzemionka i inne).
Rozwój technik pomiarów ilościowych i metod analizy chemicznej umożliwiły określenie stosunku elementów związków chemicznych. Chemik francuski Józef Louis Prost (1754-1826) po dokładnych eksperymentach z liczbą ustalonych substancji prawo stałości kompozycji.
I wszystkie związki, niezależnie od sposobu odbioru, zawierają ELE-. gliniarze w ściśle określonych proporcjach masy.
Na przykład, gaz siarkowy otrzymany przez spalanie siarki, działanie kwasów do siarczków lub w dowolnym innym sposobie zawsze zawiera 1 część wagi (frakcja masowa) siarki i 1 waga tlenu.
Pondan przeciwnik, francuski chemik Claude Louis Bertoll (1748-1822), wręcz przeciwnie, twierdził, że skład związków zależy od sposobu ich odbioru. Uważał, że jeśli w reakcji dwóch elementów, jeden z nich został podjęty w nadmiarze, ciężar tego elementu byłby również bardziej w związku. Proust udowodnił jednak, że Bertoll stał się błędnymi wynikami z powodu niedokładnej analizy i stosowania niewystarczająco czystych substancji.
Niespodziewanie, błędna idea Bertolls jest obecnie oparta na dużym kierunku naukowym w chemii - nauka o materiałach chemicznych. Głównym zadaniem materialnych naukowców jest uzyskanie materiałów o określonych właściwościach, a głównym sposobem jest stosowanie zależności kompozycji, struktury i właściwości materiału z metody uzyskania.
Prawo stałości kompozycji, otwarte przez Prousta, miało fundamentalne znaczenie. Prowadził do myśli istnienia cząsteczek i potwierdził niepodzielność atomów. W rzeczywistości stosunek w stosunku do gazu siarki S02 (masa) siarki i tlenu wynosi zawsze 1: 1, a nie 1.1: 0,9 lub 0,95: 1,05? Można założyć, że w powstawaniu cząstki gazu siarkowego (następnie cząstka ta nazywano cząsteczką) Atom siarki łączy się z pewną liczbą atomów tlenu, z masą atomów siarki równych masom atomów tlenu.
Co się stanie, jeśli dwa elementy mogą tworzyć kilka połączeń chemicznych między sobą? Wielki angielski chemik John Dalton (1766-1844) został odpowiedział na to pytanie, które sformułowane z eksperymentu prawo wielu relacji (Akt Daltonu).
I Jeśli dwa elementy tworzą wtedy kilka połączeń. W tych związkach masa jednego elementu na jednostkę masy innego elementu należy jak małe liczby całkowite.
Tak więc, w trzech tlenkach żelaza na jednostkę wagi (masa) tlenu, istnieje odpowiednio 3,5, 2,625 i 2,333 części (frakcje masowe). Relacje tych liczb są następujące: 3,5: 2.625 \u003d 4: 3; 3.5: 2.333 \u003d 3: 2.
Z prawa wielu relacji wynika, że \u200b\u200batomy elementów są podłączone do cząsteczek, a cząsteczki zawierają niewielką liczbę atomów. Pomiar masowej zawartości elementów umożliwia, z jednej strony, w celu określenia wzorów molekularnych związków, a z drugiej strony - w celu znalezienia względnych mas atomów.
Na przykład, w powstawaniu wody, jedna część wodoru łączy się z 8 częściami ważenia tlenu. Jeśli założymy, że cząsteczka wody składa się z jednego atomu wodoru i jednego atomu tlenu, okazuje się, że atom tlenu jest 8 razy cięższy niż atom wodoru.
Rozważ zadanie odwrotnego. Wiemy, że atom żelaza wynosi 3,5 razy cięższy niż atom tlenu. Z relacji
wynika z tego, że w tym związku, dwa atomy tlenu stanowią trzy atomy tlenu, tj. Wzór związek - Fe 2 0 3.
Dlatego Dalton skompilował pierwszy w historii tabeli ciężarów atomowych elementów. Niestety, okazało się nieprawidłowe pod wieloma względami, ponieważ przy określaniu ciężarów atomowych Dalton często przystąpił z niewłaściwych formuł molekularnych. Uważał, że atomy elementów są prawie zawsze (z rzadkimi wyjątkami) są połączone parami. Woda formuła na Dalton - ale. Ponadto był przekonany, że cząsteczki wszystkich prostych substancji zawierają jeden atom.
Prawidłowe wzory wody i wielu innych substancji określono w badaniu reakcji chemicznych w fazie gazowej. Chemor francuski Joseph Louis Gay-Loursak (1778-1850) odkrył, że jeden objętość wodoru reaguje z jedną objętością chloru i otrzymuje się dwie objętości produktów chlorkowych; Z elektrolityczną rozkład wodą, jedna objętość tlenu i dwie objętości wodoru są tworzone itp. Ta reguła empiryczna została opublikowana w 1808 roku i została wywołana prawo stosunków objętościowych.
I objętość reakcji gazów należą do siebie i do woluminów gazu. Produkty reakcji mody jako małe liczby całkowite.
Znaczenie prawa stosunków objętości okazało się po wielkim otwarciu włoskiego chemiku Amedeo Avogadro (1776-1856), który sformułował hipotezę (założenie), który później został nazwany później prawo Avogadro.
|. W równych ilościach jakichkolwiek gazów w stałej temperaturze i ciśnienia? Zawiera taką samą liczbę cząsteczek.
Oznacza to, że wszystkie gazy zachowują się w pewnym sensie równo i że objętość gazu w danych warunkach nie zależy od natury (kompozycji) gazu, ale jest określona tylko przez liczbę cząstek w tej kwoty. Objętość pomiaru, możemy określić liczbę cząstek (atomy i cząsteczki) w fazie gazowej. Wielką zasługą Avogadro jest to, że w stanie ustanowić prosty związek między obserwowaną wartość makroskopową (objętością) i właściwości mikroskopowymi substancji gazowych (numer cząstek).

Analizowanie wskaźników objętościowych znalezionych przez Gay Lussak i przy użyciu jego hipotezy (następnie wywołano prawo Avhipa), Naukowiec odkrył, że cząsteczki gazowe prostych substancji (tlen, azot, wodór, wodór, chlor). Rzeczywiście, z reakcją wodoru z chlorą, głośność nie zmienia się, dlatego liczba cząstek nie zmienia się również. Jeśli zakładamy, że monatominę wodoru i chloru, w wyniku reakcji załącznika, początkowo objętość powinna zmniejszyć dwukrotnie. Ale po reakcji objętość nie zmienia się, oznacza to, że cząsteczki wodoru i chlor zawierają dwa atomy, a reakcja podąża za równaniem
Podobnie można ustalić wzory molekularne kompleksowych substancji - wody, amoniaku, dwutlenku węgla i innych substancji.
Coś dziwnego, ale współczesne nie doceniły i nie uznały wniosków dokonanych przez Avogadro. Czołowe chemicy w czasie J. Dalton i Jans Jacob Berzelius (1779-1848) sprzeciwili się założeniu, że cząsteczki prostych substancji mogą być dwutlenek, ponieważ uważano, że cząsteczki powstały tylko z różnych atomów (pozytywnie i negatywnie naliczane) . Pod presją takich organów hipoteza Avogadro została odrzucona i stopniowo zapomniana.
Dopiero w 1858 r. W 1858 r. W 1858 r. Włoski chemik Stanislao Canniczaro (1826-1910) przypadkowo odkrył pracę Avogadro i zdał sobie sprawę, że pozwala nam wyraźnie odróżnić koncepcję "atomu" i "cząsteczki" dla substancji gazowych. Był Cannizaro, który zaproponował definicje atomów i cząsteczek, które są prezentowane na początku tego ustępu i dokonały całkowitej jasności w koncepcji "wagi atomowej" i "masa cząsteczkowego". W 1860 r. Odbyło się pierwsze międzynarodowe kongres chemiczny w Karlsruhe (Niemcy), przy czym po długim dyskusjom, główne przepisy teorii molekularnej atomowej zostały przyjęte przez powszechne uznanie.
Podsumujmy. W opracowywaniu nauk molekularnych atomowych można wyróżnić trzy fundamentalne etapy.
- 1. Narodziny nauczania atomowego, pojawienie się pomysłu (hipoteza) na temat istnienia atomów (levkipp i demokrytek).
- 2. Pierwsze doświadczalne potwierdzenie teorii atomowej w eksperymentach ze sprężonym powietrzem (Prawo Boyle-Mariotta).
- 3. Otwarcie ważnego wzorca, który na atomach cząsteczkowych różnych elementów występuje w pewnych stosunkach masy (prawo wielu stosunków między Daltonem) oraz ustanowienie wzorów gazowych prostych substancji (hipoteza avogadro).
Co ciekawe, gdy sugerowano, że wyrażono istnienie atomów, teoria wyprzedziła się z eksperymentu (wynaleziono pierwsze atomy, a po 2000 r. Udowodniono). W przypadku cząsteczek eksperyment był przed teorią: Idea istnienia cząsteczek została nominowana do wyjaśnienia prawa eksperymentalnego wielu stosunków. W tym sensie historia teorii molekularnej atomowej jest charakterystycznym przykładem, który odzwierciedla różne ścieżki odkryć naukowych.
Albert Einstein.
Często zasługa Albert Einsteina uważa się tylko za stworzenie teorii względności. Z punktu widzenia historii nauki, taka ocena jest nieprawidłowa i nieuczciwa w odniesieniu do jego wspaniałych osiągnięć w innych dziedzinach fizyki. "Ojciec teorii względności" był naukowcem z wyłącznie wielostronnymi interesami.
W spalaniu lat, w czasie najbardziej burzliwej działalności kreatywnej Einsteina, pierwsze wyniki swoich badań były prawie jednocześnie, którzy miały ogromne znaczenie dla dalszego rozwoju fizyki. Szczególnie owocni okazało się 1905, kiedy Einstein miał 26 lat. Jego badania na temat fizyki molekularnej były chronologicznie pierwsze.
Praca Einsteina na ruchu termicznym poświęcona jest głównie problemem statystycznym opisu ruchu atomów i cząsteczek oraz relacji między ruchem a ciepłem. W tych pracach Einstein doszedł do wniosków znacznie rozszerzając wyniki uzyskane przez pomysłowy austriacki fizyk Ludwig Boltzmann i Amerykańskie Gibbs Gibbs. Główna zasługa Einsteina nie była tak duża przywiątych trudności matematycznych, jak w głębszej sformułowaniu kwestii fizycznych. Został kierowany przez ideę Boltzmanny, że koncepcja prawdopodobieństwa powinna opierać się na matematycznej interpretacji nauczania na ciepło (zasada Boltzmanna).
Wszystkie te pytania zostały opracowane przez Einstein na własną rękę, więc mamy rację z Maxa urodzonym, aby powiedzieć, że "Einstein wyrzucił wszystkie podstawowe cechy mechaniki statystycznej". Młody badacz rozpoczął swoją pracę na temat fizyki molekularnej z solidnym zamiarem potwierdzenia wiarygodnych wyników z teorią atomistyczną, w prawidwie, której był przekonany, chociaż wydawała się kontrowersyjna.
W centrum uwagi Einsteina w swoich pracach badawczych na temat teorii ciepła była ruch molekularny Brown. W 1827 r. Angielski botanista Robert Brown analizuje kwiatowy pyłek pod mikroskopem; Jednocześnie odkrył, że cząstka zawieszona w kropli płynów stale wykonuje losowe, ruchy zygzakowe. Taki ruch cząstek jest później wywołany przez nazwę jego naukowca "Ruchu Browna", dzieje się to intensywnie niż mniejszą wagę cząstek i cieplejszej cieczy, w której znajdują się.
W ciągu wielu dekad naukowcy bezskutecznie próbowali znaleźć wyjaśnienie tego tajemniczego zjawiska. W latach 1880 - w dwóch dekadach do Einsteina - jeden francuski fizyk zasugerował, że ruch Brownów jest wynikiem nieuporządkowanego ciosów, które doświadczają zawieszonych cząstek przez niewidoczną pod mikroskopem cząsteczek płynów. Jednak to pomysłowe wyjaśnienie nie miały matematycznego uzasadnienia lub potwierdzenia eksperymentalnego.
W artykule "w sprawie ruchu cząstki zawieszonej w cieczy spoczynkowej, która wypływa z teorii molekularno-kinetycznej" Einstein, przy użyciu metod statystycznych, wykazało, że istnieje istoty ilościowe między prędkością ruchu cząstek zawieszonych, ich Rozmiar i współczynnik lepkości używany cieczy, który można weryfikować eksperymentalnie.
Einstein, który nie był jeszcze zaznajomiony z poprzednimi pracami na Ruchu Brownie, wierzył, że ruch cząstek widocznych pod mikroskopem jest przejawem mikroskopijnych cząsteczek płynnych. Einstein dał ukończoną formę matematyczną do statystycznego wyjaśnienia tego zjawiska, który został już sformułowany dla niego przez polskiego fizyka Marian von Smilukhovsky. Prawo Einsteinu Ruchu Browna zostało w pełni potwierdzone w 1908 r. Przez eksperymenty francuskiego fizyka Jean Perenena, który otrzymał nagrodę Nobla za te prace w 1926 roku.
Praca Einsteina w fizyce molekularnej okazała się poprawnością pomysłu, że ciepło jest formą energii nieuporządkowanego ruchu cząsteczek. Jednocześnie wzmocnili hipotezę atomistyczną, zgodnie z którą kwestią - w fizycznym zrozumieniu, składa się z cząsteczek i atomów.
Metoda zaproponowana przez Einsteina, metoda określania wymiarów cząsteczek i jego formuła ruchu brownów pozwala określić liczbę cząsteczek. Zanim te fizycy zostali zmuszeni do zarządzania przybliżonymi metodami proponowanymi w 1865 r. Przez austriacki fizyk konia; Teraz dzięki badaniom Einsteina mogli działać z dokładnymi metodami matematycznymi.
Wraz z czysto naukową wartością badań Einsteina na ruchu termicznym, było duże znaczenie teoretyczne i informacyjne. Pokazali, że negatywne lub sceptyczne relacje niektórych zasobów naturalnych do teorii atomistycznej nie jest uzasadnione. Dowód Einsteina o poprawności poglądów atomistycznych był tak przekonujący, że chemik Wilhelm Ostvald, który wraz z Ernstem, był upartym przeciwnikiem nauk o atomach, teraz, według własnych słów ", stawiała się do wiary jądrowej".
Decydujący wkład, który Einstein przyczynił się do zwycięstwa atomów, należy uznać za jedno z największych zasad naukowych. W tym celu jest godnym następcą wielkich materiałów starożytności: Demokrytu, Epicura i Luintia.
Friedrich Gernerk, 1984