واکنش های جایگزینی لیگاند موضوع: مراحل ابتدایی شامل هماهنگی و ترکیبات آلی فلزی در محلول ها و روی سطح فلزات و اکسیدها
مراحل اولیه واکنشهای آلی که توسط اسیدها، بازها، کاتالیزورهای هسته دوست، کمپلکسهای فلزی، فلزات جامد و ترکیبات آنها در فرآیندهای ناهمگن و همگن فاز گاز یا فاز مایع کاتالیز میشوند، واکنشهای تشکیل و تبدیل انواع واسطههای آلی و آلی فلزی هستند. و همچنین مجتمع های فلزی. ترکیبات میانی آلی شامل یونهای کربنیم R+، کربنیم RH 2 +، کربن آنیونهای R-، کاتیونهای آنیون و رادیکال، رادیکالها و دو رادیکالهای R·, R: و همچنین مجتمعهای مولکولی مولکولهای دهنده و گیرنده آلی (DA)، که توسط کمپلکس های با انتقال بار نیز نامیده می شوند. در کاتالیز همگن و ناهمگن توسط کمپلکس های فلزی (کاتالیز کمپلکس فلزی) واکنش های آلی، واسطه ها ترکیبات پیچیده (هماهنگی) با لیگاندهای آلی و معدنی، ترکیبات آلی فلزی با پیوند M-C هستند که در بیشتر موارد ترکیبات هماهنگی هستند. وضعیت مشابهی در مورد شیمی "دو بعدی" روی سطح کاتالیزورهای فلز جامد رخ می دهد. اجازه دهید انواع اصلی واکنش های کمپلکس های فلزی و ترکیبات آلی فلزی را در نظر بگیریم.
مراحل ابتدایی شامل مجتمع های فلزیواکنش های کمپلکس های فلزی را می توان به سه گروه تقسیم کرد:
الف) واکنش های انتقال الکترون؛
ب) واکنش های جایگزینی لیگاند.
ج) واکنش لیگاندهای هماهنگ.
واکنش های انتقال الکترون
دو مکانیسم در واکنش های انتقال الکترون اجرا می شود - مکانیسم کره بیرونی (بدون تغییر در کره های هماهنگ کننده دهنده و گیرنده) و مکانیسم پل زدن (کره داخلی) که منجر به تغییر در کره هماهنگی فلز می شود.
اجازه دهید مکانیسم کره بیرونی را با استفاده از مثال مجتمع های هشت وجهی فلزات واسطه در نظر بگیریم. در مورد واکنش های متقارن ( جی 0 = 0)
ثابت های سرعت در طیف وسیعی از مقادیر متفاوت است - از 10-12 تا 105 لیتر در مول در ثانیه، بسته به پیکربندی الکترونیکی یون و درجه بازسازی آن در طول فرآیند. در این واکنش ها، اصل کمترین حرکت به وضوح آشکار می شود - کمترین تغییر در پوسته ظرفیت شرکت کنندگان واکنش.
در واکنش انتقال الکترون (1) (Co * ایزوتوپی از اتم Co است)
(واکنش متقارن)، Co 2+ (d 7) به Co 3+ (d 6) می رود. پیکربندی الکترونیکی (پوسته ظرفیت) در طول این انتقال تغییر نمی کند
6 الکترون در سطح پیوند انحطاط سه گانه بدون تغییر باقی می مانند () و از سطح آنتی پیوند ه gالکترون سطح یک حذف می شود.
ثابت سرعت مرتبه دوم برای واکنش (1) ک 1 = 1.1 lmol-1 sec-1. از آنجایی که فن (فنانترولین) یک لیگاند قوی است، حداکثر عدد 7 است د-الکترون ها جفت شده اند (حالت زوج اسپین). در مورد لیگاند ضعیف NH 3 وضعیت به طور اساسی تغییر می کند. Co(NH 3) n 2+ (n = 4، 5، 6) در حالت اسپین-جفت نشده (چرخش بالا) قرار دارد.
کمپلکس قویتر Co(NH 3) 6 3+ (قویتر از Co(NH 3) 6 2+ ~ 10 30 بار) در حالت جفت چرخشی است، مانند کمپلکس با Phen. در این راستا، در فرآیند انتقال الکترون، پوسته ظرفیت باید به شدت بازسازی شود و در نتیجه، ک= 10-9 lmol-1 sec-1. نرخ تبدیل Co 2+ به Co 3+ برابر 50 درصد در مورد لیگاند Phen در 1 ثانیه و در مورد NH 3 ~ در 30 سال به دست می آید. بدیهی است که مرحله ای با چنین سرعتی (به طور رسمی ابتدایی) می تواند از مجموعه مراحل ابتدایی در هنگام تجزیه و تحلیل مکانیسم های واکنش حذف شود.
اندازه جیبرای واکنش انتقال الکترون در طول تشکیل یک مجتمع برخورد، طبق نظریه مارکوس، شامل دو جزء و
اولین عبارت انرژی سازماندهی مجدد پیوندهای M-L در داخل مجموعه است (طول و قدرت پیوند زمانی که حالت ظرفیت تغییر می کند). مقدار شامل انرژی بازآرایی پوسته حلالیت بیرونی در فرآیند تغییر مختصات M-L و بار مجموعه است. هرچه تغییر در محیط الکترونیکی کوچکتر و تغییر در طول M-L کمتر باشد، لیگاندها بزرگتر، کوچکتر و در نتیجه سرعت انتقال الکترون بیشتر می شود. مقدار مورد کلی را می توان با استفاده از معادله مارکوس محاسبه کرد
جایی که. در = 0.
در مورد مکانیسم درون کره، فرآیند انتقال الکترون تسهیل می شود، زیرا یکی از لیگاندهای کمپلکس اول یک کمپلکس پل زدنی را با کمپلکس دوم تشکیل می دهد و یکی از لیگاندها را از آن جابجا می کند.
ثابتهای سرعت چنین فرآیندی 8 مرتبه بزرگتر از ثابتهای کاهش Cr(NH 3) 6 3+ هستند. در چنین واکنش هایی، عامل کاهنده باید یک کمپلکس حساس باشد و لیگاند موجود در عامل اکسید کننده باید قادر به تشکیل پل باشد (Cl-، Br-، I-، N 3 -، NCS-، bipy).
واکنش های جایگزینی لیگاندیکی از مهمترین مراحل در کاتالیز کمپلکس فلزی، برهمکنش زیرلایه Y با کمپلکس است که از طریق سه مکانیسم انجام می شود:
الف) جایگزینی لیگاند با یک حلال. این مرحله معمولاً به عنوان تجزیه مجموعه به تصویر کشیده می شود
ماهیت فرآیند در بیشتر موارد جایگزینی لیگاند L با حلال S است که سپس به راحتی با یک مولکول سوبسترای Y جایگزین می شود.
ب) چسباندن لیگاند جدید در مختصات آزاد با تشکیل پیوند و به دنبال آن جداسازی لیگاند جایگزین شده
ج) جایگزینی همزمان (نوع S N 2) بدون تشکیل میانی
در مورد کمپلکسهای Pt(II)، سرعت واکنش اغلب با معادله دو مسیری توصیف میشود
جایی که ک اسو ک Y- ثابت سرعت فرآیندهایی که در واکنش های (5) (با یک حلال) و (6) با لیگاند Y رخ می دهند.
آخرین مرحله از مسیر دوم مجموع سه مرحله ابتدایی سریع است - حذف Cl-، افزودن Y و حذف مولکول H 2 O.
در مجتمع های مربع مسطح فلزات واسطه، یک اثر ترانس مشاهده می شود که توسط I.I. Chernyaev فرموله شده است - تأثیر LT بر سرعت جایگزینی لیگاندی که در موقعیت ترانس به لیگاند LT است. برای کمپلکسهای Pt(II)، اثر ترانس در سری لیگاندها افزایش مییابد:
H2O~NH3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
وجود اثر ترانس جنبشی و تأثیر ترمودینامیکی امکان سنتز کمپلکس های ایزومری بی اثر Pt(NH 3) 2 Cl 2 را توضیح می دهد:
واکنش لیگاندهای هماهنگ شده§ واکنش های جایگزینی الکتروفیل (SE) هیدروژن با یک فلز در کره هماهنگی فلز و فرآیندهای معکوس آنها
SH - H 2 O، ROH، RNH 2، RSH، ArH، RCCH.
حتی مولکول های H 2 و CH 4 در واکنش هایی از این نوع شرکت می کنند
§ واکنش های معرفی L از طریق اتصال M-X
در مورد X = R (کمپلکس آلی فلزی)، مولکول های هماهنگ فلزی نیز به پیوند M-R وارد می شوند (L - CO، RNC، C 2 H 2، C 2 H 4، N 2، CO 2، O 2 و غیره .). واکنش درج نتیجه حمله درون مولکولی هسته دوست X به یک مولکول هماهنگ شده توسط - یا - نوع است. واکنش های معکوس - - و - واکنش های حذف
§ واکنش های افزودن اکسیداتیو و حذف کاهشی
M 2 (C 2 H 2 ) M 2 4 + ( C 2 H 2 ) 4-
ظاهراً در این واکنش ها همیشه هماهنگی اولیه مولکول اضافه شده وجود دارد، اما همیشه نمی توان آن را تشخیص داد. در این راستا، وجود یک سایت آزاد در کره هماهنگی یا یک سایت مرتبط با یک حلال که به راحتی با یک بستر جایگزین می شود، عامل مهمی بر واکنش پذیری کمپلکس های فلزی است. به عنوان مثال، کمپلکسهای بی آلیل نیکل، پیشسازهای خوبی برای گونههای فعال کاتالیزوری هستند، زیرا به دلیل حذف تقلیلی آسان بیآلیل، یک کمپلکس با حلال ظاهر میشود، به اصطلاح. نیکل "لخت". نقش صندلی های خالی با مثال زیر نشان داده شده است:
§ واکنش های افزودن هسته دوست و الکتروفیل به کمپلکس های فلزی - و -
واکنش ترکیبات آلی فلزیبه عنوان واسطههای واکنشهای کاتالیزوری، هم ترکیبهای آلی فلزی کلاسیک با پیوندهای M-C، M=C و MC وجود دارند و هم ترکیبات غیرکلاسیکی وجود دارند که در آنها لیگاند آلی مطابق با نوع 2، 3، 4، 5 و 6 هماهنگ شده است. ساختارهای یک عنصر دارای کمبود الکترون - پل زدن گروه های CH 3 و C 6 H 6، کاربیدهای غیر کلاسیک (Rh 6 C(CO) 16، C(AuL) 5 +، C(AuL) 6 2+، و غیره).
در میان مکانیسم های علمی برای ترکیبات آلی فلزی کلاسیک، چندین مکانیسم را ذکر می کنیم. بنابراین، 5 مکانیسم جایگزینی الکتروفیل اتم فلز در پیوند M-C ایجاد شده است.
جایگزینی الکتروفیلیک با کمک نوکلئوفیلیک
AdE Addition-Elimination
افزودن AdE(C) به اتم C در هیبریداسیون sp 2
AdE(M) افزودن اکسیداتیو به فلز
جایگزینی هسته دوست در اتم کربن در واکنش های فلز زدایی ترکیبات آلی فلزی به عنوان یک فرآیند اکسیداسیون- احیا رخ می دهد:
مشارکت احتمالی یک عامل اکسید کننده در این مرحله
چنین عامل اکسید کننده ای می تواند CuCl 2، p-benzoquinone، NO 3 - و سایر ترکیبات باشد. در اینجا دو مرحله ابتدایی دیگر مشخصه RMX وجود دارد:
هیدروژنولیز پیوند M-C
و همولیز پیوند M-C
قاعده مهمی که برای تمام واکنش های ترکیبات پیچیده و آلی فلزی اعمال می شود و با اصل حداقل حرکت همراه است، قانون پوسته الکترونی 16-18 تولمن است (بخش 2).
هماهنگی و ترکیبات آلی فلزیروی یک سطحبر اساس مفاهیم مدرن، کمپلکس ها و ترکیبات آلی فلزی مشابه ترکیبات موجود در محلول ها بر روی سطح فلزات تشکیل می شوند. برای شیمی سطح، مشارکت چند اتم سطحی در تشکیل چنین ترکیباتی و البته عدم وجود ذرات باردار ضروری است.
گروه های سطحی می توانند هر اتم (H، O، N، C)، گروه های اتم (OH، OR، NH، NH 2، CH، CH 2، CH 3، R)، مولکول های هماهنگ CO، N 2، CO 2، C 2H4، C6H6. به عنوان مثال، در طول جذب CO بر روی یک سطح فلز، ساختارهای زیر پیدا شد:
مولکول C 2 H 4 بر روی سطح فلز با یک مرکز و پل های اتیلن دو متصل M-CH 2 CH 2 -M مجتمع می شود، یعنی. در اصل چرخه های فلزی
به عنوان مثال، در سطح Rh، در طول جذب اتیلن، فرآیندهای زیر تبدیل اتیلن با افزایش دما رخ می دهد:
واکنشهای واسطههای سطحی شامل مراحل افزودن اکسیداتیو، حذف احیاکننده، درج، - و - حذف، هیدروژنولیز پیوندهای M-C و C-C و سایر واکنشهای از نوع آلی فلزی، اما بدون ظاهر شدن یونهای آزاد است. جداول مکانیسم ها و واسطه های تبدیل سطحی هیدروکربن ها بر روی فلزات را نشان می دهد.
جدول 3.1. واکنش های کاتالیزوری شامل برش پیوند C-C.
نام گذاری ها:
آلکیل، متالاسیکل؛
کاربن، آلیل؛
کاربین، وینیل.
جدول 3.2. واکنش های کاتالیزوری شامل تشکیل پیوند C-C.
تعیین ها: جدول را ببینید. 3.1.
تشکیل تمامی ترکیبات آلی فلزی فوق بر روی سطح فلزات با روش های فیزیکی تایید شده است.
سوالاتی برای خودکنترلی
1) قانون کوچکترین تغییر در لایه ظرفیتی یک فلز چگونه در واکنش های انتقال الکترون خود را نشان می دهد؟
2) چرا جای خالی هماهنگی به تعامل موثر با بستر کمک می کند؟
3) انواع اصلی واکنش لیگاندهای هماهنگ را فهرست کنید.
4) مکانیسم های جایگزینی الکتروفیل در واکنش های ترکیبات آلی فلزی با NX را بیان کنید.
5) ترکیبات آلی فلزی سطحی را مثال بزنید.
6) نمونه هایی از مشارکت کمپلکس های سطحی کربن فلزی در تبدیل هیدروکربن ها را بیان کنید.
ادبیات برای مطالعه عمیق
1. Temkin O.N.، سینتیک واکنش های کاتالیزوری در محلول های مجتمع های فلزی، M.، MITHT، 1980، قسمت III.
2. Collman J., Higedas L., Norton J., Finke R., Organometallic Chemistry of Consumer Metals, M., Mir, 1989, vol. I, vol. II.
3. Moiseev I.I. - Complexes in oxidation of olefins, M., Nauka, 1970.
4. Temkin O.N., Shestakov G.K., Treger Yu.A., Acetylene: Chemistry. مکانیسم های واکنش ها فن آوری. م.، شیمی، 1991، 416 ص، بخش 1.
5. Henrici-Olivet G., Olive S., Coordination and catalysis, M., Mir, 1980, 421 p.
6. Krylov O.V.، Matyshak V.A.، ترکیبات واسطه در کاتالیز هتروژن، M.، Nauka، 1996.
7. Zaera F., An Organometallic Guide to the Chemistry of Hydrocarbon Moities on Transition Metal Surfaces., Chem. Rev., 1995, 95, 2651 - 2693.
8. Bent B.E.، تقلید جنبههای کاتالیز ناهمگن: تولید، جداسازی، و واکنش میانیهای سطحی پیشنهادی روی تک بلورها در خلاء، شیمی. Rev., 1996, 96, 1361 - 1390.
به طور معمول، واکنش های شیمیایی کمپلکس ها به لیگاندهای تبادلی، ردوکس، ایزومریزاسیون و هماهنگ تقسیم می شوند.
تفکیک اولیه کمپلکس ها به کره داخلی و خارجی، وقوع واکنش های تبادلی یون های کره خارجی را تعیین می کند:
X m + mNaY = Y m + mNaX.
اجزای حوزه داخلی کمپلکسها همچنین میتوانند در فرآیندهای متابولیکی که هم لیگاندها و هم عامل کمپلکسکننده را شامل میشوند، شرکت کنند. برای توصیف واکنشهای جایگزینی لیگاندها یا یون فلزی مرکزی، از نامگذاریها و اصطلاحات پیشنهادی K. Ingold برای واکنشهای ترکیبات آلی (شکل 42)، هسته دوست استفاده کنید.اس ن و الکتروفیلیکتعویض های S E:
Z + Y = z + X S N
Z + M" = z + M S E.
با توجه به مکانیسم واکنش جایگزینی، آنها (شکل 43) به انجمنی (شکل 43) تقسیم می شوند. S N 1 و S E 1 ) و تجزیه ای ( S N 2 و S E 2 ، در حالت گذار با افزایش و کاهش تعداد هماهنگی متفاوت است.
طبقه بندی یک مکانیسم واکنش به عنوان تداعی یا تجزیه ای یک کار آزمایشی دشوار برای شناسایی یک واسطه با تعداد هماهنگی کاهش یافته یا افزایش یافته است. در این راستا، مکانیسم واکنش اغلب بر اساس داده های غیرمستقیم در مورد تأثیر غلظت معرف ها بر سرعت واکنش، تغییرات در ساختار هندسی محصول واکنش و غیره قضاوت می شود.
برای مشخص کردن سرعت واکنشهای جایگزینی لیگاند در کمپلکسها، برنده جایزه نوبل 1983 G. Taube (شکل 44) استفاده از اصطلاحات "ناپذیر" و "بی اثر" را بسته به زمان واکنش جایگزینی لیگاند، کمتر یا بیشتر از 1 دقیقه پیشنهاد کرد. . اصطلاحات ناپایدار یا بی اثر ویژگی های سینتیک واکنش های جایگزینی لیگاند هستند و نباید با ویژگی های ترمودینامیکی پایداری یا ناپایداری کمپلکس ها اشتباه گرفته شوند.
پایداری یا بی اثر بودن کمپلکس ها به ماهیت یون کمپلکس و لیگاندها بستگی دارد. مطابق با نظریه میدان لیگاند:
1. مجتمع های هشت وجهی 3د فلزات واسطه با توزیع ظرفیت ( n -1) د الکترون در هر سیگما*(به عنوان مثال ) MOهای شل شونده ناپایدار هستند.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN - .
علاوه بر این، هر چه انرژی تثبیت توسط میدان کریستالی کمپلکس کمتر باشد، پایداری آن بیشتر است.
2. مجتمع های هشت وجهی 3د فلزات واسطه با سیگما آزاد* شل شدن مث اوربیتال ها و توزیع یکنواخت ظرفیت ( n-1) الکترون های d در اوربیتال های t 2 g (t 2 g 3، t 2 g 6) بی اثر هستند.
[Co III (CN) 6] 3- (t 2 g 6 e g 0) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. پلانو مربع و هشت وجهی 4 d و 5 d فلزات واسطه ای که الکترون در هر سیگما ندارند* MOهای شل شونده بی اثر هستند.
2+ + H 2 O =
2+ + H 2 O =
تأثیر ماهیت لیگاندها بر سرعت واکنشهای جایگزینی لیگاند در چارچوب مدل "تأثیر متقابل لیگاندها" در نظر گرفته میشود. یک مورد خاص از مدل تأثیر متقابل لیگاندها آن است که در سال 1926 توسط I.I. مفهوم نفوذ ترانس چرنیایف (شکل 45) - "ناپایداری لیگاند در کمپلکس به ماهیت لیگاند انتقال یافته بستگی دارد" - و تعدادی از تاثیرات ترانس لیگاندها را پیشنهاد می کند: CO، CN -، C 2 H 4 > PR 3، H - > CH 3 -، SC (NH 2) 2 > C 6 H 5 -، NO 2 -، I -، SCN - > Br -، Cl - > py , NH 3 , OH - , H 2 O .
مفهوم نفوذ ترانس به ما اجازه داد تا قوانین سرانگشتی را توجیه کنیم:
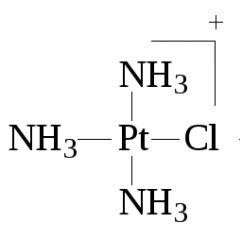
1. قانون پیرون- به دلیل اثر آمونیاک یا آمین ها بر روی تتراکلروپلاتینات ( II پتاسیم همیشه دی کلرودیامین پلاتین سیس پیکربندی به دست می آید:
2 - + 2NH 3 = cis - + 2Cl - .
از آنجایی که واکنش در دو مرحله انجام می شود و لیگاند کلرید تأثیر ترانس زیادی دارد، جایگزینی لیگاند کلرید دوم با آمونیاک با تشکیل cis-[ Pt (NH 3 ) 2 Cl 2 ]:
2- + NH 3 = -
NH 3 = cis -.
2. قانون جرگنسن - با اثر اسید کلریدریک بر روی پلاتین تترامین کلرید ( II ) یا ترکیبات مشابه با پیکربندی ترانس دی کلرودی آمین پلاتین به دست می آید:
[Pt (NH 3 ) 4 ] 2 + + 2 HCl = trans- [ Pt (NH 3 ) 2 Cl 2 ] + 2 NH 4 Cl .
مطابق با سلسله تأثیرات ترانس لیگاندها، جایگزینی مولکول دوم آمونیاک با یک لیگاند کلرید منجر به تشکیل ترانس[ Pt (NH 3 ) 2 Cl 2 ].
3. واکنش تیوریا کورناکوف - محصولات مختلف واکنش تیوریا با ایزومرهای هندسی trans-[ Pt (NH 3 ) 2 Cl 2 ] و cis- [ Pt ( NH 3 ) 2 Cl 2 ] :
سیس - + 4Thio = 2+ + 2Cl - + 2NH 3.
ماهیت متفاوت محصولات واکنش با تأثیر ترانس بالای تیوریا همراه است. اولین مرحله از واکنش ها جایگزینی لیگاندهای کلرید تیوره با تشکیل ترانس و سیس است. Pt (NH 3 ) 2 (Thio ) 2 ] 2+ :
trans-[Pt (NH 3) 2 Cl 2 ] + 2 Thio = trans-[ Pt (NH 3) 2 (Thio) 2 ] 2+
cis - + 2Thio = cis - 2+.
در cis-[Pt (NH 3 ) 2 (Thio ) 2 ] 2 + دو مولکول آمونیاک در موقعیت ترانس به تیوریا تحت جایگزینی بیشتری قرار می گیرند که منجر به تشکیل 2+ :
سیس - 2+ + 2Thio = 2+ + 2NH 3.
در trans-[Pt (NH 3 ) 2 (Thio ) 2 ] 2 + دو مولکول آمونیاک با نفوذ کمی ترانس در موقعیت ترانس نسبت به یکدیگر قرار دارند و بنابراین با تیوریا جایگزین نمی شوند.
الگوهای نفوذ ترانس توسط I.I کشف شد. چرنیایف هنگام مطالعه واکنش های جایگزینی لیگاند در مجتمع های پلاتین مربع مسطح ( II ). متعاقباً نشان داده شد که نفوذ ترانس لیگاندها در کمپلکس های فلزات دیگر نیز ظاهر می شود. Pt(IV)، Pd(II)، Co(III)، کروم(III)، Rh(III)، Ir(III) )) و سایر ساختارهای هندسی. درست است، سری نفوذ ترانس لیگاندها برای فلزات مختلف تا حدودی متفاوت است.
لازم به ذکر است که نفوذ ترانس است اثر جنبشی- هرچه تأثیر ترانس یک لیگاند معین بیشتر باشد، سریعتر با لیگاند دیگری که در موقعیت ترانس نسبت به آن قرار دارد جایگزین می شود.
همراه با اثر جنبشی نفوذ ترانس، در وسط XX قرن هجری قمری گرینبرگ و یو.ن. کوکوشکین وابستگی نفوذ فراتر از لیگاند را ایجاد کرد L از لیگاند واقع در موقعیت cis به L . بنابراین، مطالعه سرعت واکنش جانشینی Cl- آمونیاک در مجتمع های پلاتین ( II):
[PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0.42. 10 4 لیتر در مول. با
[ PtNH 3 Cl 3 ] - + NH 3 = cis- [ Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1.14. 10 4 لیتر در مول. با
trans-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2.90. 10 4 لیتر در مول. با
نشان داد که حضور یک یا دو مولکول آمونیاک در موقعیت cis به لیگاند کلرید جایگزین شده منجر به افزایش مداوم در سرعت واکنش میشود. این اثر جنبشی نامیده می شود نفوذ کشورهای مستقل مشترک المنافع. در حال حاضر، هر دو اثر جنبشی تأثیر ماهیت لیگاندها بر سرعت واکنشهای جایگزینی لیگاند (اثر ترانس و سیس) در یک مفهوم کلی ترکیب شدهاند. تأثیر متقابل لیگاندها.
اثبات نظری تأثیر تأثیر متقابل لیگاندها ارتباط نزدیکی با توسعه ایدهها در مورد پیوندهای شیمیایی در ترکیبات پیچیده دارد. در دهه 30 XX قرن هجری قمری گرینبرگ و بی.وی. نکراسوف تأثیر ترانس را در چارچوب مدل پلاریزاسیون در نظر گرفت:
1. اثر ترانس برای کمپلکس هایی که یون فلز مرکزی آنها بسیار قابل قطبش است، معمول است.
2. فعالیت ترانس لیگاندها با انرژی قطبش متقابل لیگاند و یون فلز تعیین می شود. برای یک یون فلزی مشخص، تأثیر ترانس لیگاند با قطبش پذیری و فاصله آن از یون مرکزی تعیین می شود.
مدل پلاریزاسیون با داده های تجربی برای مجتمع هایی با لیگاندهای آنیونی ساده، مانند یون های هالید، سازگار است.
در سال 1943 A.A. گرینبرگ این فرضیه را مطرح کرد که فعالیت ترانس لیگاندها با خواص کاهشی آنها مرتبط است. تغییر چگالی الکترون از لیگاند trans-located به فلز باعث کاهش بار موثر یون فلز می شود که منجر به ضعیف شدن پیوند شیمیایی با لیگاند trans-located می شود.
توسعه ایدهها در مورد تأثیر ترانس با فعالیت ترانس بالای لیگاندها بر اساس مولکولهای آلی غیراشباع مانند اتیلن مرتبط است. Pt(C2H4)Cl3 ] - . به گفته Chatt و Orgel (شکل 46)، این به دلیلپی-برهمکنش دادهای این لیگاندها با فلز و مکانیسم ارتباطی واکنشهای جایگزینی برای لیگاندهای ترانس مکان. هماهنگی با یون فلزی لیگاند مهاجمز منجر به تشکیل یک واسطه دو هرمی سه ضلعی پنج مختصات و به دنبال آن حذف سریع لیگاند خروجی X می شود. تشکیل چنین واسطه ای توسط تسهیل می شود.پی-برهمکنش لیگاند-فلز دادهای Y ، که چگالی الکترون فلز را کاهش می دهد و انرژی فعال سازی حالت گذار را با جایگزینی سریع لیگاند X کاهش می دهد.
همراه با پپذیرنده (C 2 H 4 , CN - , CO ...) لیگاندهایی که پیوند شیمیایی لیگاند-فلز را تشکیل می دهند دارای نفوذ ترانس بالایی هستند وسلیگاندهای اهداکننده: H - ، CH 3 - ، C 2 H 5 - ... نفوذ ترانس چنین لیگاندهایی با برهمکنش دهنده-گیرنده لیگاند X با فلز تعیین می شود که چگالی الکترون آن را کاهش می دهد و پیوند فلز را با لیگاند خروجی ضعیف می کند. Y.
بنابراین، موقعیت لیگاندها در سری ترانس فعالیت با عمل ترکیبی سیگما تعیین می شود.اهدا کننده و پی-خواص لیگاندها - سیگمااهدا کننده و پی-خواص پذیرنده لیگاند نفوذ ترانس آن را افزایش می دهد، در حالی کهپی-اهداکنندگان ضعیف می شوند اینکه کدام یک از این اجزای برهمکنش لیگاند-فلز در اثر ترانس غالب است، بر اساس محاسبات شیمیایی کوانتومی ساختار الکترونیکی حالت گذار واکنش قضاوت میشود.
یکی از مهمترین مراحل در کاتالیز کمپلکس فلزی - برهمکنش زیرلایه Y با کمپلکس - با سه مکانیسم انجام می شود:
الف) جایگزینی لیگاند با یک حلال. این مرحله معمولاً به عنوان تجزیه مجموعه به تصویر کشیده می شود
ماهیت فرآیند در بیشتر موارد جایگزینی لیگاند با حلال S است که سپس به راحتی با یک مولکول بستر Y جایگزین می شود.
ب) چسباندن لیگاند جدید در مختصات آزاد با تشکیل پیوند و به دنبال آن جداسازی لیگاند جایگزین شده
ج) جایگزینی همزمان (نوع S N 2) بدون تشکیل میانی
در مورد کمپلکسهای Pt(II)، سرعت واکنش اغلب با معادله دو مسیری توصیف میشود
جایی که ک اسو ک Yثابتهای سرعت فرآیندهایی هستند که در واکنشهای (5) (با یک حلال) و (6) با لیگاند Y رخ میدهند. مثلا،


آخرین مرحله از مسیر دوم مجموع سه مرحله ابتدایی سریع - حذف کلر -، افزودن Y و حذف مولکول H 2 O است.
در مجتمع های مربع مسطح فلزات واسطه، یک اثر ترانس مشاهده می شود که توسط I.I. Chernyaev فرموله شده است - تأثیر LT بر سرعت جایگزینی لیگاند واقع در موقعیت ترانس به لیگاند LT. برای کمپلکسهای Pt(II)، اثر ترانس در سری لیگاندها افزایش مییابد:
H 2 O~NH 3 وجود اثر ترانس جنبشی و تأثیر ترمودینامیکی امکان سنتز کمپلکس های ایزومری بی اثر Pt(NH 3) 2 Cl 2 را توضیح می دهد: واکنش های جایگزینی الکتروفیل (S E) هیدروژن با یک فلز در کره هماهنگی فلز و فرآیندهای معکوس آنها SH – H 2 O، ROH، RNH 2، RSH، ArH، RCCH. حتی مولکول های H 2 و CH 4 در واکنش هایی از این نوع شرکت می کنند واکنش های معرفی L در طول اتصال M-X در مورد X=R (کمپلکس آلی فلزی)، مولکولهای هماهنگ شده با فلز نیز به پیوند M-R وارد میشوند (L–CO، RNC، C2H2، C2H4، N2، CO2، O2، و غیره .). واکنش درج نتیجه حمله درون مولکولی یک هسته دوست به یک مولکول یا هماهنگ است. واکنش های معکوس - واکنش های - و - حذف واکنشهای حذف اکسیداتیو و کاهشی M 2 (C 2 H 2 ) M 2 4 + ( C 2 H 2 ) 4- ظاهراً در این واکنش ها همیشه هماهنگی اولیه مولکول اضافه شده وجود دارد، اما همیشه نمی توان آن را تشخیص داد. بنابراین، وجود یک سایت آزاد در کره هماهنگی یا یک سایت مرتبط با یک حلال که به راحتی با یک بستر جایگزین می شود، عامل مهمی است که بر واکنش پذیری کمپلکس های فلزی تأثیر می گذارد. به عنوان مثال، کمپلکسهای bis--alyl نیکل، پیشسازهای خوبی برای گونههای فعال کاتالیزوری هستند، زیرا به دلیل حذف آسان بیآلیل، یک کمپلکس با حلال ظاهر میشود، به اصطلاح. نیکل "لخت". نقش صندلی های خالی با مثال زیر نشان داده شده است: واکنش افزودن هسته دوست و الکتروفیل به کمپلکس های و فلزات به عنوان واسطههای واکنشهای کاتالیزوری، هم ترکیبات آلی فلزی کلاسیک با پیوندهای M-C، M=C و MC و ترکیبات غیرکلاسیک وجود دارند که در آنها لیگاند آلی مطابق با 2، 3، 4، 5 هماهنگ میشود. و 6-نوع، یا عنصری از ساختارهای دارای کمبود الکترون است - پل زدن گروه های CH 3 و C 6 H 6، کاربیدهای غیر کلاسیک (Rh 6 C(CO) 16، C(AuL) 5 +، C(AuL) 6 2+ و غیره). در میان مکانیسمهای خاص برای ترکیبات آلی فلزی ، مکانیسمهای مختلفی را ذکر میکنیم. بنابراین، 5 مکانیسم جایگزینی الکتروفیل اتم فلز در پیوند M-C ایجاد شده است. جایگزینی الکتروفیلیک با کمک نوکلئوفیلیک AdEAddition-Elimination افزودن AdE(C) به اتم C در هیبریداسیون sp 2 AdE(M) افزودن اکسیداتیو به فلز جایگزینی هسته دوست در اتم کربن در واکنش های فلز زدایی از ترکیبات آلی فلزی به عنوان یک فرآیند ردوکس رخ می دهد: مشارکت احتمالی یک عامل اکسید کننده در این مرحله چنین عامل اکسید کننده ای می تواند CuCl 2، p-benzoquinone، NO 3 - و سایر ترکیبات باشد. در اینجا دو مرحله ابتدایی دیگر مشخصه RMX وجود دارد: هیدروژنولیز پیوند M-C و همولیز پیوند M-C قاعده مهمی که برای تمام واکنش های ترکیبات پیچیده و آلی فلزی اعمال می شود و با اصل حداقل حرکت همراه است، قانون پوسته الکترونی 16-18 تولمن است (بخش 2). واکنش جایگزینی اصلی در محلول های آبی، مبادله مولکول های آب (22)، برای تعداد زیادی از یون های فلزی مورد مطالعه قرار گرفته است (شکل 34). مبادله مولکول های آب در کره هماهنگی یک یون فلزی با بخش عمده ای از مولکول های آب موجود به عنوان حلال برای اکثر فلزات بسیار سریع اتفاق می افتد و بنابراین سرعت چنین واکنشی را می توان عمدتاً با روش آرام سازی مطالعه کرد. این روش شامل برهم زدن تعادل سیستم، به عنوان مثال با افزایش شدید دما است. در شرایط جدید (دمای بالاتر)، سیستم دیگر در حالت تعادل نخواهد بود. سپس میزان تعادل اندازه گیری می شود. اگر می توانید دمای محلول را در داخل تغییر دهید 10-8 ثانیه، سپس می توانید سرعت واکنشی را اندازه گیری کنید که تکمیل آن به بیش از یک دوره زمانی نیاز دارد 10-8 ثانیه. همچنین می توان سرعت جایگزینی مولکول های آب هماهنگ در یون های فلزی مختلف را با لیگاندهای SO 2-4، S 2 O 3 2-، EDTA و غیره اندازه گیری کرد (26). سرعت این واکنش به غلظت یون فلزی هیدراته بستگی دارد و به غلظت لیگاند ورودی بستگی ندارد، که استفاده از معادله مرتبه اول (27) را برای توصیف سرعت این سیستم ها ممکن می سازد. در بسیاری از موارد، سرعت واکنش (27) برای یک یون فلزی معین به ماهیت لیگاند ورودی (L) بستگی ندارد، چه مولکول های H 2 O یا SO 4 2-، S 2 O 3 2-، یا یون های EDTA این مشاهدات، همراه با این واقعیت که معادله سرعت برای این فرآیند شامل غلظت لیگاند ورودی نمیشود، نشان میدهد که این واکنشها با مکانیزمی انجام میشوند که در آن گام آهسته شامل شکستن پیوند بین یون فلز و آب است. ترکیب حاصل احتمالاً به سرعت لیگاندهای مجاور را هماهنگ می کند. در بخش در 4 این فصل بیان شد که یونهای فلزی هیدراته با بار زیادتر، مانند Al 3+ و Sc 3+، مولکولهای آب را کندتر از یونهای M2+ و M+ تبادل میکنند. این دلیلی را برای این فرض فراهم می کند که شکستن اوراق قرضه نقش مهمی در مرحله ای دارد که نرخ کل فرآیند را تعیین می کند. نتایج بهدستآمده در این مطالعات قطعی نیست، اما دلیلی برای این باور است که فرآیندهای SN 1 در واکنشهای جایگزینی یونهای فلزی هیدراته مهم هستند. احتمالاً مهمترین ترکیبات پیچیده مورد مطالعه، آمین های کبالت (III) هستند. پایداری، سهولت آمادهسازی و واکنشهای آهسته آنها را برای مطالعات جنبشی مناسب میسازد. از آنجایی که مطالعات این مجتمع ها منحصراً در محلول های آبی انجام شده است، ابتدا باید واکنش های این مجتمع ها با مولکول های حلال - آب را در نظر بگیریم. مشخص شد که به طور کلی، مولکولهای آمونیاک یا آمین هماهنگشده توسط یون Co(III) به آرامی با مولکولهای آب جایگزین میشوند که معمولاً جایگزینی لیگاندهایی غیر از آمینها در نظر گرفته میشود. سرعت واکنشهای نوع (28) مورد مطالعه قرار گرفت و مشخص شد که نسبت به کمپلکس کبالت در درجه اول قرار دارد (X یکی از بسیاری از آنیونهای ممکن است). از آنجایی که در محلول های آبی غلظت H 2 O همیشه تقریباً است 55.5 م، بنابراین تعیین تأثیر تغییر غلظت مولکول های آب بر سرعت واکنش غیرممکن است. معادلات سرعت (29) و (30) برای یک محلول آبی از نظر تجربی قابل تشخیص نیستند، زیرا k به سادگی برابر با k" = k" است. بنابراین، نمی توان از معادله سرعت واکنش تشخیص داد که آیا H2O در مرحله تعیین سرعت فرآیند شرکت خواهد کرد یا خیر. پاسخ به این سوال که آیا این واکنش با مکانیسم SN 2 با جایگزینی یون X توسط یک مولکول H 2 O یا مکانیسم S N 1، که ابتدا شامل تفکیک و سپس افزودن یک مولکول H 2 O است، ادامه می یابد، باید با استفاده از سایر داده های تجربی به دست آید. این مشکل با دو نوع آزمایش قابل حل است. سرعت هیدرولیز (جایگزینی یک یون کلر در هر مولکول آب) ترنس- + تقریباً 10 3 برابر بیشتر از سرعت هیدرولیز 2+ است. افزایش بار کمپلکس منجر به استحکام پیوندهای فلز - لیگاند و در نتیجه جلوگیری از شکاف این پیوندها می شود. جذب لیگاندهای ورودی و تسهیل واکنش جایگزینی نیز باید در نظر گرفته شود. از آنجایی که با افزایش بار کمپلکس کاهش نرخ پیدا شد، در این مورد یک فرآیند تجزیه ای (SN 1) محتمل تر به نظر می رسد. روش دیگر اثبات مبتنی بر مطالعه هیدرولیز مجموعه ای از مجتمع های مشابه است ترنس- + . در این کمپلکس ها، مولکول اتیلن دی آمین با دی آمین های مشابه جایگزین می شود که در آن اتم های هیدروژن در اتم کربن با گروه های CH 3 جایگزین می شوند. کمپلکس های حاوی دی آمین های جایگزین سریعتر از کمپلکس اتیلن دی آمین واکنش نشان می دهند. جایگزینی اتم های هیدروژن با گروه های CH 3 باعث افزایش حجم لیگاند می شود و حمله اتم فلز توسط لیگاند دیگر را دشوارتر می کند. این موانع فضایی واکنش را از طریق مکانیسم S N 2 کاهش می دهد. وجود لیگاندهای حجیم در نزدیکی اتم فلز فرآیند تجزیه را ارتقا می دهد، زیرا حذف یکی از لیگاندها تجمع آنها را در اتم فلز کاهش می دهد. افزایش مشاهده شده در سرعت هیدرولیز کمپلکس ها با لیگاندهای حجیم شواهد خوبی است که نشان می دهد واکنش مطابق با مکانیسم SN1 پیش می رود. بنابراین، در نتیجه مطالعات متعدد روی کمپلکسهای اسیدوآمین Co(II)، مشخص شد که جایگزینی گروههای اسیدی با مولکولهای آب یک فرآیند تجزیهای در طبیعت است. پیوند اتم-لیگاند کبالت قبل از اینکه مولکولهای آب وارد مجتمع شوند تا یک مقدار بحرانی خاص گسترش مییابد. در کمپلکس هایی با بار 2+ و بالاتر، شکستن پیوند کبالت-لیگاند بسیار دشوار است و ورود مولکول های آب شروع به ایفای نقش مهم تری می کند. مشخص شد که جایگزینی گروه اسیدی (X -) در کمپلکس کبالت (III) با گروهی غیر از مولکول H2O، (31) ابتدا جایگزین آن با یک مولکول می شود. حلال - آب، به دنبال جایگزینی آن با یک گروه جدید Y (32). بنابراین، در بسیاری از واکنش ها با کمپلکس های کبالت (III)، سرعت واکنش (31) برابر با سرعت هیدرولیز است (28). فقط یون هیدروکسیل از نظر واکنش پذیری با آمین های Co(III) با دیگر معرف ها متفاوت است. با توجه به نوع واکنش بسیار سریع با کمپلکس های آمین کبالت (III) (حدود 10 6 برابر سریعتر از آب) واکنش می دهد. هیدرولیز پایه (33). این واکنش با توجه به لیگاند جایگزین OH - (34) مرتبه اول بود. مرتبه دوم کلی واکنش و پیشرفت غیرمعمول سریع واکنش نشان می دهد که یون OH یک معرف هسته دوست استثنایی برای کمپلکس های Co(III) است و این واکنش از طریق مکانیسم SN2 از طریق تشکیل یک واسطه انجام می شود. با این حال، این خاصیت OH - را می توان با مکانیسم دیگری نیز توضیح داد [معادلات (35)، (36)]. در واکنش (35)، کمپلکس 2+ مانند یک اسید رفتار می کند (طبق گفته برونستد)، کمپلکس + را می دهد که آمیدو-(حاوی) -ترکیب - باز مربوط به اسید 2+. سپس واکنش از طریق مکانیسم SN 1 (36) برای تشکیل یک حد واسط پنج مختصات ادامه می یابد، که بیشتر با مولکول های حلال واکنش می دهد تا محصول واکنش نهایی را تولید کند (37). این مکانیسم واکنش با سرعت یک واکنش مرتبه دوم مطابقت دارد و با مکانیسم SN 1 مطابقت دارد. از آنجایی که واکنش در مرحله تعیین سرعت شامل یک مزدوج باز به کمپلکس اصلی - اسید است، به این مکانیسم نام S N داده شده است. 1CB. تعیین اینکه کدام یک از این مکانیسم ها مشاهدات تجربی را به بهترین شکل توضیح می دهد بسیار دشوار است. با این حال، شواهد قانع کننده ای برای حمایت از فرضیه S N 1CB وجود دارد. بهترین استدلالها به نفع این مکانیسم به شرح زیر است: کمپلکسهای هشتوجهی Co(III) عموماً از طریق مکانیسم تجزیهای SN1 واکنش نشان میدهند، و هیچ استدلال قانعکنندهای وجود ندارد که چرا یون OH- باید در فرآیند SN2 واسطه شود. ثابت شده است که یون هیدروکسیل یک معرف هسته دوست ضعیف در واکنش با Pt (II) است و بنابراین واکنش غیر معمول آن با Co (III) غیر منطقی به نظر می رسد. واکنشها با ترکیبات کبالت (III) در محیطهای غیر آبی شواهد بسیار خوبی برای تشکیل واسطههای مختصات پنجگانه ارائه شده توسط مکانیسم SN1 SV فراهم میکند. اثبات نهایی این واقعیت است که در غیاب پیوندهای N-H در کمپلکس Co(III)، به آرامی با یون های OH- واکنش نشان می دهد. البته این نشان میدهد که ویژگیهای اسید-باز کمپلکس برای سرعت واکنش مهمتر از خواص هسته دوست OH است." اغلب می تواند به بیش از یک روش تفسیر شود، و برای حذف یک مکانیسم احتمالی، لازم است یک آزمایش نسبتاً ظریف انجام شود. در حال حاضر، واکنش های جایگزینی تعداد زیادی از ترکیبات هشت وجهی مورد مطالعه قرار گرفته است. اگر مکانیسم واکنش آنها را در نظر بگیریم، رایج ترین فرآیند تجزیه است. این نتیجه غیرمنتظره نیست زیرا شش لیگاند فضای کمی در اطراف اتم مرکزی باقی می گذارند تا گروه های دیگر به آن بچسبند. تنها چند نمونه وجود دارد که در آن وقوع یک واسطه هفت مختصات نشان داده شده است یا تأثیر یک لیگاند مداخله گر شناسایی شده است. بنابراین، مکانیسم SN2 را نمی توان به طور کامل به عنوان یک مسیر ممکن برای واکنش های جایگزینی در مجتمع های هشت وجهی رد کرد. واکنش های ترکیبات هماهنگی همیشه در کره هماهنگی یک فلز با لیگاندهای متصل به آن رخ می دهد. بنابراین، بدیهی است که اصلاً برای اینکه هر اتفاقی بیفتد، لیگاندها باید بتوانند در این حوزه بیفتند. این می تواند به دو صورت اتفاق بیفتد: زمانی که در مورد اشباع نشدن هماهنگی و قانون 18 الکترون بحث کردیم، قبلاً با روش اول آشنا شده ایم. در اینجا به مورد دوم می پردازیم. اما معمولاً یک قانون ناگفته وجود دارد - تعداد مکان های هماهنگی اشغال شده تغییر نمی کند. به عبارت دیگر، تعداد الکترون ها در طول جانشینی تغییر نمی کند. جایگزینی یک نوع لیگاند به جای دیگری کاملاً ممکن است و اغلب در واقعیت رخ می دهد. اجازه دهید هنگام تغییر L-ligand به X-ligand و بالعکس، فقط به مدیریت صحیح بارها توجه کنیم. اگر این موضوع را فراموش کنیم، وضعیت اکسیداسیون فلز تغییر خواهد کرد و جایگزینی لیگاندها یک فرآیند کاهش اکسیداسیون نیست (اگر مثال مخالفی پیدا کردید یا به آن رسیدید، به من اطلاع دهید - به طور خودکار به درستی اعتبار داده می شود. دور، اگر نتوانم ثابت کنم که شما اشتباه کرده اید، و حتی در این مورد، سهم مثبتی در کارما تضمین می کنم). با لیگاندهای پیچیده تر دیگر مشکلی وجود ندارد - فقط باید یک قانون نسبتاً واضح را به خاطر بسپارید: تعداد مکان های لیگاند (یعنی تعداد کل لیگاندها یا مراکز لیگاند نوع X یا L) حفظ می شود. این به طور مستقیم از پایستگی شمارش الکترون ناشی می شود. در اینجا نمونه های بدیهی است. بیایید به آخرین مثال توجه کنیم. معرف شروع این واکنش دی کلرید آهن FeCl 2 است. تا همین اواخر، می گفتیم: "این فقط نمک است، شیمی هماهنگی چه ربطی به آن دارد؟" اما ما دیگر به خود اجازه چنین نادانی را نمی دهیم. در شیمی فلزات واسطه، "فقط نمک" وجود ندارد، هر مشتق، ترکیبات هماهنگی است، که تمام ملاحظات در مورد شمارش الکترون، پیکربندی d، اشباع هماهنگی و غیره در مورد آنها اعمال می شود. دی کلرید آهن، همانطور که به نوشتن آن عادت کرده ایم، یک کمپلکس Fe(2+) از نوع MX 2 با پیکربندی d 6 و تعداد الکترون ها 10 است. کافی نیست! خوب؟ از این گذشته، ما قبلاً متوجه شده ایم که لیگاندها می توانند ضمنی باشند. برای انجام واکنش ما به یک حلال نیاز داریم و برای چنین واکنش هایی به احتمال زیاد THF است. انحلال نمک آهن کریستالی در THF دقیقاً به این دلیل اتفاق می افتد که حلال دهنده فضاهای آزاد را اشغال می کند و انرژی این فرآیند تخریب شبکه کریستالی را جبران می کند. ما نمی توانیم این "نمک" را در حلالی حل کنیم که به دلیل بازی لوئیس خدمات حلالیت فلز را ارائه نمی دهد. در این مورد، و در میلیونها مورد مشابه، حلسازی صرفاً یک تعامل هماهنگی است. اجازه دهید، فقط برای قطعیت، نتیجه حلالیت را به شکل کمپلکس FeX 2 L 4 بنویسیم، که در آن دو یون کلر به شکل دو لیگاند X در کره هماهنگی باقی می مانند، اگرچه به احتمال زیاد آنها نیز توسط آنها جابجا شده اند. مولکول های حلال دهنده با تشکیل یک مجتمع باردار FeL 6 2+. در این مورد چندان مهم نیست. در هر صورت، می توانیم با خیال راحت فرض کنیم که یک مجتمع 18 الکترونی در سمت چپ و راست داریم. اگر شیمی آلی را به یاد بیاوریم، دو مکانیسم جایگزینی در یک اتم کربن اشباع وجود دارد - SN1 و SN2. در مرحله اول، جایگزینی در دو مرحله انجام شد: جانشین قدیمی ابتدا ترک کرد و یک اوربیتال خالی روی اتم کربن باقی گذاشت که سپس توسط یک جانشین جدید با یک جفت الکترون اشغال شد. مکانیسم دوم فرض میکرد که رفتن و آمدن به طور همزمان و هماهنگ انجام میشد و این فرآیند یک مرحلهای بود. در شیمی ترکیبات هماهنگی، تصور چیزی مشابه کاملاً ممکن است. اما یک احتمال سوم ظاهر می شود که اتم کربن اشباع آن را نداشت - ابتدا یک لیگاند جدید وصل می کنیم، سپس لیگاند قدیمی را جدا می کنیم. فوراً مشخص می شود که اگر مجموعه قبلاً 18 الکترون داشته باشد و از هماهنگی اشباع شده باشد، این گزینه سوم به سختی امکان پذیر است. اما اگر تعداد الکترون ها 16 یا کمتر باشد، یعنی کمپلکس غیراشباع باشد، کاملاً ممکن است. بیایید بلافاصله قیاس آشکار از شیمی آلی را به یاد بیاوریم - جایگزینی هسته دوست در یک اتم کربن غیر اشباع (در یک حلقه معطر یا در یک کربن کربونیل) نیز ابتدا به عنوان افزودن یک هسته دوست جدید و سپس حذف اتم قدیمی رخ می دهد. بنابراین، اگر 18 الکترون داشته باشیم، جایگزینی به عنوان یک انتزاع-افزودن رخ می دهد (طرفداران کلمات "هوشمند" از اصطلاح مکانیسم تجزیه-تداعی یا به سادگی تجزیه استفاده می کنند). راه دیگر مستلزم گسترش کره هماهنگی تا تعداد 20 الکترون است. این امر مطلقاً غیرممکن نیست و حتی گاهی اوقات به چنین گزینه هایی نیز توجه می شود، اما قطعاً بسیار زیان آور است و هر بار در صورت مشکوک شدن به چنین مسیری، شواهد بسیار قابل توجهی لازم است. در بیشتر این داستانها، محققان در نهایت به این نتیجه رسیدند که چیزی را نادیده گرفتهاند یا از دست دادهاند و مکانیسم تداعی رد شد. بنابراین، اگر مجموعه اصلی 18 الکترون داشته باشد، ابتدا یک لیگاند باید ترک کند، سپس یک لیگاند جدید باید جای آن را بگیرد، به عنوان مثال: اگر میخواهیم هاپتو لیگاندی را که چندین مکان را اشغال میکند وارد حوزه هماهنگی کنیم، ابتدا باید همه آنها را خالی کنیم. به عنوان یک قاعده، این فقط در شرایط نسبتاً شدید رخ می دهد، به عنوان مثال، به منظور جایگزینی سه کربونیل در کربونیل کروم با η6-بنزن، مخلوط تحت فشار برای ساعت های زیادی گرم می شود و هر از گاهی مونوکسید کربن آزاد شده را آزاد می کند. اگرچه این نمودار تفکیک سه لیگاند را با تشکیل یک کمپلکس بسیار غیراشباع با 12 الکترون نشان میدهد، اما در حقیقت واکنش به احتمال زیاد در مراحل انجام میشود، هر بار یک کربونیل باقی میماند، و بنزن وارد کره میشود و به تدریج باعث افزایش لمسی میشود. مراحل منهای CO - دیگاپتو - منهای یک CO بیشتر - تتراهاپتو - منهای یک CO بیشتر - هگزاگپتو، به طوری که کمتر از 16 الکترون به دست نمی آید. بنابراین، اگر ما یک کمپلکس با 16 الکترون یا کمتر داشته باشیم، جایگزینی لیگاند به احتمال زیاد به عنوان حذف-افزودن اتفاق میافتد (برای کسانی که کلمات عمیق را دوست دارند: انجمنی-تجزیهای یا به سادگی تداعی کننده): لیگاند جدید ابتدا میآید. ، سپس قدیمی می رود. دو سوال واضح مطرح می شود: چرا لیگاند قدیمی ترک می کند، زیرا 18 الکترون بسیار خوب هستند، و چرا در این مورد، مانند کمپلکس های 18 الکترونی، برعکس عمل نمی کنیم. پاسخ به سوال اول آسان است: هر فلز عادات خاص خود را دارد و برخی از فلزات، به ویژه فلزات متأخر، با پوسته های D تقریباً پر شده، تعداد 16 الکترون و انواع ساختاری مربوطه را ترجیح می دهند و بنابراین لیگاند اضافی را بیرون می اندازند. ، به پیکربندی مورد علاقه خود باز می گردند. گاهی اوقات عامل فضایی نیز در این موضوع دخالت می کند؛ لیگاندهای موجود بزرگ هستند و عامل اضافی در ساعت شلوغی احساس می شود مسافر اتوبوس است. پیاده شدن و پیاده روی آسان تر از این است که اینگونه رنج بکشید. با این حال، شما می توانید یک مسافر دیگر را هل دهید، اجازه دهید او قدم بزند و ما می رویم. سوال دوم نیز ساده است - در این مورد، مکانیسم تجزیه ابتدا باید یک مجتمع 14 الکترونی ایجاد کند، و این به ندرت سودمند است. در اینجا یک مثال است. برای تنوع، بیایید لیگاند X را با یک لیگاند L جایگزین کنیم، و در مورد حالت های اکسیداسیون و بارها گیج نخواهیم شد. یک بار دیگر: پس از جایگزینی، حالت اکسیداسیون تغییر نمی کند و اگر لیگاند X از بین رفته باشد، باید از دست دادن با بار روی فلز جبران شود. اگر این را فراموش کنیم، عدد اکسیداسیون 1 کاهش می یابد، اما این نادرست است. و یه چیز عجیب دیگه یک پیوند فلزی پیریدین به دلیل جفت تنها روی نیتروژن تشکیل شد. در شیمی آلی، در این مورد، ما قطعاً در نیتروژن پیریدین یک امتیاز مثبت نشان میدهیم (مثلاً هنگام پروتونه شدن یا تشکیل یک نمک چهارتایی)، اما هرگز این کار را در شیمی هماهنگ با پیریدین یا هر لیگاند L دیگر انجام نمیدهیم. این برای همه کسانی که به سیستم سختگیرانه و بدون ابهام ترسیم ساختارها در شیمی آلی عادت دارند بسیار آزاردهنده است، اما باید به آن عادت کنید، چندان دشوار نیست. اما هیچ آنالوگ دقیقی برای SN2 در شیمی ترکیبات هماهنگی وجود ندارد؛ مشابهی دور وجود دارد، اما نسبتاً نادر است و ما واقعاً به آن نیاز نداریم. ما اصلاً نمیتوانستیم درباره مکانیسمهای جایگزینی لیگاند صحبت کنیم، اگر نه برای یک شرایط بسیار مهم که بسیار از آن استفاده خواهیم کرد: جایگزینی لیگاند، چه تداعی یا تجزیهای، لزوماً جداسازی لیگاند قدیمی را پیشفرض میگیرد. و برای ما بسیار مهم است که بدانیم کدام لیگاندها به راحتی ترک می کنند و کدام ضعیف ترک می کنند و ترجیح می دهند در کره هماهنگی فلز باقی بمانند. همانطور که به زودی خواهیم دید، در هر واکنشی برخی از لیگاندها در حوزه هماهنگی باقی می مانند و تغییر نمی کنند. چنین لیگاندهایی معمولاً لیگاند تماشاگر نامیده می شوند (اگر چنین کلمات ساده و «غیرعلمی» را نمی خواهید، از کلمه انگلیسی spectator در رونویسی محلی تماشاگر، لیگاند تماشاگر استفاده کنید، اما، به شما التماس می کنم، نه تماشاگر - این غیرقابل تحمل است!) . و برخی به طور مستقیم در واکنش شرکت می کنند و به محصولات واکنش تبدیل می شوند. اینگونه لیگاندها را کنشگر می نامند (نه بازیگر!) یعنی فعال. کاملاً واضح است که بازیگران لیگاند باید به راحتی وارد حوزه هماهنگی فلز شوند و حذف شوند، در غیر این صورت واکنش به سادگی گیر می کند. اما به دلایل زیادی بهتر است لیگاندهای تماشاگر را در حوزه هماهنگی رها کنیم، اما حداقل برای چنین پیش پا افتاده ای مانند نیاز به جلوگیری از هیاهوهای غیر ضروری در اطراف فلز. بهتر است فقط بازیگران لیگاند و به مقدار لازم بتوانند در فرآیند مورد نظر شرکت کنند. اگر مکانهای هماهنگی موجود بیش از حد لازم وجود داشته باشد، بازیگران لیگاند اضافی ممکن است روی آنها بنشینند، و حتی آنهایی که در واکنشهای جانبی شرکت میکنند و بازده محصول هدف و انتخابپذیری را کاهش میدهند. علاوه بر این ، لیگاندهای تماشاگر تقریباً همیشه بسیاری از عملکردهای مهم را انجام می دهند ، به عنوان مثال ، حلالیت کمپلکس ها را تضمین می کنند ، وضعیت ظرفیت صحیح فلز را تثبیت می کنند ، به خصوص اگر کاملاً معمولی نباشد ، به مراحل جداگانه کمک می کنند ، انتخاب استریو و غیره را فراهم می کنند. ما هنوز آن را رمزگشایی نخواهیم کرد، زیرا وقتی به واکنشهای خاص رسیدیم، همه اینها را با جزئیات بحث خواهیم کرد. به نظر می رسد که برخی از لیگاندها در حوزه هماهنگی باید محکم بسته شده و مستعد تجزیه و جایگزینی با لیگاندهای دیگر نباشند. چنین لیگاندهایی معمولاً نامیده می شوند از نظر هماهنگی پایدار است
. یا به سادگی پایدار، اگر از زمینه مشخص باشد که ما در مورد استحکام پیوندهای لیگاندها صحبت می کنیم، نه در مورد ثبات ترمودینامیکی خود آنها، که اصلاً به ما مربوط نیست. و لیگاندهایی که به راحتی و با کمال میل وارد و خارج می شوند و همیشه آماده راه دادن به دیگران هستند نامیده می شوند ناپایدار هماهنگی
، یا به سادگی labile، و در اینجا، خوشبختانه، هیچ ابهامی وجود ندارد. این احتمالاً بارزترین مثال از این واقعیت است که در کره هماهنگی، یک مولکول بسیار ناپایدار می تواند به لیگاند عالی تبدیل شود، و طبق تعریف، هماهنگی پایدار است، اگر فقط به این دلیل باشد که اگر جرات کند کره گرم و دنج بیرون را ترک کند، هیچ چیز خوبی نخواهد داشت. منتظر آن باشید (به قیمت خروجی دقیقاً انرژی بی ثباتی ضد آروماتیک خواهد بود). سیکلوبوتادین و مشتقات آن بهترین نمونه های شناخته شده ضد آروماتیک بودن هستند. این مولکولها فقط در دماهای پایین و به شکل بسیار تحریف شده وجود دارند - برای اینکه تا حد ممکن از ضد آروماتیک بودن دور شوند، چرخه به یک مستطیل کشیده تغییر شکل داده میشود و محلزدایی را از بین میبرد و حداکثر تضعیف پیوندهای دوگانه را تضعیف میکند. اثر ژان تلر از نوع دوم: سیستم منحط، و مربع سیکلوبوتادین یک بردیکال منحط است، دایره فراست را به خاطر داشته باشید - تحریف شده و تقارن را کاهش می دهد تا انحطاط را از بین ببرد. اما در کمپلکسها، سیکلوبوتادین و سیکلوبوتادینهای جایگزین لیگاندهای تتراهاپتو عالی هستند و هندسه این لیگاندها دقیقاً یک مربع و با طول پیوندهای یکسان است. اینکه چگونه و چرا این اتفاق می افتد یک داستان جداگانه است و تقریباً آنطور که اغلب تصور می شود واضح نیست. باید بدانید که هیچ حصار بتنی مسلح با سیم خاردار و برج های امنیتی بین مناطق لیگاندهای حساس و پایدار وجود ندارد. اولاً به فلز بستگی دارد و LMKO در این زمینه به خوبی کار می کند. به عنوان مثال، فلزات واسطه دیررس لیگاندهای نرم را ترجیح می دهند، در حالی که فلزات واسطه اولیه، فلزات سخت را ترجیح می دهند. فرض کنید، یدید به اتم های d 8 پالادیوم یا پلاتین بسیار محکم می چسبد، اما به ندرت وارد کره هماهنگی تیتانیوم یا زیرکونیوم در پیکربندی d 0 می شود. اما در بسیاری از مجتمع های فلزی با ویژگی های کمتر، یدید خود را به عنوان یک لیگاند کاملاً حساس نشان می دهد و به راحتی جای خود را به دیگران می دهد. مساوی بودن سایر موارد: بیایید همه را دوباره تکرار کنیم، فقط از طرف دیگر در کره هماهنگی فلزات، موارد زیر به طور کلی حفظ می شوند (از نظر هماهنگی پایدار): آخرین وضعیت عجیب به نظر می رسد، اما مجموعه ای را تصور کنید که لیگاندهای مختلف زیادی دارد، که در میان آنها هیچ لیگاند کاملاً پایداری وجود ندارد (بدون شلاتور یا پلی هاپتو لیگاند). سپس، در واکنش ها، لیگاندها، به طور نسبی، به ترتیب پایداری نسبی تغییر می کنند. کم تحرک ترین و آخرین باقی مانده. این ترفند برای مثال زمانی اتفاق می افتد که از کمپلکس های پالادیوم فسفین استفاده می کنیم. فسفین ها لیگاندهای نسبتاً پایداری هستند، اما وقتی تعداد زیادی از آنها وجود داشته باشد، و فلز غنی از الکترون باشد (d 8، d 10)، آنها یکی پس از دیگری جای خود را به لیگاندهای عامل می دهند. اما آخرین لیگاند فسفین معمولاً در کره هماهنگی باقی می ماند و این از نقطه نظر واکنش هایی که این کمپلکس ها در آن شرکت می کنند بسیار خوب است. در ادامه به این موضوع مهم باز خواهیم گشت. در اینجا یک مثال نسبتاً معمولی است زمانی که تنها یک فسفین "آخرین" از کره هماهنگی اولیه کمپلکس پالادیوم فسفین در واکنش هک باقی می ماند. این مثال ما را به مهم ترین مفهوم در واکنش های کمپلکس های فلزات واسطه - مفهوم کنترل لیگاند - نزدیک می کند. بعداً در مورد آن بحث خواهیم کرد. هنگام جایگزینی برخی لیگاندها با برخی دیگر، مهم است که در واکنش پذیری لیگاند ورودی زیاده روی نکنید. وقتی با واکنشهای مولکولهای آلی سروکار داریم، برای ما مهم است که دقیقاً یک مولکول از هر واکنشدهنده را به کره هماهنگی برسانیم. اگر دو مولکول به جای یک مولکول وارد شوند، احتمال واکنش های جانبی با دو لیگاند یکسان وجود دارد. از دست دادن واکنش پذیری نیز به دلیل اشباع کره هماهنگی و عدم امکان معرفی لیگاندهای دیگر لازم برای فرآیند مورد انتظار در آن امکان پذیر است. این مشکل به ویژه هنگامی رخ می دهد که نوکلئوفیل های آنیونی قوی، به عنوان مثال، کربنیون ها، به حوزه هماهنگی وارد می شوند. برای جلوگیری از این امر، از مشتقات واکنش پذیر کمتری استفاده می شود که در آن به جای کاتیون فلز قلیایی که یونیته بالای پیوند را تعیین می کند، از فلزات و متالوئیدهای الکترومثبت کمتری (روی، قلع، بور، سیلیکون و غیره) استفاده می شود. پیوندهای کووالانسی با بخش هسته دوست واکنشهای چنین مشتقاتی با مشتقات فلزات واسطه، محصولات جایگزین لیگاند را تولید میکند، در اصل درست مثل اینکه هسته دوست به شکل آنیونی باشد، اما به دلیل کاهش هسته دوستی با عوارض کمتر و بدون واکنش جانبی. چنین واکنشهای جایگزینی لیگاند را معمولاً ترانس فلزی مینامند تا بر این واقعیت آشکار تأکید شود که به نظر میرسد هسته دوست فلزات را تغییر میدهد - مثبتتر به الکترومثبت کمتر. بنابراین، این نام حاوی عنصر اسکیزوفرنی ناخوشایند است - به نظر می رسید قبلاً توافق کرده بودیم که همه واکنش ها را از نقطه نظر یک فلز واسطه نگاه کنیم، اما ناگهان دوباره آن را از دست دادیم و به این واکنش و فقط این واکنش نگاه می کنیم. از دیدگاه یک هسته دوست شما باید صبور باشید، اصطلاحات اینگونه توسعه یافته و پذیرفته شده است. در واقع، این کلمه به شیمی اولیه ترکیبات آلی فلزی برمی گردد و به این واقعیت که اثر ترکیبات لیتیوم یا آلی منیزیم بر روی هالیدهای فلزات و متالوئیدهای مختلف یکی از روش های اصلی سنتز همه ترکیبات آلی فلزی، در درجه اول ترکیبات غیرگذر است. و واکنشی که ما اکنون در شیمی ترکیبات هماهنگی فلزات واسطه در نظر می گیریم صرفاً تعمیم روش باستانی شیمی آلی فلزی است که همه از آن رشد کرده است. فلزکاری مجدد هم شبیه جایگزینی معمولی است و هم مشابه نیست. به نظر می رسد - اگر یک معرف آلی فلزی غیر گذار را صرفاً یک کربنیون با یک ضد یون در نظر بگیریم، پیوند کربن-فلز غیر گذار یونی است. اما به نظر می رسد این ایده فقط برای الکترومثبت ترین فلزات - منیزیم - صادق است. اما در مورد روی و قلع این ایده بسیار دور از واقعیت است. بنابراین دو پیوند σ و چهار اتم در انتهای خود وارد واکنش می شوند. در نتیجه، دو پیوند σ جدید تشکیل میشود و چهار اتم به ترتیب متفاوتی به یکدیگر پیوند میدهند. به احتمال زیاد، همه اینها به طور همزمان در یک حالت گذار چهار عضوی رخ می دهد، و خود واکنش مانند بسیاری از واکنش های دیگر فلزات واسطه، ویژگی هماهنگی دارد. فراوانی الکترونها و اوربیتالها به معنای واقعی کلمه برای همه سلیقهها و انواع تقارنها باعث میشود که فلزات واسطه قادر به حفظ همزمان پیوندها در حالتهای گذار با چندین اتم باشند. در مورد فلزکاری مجدد، یک مورد خاص از یک فرآیند بسیار کلی به دست می آوریم که به سادگی متاتز پیوند σ نامیده می شود. آنها را فقط با متاتز واقعی الفین ها و استیلن ها اشتباه نگیرید، که واکنش های کاتالیزوری تمام عیار با مکانیسم های خاص خود هستند. در این مورد ما در مورد مکانیسم انتقال فلز یا فرآیند دیگری صحبت می کنیم که در آن چیزی مشابه رخ می دهد.

واکنش لیگاندهای هماهنگ شده










واکنش ترکیبات آلی فلزی



لیگاندها از هر نوع می توانند در هر ترکیبی جایگزین شوند
جایگزینی شامل لیگاندهای هاپتو

جایگزینی، افزودن و تفکیک لیگاندها ارتباط نزدیک و جدایی ناپذیری دارند



لیگاندهای پایدار و ناپایدار
سیکلوبوتادین به عنوان لیگاند
لیگاندهای ناپایدار هماهنگی
لیگاندهای با ثبات هماهنگ

فلزسازی مجدد

انتقال فلز چگونه اتفاق می افتد؟