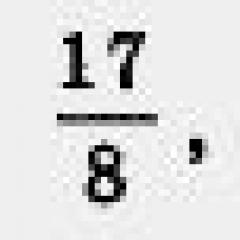Получение и практическое применение. Тема урока
Амины вошли в нашу жизнь совершенно неожиданно. Еще недавно это были ядовитые вещества, столкновение с которыми могло привести к смерти. И вот, спустя полтора столетия, мы активно пользуемся синтетическими волокнами, тканями, строительными материалами, красителями, в основе которых лежат амины. Нет, они не стали безопаснее, просто люди смогли их "приручить" и подчинить, извлекая для себя определенную пользу. О том, какую именно, и поговорим далее.
Определение
Для качественного и количественного определение анилина в растворах или соединениях используется реакция с в конце которой на дно пробирки выпадает белый осадок в виде 2,4,6-триброманилина.
Амины в природе
Амины встречаются в природе повсеместно в виде витаминов, гормонов, промежуточных продуктов обмена, есть они и в организме животных и в растениях. Кроме того, при гниении живых организмов также получаются средние амины, которые в жидком состоянии распространяют неприятный запах селедочного рассола. Широко описанный в литературе «трупный яд» появился именно благодаря специфическому амбре аминов.
Длительное время рассматриваемые нами вещества путали с аммиаком из-за похожего запаха. Но в середине девятнадцатого века французский химик Вюрц смог синтезировать метиламин и этиламин и доказать, что при сгорании они выделяют углеводород. Это было принципиальным отличием упомянутых соединений от аммиака.
Получение аминов в промышленных условиях
Так как атом азота в аминах находится в низшей степени окисления, то восстановление азотосодержащих соединений является наиболее простым и доступным способом их получения. Именно он широко распространен в промышленной практике из-за своей дешевизны.
Первый метод представляет собой восстановление нитросоединений. Реакция, во время которой образуется анилин, носит название ученого Зинина и была проведена в первый раз в середине девятнадцатого века. Второй способ заключается в восстановлении амидов при помощи алюмогидрида лития. Из нитрилов тоже можно восстановить первичные амины. Третий вариант - реакции алкилирования, то есть введение алкильных групп в молекулы аммиака.
Применение аминов

Сами по себе, в виде чистых веществ, амины используются мало. Один из редких примеров - полиэтиленполиамин (ПЭПА), который в бытовых условиях облегчает затвердение эпоксидной смолы. В основном первичный, третичный или вторичный амин - это промежуточный продукт в производстве различных органических веществ. Самым востребованным является анилин. Он - основа большой палитры анилиновых красителей. Цвет, который получится в конце, зависит непосредственно от выбранного сырья. Чистый анилин дает синий цвет, а смесь анилина, орто- и пара-толуидина будет красной.
Алифатические амины нужны для получения полиамидов, таких как нейлон и другие Они применяются в машиностроении, а также в производстве канатов, тканей и пленок. Кроме того, алифатические диизоцинаты используются в изготовлении полиуретанов. Из-за своих исключительных свойств (легкость, прочность, эластичность и способность прикрепляться к любым поверхностям) они востребованы в строительстве (монтажная пена, клей) и в обувной промышленности (противоскользящая подошва).
Медицина - еще одна сфера, где применяются амины. Химия помогает синтезировать из них антибиотики группы сульфаниламидов, которые успешно применяют в качестве препаратов второй линии, то есть резервной. На случай, если у бактерий разовьется устойчивость к основным лекарствам.
Вредное воздействие на организм человека
Известно, что амины - это весьма токсичные вещества. Вред здоровью может нанести любое взаимодействие с ними: вдыхание паров, контакт с открытой кожей или попадание соединений внутрь организма. Смерть наступает от нехватки кислорода, так как амины (в частности, анилин) связываются с гемоглобином крови и не дают ему захватывать молекулы кислорода. Тревожными симптомами являются одышка, посинение носогубного треугольника и кончиков пальцев, тахипноэ (учащенное дыхание), тахикардия, потеря сознания.
В случае попадания этих веществ на оголенные участки тела необходимо быстро убрать их ватой, предварительно смоченной в спирте. Делать это надо максимально аккуратно, чтобы не увеличить площадь загрязнения. Если появятся симптомы отравления - обязательно нужно обратиться к врачу.
Алифатические амины - это яд для нервной и сердечно-сосудистой систем. Они могут вызвать угнетение функций печени, ее дистрофию и даже онкологические заболевания мочевого пузыря.
Билет№19
Задача. Вычислить объем углекислого газа, полученного при сгорании 8 грамм метана.
1. Окислительно – восстановительные реакции (на примере взаимодействия алюминия с оксидами некоторых металлов, концентрированной серной кислоты с медью).
Окислительно-восстановительные реакции (разобрать на примерах взаимодействия алюминия с оксидом железа (III), азотной кислоты с медью).
К окислительно-восстановительным реакциям могут быть отнесены химические реак-ции следующих типов.
Реакции замещения (вытеснения)
Примером реакций этого типа может служить реакция между оксидом железа (III) и алюминием. В этой реакции алюминий вытесняет железо из раствора, причем сам алюминий окисляется, а железо восстанавливается.
Приведем еще два примера:
В этой реакции хлор вытесняет бром из раствора (хлор окисляется, бром восстанавливается), содержащего ионы брома.
Реакции металла с кислотами
Эти реакции, в сущности, тоже представляют собой реакции замещения. В качестве примера приведем реакцию между медью и азотной кислотой. Медь вытесняет водород из кислоты. При этом происходит окисление меди, которая превращается в гидратированный катион, а содержащиеся в растворе кислоты гидратированные протоны азота восстанавливаются, образуя оксид азота.
Реакции металлов с водой
Эти реакции тоже принадлежат к типу реакций замещения. Они сопровождаются вытеснением из воды водорода в газообразном состоянии. В качестве примера приведем реакцию между металлическим натрием и водой:
Реакции металлов с неметаллами
Эти реакции могут быть отнесены к реакциям синтеза. В качестве примера приведем образование хлорида натрия в результате сгорания натрия в атмосфере хлора
2. Анилин – представитель аминов, химическое строение и свойства.
Основные свойства анилина: а) ароматический амин – анилин имеет большое практическое значение; б) анилин C6H5NH2 – это бесцветная жидкость, которая плохо растворяется в воде; в) имеет светло-коричневую окраску при частичном окислении на воздухе; г) анилин сильно ядовит. Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда. 1. Анилин не изменяет окраски лакмуса, но при взаимодействии с кислотами образует соли. 2. Если к анилину прилить концентрированную соляную кислоту, то происходит экзотермическая реакция и после охлаждения смеси можно наблюдать образование кристаллов соли: +Cl-– хлорид фениламмония. 3. Если на раствор хлорида фениламмония подействовать раствором щелочи, то снова выделится анилин: [С6Н5NН3]++ Сl-+ Nа++ ОН-? Н2О + С6Н5NН2 + Nа++ СI-. Здесь выражено влияние ароматического радикала фенила – С6Н5. 4. В анилине C6H5NH2 бензольное ядро смещает к себе неподеленную электронную пару азота аминогруппы. При этом электронная плотность на азоте уменьшается и он слабее связывает ион водорода, а это значит, что свойства вещества как основания проявляются в меньшей степени. 5. Аминогруппа влияет на бензольное ядро. 6. Бром в водном растворе не реагирует с бензолом. Способы применения анилина: 1) анилин– один из важнейших продуктов химической промышленности; 2) он является исходным веществом для получения многочисленных анилиновых красителей; 3) анилин используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности. 1. Промышленность органического синтеза началась с производства красителей. 2. Широкое развитие этого производства стало возможным на основе использования реакции получения анилина, известной сейчас в химии под названием реакции Зинина. Особенности реакции Зинина: 1) эта реакция заключается в восстановлении нитробензола и выражается уравнением: С6Н5-NO2 + 6Н? С6Н5-NН2 + 2Н2О; 2) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде; 3) восстановление нитросоединений соответствующего строения – это общий способ получения аминов.
Урок 4 . Анилин как представитель ароматических аминов
Состав и строение, молекулярная и структурная формулы;
Взаимное влияние атомов в молекуле;
Физические свойства;
Химические свойства: реакции анилина по аминогруппе и ароматическому ядру.
Состав и строение, молекулярная и структурная формулы . Анили́н (аминобензол, фениламин) - органическое соединение с формулой C 6 H 5 NH 2 , состоит из бензольного кольца, в котором один атом водорода замещен на аминогруппу. Простейший ароматический амин. Структурная формула:
Впервые анилин получил в 1826 в процессе перегонки индиго с известью немецкий химик, который дал ему название «кристаллины». 1834 Ф. Рунге обнаружил анилин в каменноугольной смоле и назвал «кианолом». 1841 Ю. Ф. Фришце получил анилин в результате нагрева индиго с раствором КОН и назвал его «анилином». 1842 анилин получил М. М. Зинин путем восстановления нитробензола (NH 4) 2 SO 3 и назвал его «бензидамом». 1843 А. В. Гофман установил идентичность всех перечисленных соединений. Слово «анилин» происходит от названия одного из растений, содержащих индиго.
Взаимное влияние атомов в молекуле .
Влияние аминогруппы на свойства бензольного кольца. По отношению к кольцу аминогруппа выступает донором электронов, т.е. нагнетает на кольцо электронную плотность. Эта избыточная плотность в кольце в основном сосредотачивается в положениях 2,4,6 (орто - и ядра-положениях):

В результате: 1) реакции замещения в кольце для анилина протекают легче, чем для бензола; 2) вступающий в кольцо заместитель направляется аминогруппой преимущественно в положения 2,4,6.
Влияние кольца на свойства аминогруппы. Ароматическое кольцо оттягивает часть электронной плотности с атома азота, вовлекая ее в сопряжение с л-системой. Поэтому основные свойства анилина выражены слабее, чем у аммиака и тем более, чем у алифатических аминов. Водный раствор анилина не изменяет окраску индикаторов. В этом и состоит влияние бензольного кольца на свойства аминогруппы.
Изучение среды раствора анилина http://my.mail.ru/mail/ntl0000/video/29154/31055.html?related_deep=1
Физические свойства . Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит
Физические свойства анилина https://www.youtube.com/watch?v=2c6J-4sNGPc
Химические свойства . Обязательно просмотрите видео .
Химические свойства https://www.youtube.com/watch?v=qQ6zqUXDJdk
Анилин в отличие от бензола легко реагирует с бромной водой с образованием белого нерастворимого в воде осадка 2,4,6-триброманилина:

Аналогично протекает реакция анилина с раствором хлора в СС1 4 , этаноле.
Анилин практически не реагирует с водой (очень слабые основные свойства); основные свойства анилина проявляются в реакциях с сильными минеральными кислотами:

Анилин реагирует с хлорангидридом уксусной кислоты:

При обработке таких солей водными растворами щелочей можно выделить анилин:
Окисление анилина https://www.youtube.com/watch?v=nvxipFGxTRk
Взаимодействие анилина с соляной кислотой https://www.youtube.com/watch?v=VNUTpSaWQ0Q
Бромирование анилина https://www.youtube.com/watch?v=1UPJceDpelY
Пары анилина сгорают в избытке кислорода
4C 6 H 5 –NH 2 + 31O 2 → 24CO 2 + 14H 2 O + 2N 2
Горение анилина https://www.youtube.com/watch?v=cYtCWMczFFs
Тип урока: урок изучения нового материала на основе имеющихся знаний
Цель урока: Обобщить, расширить и систематизировать знания и понятия учеников по изученному разделу «Амины». Акцентировать внимание на ключевых понятиях темы «Анилин».
Прогнозируемый результат: Знания будут обобщены и систематизированы с целью.
Задачи урока:
Образовательные:
Проверить знания по изученному разделу, закрепить новый материал, углубить знания по теме; обобщить изученный материал; проверить усвоение материала на основе творческих заданий; формировать умения применять полученные знания на практике при выполнении упражнений и решении задач;
Развивающие:
Способствовать становлению умения оценивать товарища и самого себя развивать умение высказывать свою точку зрения, вести аргументированный разговор, делать выводы на основе анализа; помочь учащимся увидеть результаты своего труда; формировать у учащихся умения выделять главное; развивать познавательную активность и творческие способности.
Воспитательные:
Воспитывать активную жизненную позицию, честность, человеческую порядочность; воспитывать в учениках средствами урока уверенность в своих силах; подвести учащихся к выводу о самоценности человеческих качеств.
Ход урока
I Организационно-мотивационный этап (1 мин)
Цель этапа (ожидаемый результат): мотивировать учащихся на активную работу
Задачи этапа: Настроить учащихся на высокий темп урока
Приветствие учащихся на уроке. Сегодня наш урок будет очень насыщенным, и перед нами будет стоять ряд задач.
Но прежде запишите Д-З Слайд 2 Домашнее задание
(запись в дневник)
1. § 52, § 51повторить.
2. § 52, №4-6 письменно, 1-3 устно
I I Целеполагание (1,5 мин)
Цель: Обобщить знания по пройденному разделу «Амины», приобрести знания по теме урока, уметь сравнивать анилин с другими представителями ароматических и с алифатическими аминами
Задачи: Слайд 3 Задачи на уроке
Вспомнить физические и химические свойства аминов; продолжать формировать умение составлять уравнения реакций, характеризующих свойства аминов; познакомиться с особенностями химических процессов по разделу «Анилин»; продолжать учиться видеть причину течения хим. реакций в зависимости от строения молекулы; оценить свою работу на уроке.
III Основная часть. Изучение нового с опорой на известные факты
Строение аминов и анилина
Изучение нового материала на базе имеющихся знаний
Амины — органические производные , в молекуле которого один, два или все три атома замещены углеводородным остатком.
Соответственно обычно выделяют три типа аминов:
первичный амин метиламин
CH3CH2—NH—CH2CH3
вторичный амин диэтиламин
H3CСH2—N—CH2CH3
третичный амин триэтиламин
Для аминов характерна структурная изомерия:
Изомерия углеродного скелета
Изомерия положения функциональной группы
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия).
Тренинг по изомерии и номенклатуре аминов
Изучение нового материала
Электронное строение анилина
Амины, в которых аминогруппа связана непосредственно связана с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин.
Основной отличительной чертой электронного строения аминов является наличие у атома , входящего в функциональную группу, неподеленной электронной пары. Это приводит к тому, что амины проявляют свойства оснований.
Существуют ионы, которые являются продуктом формального замещения на углеводородный радикал всех атомов водорода в ионе аммония.
Эти ионы входят в состав солей, похожих на соли аммония. Они называются четвертичными солями.
Тренинг по изомерии и номенклатуре ароматических аминов
Изучение физических свойств анилина в сравнении с физическими свойствами аминов
Физические свойства аминов и анилина
Простейшие амины (метиламин, диметиламин, триметил-амин) — газообразные вещества. Остальные низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но неспособными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 °С.
Русский химик-органик, академик.
открыл (1842) реакцию восстановления ароматических нитросоединений и получил анилин. Доказал, что амины — основания, способные образовывать соли с различными кислотами. Анилин имеет такое большое промышленное значение, что за одну только реакцию имя этого учёного может быть вписано «золотыми буквами в историю химии.
Химические свойства аминов и анилина
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
1. Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания.
Как вы уже знаете из курса , реакция аммиака с водой приводит к образованию гидроксид-ионов. Раствор аммиака в воде имеет щелочную реакцию. Растворы аминов в воде также дают щелочную реакцию. А вот анилин является более слабым основанием и с взаимодействует неохотно.
Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами.
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Это связано с наличием одного и более донорных алкильных заместителей, положительный индуктивный эффект которых повышает электронную плотность на атоме азота. Повышение электронной плотности превращает азот в более сильного донора пары электронов, что повышает его основные свойства.
Так же и анилин в реакциях с кислотами основные свойства, но они менее выражены, чем у алифатических аминов.
В случае ароматических аминов аминогруппа и бензольное кольцо оказывают существенное влияние друг на друга.
Аминогруппа является ориентантом первого рода. Аминогруппа обладает отрицательным индуктивным эффектом и выраженным положительным мезомерным эффектом. Таким образом, реакции электрофильного замещения (бромирование, нитрование) будут приводить к орто - и пара-замещенным продуктам.
Обратим внимание, что в отличие от бензола, который бромируется только в присутствии катализатора — хлорида железа(III), анилин способен реагировать с бромной водой. Это объясняется тем, что аминогруппа, повышая электронную плотность в бензольном кольце (вспомните аналогичное влияние заместителей в молекулах толуола и фенола), активизирует ароматическую систему в реакциях электрофильного замещения. Кроме того, анилин, в отличие от бензола, немного растворим в воде.
Сопряжение п-системы бензольного кольца с неподеленной электронной парой аминогруппы приводит к тому, что анилин является существенно более слабым основанием, чем алифатические амины.
Особенности реакций полного и неполного окисления аминов и анилина, взаимный переход реакций окисления и восстановления показать.
ЗАПИСЫВАЮТСЯ ВСЕ ПРИМЕРЫ УХР, НАЗЫВАЮТСЯ ПРОДУКТЫ (объяснение ведётся в форме эвристической беседы)
Получение аминов и анилина
1. Получение аминов из галогенопроизводных
СН3СН2Вг + NН3 —> СН3СН2NH2 С6Н5Вг + NН3 —> С6Н5NH2
2. Получение первичных аминов восстановлением нитросоединений — алифатических и ароматических. Восстановителем является водород «в момент выделения», который образуется при взаимодействии, например, цинка со щелочью или железа с соляной кислотой.
Применение аминов и анилина
Амины широко применяются для получения лекарств, полимерных материалов. Анилин — важнейшее соединение данного класса (схема), которое используют для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол), взрывчатые вещества, ракетное топливо, пестициды.
«Активные» или «реактивные» красители - лучший выбор из анилиновых красителей, существующих на современном рынке. Эта группа красителей превосходно зарекомендовала себя для тканей из волокон растительного происхождения (хлопок, лён, вискоза, конопля, бамбук, бумага, джут и т. д.).
IV Закрепление изученного материала
1. Укажите число у-связей в молекуле метил-фенил-амина:
а) 6; б) 5; в) 7; г) 4.
2. Какие свойства анилина объясняются влиянием фенильного радикала на аминогруппу:
а) анилин вступает в реакции замещения легче, чем бензол;
б) электронная плотность в ароматическом кольце распределена неравномерно;
в) в отличие от аммиака водный раствор анилина не изменяет окраски лакмуса;
г) как основание анилин слабее, чем аммиак?
3. Напишите графические формулы изомерных аминов с общей молекулярной формулой С4Н11N. Назовите эти вещества.
4. а)Из неорганического сырья получите хлоридфенил аммония.
HC1 + KOH спирт +HI +NH3 +HC1
б) Пропанол-2 → ? → ? → ? → ? → ?
5. Найдите массу 19,6%-ного раствора серной кислоты, способного прореагировать с 11,2 л метиламина (н. у.) с образованием средней соли.
6. Смесь фенола и анилина полностью прореагировала с 480 г. бромной воды с w (Вr2) = 3 %. На нейтрализацию продуктов реакции затратили 36,4 см3 раствора NаОН (w = 10%, р=1,2 г/см3). Определите массовые доли веществ в исходной смеси.
7. На нейтрализацию 30 г смеси бензола, фенола и анилина нужно 49,7 мл 17% НС1 (p = 1,0 г/мл). В реакции такого же количества смеси с бромной водой образуется 99,05 г осадка. Найдите массовые доли компонентов в исходной смеси.
V Оценка деятельности класса. Рефлексия.
Основные свойства анилина:
а) ароматический амин – анилин имеет большое практическое значение;
б) анилин C 6 H 5 NH 2 – это бесцветная жидкость, которая плохо растворяется в воде;
в) имеет светло-коричневую окраску при частичном окислении на воздухе;
г) анилин сильно ядовит.
Основные свойства у анилина проявляются слабее, чем у аммиака и аминов предельного ряда.
1. Анилин не изменяет окраски лакмуса, но при взаимодействии с кислотами образует соли.
2. Если к анилину прилить концентрированную соляную кислоту, то происходит экзотермическая реакция и после охлаждения смеси можно наблюдать образование кристаллов соли: + Cl - – хлорид фениламмония.
3. Если на раствор хлорида фениламмония подействовать раствором щелочи, то снова выделится анилин: [С 6 Н 5 NН 3 ] + + Сl - + Nа + + ОН - → Н 2 О + С 6 Н 5 NН 2 + Nа + + СI - . Здесь выражено влияние ароматического радикала фенила – С 6 Н 5 .
4. В анилине C 6 H 5 NH 2 бензольное ядро смещает к себе неподеленную электронную пару азота аминогруппы. При этом электронная плотность на азоте уменьшается и он слабее связывает ион водорода, а это значит, что свойства вещества как основания проявляются в меньшей степени.
5. Аминогруппа влияет на бензольное ядро.
6. Бром в водном растворе не реагирует с бензолом.
Способы применения анилина:
1) анилин – один из важнейших продуктов химической промышленности;
2) он является исходным веществом для получения многочисленных анилиновых красителей;
3) анилин используется при получении лекарственных веществ, например сульфаниламидных препаратов, взрывчатых веществ, высокомолекулярных соединений и т. д. Открытие профессором Казанского университета Н.Н. Зининым (1842 г.) доступного способа получения анилина имело большое значение для развития химии и химической промышленности.
1. Промышленность органического синтеза началась с производства красителей.
2. Широкое развитие этого производства стало возможным на основе использования реакции получения анилина, известной сейчас в химии под названием реакции Зинина.
Особенности реакции Зинина:
1) эта реакция заключается в восстановлении нитробензола и выражается уравнением:
С 6 Н 5 -NO 2 + 6Н → С 6 Н 5 -NН 2 + 2Н 2 О;
2) распространенным промышленным способом получения анилина является восстановление нитробензола металлами, например железом (чугунными стружками), в кислой среде;
3) восстановление нитросоединений соответствующего строения – это общий способ получения аминов.
74. Аминокислоты
Строение и физические свойства.
1. Аминокислоты – это вещества, в молекулах которых содержатся одновременно аминогруппа NН 2 и карбоксильная группа – СООН.
Например: NH 2 -CH 2 -COOH – аминоуксусная кислота, CH 3 -CH(NH 2)-COOH – аминопропионовая кислота.
2. Аминокислоты – это бесцветные кристаллические вещества, растворимые в воде.
3. Многие аминокислоты имеют сладкий вкус.
4. Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой. При этом аминогруппа может находится у разных атомов углерода, что обусловливает один из видов изомерии аминокислот.
Некоторые представители аминокислот:
1) аминоуксусная кислота Н 2 N-СН 2 -СООН;
2) аминопропионовая кислота Н 2 N-СН 2 -СН 2 -СООН;
3) аминомасляная кислота Н 2 N-СН 2 -СН 2 -СН 2 -СООН;
4) аминовалериановая кислота Н 2 N-(СН 2) 4 -СООН;
5) аминокапроновая кислота Н 2 N-(СН 2) 5 -СООН.
5. Чем больше атомов углерода в молекуле аминокислоты, тем больше может существовать изомеров с различным положением аминогруппы по отношению к карбоксильной группе.
6. Чтобы в названии изомеров можно было указывать положение группы – NH 2 по отношению к карбоксилу, атомы углерода в молекуле аминокислоты обозначаются последовательно буквами греческого алфавита: а) α-аминокапроновая кислота; б) β-аминокапроновая кислота.
Особенности строения аминокислот заключаются в изомерии, которая может быть обусловлена также разветвлением углеродного скелета, а также строением своей углеродной цепи.
Способы применения аминокислот:
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных, минуя желудочно-кишечный тракт;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.