Реакція заміщення лігандів. Тема роботи: Елементарні стадії за участю координаційних та металоорганічних сполук у розчинах та на поверхні металів та оксидів
Елементарні стадії органічних реакцій, що каталізуються кислотами, основами, нуклеофільними каталізаторами, комплексами металів, твердими металами та їх сполуками в газофазних або рідкофазних гетерогенних та гомогенних процесах, - це реакції утворення та перетворення різних органічних та металоорганічних інтермедіатів, а також комплексів. До органічних проміжних сполук відносяться іони карбенія R + , карбонія RH 2 + , карбо-аніони R-, аніон- та катіонрадикали, радикали та бірадикали R·, R:, а також молекулярні комплекси органічних донорних та акцепторних молекул (DA), які називають також комплексами з перенесенням заряду. У гомогенному та гетерогенному каталізі комплексами металів (металокомплексному каталізі) органічних реакцій інтермедіати - комплексні (координаційні) сполуки з органічними та неорганічними лігандами, металоорганічні сполуки зі зв'язком М-С, які у більшості випадків є координаційними сполуками. Аналогічна ситуація має місце і у разі "двовимірної" хімії на поверхні твердих металевих каталізаторів. Розглянемо основні типи реакцій металокомплексів та металоорганічних сполук.
Елементарні стадії за участю комплексів металівРеакції металокомплексів можна поділити на три групи:
а) реакції перенесення електрона;
б) реакції заміщення лігандів;
в) реакції координованих лігандів.
Реакції перенесення електронів
Два механізми реалізуються в реакціях перенесення електронів - зовнішньосферний механізм (без змін у координаційних сферах донора і акцептора) і містковий (внутрішньосферний) механізм, що призводить до змін у координаційній сфері металу.
Розглянемо зовнішньосферний механізм на прикладі октаедричних комплексів вихідних металів. У разі симетричних реакцій ( G 0 = 0)
константи швидкості змінюються дуже широкому інтервалі значень - від 10- 12 до 10 5 л·моль- 1 ·сек- 1 , залежно від електронної конфігурації іона і його розбудови під час процесу. У цих реакціях дуже наочно проявляється принцип найменшого руху – найменшої зміни валентної оболонки учасників реакції.
У реакції перенесення електрона (1) (З * - ізотоп атома З)
(симетрична реакція), Co 2+ (d 7) переходить у Co 3+ (d 6). Електронна конфігурація (валентна оболонка) у ході цього переходу не змінюється
6 електронів на тричі виродженому зв'язувальному рівні залишаються без зміни (), а з розпушувального e gрівня знімається один електрон.
Константа швидкості другого порядку реакції (1) k 1 = 1.1 лмоль-1 сек-1. Оскільки Phen (фенантролін) відноситься до сильних лігандів, максимальна кількість з 7 d-електронів спарений (спін-спарений стан). У разі слабкого ліганду NH3 ситуація кардинально змінюється. Co(NH 3) n 2+ (n = 4, 5, 6) знаходиться в спин-неспареному (високоспіновому) стані.
Більш міцний комплекс Co(NH 3) 6 3+ (міцніше Co(NH 3) 6 2+ ~ у 10 30 разів) знаходиться у спін-спареному стані, як і комплекс із Phen. У зв'язку з цим у процесі перенесення електрона повинна сильно перебудуватися валентна оболонка і в результаті k= 10-9 лмоль-1 сек-1. Ступінь перетворення З 2+ на З 3+ , рівна 50%, досягається у разі ліганду Phen за 1 секунду, а у разі NH 3 ~ за 30 років. Очевидно, що стадію з такою швидкістю (формально елементарну) можна виключити із набору елементарних стадій під час аналізу механізмів реакції.
Величина Gдля реакції перенесення електронів при утворенні комплексу зіткнення згідно з теорією Маркуса включає два компоненти і
Перший член - енергія реорганізації зв'язків M-L всередині комплексу (довжина та міцність зв'язку при зміні валентного стану). Величина включає енергію перебудови зовнішньої сольватної оболонки у процесі зміни координат M-L і заряду комплексу. Чим менше зміна електронного оточення і менше зміна довжини M-L, тим нижче, чим більше за розмірами ліганди, тим менше і, в результаті, вища швидкість передачі електронів. Величину для загального випадку можна розрахувати за рівнянням Маркуса
де. При = 0.
У разі внутрішньосферного механізму процес перенесення електрона полегшується, оскільки один з лігандів першого комплексу утворює містковий комплекс з другим комплексом, витісняючи з нього один з лігандів
Константи швидкості такого процесу на 8 порядків вищі за константу для відновлення Cr(NH 3) 6 3+ . У таких реакціях відновлюючий агент має бути лабільним комплексом, а ліганд в окислювачі повинен бути здатний до утворення містків (Cl-, Br-, I-, N 3-, NCS-, bipy).
Реакції заміщення лігандівОдна з найважливіших стадій у металокомплексному каталізі – взаємодія субстрату Y з комплексом – відбувається за трьома механізмами:
а) Заміщення ліганду розчинником. Зазвичай таку стадію зображують як дисоціацію комплексу
Суть процесу в більшості випадків - заміщення ліганду L розчинником S, який далі легко замінюється молекулою субстрату Y
б) Приєднання нового ліганду за вільною координатою з утворенням асоціату з подальшою дисоціацією ліганду, що заміщується
в) Синхронне заміщення (типу S N 2) без утворення інтермедіату
У разі комплексів Pt(II) дуже часто швидкість реакції описується двомаршрутним рівнянням
де k Sі k Y- константи швидкості процесів, що протікають по реакціях (5) (з розчинником) та (6) з лігандом Y. Наприклад,
Остання стадія другого маршруту є сумою трьох швидких елементарних стадій - відщеплення Cl-, приєднання Y та відщеплення молекули H 2 O.
У плоских квадратних комплексах переходних металів спостерігається транс-ефект, сформульований І.І. Черняєвим - вплив LT на швидкість заміщення ліганда, що знаходиться в транс-положенні до ліганду LT. Для комплексів Pt(II) транс-ефект зростає у ряді лігандів:
H 2 O ~ NH 3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
Наявність кінетичного трансефекту та термодинамічного трансвпливу пояснює можливість синтезу інертних ізомерних комплексів Pt(NH 3) 2 Cl 2 :
Реакції координованих лігандів§ Реакції електрофільного заміщення (SE) водню металом у координаційній сфері металу та зворотні ним процеси
SH - H2O, ROH, RNH2, RSH, ArH, RCCН.
Навіть молекули H 2 та CH 4 беруть участь у реакціях такого типу
§ Реакції впровадження L зі зв'язку M-X
У разі X = R (металоорганічний комплекс) координовані металом молекули також впроваджуються по зв'язку M-R (L - CO, RNC, C 2 H 2 , C 2 H 4 , N 2 , CO 2 , O 2 та ін). Реакції впровадження є результатом внутрішньомолекулярної атаки нуклеофіла X на координовану по - або -типу молекулу. Зворотні реакції - реакції - та -елімінування
§ Реакції окисного приєднання та відновного елімінування
M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4-
Очевидно, у цих реакціях завжди має місце попередня координація молекули, що приєднується, але це не завжди вдається зафіксувати. У зв'язку з цим наявність вільного місця в координаційній сфері або місця, пов'язаного з розчинником, який легко замінюється субстратом, є важливим фактором, що впливає на реакційну здатність металокомплексів. Наприклад, біс-алільні комплекси Ni є хорошими попередниками каталітично активних частинок, оскільки внаслідок легкого відновного елімінування біс-алілу з'являється комплекс з розчинником, т.зв. "Голий" нікель. Роль вільних місць ілюструє такий приклад:
§ Реакції нуклеофільного та електрофільного приєднання до - та -комплексів металів
Реакції металоорганічних сполукВ якості інтермедіатів каталітичних реакцій зустрічаються як класичні металоорганічні сполуки, що мають зв'язки M-C, M=C і MC, так і некласичні сполуки, в яких органічний ліганд координований по 2, 3, 4, 5 і 6-типу, або є елементом електронно-дефіцитних структур - місткові СН 3 і 6 Н 6 -групи, некласичні карбіди (Rh 6 C(CO) 16 , C(AuL) 5 + , C(AuL) 6 2+ та ін).
Серед специфічних механізмів для класичних-металоорганічних сполук відзначимо кілька механізмів. Так, встановлено 5 механізмів електрофільного заміщення атома металу зв'язку M-C.
електрофільне заміщення з нуклеофільним сприянням
AdE Приєднання-елімінування
AdE(C) Приєднання до атома С в sp 2 -гібридизації
AdE(M) Приєднання окисне до металу
Нуклеофільне заміщення у атома вуглецю в реакціях деметалювання металоорганічних сполук, відбувається як окислювально-відновний процес:
Можлива участь окислювача у такій стадії
Таким окислювачем може служити CuCl 2 , п-бензохінон, NO 3 - та ін сполуки. Наведемо ще дві характерні для RMX елементарні стадії:
гідрогеноліз зв'язку M-C
та гомоліз зв'язку M-C
Важливим правилом, що стосується всіх реакцій комплексних і металоорганічних сполук і пов'язаних з принципом найменшого руху, є правило 16-18-електронної оболонки Толмена (розділ 2).
Координаційні та металоорганічні сполукина поверхніВідповідно до сучасних уявлень на поверхні металів утворюються комплекси та металоорганічні сполуки, аналогічні сполукам у розчинах. Для поверхневої хімії істотно участь кількох атомів поверхні в утворенні таких сполук та, звичайно, відсутність заряджених частинок.
Поверхневими групами можуть бути будь-які атоми (H, O, N, C), групи атомів (OH, OR, NH, NH 2 , CH, CH 2 , CH 3 , R), координовані молекули CO, N 2 , CO 2 , C 2 H 4 , C 6 H 6 . Наприклад, при адсорбції на поверхні металу виявлені наступні структури:
Молекула З 2 Н 4 на поверхні металу утворює-комплекси з одним центром і ди-пов'язані етиленові містки M-CH 2 CH 2 -M, тобто. по суті, металоцикли
На поверхні Rh, наприклад, при адсорбції етилену, відбуваються такі процеси перетворення етилену з підвищенням температури:
Реакції поверхневих інтермедіатів включають стадії окисного приєднання, відновного елімінування, впровадження, - та -елімінування, гідрогенолізу M-C і С-З зв'язків та ін реакції металоорганічного типу, проте без появи вільних іонів. У таблицях наведено механізми та інтермедіати поверхневих перетворень вуглеводнів на металах.
Таблиця 3.1. Каталітичні реакції, що включають розрив СЗ зв'язку.
Позначення:
Алкіл, металоцикл;
Карбен, аліл;
Карбін, вініл.
Таблиця 3.2. Каталітичні реакції, що включають утворення СЗ зв'язку.
Позначення: див. табл. 3.1.
Утворення всіх наведених металоорганічних сполук на поверхні металів підтверджено фізичними методами.
Запитання для самоконтролю
1) Як проявляється правило найменшої зміни валентної оболонки металу в ході ЕС в реакціях перенесення електрона?
2) Чому координаційні вакансії сприяють ефективному взаємодії із субстратом?
3) Перелічити основні типи реакцій координованих лігандів.
4) Навести механізми електрофільного заміщення у реакціях металоорганічних сполук з НХ.
5) Навести приклади поверхневих металоорганічних сполук.
6) Навести приклади участі металкарбенових поверхневих комплексів у перетвореннях вуглеводнів.
Література для поглибленого вивчення
1. Темкін О.М., Кінетика каталітичних реакцій у розчинах комплексів металів, М., МІТХТ, 1980, Ч.III.
2. Коллмен Дж., Хігедас Л., Нортон Дж., Фінке Р., Металоорганічна хімія вихідних металів, М., Світ, 1989, т. I, т. II.
3. Мойсеєв І.І., -Комплекси в окисленні олефінів, М., Наука, 1970.
4. Темкін О.М., Шестаков Г.К., Трегер Ю.А., Ацетилен: Хімія. Механізми реакцій. Технологія. М., Хімія, 1991, 416 с., Розділ 1.
5. Хенріці-Оліве Р., Оліве С., Координація та каталіз, М., Світ, 1980, 421 с.
6. Крилов О.В., Матишак В.А., Проміжні сполуки в гетерогенному каталізі, М., Наука, 1996.
7. Zaera F., An Organometallic Guide до Chemistry of Hydrocarbon Moities on Transition Metal Surfaces., Chem. Rev., 1995, 95, 2651 – 2693.
8. Bent B.E., Mimicking Aspects Heterogeneous Catalysis: Generating, Isolating, and Reacting Proposed Surface Intermediates on Single Crystals in Vacuum, Chem. Rev., 1996, 96, 1361 – 1390.
Умовно хімічні реакції комплексів поділяють на обмінні, окислювально-відновні, ізомеризації та координованих лігандів.
Первинна дисоціація комплексів на внутрішню та зовнішню сферу визначає перебіг реакцій обміну зовнішньосферних іонів:
Xm+mNaY = Ym+mNaX.
Компоненти внутрішньої сфери комплексів можуть брати участь у обмінних процесах з участю як лігандів, і комплексообразователя. Для характеристики реакцій заміщення лігандів або центрального іона металу використовують позначення та термінологію, запропоновану К. Інгольдом для реакцій органічних сполук (Рис. 42), нуклеофільного S N та електрофільного S E заміщення:
Z + Y = z + X S N
Z + M" = z + M S E .
За механізмом реакції заміщення поділяють (Рис. 43) на асоціативний ( S N 1 та S E 1 ) та дисоціативний ( S N 2 та S E 2 ), що відрізняються перехідним станом зі збільшеним та зменшеним координаційним числом.
Віднесення механізму реакції до асоціативного або дисоціативного є важко експериментально досяжним завданням ідентифікації інтермедіату зі зменшеним або збільшеним координаційним числом. У зв'язку з цим часто про механізм реакції судять на підставі непрямих даних про вплив концентрації реагентів на швидкість реакції, зміну геометричної будови продукту реакції та ін.
Для характеристики швидкості реакцій заміщення лігандів комплексів, нобелівський лауреат 1983 р. Р. Таубе (Рис. 44) запропонував використовувати терміни «лабільний» і «інертний» залежно від часу перебігу реакції заміщення лігандів менше 1 хвилини. Терміни лабільний або інертний є характеристикою кінетики реакцій заміщення лігандів і їх не слід плутати з термодинамічних характеристик про стійкість або нестійкість комплексів.
Лабільність чи інертність комплексів залежить від природи іона комплексоутворювача та лігандів. Відповідно до теорії поля лігандів:
1. Октаедричні комплекси 3 d перехідних металів з розподілом валентних ( n -1) d електронів на сигму*(e g ) Розпушують МО лабільні.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN -.
Причому, що менше величина енергії стабілізації кристалічним полем комплексу, то його лабільність більше.
2. Октаедричні комплекси 3 d перехідних металів з вільними сигма* Розпушуючими e g орбіталями та рівномірним розподілом валентних ( n -1) d електронів по t 2 g орбітал (t 2 g 3 , t 2 g 6 ) інертні.
[Co III (CN) 6] 3- (t 2 g 6 e g 0 ) + H 2 O =
[ Cr III (CN ) 6 ] 3- (t 2 g 3 e g 0 ) + H 2 O =
3. Плоско-квадратні та октаедричні 4 d та 5 d перехідних металів, що не мають електронів на сигму* Розпушують МО інертні.
2+ + H 2 O =
2+ + H 2 O =
Вплив природи лігандів на швидкість реакцій заміщення лігандів у рамках моделі «взаємного впливу лігандів». Окремим випадком моделі взаємного впливу лігандів є, сформульована 1926 р. І.І. Черняєвим концепція транс-впливу (Рис. 45) - «лабільність ліганду в комплексі залежить від природи транс-розташованого ліганду» - і запропонувати ряд транс-впливу лігандів: CO , CN - , C 2 H 4 > PR 3 , H - > CH 3 - , SC (NH 2 ) 2 > C 6 H 5 - , NO 2 - , I - , SCN - > Br - , Cl - > py , NH 3 , OH - , H 2 O .
Концепція транс-впливу дозволила обґрунтувати емпіричні правила:
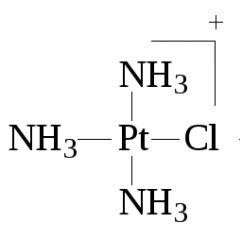
1. Правило Пейроні- при дії аміаку або амінів на тетрахлопла-тинат( II ) калію виходить завжди дихлодіамінплатина цис-конфігурації:
2 - + 2NH 3 = цис - + 2Cl -.
Оскільки реакція протікає у дві стадії і хлоридний ліганд має великий транс-вплив, то заміщення другого хлоридного ліганду на аміак відбувається з утворенням цис-[ Pt (NH 3 ) 2 Cl 2 ]:
2 - + NH 3 = -
NH 3 = цис -.
2. Правило Єргенсена - при дії хлороводневої кислоти на хлорид тетраміну платини ( II ) або подібні сполуки виходить дихлороди-аммінплатину транс-конфігурації:
[Pt(NH 3 ) 4 ] 2+ + 2 HCl = транс-[Pt (NH 3 ) 2 Cl 2 ] + 2 NH 4 Cl .
Відповідно до ряду транс-впливу лігандів, заміщення другої молекули аміаку на хлоридний ліганд призводить до утворення транс-[ Pt (NH 3 ) 2 Cl 2].
3. Тіомочевинна реакція Курнакова - різні продукти реакції тіомо-чевини з геометричними ізомерами транс-[ Pt (NH 3 ) 2 Cl 2 ] і цис-[ Pt (NH 3 ) 2 Cl 2 ]:
цис - + 4Thio = 2 + + 2Cl - + 2NH 3 .
Різний характер продуктів реакції пов'язаний з високим транс-впливом тіомочевини. Першою стадією реакцій є заміщення тіомочевинної хлоридних лігандів з утворенням транс- та цис- [ Pt (NH 3 ) 2 (Thio ) 2 ] 2+ :
транс-[ Pt (NH 3 ) 2 Cl 2 ] + 2 Thio = транс-[ Pt (NH 3 ) 2 (Thio ) 2 ] 2+
цис - + 2Thio = цис - 2+.
У цис-[ Pt (NH 3 ) 2 (Thio ) 2 ] 2+ дві молекули аміаку знаходяться в транс положенні до тіомочевіни піддаються подальшому заміщенню, що і призводить до утворення 2+ :
цис - 2+ + 2Thio = 2+ + 2NH 3 .
У транс-[ Pt (NH 3 ) 2 (Thio ) 2 ] 2+ дві молекули аміаку з малим транс-впливом розташовані в транс положенні один до одного і тому не заміщаються тіомочевінної.
Закономірності транс-впливу було відкрито І.І. Черняєвим щодо реакцій заміщення лігандів в плоско-квадратных комплексах платини( II ). Надалі було показано, що транс-вплив лігандів проявляється і в комплексах інших металів ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) та іншої геометричної будови. Щоправда, ряди транс-впливу лігандів для різних металів дещо різняться.
Слід зазначити, що транс-вплив є кінетичним ефектом- чим більшим транс-впливом має даний ліганд, тим із більшою швидкістю заміщається інший ліганд, що знаходиться по відношенню до нього в транс-положенні.
Поряд з кінетичним ефектом транс-впливу, в середині XX століття А.А. Грінбергом та Ю.М. Кукушкіним встановлено залежність транс-впливу ліганду L від ліганду, що знаходиться в цис-положенні до L . Так, дослідження швидкості реакції заміщення Cl - аміаком у комплексах платини( II):
[ PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0.42. 10 4 л/моль. з
[PtNH 3 Cl 3 ] - + NH 3 = цис-[Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1.14. 10 4 л/моль. з
транс-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2.90. 10 4 л/моль. з
показало, що наявність у цис-положенні до хлоридного ліганду, що заміщується, однієї і двох молекул аміаку призводить до послідовного збільшення швидкості реакції. Цей кінетичний ефект отримав назву цис-вплив. В даний час обидва кінетичні ефекти впливу природи лігандів на швидкість реакцій заміщення лігандів (транс- і цис-вплив) поєднані в загальній концепції взаємного впливу лігандів.
Теоретичне обґрунтування ефекту взаємного впливу лігандів тісно пов'язане з розвитком уявлень про хімічний зв'язок у комплексних сполуках. У 30-х роках XX століття А.А. Грінбергом та Б.В. Некрасовим транс-вплив розглянуто в рамках поляризаційної моделі:
1. Транс-вплив характерний для комплексів, центральний іон металу яких має велику поляризуемість.
2. Транс-активність лігандів визначається величиною енергії взаємної поляризації ліганду та іону металу. Для даного іона металу транс-вплив ліганду визначається його поляризацією та відстанню від центрального іона.
Поляризаційна модель узгоджується з експериментальними даними для комплексів з простими аніонними лігандами, наприклад, галогенід-іонами.
У 1943 р. А.А. Грінберг висунув припущення, що транс-активність лігандів пов'язана з їх відновними властивостями. Зміщення електронної щільності від транс-активного ліганду до металу зменшує ефективний заряд іона металу, що призводить до ослаблення хімічного зв'язку з транс-розташованим лігандом.
Розвиток уявлень про транс-вплив пов'язано з великою транс-активністю лігандів на основі ненасичених органічних молекул, подібних до етилену в [ Pt (C 2 H 4 ) Cl 3 ] - . На думку Чатта та Оргела (Рис. 46), це пов'язано зпі-дативною взаємодією таких лігандів з металом і асоціативним механізмом реакцій заміщення транс-розташованих лігандів. Координація до іону металу атакуючого ліганду Z призводить до утворення п'ятикоординаційного тригонально-біпірамідального інтермедіату з подальшим швидким відщепленням ліганду, що йде, Х. Утворенню такого інтермедіату сприяєпі-дативне ліганд-метал взаємодія ліганда Y , що зменшує електронну щільність металу та знижує енергію активації перехідного стану з подальшим швидким заміщенням ліганду Х.
Поряд з pакцепторними (C 2 H 4 , CN - , CO ...) лігандами, що утворюють дативний ліганд-метал хімічний зв'язок, високий транс-вплив мають іsдонорні ліганди: H - , CH 3 - , C 2 H 5 - ... Транс-вплив таких лігандів визначається донорно-акцепторною взаємодією ліганду Х з металом, що знижує його електонну щільність і послаблює зв'язок металу з лігандом, що йде. Y.
Таким чином, положення лігандів у ряді транс-активності визначаться спільною дією сигма-донорних та пі-властивостей лігандів - сигма-донорні та пі-акцепторні властивості ліганду посилюють його транс-вплив, тоді якпі-донорні – послаблюють. Яка з цих складових ліганд-метал взаємодії переважає у транс-впливі судять на підставі квантово-хімічних розрахунків електронної будови перехідного стану реакції.
Одна з найважливіших стадій у металокомплексному каталізі – взаємодія субстрату Y з комплексом – відбувається за трьома механізмами:
а) Заміщення ліганду розчинником. Зазвичай таку стадію зображують як дисоціацію комплексу
Суть процесу в більшості випадків - заміщення ліганду L розчинником S, який далі легко замінюється молекулою субстрату Y
б) Приєднання нового ліганду за вільною координатою з утворенням асоціату з подальшою дисоціацією ліганду, що заміщується
в) Синхронне заміщення (типу S N 2) без утворення інтермедіату
У разі комплексів Pt(II) дуже часто швидкість реакції описується двомаршрутним рівнянням
де k Sі k Y- Константи швидкості процесів, що протікають по реакціях (5) (з розчинником) та (6) з лігандомY. Наприклад,


Остання стадія другого маршруту є сумою трьох швидких елементарних стадій – відщеплення Cl – , приєднання Y та відщеплення молекули H 2 O.
У плоских квадратних комплексах перехідних металів спостерігається транс-ефект, сформульований І.І. Черняєвим – вплив LT на швидкість заміщення ліганду, що перебуває в положенні до ліганду LT. Для комплексів Pt(II) транс-ефект зростає у ряді лігандів:
H 2 O~NH 3 Наявність кінетичного трансефекту та термодинамічного трансвпливу пояснює можливість синтезу інертних ізомерних комплексів Pt(NH 3) 2 Cl 2 : Реакції електрофільного заміщення (SE) водню металом у координаційній сфері металу та зворотні ним процеси SH – H 2 O, ROH, RNH 2 , RSH, ArH, RCCН. Навіть молекули H 2 і CH 4 беруть участь у реакціях такого типу Реакції застосування Lз зв'язкуM-X У випадку X = R (металоорганічний комплекс) координовані металом молекули також впроваджуються по зв'язку M-R (L-CO, RNC, C2H2, C2H4, N2, CO2, O2 та ін.). Реакції впровадження є результатом внутрішньомолекулярної атаки нуклеофіла X на координовану по- або -типу молекулу. Зворотні реакції – реакції - та -елімінування Реакції окисного приєднання та відновного елімінування M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4– Очевидно, у цих реакціях завжди має місце попередня координація молекули, що приєднується, але це не завжди вдається зафіксувати. Тому наявність вільного місця в координаційній сфері або місця, пов'язаного з розчинником, який легко замінюється субстратом, є важливим фактором, що впливає на реакційну здатність металокомплексів. Наприклад, біс--алільні комплекси Ni є хорошими попередниками каталітично активних частинок, оскільки внаслідок легкого відновного елімінування біс-алілу з'являється комплекс з розчинником, т.зв. "Голий" нікель. Роль вільних місць ілюструє такий приклад: Реакції нуклеофільного та електрофільного приєднання до - та -комплексів металів В якості інтермедіатів каталітичних реакцій зустрічаються як класичні металоорганічні сполуки, що мають зв'язки M-C, M=CіMC, так і некласичні сполуки, в яких органічний ліганд координований по 2 , 3 , 4 , 5 і 6 -типу, є елементом електронно-дефіцитних структур - місткові СН 3 і С 6 Н 6 -групи, некласичні карбіди (Rh 6 C(CO) 16 ,C(AuL) 5 + ,C(AuL) 6 2+ та ін.). Серед специфічних механізмів для класичних -металоорганічних сполук відзначимо кілька механізмів. Так, встановлено 5 механізмів електрофільного заміщення атома металу зв'язку M-C. електрофільне заміщення з нуклеофільним сприянням AdEПриєднання-елімінування AdE(C) Приєднання до атома С вsp 2 -гібридизації AdE(M) Приєднання окисне до металу Нуклеофільне заміщення у атома вуглецю в реакціях деметалювання металоорганічних сполук, відбувається як окислювально-відновний процес: Можлива участь окислювача у такій стадії Таким окислювачем може бути CuCl 2 , п-бензохинон,NO 3 – та інших. сполуки. Наведемо ще дві характерні для RMX елементарні стадії: гідрогеноліз зв'язку M-C та гомоліз зв'язку M-C Важливим правилом, що стосується всіх реакцій комплексних і металоорганічних сполук і пов'язаних з принципом найменшого руху, є правило 16-18-електронної оболонки Толмена (розділ 2). Основна реакція заміщення у водних розчинах – обмін молекул води (22) – була вивчена для великої кількості іонів металів (рис. 34). Обмін молекул води координаційної сфери іона металу з основною масою молекул води, що є розчинником, для більшості металів протікає дуже швидко, і тому швидкість такої реакції вдалося вивчити головним чином методом релаксації. Метод полягає у порушенні рівноваги системи, наприклад, різким підвищенням температури. За нових умов (вищій температурі) система вже не перебуватиме в рівновазі. Потім вимірюють швидкість встановлення рівноваги. Якщо можна змінити температуру розчину протягом 10 -8 сек, то можна виміряти швидкість реакції, яка вимагає свого завершення проміжку часу більше 10 -8 сек. Можна також виміряти швидкість заміщення координованих молекул води у різних іонів металів лігандами SO 2- 4 , S 2 O 3 2- , EDTA та ін. (26). Швидкість такої реакції залежить від концентрації гідратованого іону металу і не залежить від концентрації вхідного ліганду, що дозволяє використовувати для опису швидкості цих систем рівняння першого порядку (27). У багатьох випадках швидкість реакції (27) для даного іону металу не залежить від природи вхідного ліганду (L), чи це молекули H 2 O або іони SO 4 2- , S 2 O 3 2- або EDTA. Це спостереження, а також той факт, що рівняння швидкості цього процесу не включена концентрація вхідного ліганду, дозволяють припускати, що ці реакції протікають по механізму, в якому повільна стадія полягає в розриві зв'язку між іоном металу і водою. З'єднання, що виходить, ймовірно, потім швидко координує ліганди, що знаходяться поблизу. У розд. 4 цієї глави було зазначено, що більш високозаряджені гідратовані іони металу, такі, як Al 3+ і Sc 3+ обмінюють молекули води повільніше, ніж іони M 2+ і M + ; це дає підставу припускати, що у стадії, що визначає швидкість всього процесу, важливу роль відіграє розрив зв'язків. Висновки, отримані в цих дослідженнях, не є остаточними, але вони дають підставу думати, що в реакціях заміщення гідратованих іонів металів важливе значення мають S N 1-процеси. Ймовірно, найбільш вивченими комплексними сполуками є аміни кобальту (III). Їх стійкість, легкість приготування та повільно поточні з ними реакції роблять їх особливо зручними для кінетичного вивчення. Оскільки дослідження цих комплексів було проведено виключно водних розчинах, спочатку слід розглянути реакції цих комплексів з молекулами розчинника - води. Було встановлено, що молекули аміаку або амінів, координовані іоном Co(III), настільки повільно заміщаються молекулами води, що зазвичай розглядають заміщення інших лігандів, а не амінів. Було вивчено швидкість реакцій типу (28) і знайдено, що вона першого порядку щодо комплексу кобальту (X - один із безлічі можливих аніонів). Так як у водних розчинах концентрація H 2 O завжди дорівнює приблизно 55,5 М, не можна визначити вплив зміни концентрації молекул води на швидкість реакції. Рівняння швидкості (29) і (30) для водного розчину експериментально не помітні, тому що просто дорівнює k" = k". Отже, за рівнянням швидкості реакції не можна сказати, чи H 2 O братиме участь у стадії, що визначає швидкість процесу. Відповідь питанням, чи протікає ця реакція механізму S N 2 із заміною іона X на молекулу H 2 O чи механізму S N 1, що передбачає спочатку дисоціацію з наступним приєднанням молекули H 2 O, необхідно отримати з допомогою інших експериментальних даних. Розв'язання цього завдання можна досягти двома типами експериментів. Швидкість гідролізу (заміщення одного іона Cl – на молекулу води) транс- + Приблизно в 10 3 разів більше швидкості гідролізу 2+. Збільшення заряду комплексу призводить до посилення зв'язків метал – ліганд, а отже, і до гальмування розриву цих зв'язків. Слід також враховувати тяжіння вхідних лігандів та полегшення протікання реакції заміщення. Так як виявлено зменшення швидкості зі збільшенням заряду комплексу, то в даному випадку здається більш ймовірним дисоціативний процес (S N 1). Інший спосіб доказу заснований на вивченні гідролізу серії подібних комплексів транс- +. У цих комплексах молекула етилендіаміну замінена аналогічними діамінами, в яких атоми водню атома вуглецю заміщені на групи CH 3 . Комплекси, що містять заміщені діаміни, реагують швидше, ніж етилендіамінний комплекс. Заміна атомів водню на CH 3 -групи збільшує обсяг ліганду, що ускладнює атаку атома металу іншим лігандом. Ці стеричні перешкоди уповільнюють реакцію механізму S N 2. Наявність поблизу атома металу об'ємистих лігандів сприяє дисоциативному процесу, оскільки видалення однієї з лігандів знижує їх скупчення в атома металу. Спостережуване збільшення швидкості гідролізу комплексів з об'ємними лігандами є хорошим доказом протікання реакції механізму S N 1. Отже, внаслідок численних досліджень ацидоамінних комплексів Co(II) виявилося, що заміна ацидогруп молекулами води є за своїм характером дисоціативним процесом. Зв'язок атом кобальту - ліганд подовжується до деякої критичної величини, перш ніж молекули води почнуть входити в комплекс. У комплексах, що мають заряд 2+ і вище, розрив зв'язку кобальт - ліганд дуже утруднений, і входження молекул води починає відігравати важливішу роль. Було виявлено, що заміна ацидо-групи (Х -) в комплексі кобальту(III) іншу групу, ніж молекула H 2 O, (31) проходить спочатку через заміщення її молекулою розчинника - води з наступною заміною на нову групу Y (32). Таким чином, у багатьох реакціях з комплексами кобальту(III) швидкість реакції (31) дорівнює швидкості гідролізу (28). Лише іон гідроксилу відрізняється від інших реагентів щодо реакційної здатності з аммінами Co(III). Він дуже швидко реагує з аммінними комплексами кобальту(III) (приблизно в 10 6 разів швидше, ніж вода) за типом реакції основного гідролізу (33). Знайдено, що ця реакція першого порядку щодо заміщуючого ліганду OH - (34). Загальний другий порядок реакції і надзвичайно швидке протікання реакції дозволяють припустити, що іон OH - виключно ефективний нуклеофільний реагент по відношенню до комплексів Co(III) і що реакція протікає механізмом S N 2 через утворення проміжного з'єднання. Однак це властивість OH - можна пояснити і іншим механізмом [рівняння (35), (36)]. У реакції (35) комплекс 2+ веде себе як кислота (за Бренстедом), даючи комплекс + , який є амідо-(містить )-сполукою - основою, що відповідає кислоті 2+ . Потім реакція протікає механізмом S N 1 (36) з утворенням п'ятикоординаційної проміжної сполуки, далі реагує з молекулами розчинника, що призводить до кінцевого продукту реакції (37). Цей механізм реакції узгоджується зі швидкістю реакції другого порядку і відповідає механізму S N 1. Оскільки реакція в стадії, що визначає швидкість, включає основу, пов'язану з початковим комплексом - кислотою, то цьому механізму дано позначення S N 1СВ. Визначити, який із цих механізмів найкраще пояснює експериментальні спостереження, дуже важко. Однак є переконливі докази, що підтверджують гіпотезу N 1CB. Найкращі аргументи на користь цього механізму такі: октаедричні комплекси Со(III) взагалі реагують за дисоціативним механізмом S N 1, і немає жодних переконливих доводів, чому б іон OH - повинен зумовити процес S N 2. Встановлено, що іон гідроксилу - слабкий нуклеофільний реагент у реакціях з Pt(II), і тому здається безпричинною його незвичайна реакційна здатність до Co(III). Реакції із сполуками кобальту(III) у неводних середовищах є прекрасним доказом утворення п'ятикоординаційних проміжних сполук, що передбачаються механізмом S N 1 СВ. Остаточним доказом є те що, що за відсутності у комплексі Co(III) зв'язків N - Н він повільно реагує з іонами ОН - . Це, звичайно, дає підставу вважати, що для швидкості реакції кислотно-основні властивості комплексу важливіші за нуклеофільні властивості ВІН". Щоб виключити той чи інший можливий механізм, потрібно здійснити досить тонкий експеримент. В даний час досліджено реакції заміщення великої кількості октаедричних сполук. Якщо розглянути їх механізми реакцій, найчастіше зустрічається дисоціативний процес. Цей результат не є несподіваним, оскільки шість лігандів залишають мало місця навколо центрального атома для приєднання інших груп. Відомо лише кілька прикладів, коли доведено виникнення семикоординаційного проміжного з'єднання або виявлено вплив ліганду, що впроваджується. Тому S N 2 механізм не можна повністю відкинути як можливий шлях реакцій заміщення в октаедричних комплексах. Реакції координаційних сполук завжди відбуваються у координаційній сфері металу із пов'язаними у ній лігандами. Тому очевидно, що для того, щоби взагалі щось відбувалося, ліганди повинні вміти в цю сферу потрапляти. Це може відбуватися двома способами: З першим способом ми вже ознайомилися, коли обговорювали координаційну ненасиченість та 18-електронне правило. Другим займемося тут. Але зазвичай діє негласне правило – кількість зайнятих координаційних місць не змінюється. Іншими словами, при заміщенні не змінюється рахунок електронів. Заміщення ліганду одного типу на інший цілком можливе і часто відбувається насправді. Звернемо лише увагу на коректне поводження із зарядами, коли змінюється L-ліганд на X-ліганд і навпаки. Якщо ми про це забудемо, то зміниться ступінь окислення металу, а заміщення лігандів не є окислювально-відновним процесом (якщо знайдете або придумаєте неприємний приклад, дайте знати – залік автоматично відразу, якщо я не зможу довести, що ви помилилися, навіщо навіть і в цьому випадку гарантую позитивний внесок у карму). З більш складними лігандами складнощів не більше – потрібно просто пам'ятати досить очевидне правило: кількість лігандних місць (тобто загальна кількість лігандів чи лігандних центрів X- або L-типів) зберігається. Це безпосередньо випливає із збереження рахунку електронів. Ось очевидні приклади. Звернімо увагу на останній приклад. Вихідний реагент цієї реакції дихлорид заліза FeCl 2 . Ще недавно ми сказали б: “Це просто сіль, причому тут координаційна хімія?”. Але більше ми не будемо собі дозволяти таке невігластво. У хімії перехідних металів немає “просто солей”, будь-які похідні суть координаційні сполуки, яких застосовні всі міркування про рахунок електронів, d-конфігурацію, координаційну насиченість тощо. Дихлорид заліза, оскільки ми його звикли писати, виявився б комплексом Fe(2+) типу MX 2 з конфігурацією d 6 і числом електронів 10. Замало щось! Нормально? Ми вже розібралися, що ліганди бувають неявні. Щоб зробити реакцію, нам потрібен розчинник, і для таких реакцій це швидше за все ТГФ. Розчинення кристалічної солі заліза в ТГФ відбувається саме тому, що донорний розчинник займає вільні місця, і енергія цього процесу компенсує руйнування кристалічної решітки. Ми не змогли б розчинити цю “сіль” у розчиннику, який не надає послуг сольватації металу за рахунок основності Льюїса. В даному випадку, і в мільйоні подібних, сольватація – це просто координаційна взаємодія. Напишемо, просто для визначеності результат сольватації у вигляді комплексу FeX 2 L 4 , у якого два іони хлору залишаються в координаційній сфері у вигляді двох X-лігандів, хоча швидше за все вони теж витіснені молекулами донорного розчинника з освітою зарядженого комплексу FeL 6 2+. У цьому випадку це не так важливо. І так, і так ми можемо спокійно вважати, що у нас 18-електронний комплекс і ліворуч, і праворуч. Якщо ми пам'ятаємо органічну хімію, там було два механізми заміщення при насиченому атомі вуглецю – SN1 і SN2. У першому заміщення відбувалося двостадійно: старий заступник спочатку йшов, залишаючи вакантну орбіталь на атомі вуглецю, яку слідом заходив новий заступник із парою електронів. Другий механізм припускав, що догляд та прихід здійснюються одночасно, узгоджено, а процес був одностадійним. У хімії координаційних сполук цілком можна уявити щось схоже. Але з'являється і третя можливість, якої не було насиченого атома вуглецю – спочатку приєднуємо новий ліганд, потім відчіплюємо старий. Відразу стає зрозуміло, що цей третій варіант навряд чи можливий, якщо комплекс має 18 електронів і є координаційно насиченим. Але цілком можливе, якщо число елетронів 16 або менше, тобто комплекс ненасичений. Тут же згадаємо й очевидну аналогію з органічної хімії – нуклеофільне заміщення у ненасиченого атома вуглецю (в ароматичному кільці чи карбонильного вуглецю) теж йдуть спочатку як приєднання нового нуклеофіла, і потім відщеплення старого. Отже, якщо у нас 18 електронів, то заміщення йде як відщеплення-приєднання (любителі "розумних" слів використовують термін дисоціативно-асоціативний або просто дисоціативний механізм). Інший шлях зажадав би розширення координаційної сфери до рахунку 20 електронів. Це не є абсолютно неможливим, і такі варіанти іноді навіть розглядаються, але це точно дуже невигідно і щоразу у разі підозри на такий шлях потрібні дуже вагомі докази. У більшості таких історій дослідники зрештою приходили до висновку, що вони щось переглянули чи не врахували, асоціаційний механізм відкидався. Отже, якщо вихідний комплекс із 18 електронами, то спочатку один ліганд повинен піти, потім на його місце прийти новий, наприклад: Якщо ми хочемо ввести в координаційну сферу гапто-ліганд, який займає кілька місць, то спочатку ми маємо їх все звільнити. Як правило, це відбувається тільки в досить жорстких умовах, наприклад, щоб в карбонілі хрому замінити три карбонілу на 6 -бензол, суміш багато годин нагрівають під тиском, час від часу стравлюючи оксид вуглецю, що вивільнився. Хоча у схемі намальована дисоціація трьох лігандів з утворенням дуже ненасиченого комплексу з 12 електронами, насправді реакція, швидше за все, відбувається стадійно, йде по одному карбонілу, а бензол заходить у сферу, поступово збільшуючи гаптність, через стадії мінус CO – дигапто – мінус ще одна CO – тетрагапто – мінус ще одна CO – гексагапто, щоб менше 16 електронів не виходило. Отже, якщо у нас комплекс із 16 електронами або менше, то заміщення ліганду, швидше за все, йде як приєднання-відщеплення (для любителів глибокодумних слів: асоціативно-дисоціативний чи просто асоціативний): новий ліганд спочатку приходить, потім старий іде. Напрошуються два очевидні питання: чому йде старий ліганд, адже 18 електронів це дуже добре, і чому б і в цьому випадку не зробити навпаки, як у 18-електронних комплексах. На перше запитання відповісти легко: у кожного металу свої звички, і деякі метали, особливо з пізніх, з майже повністю заповненими d-оболонками, віддають перевагу 16-електронному рахунку та відповідним структурним типам, тому й викидають зайвий ліганд, повертаючись до улюбленої конфігурації. Іноді в справу ще втручається просторовий фактор, вже наявні ліганди великі і додатковий почувається, як пасажир автобуса в годину пік. Простіше зійти і прогулятися пішки, ніж так мучитися. Втім, можна випхати іншого пасажира, хай погуляє, а ми поїдемо. Друге питання теж просте – у цьому випадку дисоціативний механізм мав би спочатку дати 14-електронний комплекс, а це рідко буває вигідно. Ось приклад. Для різноманітності замінимо X-ліганд на L-ліганд, і не заплутаємось у ступенях окиснення та зарядах. Ще раз: при заміщенні ступінь окислення не змінюється, і якщо пішов X-ліганд, то втрату потрібно компенсувати зарядом на металі. Якщо про це забути, то ступінь окислення зменшилася б на 1, а це не так. І ще одна дивина. Утворився зв'язок метал-піридин за рахунок неподіленої пари на азоті. В органічній хімії в цьому випадку ми обов'язково показали плюс на азоті піридину (наприклад, при протонуванні або утворенні четвертинної солі), але ми ніколи не робимо це в координаційній хімії ні з піридином, ні з будь-якими іншими L-лігандами. Це страшно дратує всіх, хто звик до суворої та недвозначної системи малювання структур в органічній хімії, але доведеться звикати, це не так складно. А точного аналога SN2 в хімії координаційних з'єднань немає, є далекий, але відносно рідкісний і нам не дуже потрібен. Про механізми заміщення лігандів можна було б взагалі не говорити, якби не одна надзвичайно важлива обставина, якою ми дуже користуватимемося: заміщення лігандів, хоч асоціативне, хоч дисоціативне обов'язково передбачає дисоціацію старого ліганду. І нам дуже важливо знати, які ліганди легко йдуть, а які йдуть погано, воліючи залишатися в координаційній сфері металу. Як скоро побачимо, у будь-якій реакції частина лігандів залишається у координаційної сфері і змінюється. Такі ліганди прийнято називати лігандами-глядачами (якщо не хочете таких простих, “ненаукових” слів, використовуйте англійське слово spectator у місцевій транскрипції спектатор, ліганд-спектатор, тільки, благаю, не спектейтор – це нестерпно!). А частина безпосередньо бере участь у реакції, перетворюючись на продукти реакції. Такі ліганди називають акторами (не акторами!), тобто чинними. Цілком зрозуміло, що ліганди-актори потрібно в координаційну сферу металу легко вводити та виводити, інакше реакція просто застрягне. А ось ліганди-спектатори краще в координаційній сфері залишати з багатьох причин, але хоча б і за такою банальною, як необхідність уникнути зайвої метушні навколо металу. Краще, щоб тільки ліганди актори і в необхідних кількостях могли брати участь у потрібному процесі. Якщо доступних координаційних місць буде більше, ніж необхідно, на них можуть сісти зайві ліганди-актори, і навіть такі, які братимуть участь у побічних реакціях, знижуючи вихід цільового продукту та селективність. Ліганди-спектатори також майже завжди здійснюють безліч важливих функцій, наприклад, забезпечують розчинність комплексів, стабілізують правильний валентний стан металу, особливо якщо воно не зовсім звичайне, допомагають окремим стадіям, забезпечують стереоселективність, і т.п. Поки не розшифровуємо, тому що все це ми обговорюватимемо детально, коли дістанемося конкретних реакцій. Виходить, що частина лігандів у координаційній сфері має бути міцно пов'язаною та не схильною до дисоціації та заміщення іншими лігандами. Такі ліганди прийнято називати координаційно стабільними
. Або просто стабільними, якщо з контексту ясно, що йдеться про міцність зв'язку лігандів, а не про їхню власну термодинамічну стабільність, яка якраз нас абсолютно не хвилює. А ліганди, які легко і охоче входять і виходять, і завжди готові поступитися місцем іншим, називають координаційно-лабільними
, або просто лабільними, і тут, на щастя, жодних двозначностей немає. Ось, напевно, найяскравіший приклад того, що в координаційній сфері дуже нестабільна молекула може стати відмінним лігандом, причому за визначенням координаційно стабільним, хоча б тому, що якщо вона ризикне вийти з теплої та затишної сфери назовні, нічого хорошого на неї не чекає (ціною виходу буде якраз енергія антиароматичної дестабілізації). Циклобутадієн та його похідні – найвідоміші приклади антиароматичності. Ці молекули існують тільки при низьких температурах, і в сильно спотвореному вигляді, - щоб піти якнайдалі від антиароматичності, цикл спотворюється у витягнутий прямокутник, знімаючи делекалізацію і максимально послаблюючи пару подвійних зв'язків (інакше це називається ефектом Яна-Теллера 2 роду: вироджена система, а циклобутадієн-квадрат є виродженим бірадикалом, згадайте коло Фроста, – спотворюється і знижує симетрію, щоб зняти виродження). Але в комплексах циклобутадієн та заміщені циклобутадієни – відмінні тетрагапто-ліганди, та геометрія таких лігандів – саме квадрат, з однаковими довжинами зв'язків. Як і чому це відбувається – окрема історія, і далеко не така очевидна, якою її часто подають. Потрібно розуміти, що залізобетонного паркану з колючим дротом та вежами охорони між областями лабільних та стабільних лігандів немає. По-перше, це залежить від металу, і в цьому контексті непогано працює ЖМКО. Наприклад, пізні перехідні метали віддають перевагу м'яким лігандам, а ранні – жорсткі. Скажімо, іодид дуже міцно тримається за d 8 атоми паладію або платини, але рідко взагалі входять до координаційної сфери титану або цирконію в конфігурації d 0 . Але у багатьох комплексах металів з менш яскраво вираженими ознаками, иодид поводиться як цілком лабільний ліганд, легко поступається місцем іншим. За інших рівних умов: Повторимо все ще раз, тільки з іншого боку У координаційній сфері металів зберігаються (є координаційно стабільними) як правило: Остання умова виглядає дивно, але уявіть собі комплекс, який має багато різних лігандів, серед яких немає безумовно стабільних (немає хелаторів і полігапто-лігандів). Тоді в реакціях ліганди змінюватимуться, умовно кажучи, як відносна лабільність. Найменш лабільний і залишиться останнім. Такий фокус має місце, наприклад, коли ми використовуємо фосфінові комплекси паладію. Фосфіни – відносно стабільні ліганди, але коли їх багато, а метал багатий електронами (d 8 , d 10), вони поступаються, один за одним, місцем лігандам-акторам. Але останній фосфіновий ліганд зазвичай залишається у координаційній сфері, і це дуже добре з погляду тих реакцій, у яких ці комплекси беруть участь. Ми ще повернемось до цієї важливої проблеми. Ось типовий приклад, коли від вихідної координаційної сфери фосфінового комплексу паладію в реакції Хека залишається лише один, “останній” фосфін. Цей приклад дуже близько підводить нас до найважливішої концепції реакціях комплексів перехідних металів – концепції контролюючого ліганду (ligand control). Обговоримо пізніше. При заміщенні одних лігандів на інші важливо не переборщити з реакційною здатністю ліганду, що входить. Коли ми маємо справу з реакціями органічних молекул, важливо доставити в координаційну сферу рівно по одній молекулі кожного з реагентів. Якщо замість однієї увійде дві молекули, то висока ймовірність побічних реакцій за участю двох однакових лігандів. Можлива також і втрата реакційної здатності через насичення координаційної сфери та неможливості введення в неї інших необхідних для очікуваного процесу лігандів. особливо часто ця проблема виникає при введенні в координаційну сферу сильних аніонних нуклеофілів, наприклад карбаніонів. Щоб уникнути цього, використовують менш реакційноздатні похідні, в яких замість катіону лужного металу, що зумовлює високу іонність зв'язку, використовують менш електропозитивні метали та металоїди (цинк, олово, бор, кремній тощо), що утворюють ковалентні зв'язки з нуклеофільною частиною . Реакції таких похідних з похідними перехідних металів дають продукти заміщення лігандів, в принципі, так само як би нуклеофіл був в аніонній формі, але через знижену нуклеофільність з меншими ускладненнями і без побічних реакцій. Такі реакції заміщення лігандів прийнято називати переметалюванням (transmetallation), щоб підкреслити те очевидне обсоятельство, що нуклеофіл нібито змінює метали - більш електропозитивний на менш електропозитивний. У цій назві, таким чином, закладено елемент малоприємної шизофренії – ми начебто вже домовилися, що на всі реакції дивитися з погляду перехідного металу, але раптом знову зірвалися і дивимося на цю реакцію і тільки на цю реакцію з точки зору нуклеофіла. Доведеться потерпіти, так склалася термінологія і так заведено. Насправді, це слово походить від ранньої хімії металоорганічних сполук і до того, що дія літій або магнійорганічних сполук на галогеніди різних металів і металоїдів – один з основних методів синтезу будь-якої металоорганіки, насамперед неперехідної, і реакція, яку ми зараз розглядаємо в хімії координаційних з'єднань перехідних металів - просто узагальнення старовинного методу металоорганічної хімії, з якого вона вся і зросла. Переметалювання і схоже на звичайне заміщення, і не схоже. Схоже – якщо ми вважаємо неперехідний металоорганічний реагент просто карбаніоном із протиіоном, тобто зв'язок вуглець-неперехідний метал іонний. Але це уявлення схоже на правду тільки для електропозитивних металів – для магнію. Але вже для цинку та олова ця вистава дуже далека від істини. Тому в реакцію вступають два σ-зв'язку та чотири атоми на їх кінцях. В результаті утворюються два нових σ-зв'язку і чотири атоми зв'язуються один з одним в іншому порядку. Швидше за все, все це відбувається одночасно в чотиричленному перехідному стані, і сама реакція має узгоджений характер, як і багато інших реакцій перехідних металів. Велика кількість електронів і орбіталей буквально на всі смаки та всі види симетрій робить перехідні метали здатними одночасно підтримувати зв'язки в перехідних станах з кількома атомами. У разі переметаллювання отримуємо окремий випадок дуже загального процесу, який називається просто метатезою σ-зв'язків (σ-bond metathesis). Не плутайте тільки зі справжніми метатезами олефінів та ацетиленів, які є повноцінними каталітичними реакціями зі своїми механізмами. У разі йдеться про механізм переметалирования чи іншого процесу, у якому відбувається щось подібне.

Реакції координованих лігандів










Реакції металоорганічних сполук



Заміщатися можуть у будь-яких комбінаціях ліганди будь-яких типів
Заміщення за участю гапто-лігандів

Заміщення, приєднання та дисоціація лігандів тісно та нерозривно пов'язані



Стабільні та лабільні ліганди
Циклобутадієн як ліганд
Координаційно-лабільні ліганди
Координаційно стабільні ліганди

Переметування

Як відбувається переметалювання?