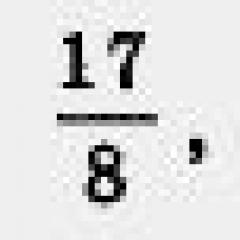Аминокислоты характеризуются свойствами. Аминокислоты, их состав и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом
Кислотно-основные свойства аминокислот связаны с наличием в их структуре двух ионизируемых групп-карбоксильной и аминогруппы, поэтому амнокислоты могут проявлять свойства как кислот, так и оснований, т.е. они являются амфотерными соединениями. В кристаллическом состоянии и в водных растворах -аминокислоты существуют в виде биполярных ионов, называемых также цвиттерионами. Ионное строение обуславливает некоторые особенности свойств-аминокислот: высокую температуру плавления (200-300С), нелетучесть, растворимость в воде и нерастворимость в неполярных органических растворителях. С растворимостью аминокислот в воде связана их всасываемость и транспорт в организме. Ионизация молекул аминокислот зависит от рН раствора. Для моноаминомонокарбоновых кислот процесс диссоциации имеет следующий вид:
В сильно кислых растворах аминокислоты присутствуют в виде положительных ионов, а в щелочных – в виде отрицательных.
Кислотно-основные свойства аминокислот можно объяснить исходя из теории кислот и оснований Бренстеда-Лоури. Полностью протонированная -аминокислота (катионная форма) с позиции теории Бренстеда является двухосновной кислотой, содержащей две кислотные группы:недиссоциированную карбоксильную группу (– СООН) и протонированную аминогруппу (NН 3), которые характеризуются соответствующими значениями рК 1 и рК 2 .
Величины рК для аминокислот определяют по кривым титрования. Рассмотрим кривую титрования аланина (рис. 1).

Рис. 1 – кривые, полученные при титровании 0,1М раствора аланина 0,1М раствором HCl(а) и 0,1М расторомNaOH(б).
Из кривой титрования аланина следует, что карбоксильная группа имеет рК 1 =2,34, а протонированная аминогруппа рК 2 = 9,69. При рН = 6,02 аланин существует в виде биполярного иона, когда суммарный электрический заряд частицы равен 0. При этом значении рН молекула аланина электронейтральна. Такое значение рН называют изоэлектрической точкой и обозначают рН иэт или рI. Для моноаминомонокарбоновых кислот изоэлектрическая точка рассчитывается как среднее арифметическое двух значений рК . Например для аланина она равна:
рI= ½(рК 1 + рК 2) = ½(2,34 + 9,69) = 6,02
При значении рН, превышающем изоэлектрическую точку, аминокислота заряжается отрицательно, а при значении рН ниже рIаминокислота несет суммарный положительный заряд. Например, при рН = 1,0 все молекулы аланина существуют в форме ионов

с суммарным зарядом +1. При рН = 2,34, когда имеется смесь равных количеств ионов

суммарный заряд = +0,5. Аналогичным образом можно предсказать знак и величину суммарного заряда для любой другой аминокислоты при любом значении рН.
Аминокислоты с ионизируемой группой в радикале имеют более сложные кривые титрования, складывающиеся из 3-ох участков, соответствующих трем возможным стадиям ионизации, и, следовательно, они имеют три значения рК (рК 1 , рК 2 и рК R). Ионизация кислых аминокислот, например аспарагиновой, состоит из следующих последовательных стадий:

Изоэлектрические точки таких аминокислот определяются также присутствием ионизируемой группой радикала, наряду с -амино и-карбоксильными группами. Для моноаминодикарбоновых кислот изоэлектрические точки смещены в кислую область рН и определяются как среднее арифметическое между величинами рК для двух карбоксильных групп (рIаспарагиновой кислоты = 2,97). Для основных аминокислот рIсмещены в щелочную область и вычисляются как среднее арифметическое между величинами рК для двух протонированных аминогрупп (рIлизина = 9,74).
Кислотно-основные свойства аминокислот используются для разделения и последующей идентификации аминокислот методами электрофореза и ионообменной хроматографии. Оба эти метода основаны на различиях в знаке и величине суммарного электрического заряда при данном значении рН.
Аминокислоты, белки и пептиды являются примерами соединений, описанных далее. Многие биологически активные молекулы включают несколько химически различных функциональных групп, которые могут взаимодействовать между собой и с функциональными группа друг друга.
Аминокислоты.
Аминокислоты - органические бифункциональные соединения, в состав которых входит карбоксильная группа -СООН , а аминогруппа - NH 2 .
Разделяют α и β - аминокислоты:
В природе встречаются в основном α -кислоты. В состав белков входят 19 аминокислот и ода иминокислота (С 5 Н 9 NO 2 ):


Самая простая аминокислота - глицин. Остальные аминокислоты можно разделить на следующие основные группы:
1) гомологи глицина - аланин, валин, лейцин, изолейцин.
Получение аминокислот.
Химические свойства аминокислот.
Аминокислоты - это амфотерные соединения, т.к. содержат в своём составе 2 противоположные функциональные группы - аминогруппу и гидроксильную группу. Поэтому реагируют и с кислотами и с щелочами:
Кислотно-основные превращение можно представить в виде:
1.Аминокислоты проявляют амфотерные свойства и кислот и аминов, а также специфические свойства, обусловленные совместным присутствием указанных групп. В водных растворах АМК существуют в виде внутренних солей (биполярных ионов). Водные растворы моноаминомонокарбоновых кислот на лакмус нейтральны, т.к. в их молекулах содержится равное число -NН 2 - и -СООН групп. Эти группы взаимодействуют между собой с образованием внутренних солей:
Такая молекула имеет в двух местах противоположные заряды: положительный NН 3 + и отрицательный на карбоксиле –СОО - . В связи с этим внутренняя соль АМК имеет название биполярного иона или Цвиттер–иона (Zwitter – гибрид).
Биполярный ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы; в щелочной среде – как анион. Существуют значения рН специфические для каждой аминокислоты, в которой количество анионных форм в растворе равно количеству катионных форм. Значение рН при котором общий заряд молекулы АМК равен 0, называется изоэлектрической точкой АМК (pI АК).
Водные растворы моноаминодикарбоновых кислот обладают кислой реакцией среды:
HООС-СH 2 -СH-СOOH « - OOC-CH 2 -CH–COO - + H +
Изоэлектрическая точка моноаминодикарбоновых кислот находится в кислой среде и такие АМК называют кислыми.
Диаминомонокарбоновые кислоты обладают в водных растворах основными свойствами (участие воды в процессе диссоциации показывать обязательно):
NH 2 -(CH 2) 4 -CH-COOH + H 2 O « NH 3 + -(CH 2) 4 -CН–COO - + OH -
Изоэлектрическая точка диаминомонокарбоновых кислот находится в при рН>7 и такие АМК называют основными.
Являясь биполярными ионами, аминокислоты проявляют амфотерные свойства: они способны образовывать соли как с кислотами, так и с основаниями:
Взаимодействие с соляной кислотой HCl приводит к образованию соли:
R-CH-COOH + HCl ® R-CH-COOH
NH 2 NH 3 + Сl -
Взаимодействие с основанием приводит к образованию соли:
R-CH(NH 2)-COOH + NaOH ® R-CH(NH 2)-COONa + H 2 O
2. Образование комплексов с металлами – хелатный комплекс. Строение медной соли гликокола (глицина) можно изобразить следующей формулой:

Почти вся имеющаяся в организме человека медь (100 мг) связана с белками (аминокислотами) в виде этих устойчивых клешневидных соединений.
3. Подобно другим кислотам аминокислоты образуют сложные эфиры, галоген ангидриды, амиды.
4. Реакции декарбоксилирования протекают в организме при участии специальных ферментов декарбоксилаз: получающиеся при этом амины (триптамин, гистамин, серотинин) называются биогенными аминами и являются регуляторами ряда физиологических функций человеческого организма.
5. Взаимодействие с формальдегидом (альдегидами)
R-CH-COOH + H 2 C=О ® R-CH-COOH
Формальдегид связывает NН 2 – группу, -СООН группа остается свободной и может быть оттитрована щелочью. Поэтому данная реакция используется для количественного определения аминокислот (метод Сёренсена).
6. Взаимодействие с азотистой кислотой приводит к образованию гидроксикислот и выделению азота. По объему выделившегося азота N 2 определяют его количественное содержание в исследуемом объекте. Эта реакция применяется для количественного определения аминокислот (метод Ван–Слайка):
R-CH-COOH + HNO 2 ® R-CH-COOH + N 2 + H 2 O
Это один из способов дезаминирования АМК вне организма
7. Ацилирование аминокислот. Аминогруппу АМК можно ацилировать хлорангидридами и ангидридами кислот уже при комнатной температуре.
Продуктом записанной реакции является ацетил-α-аминопропионовая кислота.
Ацильные производные АМК широко используются при изучении последовательности их в белках и в синтезе пептидов (защита аминогруппы).
8.Специфические свойства, реакции, связанные с наличием и взаимным влиянием амино- и карбоксильной групп - образование пептидов. Общим свойством a-АМК является процесс поликонденсации , приводящий к образованию пептидов. В результате этой реакции формируются амидные связи по месту взаимодействию карбоксильной группы одной АМК и аминогруппы другой АМК. Другими словами, пептиды – это амиды, образующиеся в результате взаимодействия аминогрупп и карбоксилов аминокислот. Амидная связь в таких соединениях называется пептидной связью (разобрать строение пептидной группы и пептидной связи: трехцентровая р,p-сопряженная система)
В зависимости от числа аминокислотных остатков в молекуле различают ди-, три-, тетрапептиды и т.д. вплоть до полипептидов (до 100 остатков АМК). Олигопептиды содержат от 2 до 10 остатков АМК, белки - более100 остатков АМК.В общем виде полипептидную цепь можно представить схемой:
H 2 N-CH-CO-NH-CH-CO-NH-CH-CO-... -NH-CH-COOH
Где R 1 , R 2 , … R n – радикалы аминокислот.
Понятие о белках.
Наиболее важными биополимерами аминокислот являются белки – протеины. В организме человека насчитывается около 5млн. различных белков, которые входят в состав кожи, мышц, крови и других тканей. Белки (протеины) получили свое название от греческого слова «protos» - первый, важнейший. Белки выполняют ряд важнейших функций в организме: 1. Строительная функция; 2. Транспортная функция; 3. Защитная функция; 4. Каталитическая функция; 5. Гормональная функция; 6. Питательная функция.
Все природные белки образуются из мономеров аминокислот. При гидролизе белков образуется смесь АМК. Этих АМК – 20.
4. Иллюстративный материал: презентация
5. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
- Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
- Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с. : ил
- Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с. : ил.
- Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
- Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
6. Контрольные вопросы (обратная связь):
1. Что преопределяет структуру полипептидной цепи в целом?
2. К чему приводит денатурация белка?
3. Что называют изоэлектрической точкой?
4. Какие аминокислоты называются незаменимыми?
5. Каким же образом белки образуются в нашем организме?
Похожая информация.
Аминокислоты проявляют свойства и кислот, и аминов. Так, они образуют соли (за счет кислотных свойств карбоксильной группы):
NH 2 CH 2 COOH + NaOH (NH 2 CH 2 COO)Na + Н 2 О
глицин глицинат натрия
и сложные эфиры (подобно другим органическим кислотам):
NH 2 CH 2 COOH + С 2 Н 5 ОНNH 2 CH 2 C(O)OC 2 H 5 + Н 2 О
глицин этилглицинат
С более сильными кислотами аминокислоты проявляют свойства оснований и образуют соли за счет основных свойств аминогруппы:

глицин хлорид глициния
Простейший белок - полипептид, содержащий в своей структуре не менее 70 аминокислотных остатков и имеющий молекулярную массу свыше 10 000 Да (дальтон). Дальтон - единица измерения массы белков, 1 дальтон равен 1,66054·10 -27 кг (углеродная единица массы). Аналогичные соединения, состоящие из меньшего количества аминокислотных остатков, относят к пептидам. Пептидами по своей природе являются некоторые гормоны – инсулин, окситоцин, вазопрессин. Некоторые пептиды являются регуляторами иммунитета. Пептидную природу имеют некоторые антибиотики (циклоспорин А, грамицидины А, В, С и S), алкалоиды, токсины пчел и ос, змей, ядовитых грибов (фаллоидин и аманитин бледной поганки), холерный и ботулинический токсины и др.
Уровни структурной организации белковых молекул .
Молекула белка имеет сложное строение. Выделяют несколько уровней структурной организации белковой молекулы – первичную, вторичную, третичную и четвертичную структуры.
Первичная структура определяется как линейная последовательность остатков протеиногенных аминокислот, связанных пептидными связями (Рис.5):

Рис.5. Первичная структура молекулы белка
Первичная структура молекулы белка генетически детерминирована для каждого конкретного белка в последовательности нуклеотидов информационной РНК. Первичная структура определяет и более высокие уровни организации белковых молекул.
Вторичная структура - конформация (т. е. расположение в пространстве) отдельных участков белковой молекулы. Вторичная структура в белках может быть представлена -спиралью, -структурой (структура складчатого листа) (Рис.6).
Рис.6. Вторичная структура белка
Вторичную структуру белка поддерживают водородные связи между пептидными группировками.
Третичная структура - конформация всей молекулы белка, т.е. укладка в пространстве всей полипептидной цепи, включая укладку боковых радикалов. Для значительного числа белков методом рентгеноструктурного анализа получены координаты всех атомов белка, за исключением координат атомов водорода. В формировании и стабилизации третичной структуры принимают участие все виды взаимодействий: гидрофобное, электростатическое (ионное), дисульфидные ковалентные связи, водородные связи. В этих взаимодействиях участвуют радикалы аминокислотных остатков. Среди связей, удерживающих третичную структуру следует отметить: а) дисульфидный мостик (- S - S -); б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой); в) солевой мостик (между карбоксильной группой и аминогруппой); г) водородные связи.
В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков
1) Глобулярные белки , которые имеют форму глобулы (сферы). К таким белкам относится, например, миоглобин, имеющий 5 α -спиральных сегментов и ни одной β – складки, иммуноглобулины, у которых нет α -спирали, основными элементами вторичной структуры являются β –складки
2) Фибриллярные белки . Эти белки имеют вытянутую нитевидную форму, они выполняют в организме структурную функцию. В первичной структуреони имеют повторяющиеся участки и формируют достаточно однотипную для всей полипептидной цепивторичную структуру. Так, белок α - кератин (основной белковый компонент ногтей, волос, кожи) построен из протяженных α - спиралей. Существуют менее распространенные элементы вторичной структуры, например - полипептидные цепи коллагена, образующие левые спирали с параметрами, резко отличающимися от параметров α -спиралей. В коллагеновых волокнах три спиральные полипептидные цепи скручены в единую правую суперспираль (Рис.7):
Рис.7 Третичная структура коллагена
Четвертичная структура белка. Под четвертичной структурой белков подразумевают способ укладки в пространстве отдельных полипептидных цепей (одинаковых или разных) с третичной структурой, приводящий к формированию единого в структурном и функциональном отношениях макромолекулярного образования (мультимера). Четвертичную структуру имеют не все белки. Примером белка, имеющего четвертичную структуру, является гемоглобин, который состоит из 4-х субъединиц. Этот белок участвует в транспорте газов в организме.
При разрыве дисульфидных и слабых типов связей в молекулах все структуры белка, кроме первичной, разрушаются (полностью или частично), при этом белок теряет свои нативные свойства (свойства белковой молекулы, присущие ей в естественном, природном (нативном) состоянии). Данный процесс называется денатурация белка . К факторам, вызывающим денатурацию белка относят высокие температуры, ультрафиолетовое облучение, концентрированные кислоты и щелочи, соли тяжелых металлов и другие.
Белки подразделяются на простые (протеины), состоящие только из аминокислот, и сложные (протеиды), содержащие, кроме аминокислот, другие небелковые вещества, например, углеводы, липиды, нуклеиновые кислоты. Небелковая часть сложного белка называется простетической группой.
Простые белки , состоящие только из остатков аминокислот, широко распространены в животном и растительном мире. В настоящее время не существует четкой классификации данных соединений.
Гистоны
Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток, растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция - регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи).
Протамины
Эти белки имеют самую низкую молекулярную массу (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, придают ДНК химическую устойчивость, но в отличие от гистонов, .не выполняют регуляторной функции.
Глютелины
Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других культур, в зеленых частях растений. Не растворимы в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Проламины
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием в этих белках пролина и неполярных аминокислот).
Протеиноиды.
К протеиноидам относятся белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы), для них характерно высокое содержание серы. Эти белки нерастворимы или трудно растворимы в воде, солевых и водно-спиртовых смесях..К протеиноидам относятся кератин, коллаген, фиброин.
Альбумины
Это кислые белки невысокой молекулярной массы (15-17 тыс.), растворимы в воде и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке.
Глобулины
Молекулярная масса до 100 тыс. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняют функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям.
Аминокислоты – это гетерофункциональные органические соединения, в состав молекул которых входит аминогруппа NH2 и карбоксильная группа COOH
Аминоуксусная кислота
![]() аминопропановая кислота
аминопропановая кислота
Физические свойства.
Аминокислоты – это бесцветные кристаллические растворимые в воде вещества. В зависимости от радикала они могут быть кислыми, горькими и безвкусными.
Химические свойства
Аминокислы – это амфотерные органические соединения (за счёт аминогруппы, они проявляют основные свойства и за счёт карбоксильной группы COOH проявляют кислотные свойства)
Реагируют с кислотами
H 2 N – CH 2 – COOH + NaOH = Cl - аминоуксусная кислота
Реагируют со щелочами
H 2 N – CH 2 – COOH + NaOH = H 2 N – CH 3 – COONa + H 2 O - натриевая соль глицина
Реагируют с основными оксидами
2H 2 N – CH 2 – COOH + CuO = (H 2 N – OH 2 – COO) 2 + H 2 O - медная соль глицина
Билет №17
Взаимосвязь строения, свойства и применения на примере простых веществ.
Для большинства неметаллов простых веществ характерно молекулярное строение, и лишь некоторые из них имеют немолекулярное строение.
Немолекулярное строение
C, B, Si
У этих неметаллов атомные кристаллические решётки, поэтому они обладают большой твёрдостью и очень высокими температурами плавления.
Добавка бора к стали, к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Применение:
1. Алмаз – для бурения горных пород
2. Графит – для изготовления электродов, замедлителей нейтронов в атомных реакторах, в качестве смазочного материала в технике.
3. Уголь, состоящий в основном из углерода, - адсбент – для получения карбида кальция, чёрной краски.
Молекулярное строение
F 2 , O 2 , Cl 2 , Br 2 , N 2 , I 2 , S 8
Для этих неметаллов в твёрдом состоянии характерны молекулярные кристалические решётки, при обычных условиях это газы, жидкости или твёрдые вещества с низкими температурами плавления.
Применение:
1. Ускорение химических реакций, в том числе в металлургии
2. Резка и сварка металлов
3. В жидком виде в ракетных двигателях
4. В авиации и подводных лодках для дыхания
5. В медицине
Белки – как биополимеры. Первичная, вторичная и третичная структура белков. Свойства и биологические свойства белков.
Белки – это биополимеры в состав молекул которых входят остатки аминокислот
Белки имеют первичную, вторичную, третичную, и четвертичную структуру.
Первичная структура – это состоящая из остатков аминокислот соежинённых между собой пектидными связями
Вторичная структура – это цепь, свёрнутая в спираль и кроме пептидных связей есть водородные
Третичная структура – спираль, свёрнутая в клубок и дополнительно имеет сульфидные связи S-S
Четвертичная структура – двойная спираль, свёрнутая в клубок
Физические свойства
Белки – амфотерные электролиты. При определенном значении pH среды число положительных и отрицательных зарядов в молекуле белка одинаково. Белки имею разнообразное строение. Есть белки нерастворимые в воде, есть белки легко растворимые в воде. Есть белки малоактивные в химическом отношении, устойчивые к действию агентов. Есть белки крайне неустойчивые. Есть белки, имеющие вид нитей, достигающих в длину сотен нанометров; есть белки, имеющие форму шариков диаметром всего 5–7 нм. Они имеют большую молекулярную массу (104-107).
Химмические свойства
1. Реакция денатурации – это разрушение первичной структуры белка под действием температуры.
2. Цветные реакции на белки
а) Взаимодействие белка с Cu(OH)2
2NaOH + CuSO 4 = Na 2 SO 4 + Cu(OH) 2
б) Взаимодействие белка с HNO 3
Реактивом на серу является ацетат свинца (CH 3 COO) 2 Pb, образуется черный осадок PbS
Биологическая роль
Белки – строительные материалы
Белки являются обязательными компонентом всех клеточных структур
Белки ферменты, играют роль катализаторов
Регулярные белки: к ним относят гармоны
Белки – средство защиты
Белки как источник энергии