¡Sobre la energía térmica en un lenguaje sencillo! Cuánto calor se requiere para m gramos Cuánto calor se requiere para m gramos.
Por definición, una caloría es la cantidad de calor necesaria para calentar un centímetro cúbico de agua en 1 grado Celsius. Una gigacaloría, que se utiliza para medir la energía térmica en la industria y los servicios públicos de energía térmica, equivale a mil millones de calorías. En 1 metro hay 100 centímetros, por lo tanto, en uno metro cúbico- 100 x 100 x 100 = 1.000.000 centímetros. Por lo tanto, calentar un cubo de agua
1 grado, necesitas un millón de calorías o 0,001 Gcal.
En mi ciudad, el precio de la calefacción es de 1132,22 rublos / Gcal, y el precio del agua caliente es de 71,65 rublos / metro cúbico, el precio agua fría 16,77 rublos / metro cúbico
¿Cuánto Gcal se gasta para calentar 1 metro cúbico de agua?
creo que sí
s x 1132.22 = 71.65 - 16.77 y así resuelvo las ecuaciones para averiguar a qué es igual s (Gcal), es decir, es igual a 0.0484711452 Gcal
Lo dudo, en mi opinión decido mal
RESPUESTA:
No encuentro errores en tu cálculo.
Naturalmente, las tarifas dadas no deben incluir el costo de las aguas residuales (eliminación de aguas residuales).
Un cálculo aproximado para la ciudad de Izhevsk de acuerdo con los estándares antiguos se ve así:
0,19 Gcal por persona al mes (esta norma ya ha sido anulada, pero no hay otra, por ejemplo sirve) / 3,6 metros cúbicos. por persona por mes (norma de consumo de agua caliente) = 0.05278 Gcal por 1 metro cúbico. (Se necesita tanto calor para calentar 1 metro cúbico de agua fría a la temperatura estándar del agua caliente, que, recordemos, es de 60 grados C).
Para un cálculo más preciso de la cantidad de energía térmica para calentar agua por el método directo basado en cantidades físicas (y no al revés según las tarifas aprobadas para el suministro de agua caliente), recomiendo usar plantilla para el cálculo de la tarifa del agua caliente (REC UR)... En la fórmula de cálculo, entre otras cosas, se utiliza la temperatura del agua fría en los períodos de verano e invierno (calefacción), la duración de estos períodos.
Etiquetas: gigacaloría, agua caliente
- Pagamos por el suministro de agua caliente, la temperatura es mucho más baja que la estándar. ¿Qué hacer?
- La duración del período de parada de ACS establecido por las Reglas no es ilegal: la decisión del Tribunal Supremo de la Federación de Rusia (2017)
- Iniciativa para establecer tarifas y metodología de medición más justas para el consumo de agua caliente
- Sobre el procedimiento para volver a calcular el monto del pago por calefacción y suministro de agua caliente en caso de cortes: explicación de Rospotrebnadzor para UR
- Sobre la medición del refrigerante en un sistema de suministro de calor cerrado: carta del Ministerio de Construcción de la Federación de Rusia del 31/03/2015 No. 9116-OD / 04
- UR - Sobre la reducción de los pagos por calefacción y suministro de agua caliente - carta del Ministerio de Energía UR de fecha 17.08.2015 No. 11-10 / 5661
- ¿Cuál es el período estándar para calibrar un dispositivo de medición doméstico común para calefacción y suministro de agua caliente?
- Agua caliente del grifo sucia. ¿Dónde contactar?
- ¿Se puede subir el contador de agua del apartamento en toda la entrada? ¿Como pagar? Lecturas mensuales - 42 metros cúbicos
- El procedimiento para mantener una contabilidad separada de los costos en el campo del suministro de agua y la eliminación de aguas residuales: orden del Ministerio de Construcción de la Federación de Rusia de 25.01.2014 No. 22 / pr
- pago de agua y luz en un apartamento sin alojamiento
- cálculo de calor según ODPU a 1/12
- Fuente de alimentación
- Pagos enormes por un dormitorio (17.3 metros cuadrados)
| Comentarios: (11) | |
| Sugerencia: ¡Comparta el enlace en las redes sociales si desea más respuestas / comentarios! | |
(o transferencia de calor).
Calor específico de una sustancia.
Capacidad calorífica- Esta es la cantidad de calor que absorbe el cuerpo cuando se calienta en 1 grado.
La capacidad calorífica de un cuerpo se indica con una letra latina mayúscula. CON.
¿Qué determina la capacidad calorífica del cuerpo? En primer lugar, de su masa. Está claro que calentar, por ejemplo, 1 kilogramo de agua requerirá más calor que calentar 200 gramos.
¿Y del tipo de sustancia? Hagamos un experimento. Cogemos dos recipientes idénticos y, echando agua de 400 g en uno de ellos y 400 g de aceite vegetal en el otro, comenzamos a calentarlos con quemadores idénticos. Observando las lecturas de los termómetros, veremos que el aceite se calienta rápidamente. Para calentar agua y aceite a la misma temperatura, el agua debe calentarse más tiempo. Pero cuanto más calentamos el agua, más calor recibe del quemador.
Por lo tanto, para calentar la misma masa de diferentes sustancias a la misma temperatura, se requiere una cantidad diferente de calor. La cantidad de calor necesaria para calentar un cuerpo y, por tanto, su capacidad calorífica, dependen del tipo de sustancia que lo componga.
Entonces, por ejemplo, para aumentar la temperatura del agua con una masa de 1 kg en 1 ° C, se requiere una cantidad de calor igual a 4200 J, y para calentar la misma masa de aceite de girasol en 1 ° C, una cantidad de Se requiere calor igual a 1700 J.
Una cantidad física que muestra cuánto calor se requiere para calentar 1 kg de una sustancia por 1 ºС se llama calor especifico de esta sustancia.
Cada sustancia tiene su propio calor específico, que se denota con la letra latina cy se mide en julios por kilogramo-grado (J / (kg · ° C)).
La capacidad calorífica específica de una misma sustancia en diferentes estados de agregación (sólido, líquido y gaseoso) es diferente. Por ejemplo, la capacidad calorífica específica del agua es 4200 J / (kg · ºС), y la capacidad calorífica específica del hielo es 2100 J / (kg · ° С); el aluminio en estado sólido tiene un calor específico igual a 920 J / (kg - ° С), y en estado líquido - 1080 J / (kg - ° С).
Tenga en cuenta que el agua tiene un calor específico muy alto. Por lo tanto, el agua de los mares y océanos, que se calienta en verano, se absorbe del aire. un gran número de calor. Gracias a esto, en aquellos lugares que se ubican cerca de grandes masas de agua, el verano no es tan caluroso como en lugares alejados del agua.
Cálculo de la cantidad de calor necesaria para calentar un cuerpo o que emite durante el enfriamiento.
De lo anterior queda claro que la cantidad de calor necesaria para calentar un cuerpo depende del tipo de sustancia que lo compone (es decir, su capacidad calorífica específica) y de la masa del cuerpo. También está claro que la cantidad de calor depende de cuántos grados vayamos a aumentar la temperatura corporal.
Entonces, para determinar la cantidad de calor requerida para calentar un cuerpo o que emite durante el enfriamiento, el calor específico del cuerpo debe multiplicarse por su masa y por la diferencia entre sus temperaturas inicial y final:
Q = cm (t 2 - t 1 ) ,
dónde Q- cantidad de calor, C- calor especifico, metro- masa corporal , t 1 - temperatura inicial, t 2 - temperatura final.
Cuando el cuerpo se calienta t 2> t 1 y por lo tanto Q > 0 ... Al enfriar el cuerpo t 2 y< t 1 y por lo tanto Q< 0 .
Si se conoce la capacidad calorífica de todo el cuerpo CON, Q determinado por la fórmula:
Q = C (t 2 - t 1 ) .
La humanidad conoce pocos tipos de energía: energía mecánica (cinética y potencial), energía interna (térmica), energía de campo (gravitacional, electromagnética y nuclear), química. Por separado, cabe destacar la energía de la explosión, ...
La energía del vacío y todavía existe solo en teoría - energía oscura. En este artículo, el primero en el título "Ingeniería térmica", lo intentaré en un lenguaje sencillo y accesible, utilizando ejemplo practico, para contar sobre el tipo más importante energía en la vida de las personas - oh energía térmica y de darla a luz a tiempo energía térmica.
Algunas palabras para entender el lugar de la ingeniería térmica como una rama de la ciencia de la obtención, transferencia y uso de energía térmica. La ingeniería térmica moderna ha surgido de la termodinámica general, que a su vez es una de las ramas de la física. La termodinámica es literalmente "cálida" más "potencia". Por tanto, la termodinámica es la ciencia de "cambiar la temperatura" de un sistema.
El impacto en el sistema desde el exterior, en el que cambia su energía interna, puede ser el resultado de la transferencia de calor. Energía térmica, que es adquirido o perdido por el sistema como resultado de dicha interacción con el medio ambiente, se denomina la cantidad de calor y se mide en unidades SI en julios.
Si no es un ingeniero de calefacción y no se ocupa de los problemas de ingeniería térmica todos los días, cuando se enfrente a ellos, a veces sin experiencia, es muy difícil resolverlos rápidamente. Es difícil, sin experiencia, imaginar incluso la dimensionalidad de los valores buscados de la cantidad de calor y poder calorífico. ¿Cuántos julios de energía se necesitan para calentar 1000 metros cúbicos de aire desde una temperatura de -37˚C a + 18˚C? .. ¿Qué potencia de una fuente de calor se necesita para hacer esto en 1 hora? "No todos los ingenieros. A veces, los especialistas incluso recuerdan las fórmulas, ¡pero solo unos pocos pueden aplicarlas en la práctica!
Después de leer este artículo hasta el final, podrá resolver fácilmente problemas industriales y domésticos reales asociados con el calentamiento y enfriamiento de diversos materiales. ¡Comprender la esencia física de los procesos de transferencia de calor y conocer fórmulas básicas simples son los bloques principales en la base del conocimiento en ingeniería térmica!
La cantidad de calor en varios procesos físicos.
Mayoria sustancias conocidas puede estar en estado sólido, líquido, gaseoso o de plasma a diferentes temperaturas y presiones. Transición de un estado de agregación a otro ocurre a temperatura constante(siempre que la presión y otros parámetros ambientales no cambien) y va acompañado de la absorción o liberación de energía térmica. A pesar de que el 99% de la materia del Universo se encuentra en estado de plasma, no consideraremos este estado de agregación en este artículo.
Considere el gráfico que se muestra en la figura. Muestra la dependencia de la temperatura de la sustancia. T en la cantidad de calor Q, llevado a cierto sistema cerrado que contiene una cierta masa de una sustancia específica.

1. Cuerpo sólido con temperatura T1, calentar a temperatura Tm, gastando en este proceso una cantidad de calor igual a Q1 .
2. A continuación, comienza el proceso de fusión, que se produce a temperatura constante. Tm(punto de fusion). Para derretir toda la masa de un sólido, es necesario gastar energía térmica en una cantidad Q2 - Q1 .
3. A continuación, el líquido resultante de la fusión de un sólido se calienta hasta el punto de ebullición (formación de gas). Tkp, gastando en esta cantidad de calor igual a Tercer trimestre-Q2 .
4. Ahora en un punto de ebullición constante Tkp el líquido hierve y se evapora, convirtiéndose en gas. Para la transferencia de toda la masa de líquido a gas, es necesario gastar energía térmica en la cantidad Cuarto trimestre-Tercer trimestre.
5. Sobre la ultima etapa el gas se calienta a partir de la temperatura Tkp hasta una cierta temperatura T2... En este caso, el costo de la cantidad de calor será Q5-Cuarto trimestre... (Si calentamos el gas a la temperatura de ionización, entonces el gas se convierte en plasma).
Así, calentar el original sólido de la temperatura T1 a la temperatura T2 hemos gastado energía térmica en la cantidad Q5, transfiriendo materia a través de tres estados de agregación.
Moviéndonos en la dirección opuesta, eliminaremos la misma cantidad de calor de la sustancia. Q5, pasando por las etapas de condensación, cristalización y enfriamiento desde la temperatura T2 a la temperatura T1... Por supuesto, estamos considerando un sistema cerrado sin pérdida de energía al ambiente externo.
Tenga en cuenta que es posible una transición de un estado sólido a un estado gaseoso, sin pasar por la fase líquida. Este proceso se llama sublimación y el proceso inverso se llama desublimación.
Entonces, nos dimos cuenta de que los procesos de transiciones entre los estados de agregación de la materia se caracterizan por el consumo de energía a temperatura constante. Al calentar una sustancia en una sin cambios estado de agregación, la temperatura aumenta y también se consume energía térmica.
Las principales fórmulas para la transferencia de calor.
Las fórmulas son muy sencillas.
Cantidad de calor Q en J se calcula mediante las fórmulas:
1. Desde el lado del consumo de calor, es decir, desde el lado de la carga:
1.1. Al calentar (enfriar):
Q = metro * C * (T2-T1)
metro – masa de materia en kg
con - capacidad calorífica específica de una sustancia en J / (kg * K)
1.2. Al derretir (congelar):
Q = metro * λ
λ – calor específico de fusión y cristalización de una sustancia en J / kg
1.3. Ebullición, evaporación (condensación):
Q = metro * r
r – Calor específico de formación de gas y condensación de una sustancia en J / kg
2. Desde el lado de la producción de calor, es decir, desde el lado de la fuente:
2.1. Durante la combustión de combustible:
Q = metro * q
q – calor específico de combustión del combustible en J / kg
2.2. Al convertir la electricidad en energía térmica (ley de Joule-Lenz):
Q = t * I * U = t * R * I ^ 2 = (t / R)* U ^ 2
t – tiempo en s
I – corriente efectiva en A
U – valor de voltaje efectivo en V
R – resistencia de carga en ohmios
Concluimos que la cantidad de calor es directamente proporcional a la masa de la sustancia durante todas las transformaciones de fase y, cuando se calienta, es adicionalmente directamente proporcional a la diferencia de temperatura. Los coeficientes de proporcionalidad ( C , λ , r , q ) para cada sustancia tienen sus propios valores y se determinan empíricamente (tomados de libros de referencia).
Energía térmica norte en W es la cantidad de calor transferida al sistema durante un tiempo determinado:
N = Q / t
Cuanto más rápido queremos calentar el cuerpo a una determinada temperatura, más potencia debe ser la fuente de energía térmica; todo es lógico.
Cálculo en Excel de un problema aplicado.
En la vida, a menudo es necesario hacer un cálculo estimado rápido para comprender si tiene sentido continuar estudiando el tema, haciendo un proyecto y cálculos detallados y precisos que requieren mucha mano de obra. Habiendo realizado un cálculo en unos minutos, incluso con una precisión de ± 30%, puede tomar una importante decisión de gestión que será 100 veces más barato y 1000 veces más eficiente y, como resultado, 100,000 veces más eficiente que realizar un cálculo preciso en una semana, o incluso un mes, por un grupo de especialistas costosos ...
Condiciones del problema:
En las instalaciones del taller para la preparación de laminados de metal con dimensiones de 24m x 15m x 7m, importamos productos metálicos por un monto de 3 toneladas desde un almacén en la calle. El metal laminado tiene hielo con un peso total de 20 kg. En la calle -37˚С. Cuánto calor se necesita para calentar el metal a + 18˚С; calentar el hielo, derretirlo y calentar el agua a + 18˚С; calentar todo el volumen de aire en la habitación, suponiendo que la calefacción estaba completamente apagada antes? ¿Qué capacidad debe tener el sistema de calefacción si todo lo anterior debe realizarse en 1 hora? (Condiciones muy duras y casi irreales, ¡especialmente cuando se trata de aire!)
Realizaremos el cálculo en el programaMS Excel o en el programaOOo Calc.
Para el formato de color de celdas y fuentes, consulte la página "".
Datos iniciales:
1. Escribimos los nombres de las sustancias:
a la celda D3: Acero
a la celda E3: Hielo
en la celda F3: Agua congelada
a la celda G3: Agua
a la celda G3: Aire
2. Ingresamos los nombres de los procesos:
en las celdas D4, E4, G4, G4: calor
a la celda F4: derritiendo
3. Calor específico de sustancias C en J / (kg * K) escribimos para acero, hielo, agua y aire, respectivamente
a la celda D5: 460
a la celda E5: 2110
a la celda G5: 4190
a la celda H5: 1005
4. Calor específico de fusión del hielo λ en J / kg ingresamos
a la celda F6: 330000
5. Masa de sustancias metro en kg ingresamos, respectivamente, para acero y hielo
a la celda D7: 3000
a la celda E7: 20
Dado que la masa no cambia cuando el hielo se convierte en agua, entonces
en las celdas F7 y G7: = E7 =20
Encontramos la masa de aire por el producto del volumen de la habitación por la gravedad específica
en la celda H7: = 24 * 15 * 7 * 1.23 =3100
6. Tiempos de proceso t en min escribimos solo una vez para el acero
a la celda D8: 60
Los tiempos para calentar hielo, derretirlo y calentar el agua resultante se calculan a partir de la condición de que estos tres procesos deben completarse en la misma cantidad de tiempo que se asigna para calentar el metal. Leemos en consecuencia
en la celda E8: = E12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =9,7
en la celda F8: = F12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =41,0
en la celda G8: = G12 / (($ E $ 12 + $ F $ 12 + $ G $ 12) / D8) =9,4
El aire también debe calentarse durante el mismo tiempo asignado, lea
en la celda H8: = D8 =60,0
7. La temperatura inicial de todas las sustancias. T1 en ˚C entramos
a la celda D9: -37
a la celda E9: -37
a la celda F9: 0
a la celda G9: 0
a la celda H9: -37
8. La temperatura final de todas las sustancias. T2 en ˚C entramos
a la celda D10: 18
a la celda E10: 0
en la celda F10: 0
a la celda G10: 18
a la celda H10: 18
Creo que no debería haber preguntas sobre las cláusulas 7 y 8.

Resultados del cálculo:
9. Cantidad de calor Q en KJ, calculamos los requeridos para cada uno de los procesos
para calentar acero en la celda D12: = D7 * D5 * (D10-D9) / 1000 =75900
para calentar hielo en el compartimento E12: = E7 * E5 * (E10-E9) / 1000 = 1561
para derretir hielo en la celda F12: = F7 * F6 / 1000 = 6600
para calentar agua en la celda G12: = G7 * G5 * (G10-G9) / 1000 = 1508
para calentar aire en la celda H12: = H7 * H5 * (H10-H9) / 1000 = 171330
Se lee la cantidad total de energía térmica requerida para todos los procesos
en la celda combinada D13E13F13G13H13: = SUM (D12: H12) = 256900
En las celdas D14, E14, F14, G14, H14 y en la celda combinada D15E15F15G15H15, la cantidad de calor se indica en la unidad de medida del arco, en Gcal (en giga calorías).
10. Energía térmica norte en kW, requerido para cada uno de los procesos se calcula
para calentar acero en la celda D16: = D12 / (D8 * 60) =21,083
para calentar hielo en la celda E16: = E12 / (E8 * 60) = 2,686
para derretir hielo en la celda F16: = F12 / (F8 * 60) = 2,686
para calentar agua en la celda G16: = G12 / (G8 * 60) = 2,686
para calentar aire en la celda H16: = H12 / (H8 * 60) = 47,592
La potencia térmica total necesaria para completar todos los procesos a tiempo t calculado
en la celda combinada D17E17F17G17H17: = D13 / (D8 * 60) = 71,361
En las celdas D18, E18, F18, G18, H18 y en la celda combinada D19E19F19G19H19, la potencia térmica se da en la unidad de medida del arco, en Gcal / hora.
Esto completa el cálculo en Excel.
Conclusiones:
Tenga en cuenta que calentar el aire requiere más del doble de energía que calentar la misma masa de acero.
Al calentar agua, el consumo de energía es el doble que al calentar hielo. El proceso de fusión consume muchas veces más energía que el proceso de calentamiento (con una pequeña diferencia de temperatura).
Calentar agua consume diez veces más energía térmica que calentar acero y cuatro veces más que calentar aire.
Para recepción información sobre el lanzamiento de nuevos artículos y para descarga de archivos de programa de trabajo Le pido que se suscriba a los anuncios en la ventana ubicada al final del artículo o en la ventana en la parte superior de la página.
Después de ingresar su dirección Correo electrónico y haciendo clic en el botón "Recibir anuncios de artículos" NO LO OLVIDECONFIRMAR SUSCRIBIR haciendo clic en el enlace en una carta que le llegará inmediatamente al correo especificado (a veces, a la carpeta « Correo no deseado » )!
Recordamos los conceptos de "cantidad de calor" y "potencia térmica", consideramos las fórmulas fundamentales para la transferencia de calor y analizamos un ejemplo práctico. Espero que mi lenguaje sea sencillo, claro e interesante.
¡Estoy esperando preguntas y comentarios sobre el artículo!
te apuesto EL RESPETO archivo de descarga del trabajo del autor DESPUÉS DE LA SUSCRIPCIÓN para anuncios de artículos.
“… - Cuántos loros caben en ti, esa es tu altura.
- ¡Realmente necesario! ¡No me tragaré tantos loros! ... ”
De m / f "38 loros"
De acuerdo con las reglas internacionales SI (sistema internacional de unidades de medida) la cantidad de energía térmica o la cantidad de calor se mide en julios [J], también hay múltiplos de kilojulio [kJ] = 1000 J., megajulio [MJ] = 1,000,000 J, GigaJoule [GJ] = 1,000,000,000 J., etc. Esta unidad de medida de energía térmica es la principal unidad internacional y se utiliza con mayor frecuencia en cálculos científicos y científico-técnicos.
Sin embargo, todos sabemos o al menos una vez hemos escuchado que otra unidad para medir la cantidad de calor (o simplemente calor) es una caloría, además de kilocaloría, Megacaloría y Gigacaloría, que significan los prefijos kilo, Giga y Mega, ver el ejemplo con Joules arriba. En nuestro país, históricamente, se ha desarrollado de manera que al calcular las tarifas de calefacción, ya sea calefacción con calderas de electricidad, gas o pellet, se acostumbra considerar el costo de exactamente una Gigacaloría de energía térmica.
Entonces, ¿qué son Gigacaloria, kilovatio, kilovatio * hora o kilovatio / hora y julios y cómo se relacionan?, Lo descubrirás en este artículo.
Entonces, la unidad principal de energía térmica es, como ya se mencionó, Joule. Pero antes de hablar de las unidades de medida, es necesario, en principio, a nivel doméstico explicar qué es la energía térmica y cómo y con qué finalidad debe medirse.
Todos sabemos desde la infancia que para calentarnos (obtener energía térmica) necesitamos prender fuego a algo, por eso todos quemamos fuegos, el combustible tradicional para un fuego es la leña. Por lo tanto, es obvio que al quemar combustible (cualquiera: madera, carbón, pellets, gas natural, combustible diesel), se libera energía térmica (calor). Pero para calentar, por ejemplo, diferentes volúmenes de agua, se requieren diferentes cantidades de madera (u otro combustible). Está claro que para calentar dos litros de agua bastan unas cuantas leñas, y para preparar medio balde de sopa para todo el campamento hay que abastecerse de varios manojos de leña. Para no medir valores técnicos tan estrictos como la cantidad de calor y el calor de combustión del combustible con haces de leña y baldes de sopa, los ingenieros de calefacción decidieron aclarar y ordenar y acordaron inventar una unidad de la cantidad de calor. Para que esta unidad fuera la misma en todas partes, se definió de la siguiente manera: calentar un kilogramo de agua en un grado en condiciones normales ( presión atmosférica) requiere 4.190 calorías, o 4.19 kilocalorías, por lo tanto, para calentar un gramo de agua, será suficiente mil veces menos calor: 4.19 calorías.
Una caloría está relacionada con la unidad internacional de energía térmica - Joule por la siguiente relación:
1 caloría = 4,19 julios.
Así, para calentar 1 gramo de agua en un grado, se requieren 4,19 julios de energía térmica y para calentar un kilogramo de agua, 4,190 julios de calor.
En tecnología, junto con la unidad de medida de la energía térmica (y cualquier otra), hay una unidad de potencia y, de acuerdo con el sistema internacional(SI) es Watt. El concepto de potencia también se aplica a los aparatos de calefacción. Si un dispositivo de calentamiento es capaz de proporcionar 1 Joule de energía térmica en 1 segundo, entonces su potencia es de 1 Watt. El poder es la capacidad de un dispositivo para producir (crear) una cierta cantidad de energía (en nuestro caso, energía térmica) por unidad de tiempo. Volvamos a nuestro ejemplo con agua, para calentar un kilogramo (o un litro, en el caso del agua, un kilogramo es un litro) de agua por un grado Celsius (o Kelvin, sin diferencia), necesitamos una potencia de 1 kilocaloría o 4.190 J. de energía térmica. Para calentar un kilogramo de agua en 1 segundo de tiempo por 1 grado centígrado, necesitamos un dispositivo de la siguiente potencia:
4190 J / 1 s. = 4 190 W. o 4,19 kW.
Si queremos calentar nuestro kilogramo de agua en 25 grados en el mismo segundo, entonces necesitamos veinticinco veces más energía, es decir,
4,19 * 25 = 104,75 kW.
Así, podemos concluir que una caldera de pellets con una capacidad de 104,75 kW. calienta 1 litro de agua a 25 grados en un segundo.
Ya que llegamos a Watts y kilovatios, también deberíamos hablar sobre ellos. Como ya se mencionó, Watt es una unidad de potencia, incluida la potencia térmica de una caldera, pero además de las calderas de pellets y las calderas de gas, las calderas eléctricas también son familiares para la humanidad, cuya potencia se mide, por supuesto, en el mismo. kilovatios y no consumen pellets ni gas, ni electricidad, cuya cantidad se mide en kilovatios hora. La ortografía correcta de la unidad de energía kilovatio * hora (es decir, kilovatio se multiplica por una hora, no se divide), ¡escribir kW / hora es un error!
En las calderas eléctricas, la energía eléctrica se convierte en calor (el llamado calor Joule), y si la caldera consumió 1 kW * hora de electricidad, ¿cuánto calor generó? Para responder a esta simple pregunta, necesita hacer un cálculo simple.
Convierta kilovatios a kiloJoules / segundos (kiloJoules por segundo) y horas a segundos: en una hora, 3600 segundos, obtenemos:
1 kW * hora = [1 kJ / s] * 3600 s. = 1,000 J * 3600 s = 3,600,000 Joules o 3.6 MJ.
Entonces,
1 kW * hora = 3,6 MJ.
A su vez, 3.6 MJ / 4.19 = 0.859 Mcal = 859 kcal = 859,000 cal. Energía (térmica).
Ahora pasemos a la Gigacaloría, cuyo precio es diferentes tipos a los ingenieros de calefacción les gusta contar los combustibles.
1 Gcal = 1,000,000,000 cal.
1,000,000,000 cal. = 4,19 * 1.000.000.000 = 4.190.000.000 J = 4.190 MJ. = 4,19 GJ.
O sabiendo que 1 kW * hora = 3.6 MJ, recalculamos 1 Gigacaloria por kilovatio * hora:
1 Gcal = 4190 MJ / 3,6 MJ = 1163 kW * horas!
Si, después de leer este artículo, decide consultar con un especialista de nuestra empresa sobre cualquier tema relacionado con el suministro de calor, entonces ¡Aquí!
Fuente: teplo-en.ru
730. ¿Por qué se usa agua para enfriar algunos mecanismos?
El agua tiene una alta capacidad calorífica específica, lo que contribuye a una buena disipación del calor del mecanismo.
731. ¿En qué caso es necesario gastar más energía: para calentar un litro de agua a 1 ° C o para calentar cien gramos de agua a 1 ° C?
Calentar un litro de agua, ya que mas masa, más necesita gastar energía.
732. Se sumergieron en agua caliente horquillas de cuproníquel y plata de la misma masa. ¿Recibirán la misma cantidad de calor en agua?
El tapón de cuproníquel recibirá más calor, porque el calor específico del cuproníquel es mayor que el de la plata.
733. Un trozo de plomo y un trozo de hierro fundido de la misma masa fueron golpeados tres veces con un mazo. ¿Qué pieza está más caliente?
El plomo se calentará más porque tiene un calor específico más bajo que el hierro fundido y requiere menos energía para calentar el plomo.
734. En un frasco hay agua, en el otro hay queroseno de la misma masa y temperatura. En cada matraz se arrojó un cubo de hierro igualmente calentado. ¿Qué se calentará a una temperatura más alta, el agua o el queroseno?
Queroseno.
735. ¿Por qué en las ciudades a orillas del mar las fluctuaciones de temperatura en invierno y verano son menos pronunciadas que en las ciudades ubicadas en el interior del continente?
El agua se calienta y enfría más lentamente que el aire. En invierno, se enfría y mueve masas de aire cálido a la tierra, lo que hace que el clima de la costa sea más cálido.
736. La capacidad calorífica específica del aluminio es de 920 J / kg ° C. ¿Qué significa esto?
Esto significa que para calentar 1 kg de aluminio a 1 ° C, 920 J.
737. Barras de aluminio y cobre del mismo peso 1 kg se enfrían a 1 ° C. ¿Cuánto cambiará la energía interna de cada barra? ¿Qué barra cambiará más y cuánto?
738. ¿Qué cantidad de calor se necesita para calentar un kilogramo de palanquilla de hierro a 45 ° C?
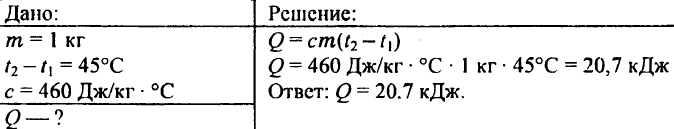
739. ¿Qué cantidad de calor se requiere para calentar 0,25 kg de agua de 30 ° C a 50 ° C?

740. ¿Cómo cambiará la energía interna de dos litros de agua cuando se calientan a 5 ° C?

741. ¿Qué cantidad de calor se necesita para calentar 5 g de agua de 20 ° C a 30 ° C?

742. ¿Qué cantidad de calor se necesita para calentar una bola de aluminio que pesa 0.03 kg a 72 ° C?

743. Calcule la cantidad de calor necesaria para calentar 15 kg de cobre a 80 ° C.

744. Calcule la cantidad de calor necesaria para calentar 5 kg de cobre de 10 ° C a 200 ° C.

745. ¿Qué cantidad de calor se requiere para calentar 0,2 kg de agua de 15 ° C a 20 ° C?

746. Agua con un peso de 0,3 kg enfriada a 20 ° C. ¿Cuánto ha disminuido la energía interna del agua?

747. ¿Qué cantidad de calor se necesita para calentar 0.4 kg de agua a una temperatura de 20 ° C a una temperatura de 30 ° C?

748. ¿Qué cantidad de calor se gasta en calentar 2,5 kg de agua a 20 ° C?

749. ¿Qué cantidad de calor se liberó al enfriar 250 g de agua de 90 ° C a 40 ° C?

750. ¿Qué cantidad de calor se requiere para calentar 0.015 litros de agua a 1 ° C?

751. Calcular la cantidad de calor necesaria para calentar un estanque de 300 m3 a 10 ° C.
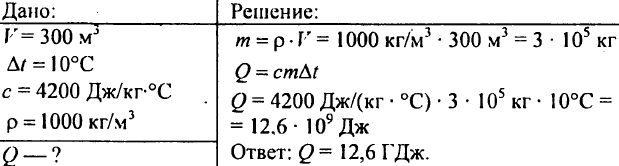
752. ¿Qué cantidad de calor se le debe dar a 1 kg de agua para elevar su temperatura de 30 ° С a 40 ° С?
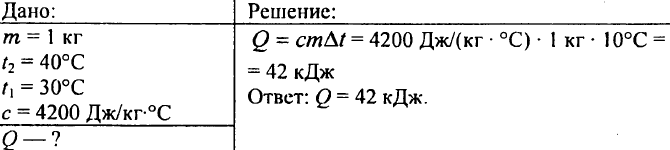
753. El agua con un volumen de 10 litros se ha enfriado de una temperatura de 100 ° C a una temperatura de 40 ° C. ¿Cuánto calor se liberó durante esto?

754. Calcule la cantidad de calor necesaria para calentar 1 m3 de arena a 60 ° C.

755. Volumen de aire 60 m3, calor específico 1000 J / kg ° С, densidad del aire 1,29 kg / m3. ¿Cuánto calor se necesita para calentarlo a 22 ° C?

756. El agua se calentó a 10 ° C, usando 4,20 103 J de calor. Determina la cantidad de agua.
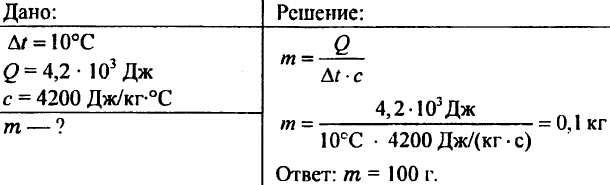
757. Se informó que el agua que pesaba 0,5 kg tenía 20,95 kJ de calor. ¿Cuál era la temperatura del agua si la temperatura inicial del agua era de 20 ° C?

758. Una cacerola de cobre que pesa 2,5 kg se llena con 8 kg de agua a 10 ° C. ¿Cuánto calor se necesita para que hierva el agua de una cacerola?

759. Se vierte un litro de agua a una temperatura de 15 ° C en un cucharón de cobre que pesa 300 g. ¿Qué cantidad de calor se necesita para calentar el agua en el cucharón a 85 ° C?

760. Se coloca en agua una pieza de granito calentado que pesa 3 kg. El granito transfiere 12,6 kJ de calor al agua, enfriándose a 10 ° C. ¿Cuál es la capacidad calorífica específica de la piedra?
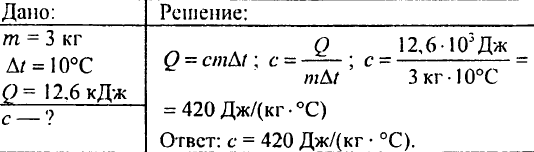
761. Se añadió agua caliente a 50 ° C a 5 kg de agua a 12 ° C para obtener una mezcla con una temperatura de 30 ° C. ¿Cuánta agua se agregó?

762. Se añadió agua a 20 ° C a 3 litros de agua a 60 ° C para obtener agua a 40 ° C. ¿Cuánta agua se agregó?

763. ¿Cuál será la temperatura de la mezcla si mezcla 600 g de agua a 80 ° C con 200 g de agua a 20 ° C?

764. Se vertió un litro de agua a 90 ° C en agua a 10 ° C y la temperatura del agua llegó a 60 ° C. ¿Cuánta agua fría había?
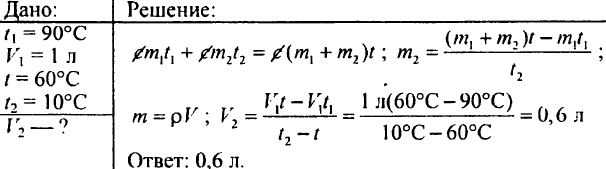
765. Determine cuánta agua caliente se debe verter en el recipiente, calentado a 60 ° C, si el recipiente ya contiene 20 litros de agua fría a una temperatura de 15 ° C; la temperatura de la mezcla debe ser de 40 ° C.
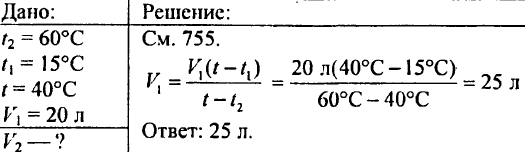
766. Determine cuánto calor se requiere para calentar 425 g de agua a 20 ° C.

767. ¿Cuántos grados se calentarán 5 kg de agua si el agua recibe 167,2 kJ?

768. ¿Cuánto calor se requiere para calentar m gramos de agua a la temperatura t1 a la temperatura t2?
769. El calorímetro se llena con 2 kg de agua a una temperatura de 15 ° C. ¿A qué temperatura se calentará el agua del calorímetro si se baja un peso de latón de 500 g, calentado a 100 ° C? La capacidad calorífica específica del latón es de 0,37 kJ / (kg ° C).
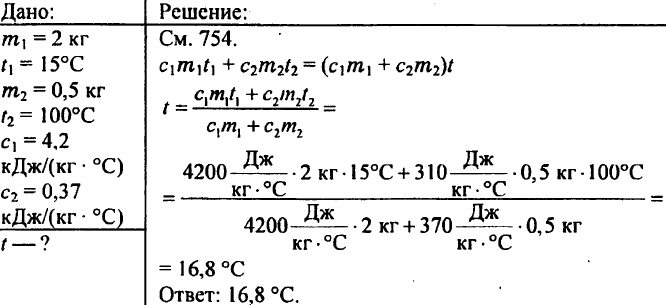
770. Hay trozos de cobre, estaño y aluminio del mismo volumen. ¿Cuál de estas piezas tiene la capacidad calorífica más alta y más baja?

771. El calorímetro se llenó con 450 g de agua, cuya temperatura era de 20 ° C. Cuando se sumergieron en esta agua 200 g de limaduras de hierro calentadas a 100 ° C, la temperatura del agua pasó a ser de 24 ° C. Determine el calor específico del aserrín.

772. Un calorímetro de cobre que pesa 100 g contiene 738 g de agua, cuya temperatura es de 15 ° C. Se introdujeron 200 g de cobre en este calorímetro a una temperatura de 100 ° C, después de lo cual la temperatura del calorímetro se elevó a 17 ° C. ¿Cuál es el calor específico del cobre?

773. Una bola de acero que pesa 10 g se saca del horno y se sumerge en agua a una temperatura de 10 ° C. La temperatura del agua subió a 25 ° C. ¿Cuál fue la temperatura de la bola en el horno si la masa de agua fuera de 50 g? La capacidad calorífica específica del acero es de 0,5 kJ / (kg ° C).
776. Se mezcló agua que pesaba 0,95 ga una temperatura de 80 ° C con agua que pesaba 0,15 ga una temperatura de 15 ° C. Determina la temperatura de la mezcla. 779. Se calentó un cortador de acero que pesaba 2 kg a una temperatura de 800 ° C y luego se bajó a un recipiente que contenía 15 litros de agua a una temperatura de 10 ° C. ¿A qué temperatura se calentará el agua del recipiente?

(Nota. Para resolver este problema, es necesario componer una ecuación en la que la temperatura desconocida del agua en el recipiente después de bajar el cortador se tome como desconocida).
780. ¿Cuál es la temperatura del agua obtenida si se mezclan 0.02 kg de agua a 15 ° C, 0.03 kg de agua a 25 ° C y 0.01 kg de agua a 60 ° C?

781. Calentar una clase bien ventilada requiere una cantidad de calor de 4,19 MJ por hora. El agua entra en los radiadores de calefacción a 80 ° C y los deja a 72 ° C. ¿Cuánta agua necesita suministrar cada hora a los radiadores?

782. Se sumergió plomo que pesaba 0,1 kg a una temperatura de 100 ° C en un calorímetro de aluminio que pesaba 0,04 kg que contenía 0,24 kg de agua a una temperatura de 15 ° C. Después de eso, la temperatura en el calorímetro se fijó en 16 ° C. ¿Cuál es el calor específico del plomo?