Физическа химия. Раздели по физическа химия Физическа химия и други химически дисциплини

3-то изд., преп. - М.: Висше училище, 2001 - 512 с., 319 с.
Учебникът е съставен в съответствие с програмата по физическа химия.
Следните раздели на курса са подробно описани в първата книга: квантовомеханични основи на теорията на химичното свързване, структура на атомите и молекулите, спектрални методи за изследване на молекулярната структура, феноменологична и статистическа термодинамика, термодинамика на разтворите и фазови равновесия.
Във втората част на раздела от курса по физична химия са представени електрохимията, химичната кинетика и катализа въз основа на идеите, развити в първата част на книгата – структурата на материята и статистическата термодинамика. Разделът "Катализа" отразява кинетиката на хетерогенните и дифузионни процеси, адсорбционната термодинамика и въпросите за реактивността.
За студенти, записани в специалности по химия.
книга 1.
Формат: djvu
размер: 11,2 MB
Изтегли: drive.google
книга 2.
Формат: djvu
размер: 7 MB
Изтегли: drive.google
СЪДЪРЖАНИЕ Книга 1.
Предговор. 3
Въведение 6
Раздел първи. Квантово-механично обосноваване на теорията за молекулярната структура и химичната връзка
Глава 1. Структурата на атома 9
§ 1.1. Квантовомеханични характеристики на микрочастиците 9
§ 1.2. Водороден атом 11
§ 1.3. Атомни орбитали на водород-подобен атом 14
§ 1.4. Завъртане на електрона 21
§ 1.5. Многоелектронни атоми 23
§ 1.6. Принцип на Паули 26
§ 1.7. Електронни конфигурации на атоми 28
Глава 2. Молекули. Теоретични методи, използвани при изследване на структурата на молекулите и химичното свързване 34
§ 2.1. Молекула. потенциална повърхност. Равновесна конфигурация 34
§ 2.2. Теория на химическата връзка и нейните проблеми. Уравнение на Шрьодингер за молекули 39
§ 2.3. Вариационен метод за решаване на уравнение на Шрьодингер 42
§ 2.4. Два основни метода на теорията за структурата на молекулите. Метод на валентна връзка и метод на молекулярна орбита 44
§ 2.5. Основни идеи на молекулярния орбитален метод 49
§ 2.6. Приблизително описание на молекулярната орбитала в метода MO LCAO 50
§ 2.7. Молекулата II в метода MO LCAO. Изчисляване на енергията и вълновата функция по вариационния метод 53
§ 2.8. Молекула H в метода MO LCAO. Ковалентна връзка 58
Глава 3. Двуатомни молекули в метода MO LCAO 62
§ 3.1. Молекулни орбитали на хомонуклеарни двуатомни молекули 62
§ 3.2. Електронни конфигурации и свойства на хомонуклеарни молекули, образувани от атоми на елементи от първия и втория период 65
§ 3.3. Хетеронуклеарни двуатомни молекули 73
§ 3.4. полярна връзка. Електрически диполен момент на молекула 78
§ 3.5. Насищане на ковалентна връзка 81
§ 3.6. Донор-акцепторна връзка 82
§ 3.7. Йонна връзка. Степента на полярност на химическата връзка 84
Глава 4. Многоатомни молекули в МО метода 88
§ 4.1. Молекулни орбитали в многоатомни молекули. Орбитална симетрия. Делокализирани и локализирани орбитали. HgO 88 молекула
§ 4.2. Описание на молекулата на метана. Делокализирани и локализирани МО. Хибридизация на орбитали 95
§ 4.3. Относно прогнозирането на равновесните конфигурации на молекулите 99
§ 4.4. Нетвърди молекули 101
§ 4.5. Молекули с множество връзки по метода MO LCAO 104
§ 4.6. Метод на Хюкел 108
§ 4.7. Описание на ароматни системи в метода MOX 110
§ 4.8. Химическа връзка в координационни съединения. Теория на полето на лигандите 117
§ 4.9. Йонно свързване в кристал 126
Глава 5. Междумолекулно взаимодействие 129
§ 5.1. Силите на Ван дер Ваалс. Други видове неспецифични взаимодействия 129
§ 5.2. Водородна връзка 136
Раздел втори. Спектрални методи за изследване на структурата и енергийните състояния на молекулите
Глава 6. Обща информация за молекулярните спектри. Елементи на теорията на молекулярните спектри 141
§ 6.1. Вътрешномолекулно движение и електромагнитен спектър. 141
§ 6.2. Молекулни спектри на емисия, абсорбция и Раманово разсейване. EPR и NMR спектри 145
§ 6.3. Спектър на въртене на двуатомна молекула (приближение на твърд ротатор) 150
§ 6.4. Вибрационно-ротационен спектър на двуатомна молекула. Приближение на хармоничния осцилатор 156
§ 6.5. Молекулата е анхармоничен осцилатор. Структура на вибрационния спектър 162
§ 6.6. Електронни спектри. Определяне на енергията на дисоциация на двуатомни молекули 169
§ 6.7. Ротационни спектри и строги многоатомни молекули.... 171
§ 6.8. Вибрации, спектър и структура на многоатомни молекули 175
§ 6.9. Използване на вибрационни спектри за определяне на структурата на молекулите 180
§ 6.10. Влияние на междумолекулното взаимодействие на средата и агрегатното състояние върху вибрационния спектър 183
Раздел три. Химическа термодинамика
Глава 7. Общи понятия. Първият закон на термодинамиката и неговото приложение 186
§ 7.1. Предмет и задачи на химическата термодинамика 186
§ 7.2. Основни понятия и дефиниции на химическата термодинамика 188
§ 7.3. Първият закон на термодинамиката. Некръгли процеси 199
§ 7.4. Топлинен капацитет 202
§ 7.5. Влияние на температурата върху топлинния капацитет. Температурна серия.. 208
§ 7.6. Квантова теория на топлинния капацитет на кристалната материя 211
§ 7.7. Квантово-статистическа теория на топлинния капацитет на газообразно вещество 215
§ 7.8. термични ефекти. Закон на Хес 217
§ 7.9. Прилагане на закона на Хес за изчисляване на топлинните ефекти 220
§ 7.10. Зависимост на топлинния ефект от температурата. Уравнение на Кирхоф 227
Глава 8. Вторият закон на термодинамиката и неговото приложение 235
§ 8.1. Спонтанни и неспонтанни процеси. Вторият закон на термодинамиката 235
§ 8.2. Ентропия 236
§ 8.3. Промяна на ентропията при нестатични процеси 239
§ 8.4. Промяната на ентропията като критерий за насоченост и равновесие в изолирана "система 240
§ 8.5. Характерни функции. Термодинамични потенциали 241
§ 8.6. Критерии за възможност за спонтанен процес и равновесие в затворени системи 249
§ 8.7. Промяна на ентропията при някои процеси 251
§ 8.8. Енергия на Гибс на смес от идеални газове. Химичен потенциал 261
§ 8.9. Общи условия на химично равновесие 265
§ 8.10. Законът за активните маси. Равновесна константа за реакции в газова фаза 266
§ 8.11. Уравнение на реакционната изотерма 271
§ 8.12. Използване на закона за действието на масата за изчисляване на състава на равновесна смес 273
§ 8.13. Влияние на температурата върху химичното равновесие. Реакционно изобарно уравнение 282
§ 8.14. Интегрална форма на зависимост на енергията на Гибс и константата на равновесие от температура 284
§ 8.15. Химическо равновесие в хетерогенни системи 286
Глава 9. Третият закон на термодинамиката и изчисляването на химичното равновесие 289
§ 9.1. Топлинна теорема на Нернст. Трети закон на термодинамиката 289
§ 9.2. Изчисляване на промяната в стандартната енергия на Гибс и константата на равновесие по метода на Темкин - Шварцман 294
§ 9.3. Изчисляване на промяната в стандартната енергия на Гибс и равновесната константа с помощта на функциите на намалената енергия на Гибс 297
§ 9.4. Адиабатни реакции 299
Глава 10. Химическо равновесие в реални системи 303
§ 10.1. Летливост и коефициент на фугиозност на газовете 303
§ 10.2. Изчисляване на химическо равновесие в реална газова система при високо налягане 312
§ 10.3. Изчисляване на химичното равновесие в системи, в които няколко реакции протичат едновременно 314
Глава 11. Въведение в статистическата термодинамика 320
§ 11.1. Статистическа физика и статистическа термодинамика. Макроскопско и микроскопско описание на състоянието на системата 320
§ 11.2. Микроскопско описание на състоянието по метода на класическата механика 323
§ 11.3. Микроскопско описание на състоянието по метода на квантовата механика. Квантова статистика 324
§ 11.4. Два вида средни (микроканонични и канонични средни) 325
§ 11.5. Връзка между ентропията и статистическото тегло. Статистическа природа на втория закон на термодинамиката 326
§ 11.6. Термостатна система. Канонично разпределение на Гибс. 330
§ 11.7. Сборът от състоянията на системата и връзката й с енергията. Хелмхолц 335
§ 11.8. Сума по състояния на частица 337
§ 11.9. Изразяване на термодинамичните функции чрез сумата от състоянията на системата 340
§ 11.10. Сборът от състоянията на система от едномерни хармонични осцилатори. Термодинамични свойства на едноатомно твърдо вещество според теорията на Айнщайн 343
§ 11.11. Болцманова квантова статистика. Законът на Максуел за разпределение на молекулярните скорости 346
§ 11.12. Ферми - Дирак и Бозе - Айнщайн статистика 352
§ 11.13 Общи формули за изчисляване на термодинамични функции от молекулярни данни 353
§ 11.14 Изчисляване на термодинамичните функции на идеален газ при допускането за твърдо въртене и хармонични вибрации на молекулите 357
Четвърти раздел. Решения
Глава 12. Обща характеристика на решенията 365
§ 12.1. Класификация на минохвъргачки 365
§ 12.2. Концентрация на разтворите 367
5 12.3. Специфика на решенията. Ролята на междумолекулните и химичните взаимодействия, концепцията за солватация 368
§ 12.4. Основните насоки в развитието на теорията на решенията 372
§ 12.5. Термодинамични условия за образуване на разтвори 374
§ 12.6. Частични моларни стойности 375
§ 12.7. Основни методи за определяне на частични моларни стойности 379
§ 12.8. Частични и относителни частични моларни енталпии 381
§ 12.9. Топлини на разтваряне и разреждане 382
§ 12.10 Термодинамични свойства на идеални течни разтвори 386
§ 12.11.3 Закон на Раул 390
§ 12.12. Точка на кипене на идеален разтвор 392
§ 12.13 Точка на замръзване на идеално решение 395
§ 12.14.0 сметично налягане на идеално решение 397
§ 12.15 Неидеални решения 400
§ 12.16. Изключително разредени, редовни и атермални разтвори 402
§ 12.17. Дейност. Коефициент на активност. Стандартно състояние 404
§ 12.18.0смотичен коефициент 407
§ 12.19 Методи за определяне на дейностите 409
§ 12.20 Връзка на активността и коефициента на активност с термодинамичните свойства на разтвора и излишните термодинамични функции 412
Раздел 5. Фазови равновесия
Глава 13. Термодинамична теория на фазовите равновесия 415
§ 13.1. Основни понятия 415
§ 13.2. Условия за фазово равновесие 418
§ 13.3. Правило за фаза на Гибс 419
Глава 14 Еднокомпонентни системи 421
§ 14.1. Прилагане на фазовото правило на Гибс към еднокомпонентни системи 421
§ 14.2. Фазови преходи от първи и втори вид 422
§ 14.3. Уравнение на Клапейрон - Клаузиус 425
§ 14.4. Налягане на наситена пара 423
§ 14.5. Диаграми на състоянието на еднокомпонентни системи 429
§ 14.6. Диаграма на състоянието на въглероден диоксид 431
§ 14.7. Диаграма за състоянието на водата 432
§ 14.8. Диаграма на състоянието на сярата 433
§ 14.9. Енантиотропни и монотропни фазови преходи 435
Глава 15. Двукомпонентни системи 436
§ 15.1. Метод на физичен и химичен анализ 436
§ 15.2. Прилагане на фазовото правило на Гибс към двукомпонентни системи 437
§ 15.3. Равновесен газ - течен разтвор в двукомпонентни системи 438
§ 15.4. Равновесна течност - течност в двукомпонентни системи 442
§ 15.5. Равновесна пара - течен разтвор в двукомпонентни системи 444
§ 15.6. Физически и химични основи на дестилация на разтвор 453
§ 15.7. Равновесни кристали - течен разтвор в двукомпонентни системи 457
§ 15.8. Равновесна течност - газ и кристали - газ (пара) в двукомпонентни системи 476
§ 15-9. Изчисления на диаграма на състоянието 476
Глава 16. Трикомпонентни системи 482
§ 16.1. Прилагане на фазовото правило на Гибс към трикомпонентни системи 482
§ 16.2. Графично представяне на състава на трикомпонентна система 482
§ 16.3. Равновесни кристали - течен разтвор в трикомпонентни системи 484
§ 16.4. Равновесна течност - течност в трикомпонентни системи 489
§ 16.5. Разпределение на разтвореното вещество между две течни фази. Екстракция 491
Приложение 495
Индекс 497
СЪДЪРЖАНИЕ Книга 2.
Предговор 3
Раздел шест. електрохимия
Глава 17. Разтвори, електролити 4
§ 17.1. Предмет електрохимия 4
§ 17.2. Специфичност на електролитните разтвори 5
§ 17.3. Електролитна дисоциация в разтвор 6
§ 17.4. Средна йонна активност и фактор на активност 10
§ 17.5. Основни понятия на електростатичната теория на силните електролити Дебай и Хюкел 13
§ 17.6. Основни понятия на теорията на йонните асоциации 22
§ 17.7. Термодинамични свойства на йони 24
§ 17.8. Термодинамика на йонната солватация 28
Глава 18. Неравновесни явления в електролити. Електрическа проводимост на електролитите 30
§ 18.1. Основни понятия. Законите на Фарадей 30
§ 18.2. Движение на йони в електрическо поле. Номера на йонния транспорт. 32
§ 18.3. Електрическа проводимост на електролитите. Електрическа проводимост 37
§ 18.4. Електрическа проводимост на електролитите. Моларна електропроводимост 39
§ 18.5. Моларна електропроводимост на хидрониеви и хидроксидни йони 43
§ 18.6. Електрическа проводимост на неводни разтвори 44
§ 18.7. Електрическа проводимост на твърди и разтопени електролити 46
§ 18.8. Кондуктометрия 47
Глава 19. Равновесни електродни процеси 49
§ 19.1. Основни понятия 49
§ 19.2. ЕМП на електрохимична система. Потенциал на електрода 51
§ 19.3. Възникване на потенциален скок на интерфейса разтвор-метал 53
§ 19.4. Дифузионен потенциал 55
§ 19.5. Структурата на електрическия двоен слой на интерфейса разтвор-метал 56
§ 19.6. Термодинамика на обратими електрохимични системи 60
§ 19.7. Класификация на реверсивните електроди 64
§ 19.8. Електродни потенциали в неводни разтвори 74
§ 19.9. Електрохимични вериги 75
§ 19.10. Приложение на теорията на електрохимичните системи за изследване на равновесието в разтворите 82
§ 19.11. Потенциометрия 85
Раздел седми. Кинетика на химичните реакции
Глава 20. Закони на химическата кинетика 93
§ 20.1. Общи понятия и определения 93
§ 20.2. Скорост на химическа реакция 95
§ 20.3. Законът за масовото действие и принципът за независимост на реакциите 101
Глава 21. Кинетика на химичните реакции в затворени системи. 105
§ 21.1. Едностранни реакции от първи ред 105
§ 21.2. Едностранни реакции от втори ред 109
§ 21.3. Еднопосочни реакции от n-ти порядък 111
§ 21.4. Методи за определяне на реда на реакцията 112
§ 21.5. Двустранни реакции от първи порядък 113
§ 21.6. Двустранни реакции от втори порядък 116
§ 21.Т. Паралелни еднопосочни реакции 117
§ 21.8. Едностранни последователни реакции 119
§ 21.9. Метод на квазистационарни концентрации 125
Глава 22. Кинетика на реакциите в отворени системи 127
§ 22.1. Кинетика на реакцията в идеално смесен реактор 127
§ 22.2. Кинетика на реакцията в реактор с тапа 129
Глава 23. Теорията на елементарния акт на химичното взаимодействие 133
§ 23.1. Елементарно химично действие 133
§ 23.2. Теория на активните сблъсъци 137
§ 23.3. Теория на активирания комплекс 141
§ 23.4. Предекспоненциален фактор в уравнението на Арениус според теорията на преходното състояние 154
§ 23.5. МО симетрия и енергия на активиране на химичните реакции 159
Глава 24. Кинетика на реакциите в разтвори, верижни и фотохимични реакции 166
§ 24.1. Характеристики на кинетиката на реакциите в разтвори 166
§ 24.2. Влияние на средата върху константата на скоростта на реакцията 170
§ 24.3. Кинетика на йонните реакции в разтвори 178
§ 24.4. Верижни реакции 181
§ 24.5. Фотохимични реакции 189
Глава 25. Кинетика на електродните процеси 196
§ 25.1. Скоростта на електрохимична реакция. обменен ток 196
§ 25.2. Поляризация на електрода 197
§ 25.3. Дифузионно пренапрежение 199
§ 25.4. Електрохимично пренапрежение 205
§ 25.5. Други видове пренапрежения 210
5 25.6. Температурно-кинетичен метод за определяне естеството на поляризацията при електрохимични процеси 211
§ 25.7. Свръхнапрежение по време на електролитно отделяне на водород 213
§ 25.8. Електролиза. Напрежение на разлагане 217
§ 25.9. Поляризационни явления в химически източници на електрически ток 220
§ 25.10. Електрохимична корозия на метали. пасивност на металите. Методи за защита от корозия 222
Раздел осми. Катализа
Глава 26. Принципи на каталитично действие 228
§ 26.1. Основни понятия и дефиниции 228
§ 26.2. Характеристики на кинетиката на каталитичните реакции 232
§ 26.3. Енергия на активиране на каталитични реакции 237
§ 26.4. Взаимодействие на реагентите с катализатор и принципи на каталитично действие 241
Глава 27. Хомогенна катализа 245
§ 27.1. Киселинно-алкална катализа 246
§ 27.2. Редокс катализа 255
§ 27.3. Ензимна катализа 260
§ 27.4. Автокатализа, инхибиране и периодични каталитични реакции 266
§ 27.5. Приложение в индустрията и перспективи за развитие на хомогенна катализа 271
Глава 28. Хетерогенна катализа. 273
§ 28.1. Повърхностна структура на хетерогенни катализатори 273
§ 28.2. Адсорбцията като етап на хетерогенни каталитични реакции 277
§ 28.3. Механизъм на хетерогенните каталитични реакции 282
§ 28.4. Кинетика на хетерогенни каталитични реакции върху еднакво достъпна повърхност 285
§ 28.5. Макрокинетика на хетерогенни каталитични процеси 292
§ 28.6. Приложение на хетерогенна катализа в индустрията 300
Литература 303
Приложение 305
Индекс 312
Съдържание 316
Класификацията на науките се основава на класификацията на формите на движение на материята и тяхната взаимовръзка и разлика. Следователно, за да се очертаят границите на физическата химия с редица клонове на физиката и химията, трябва да се разгледа връзката и разликата между химичните и физическите форми на движение.
За химичната форма на движение, т.е. за химичен процес, е характерна промяна в броя и разположението на атомите в молекулата на реагиращите вещества. Сред много физически форми на движение (електромагнитно поле, движение и трансформация на елементарни частици, физика на атомните ядра и др.) има особено тясна връзка с химичните процеси. вътрешномолекулна форма на движение (вибрации в молекула, нейното електронно възбуждане и йонизация). Най-простият химичен процес - елементарен акт на термична дисоциация на молекула протича с увеличаване на интензитета (амплитудата и енергията) на вибрациите в молекулата, особено вибрациите на ядрата по протежение на валентната връзка между тях. Постигането на известна критична стойност на вибрационната енергия в посока на определена връзка в молекулата води до разкъсване на тази връзка и дисоциация на молекулата на две части.
По-сложните реакции, включващи няколко (обикновено две) молекули, могат да се разглеждат като комбинация от две молекули, когато се сблъскат в нестабилен и краткотраен комплекс (т.нар. активен комплекс) и бързото разрушаване на този комплекс в нови молекули, т.к. този комплекс се оказва нестабилен при вътрешни вибрации.чрез определени връзки.
По този начин елементарен химичен акт е специална, критична точка на осцилаторното движение на молекулите. Последното само по себе си не може да се счита за химическо движение, но е в основата на първичните химични процеси.
За химическото преобразуване на значителни маси материя, т.е. много молекули, сблъсъкът на молекули и обменът на енергии между тях (прехвърляне на енергията на движението на молекулите на реакционните продукти към молекулите на изходните вещества чрез на сблъсъци) са необходими. Така истинският химичен процес е тясно свързан с втория физическа форма на движение - хаотично движение на молекули на макроскопични тела, което често се нарича топлинно движение.
Взаимните връзки на химичната форма на движение с двете физически форми на движение бяха очертани по-горе накратко и най-общо. Очевидно има същите връзки на химичния процес с излъчването на движението на електромагнитно поле, с йонизацията на атоми и молекули (електрохимия) и т.н.
Структурата на материята . Този раздел включва структурата на атомите, структурата на молекулите и доктрината за агрегатните състояния.
Доктрината за структурата на атомите има повече общо с физиката, отколкото с физическата химия. Тази доктрина е основата за изучаване на структурата на молекулите.
При изучаването на структурата на молекулите се изучават геометрията на молекулите, вътрешномолекулните движения и силите, които свързват атомите в една молекула. При експериментални изследвания на структурата на молекулите най-голямо приложение е получил методът на молекулярната спектроскопия (включително радиоспектроскопията), широко се използват електрически, рентгенови, магнитни и други методи.
В теорията на агрегатните състояния се разглеждат взаимодействията на молекулите в газове, течности и кристали, както и свойствата на веществата в различни агрегатни състояния. Този клон на науката, който е много важен за физическата химия, може да се счита за част от физиката (молекулярната физика).
Целият раздел за структурата на материята също може да се разглежда като част от физиката.
Химическа термодинамика . В този раздел, въз основа на законите на общата термодинамика, се излагат законите на химическото равновесие и учението за фазовите равновесия, което обикновено се нарича правило на фазите. Част от химическата термодинамика е термохимия,в които се разглеждат топлинните ефекти на химичните реакции.
Учението за разтворите има за цел да обясни и предскаже свойствата на разтворите (хомогенни смеси от няколко вещества) въз основа на свойствата на веществата, които съставляват разтвора.
Решаването на този проблем изисква изграждането на обща теория за взаимодействието на хетерогенни молекули, т.е. решението на основния проблем, молекулярната физика. За разработването на обща теория и частни обобщения се изследва молекулярната структура на разтворите и различните им свойства в зависимост от състава.
Учението за повърхностните явления . Изследват се различни свойства на повърхностните слоеве на твърди вещества и течности (между фазите); едно от основните явления, изучавани в повърхностните слоеве е адсорбция(натрупване на вещества в повърхностния слой).
В системи, където интерфейсите между течна, твърда и газообразна фаза са силно развити (колоидни разтвори, емулсии, мъгли, дим), свойствата на повърхностните слоеве стават от първостепенно значение и определят много от уникалните свойства на цялата система като цяло . Такава микрохетерогененсистеми се изучават колоидна химия,който е основен самостоятелен раздел по физическа химия и самостоятелна академична дисциплина във висшите химически учебни заведения.
електрохимия. Изучава се взаимодействието на електрическите явления и химичните реакции (електролиза, химически източници на електрически ток, теорията на електросинтеза). Електрохимията обикновено включва изследване на свойствата на електролитните разтвори, което с еднакво право може да се припише на изследването на разтворите.
Химическа кинетика и катализа . Изучаваме скоростта на химичните реакции, зависимостта на скоростта на реакцията от външни условия (налягане, температура, електрически разряд и др.), връзката на скоростта на реакцията със структурата и енергийните състояния на молекулите, ефекта върху скоростта на реакцията на вещества, които не участват в стехиометричното уравнение на реакцията (катализа).
фотохимия. Изследва се взаимодействието на радиацията и веществата, участващи в химичните трансформации (реакции, протичащи под въздействието на радиация, например фотографски процеси и фотосинтеза, луминесценция). Фотохимията е тясно свързана с химическата кинетика и изучаването на структурата на молекулите.
Горният списък на основните раздели на физическата химия не обхваща някои от най-новите области и по-малки раздели на тази наука, които могат да се разглеждат като части от по-големи раздели или като самостоятелни раздели на физическата химия. Такива са например радиационната химия, физикохимията на макромолекулните вещества, магнитохимията, газовата електрохимия и други клонове на физичната химия. Някои от тях сега бързо набират значение.
Методи на физични и химични изследвания
Основните методи на физическата химия са естествено методите на физиката и химията. Това е на първо място експериментален метод - изследване на зависимостта на свойствата на веществата от външни условия и експериментално изследване на законите на протичането на химичните реакции във времето и законите на химичното равновесие.
Теоретичното разбиране на експерименталния материал и създаването на последователна система от познания за свойствата на веществата и законите на химичните реакции се основава на следните методи на теоретичната физика.
Квантово механичен метод (по-специално методът на вълновата механика), който е в основата на изследването на структурата и свойствата на отделните атоми и молекули и тяхното взаимодействие помежду си. Факти, свързани със свойствата на отделните молекули, се получават главно с помощта на експериментални оптични методи.
Метод на статистическа физика , което дава възможност да се изчислят свойствата на дадено вещество; състоящ се от много молекули („макроскопични“ свойства), базирани на познаване на свойствата на отделните молекули.
Термодинамичен метод , което позволява количествено да се свържат различни свойства на веществото („макроскопични“ свойства) и да се изчислят някои от тези свойства въз основа на експерименталните стойности на други свойства.
Съвременните физикохимични изследвания във всяка конкретна област се характеризират с използването на различни експериментални и теоретични методи за изследване на различните свойства на веществата и за изясняване на връзката им със структурата на молекулите. Целият набор от данни и горните теоретични методи се използват за постигане на основната цел - да се определи зависимостта на посоката, скоростта и границите на химичните трансформации от външните условия и от структурата на молекулите, участващи в химичните реакции.
ФИЗИЧЕСКА ХИМИЯ
§ 1. Предмет физикохимия. Неговото значение
Изучава връзката на химичните и физичните явления физическа химия.Този клон на химията е границата между химията и физиката. Използвайки теоретичните и експериментални методи на двете науки, както и собствените си методи, физическата химия се занимава с многостранно изследване на химичните реакции и придружаващите ги физични процеси. Тъй като обаче дори едно многостранно изследване никога не е пълно и не обхваща изчерпателно явлението, законите и законите на физичната химия, както и тези на другите природни науки, винаги опростяват явлението и не го отразяват напълно.
Бързото развитие и нарастващото значение на физическата химия са свързани с нейното гранично положение между физика и химия. Основната обща задача на физичната химия е прогнозирането на хода на процеса и крайния резултат (равновесно състояние) при различни условия въз основа на данни за структурата и свойствата на веществата, които съставляват изследваната система.
§ 2. Кратко изложение на историята на развитието на физичната химия
Терминът "физическа химия" и определението на тази наука са дадени за първи път от М. В. Ломоносов, който през 1752-1754 г. прочете курс по физическа химия на студентите от Академията на науките и остави ръкописа на този курс "Въведение в истинската физическа химия" (1752). Ломоносов извършва много изследвания, чиито теми съответстват на съставения от него "План за курса по физическа химия" (1752) и програмата за експериментална работа "Опит по физическа химия" (1754). Под негово ръководство се проведе и ученическа работилница по физическа химия.
Ломоносов дава следната дефиниция на физичната химия: „Физическата химия е наука, която обяснява, въз основа на разпоредбите и експериментите на физиката, какво се случва в смесени тела по време на химически операции“. Това определение е близко до съвременното.
За развитието на физичната химия откриването на два закона на термодинамиката в средата на 19 век (С. Карно, Ю. Р. Майер, Г. Хелмхолц, Д. П. Джоул, Р. Клаузиус, В. Томсън) е от голямо значение. важност.
Броят и разнообразието на изследванията, лежащи в областта, която граничи между физика и химия, непрекъснато нараства през 19 век. Разработена е термодинамичната теория на химичното равновесие (K.M. Guldberg, P. Waage, D.W. Gibbs). Изследванията на Л. Ф. Вилхелми положиха основата на изучаването на скоростта на химичните реакции (химическа кинетика). Изучава се преносът на електричество в разтвори (I.V. Gittorf, F.V.G. Kolrausch), изследвани са законите на равновесието на разтворите с пара (D.P. Konovalov) и е разработена теорията на разтворите (D.I. Mendeleev).
Признаването на физическата химия като самостоятелна наука и академична дисциплина се изразява в създаването в университета в Лайпциг (Германия) през 1887 г. на първата катедра по физическа химия, ръководена от В. Оствалд и в основаването на първото научно списание по физика химия там. В края на 19 век Лайпцигският университет е център за развитие на физическата химия, а водещи физикохимици са В. Оствалд, Й. Х. Вант Хоф, С. Арениус и В. Нернст. По това време са определени три основни раздела на физичната химия - химична термодинамика, химическа кинетика и електрохимия.
Най-важните области на науката, чието развитие е необходимо условие за техническия прогрес, включват изучаването на химичните процеси; физическата химия играе водеща роля в развитието на този проблем.
§ 3. Раздели по физическа химия. Изследователски методи
Химическа термодинамика. В този раздел, въз основа на законите на общата термодинамика, се излагат законите на химическото равновесие и учението за фазовите равновесия.
Учението за разтворите има за цел да обясни и предскаже свойствата на разтворите (хомогенни смеси от няколко вещества) въз основа на свойствата на веществата, които съставляват разтвора.
Учението за повърхностните явления. Изследват се различни свойства на повърхностните слоеве на твърди вещества и течности (между фазите); едно от основните изследвани явления в повърхностните слоеве е адсорбция(натрупване на материя в повърхностния слой).
В системи, където интерфейсите между течна, твърда и газообразна фаза са силно развити (емулсии, мъгли, дим и др.), свойствата на повърхностните слоеве стават от първостепенно значение и определят много от уникалните свойства на цялата система като цяла. Такава разпръснато (микрохетероген)системи се изучават колоидна химия,което е основен независим клон на физическата химия.
Горният списък на основните раздели на физическата химия не обхваща някои области и по-малки раздели от тази наука, които могат да се разглеждат като части от по-големи раздели или като самостоятелни раздели на физическата химия. Трябва още веднъж да се подчертае тясната взаимовръзка между различните клонове на физичната химия. При изучаването на всяко явление трябва да се използва арсенал от идеи, теории и методи за изучаване на много клонове на химията (а често и други науки). Само при първоначално запознаване с физикохимията е възможно с образователна цел материалът да се разпредели в посочените раздели.
Методи на физични и химични изследвания. Основните методи на физическата химия са естествено методите на физиката и химията. Това е преди всичко експериментален метод - изследване на зависимостта на свойствата на веществата от външни условия, експериментално изследване на законите на протичането на различни процеси и законите на химическото равновесие.
Теоретичното разбиране на експерименталните данни и създаването на последователна система от знания се основава на методите на теоретичната физика.
Термодинамичният метод, който е един от тях, дава възможност да се свържат количествено различни свойства на веществото („макроскопични“ свойства) и да се изчислят някои от тези свойства въз основа на експерименталните стойности на други свойства.
ГЛАВА I
ПЪРВИЯТ ЗАКОН НА ТЕРМОДИНАМИКАТА
§ 1. Енергия. Законът за запазване и преобразуване на енергията
Неразделно свойство (атрибут) на материята е движението; тя е неразрушима, като самата материя. Движението на материята се проявява в различни форми, които могат да преминават една в друга. Мярката за движение на материята е енергия.Количествено енергията се изразява по определен начин чрез параметрите, характерни за всяка конкретна форма на движение, и в единици, специфични за тази форма.
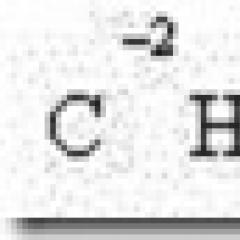
В системата от единици SI единицата за енергия (топлота и работа) е джаул ( J),равно на работата на силата в 1 Хпо пътя към 1 м. 1 J = 1 Nm.
Широко използваната единица за енергия (топлина), калориите, в момента е извънсистемна единица, която е разрешена за употреба. Използваната в момента калория по дефиниция се равнява на определен брой джаули: 1 изпражненияе равно на 4,1868 джаула. Това устройство се използва в топлотехниката и може да се нарече термична калория.В химическата термодинамика се използва малко по-различна единица, приравнена на 4,1840 джаула и наречена термохимична калория.Целесъобразността на неговото приложение е свързана с удобството при използване на обширния експериментален термохимичен материал, събран в справочниците и изразен в тези единици.
Когато една форма на движение се трансформира в друга, енергиите на изчезналото и появилото се движение, изразени в различни единици, са еквивалентни една на друга, т.е. енергията на изчезналото движение е в постоянна количествена връзка с енергията на движението. който е възникнал (законът за еквивалентните трансформации на енергията).Това съотношение не зависи от енергиите на двете форми на движение и от специфичните условия, при които е осъществен преходът от една форма на движение към друга. И така, когато енергията на електрически ток се преобразува в енергията на хаотично молекулярно движение, един джаул електрическа енергия винаги се превръща в 0,239 изпражненияенергия на молекулярното движение.
Така енергията като мярка за движение на материята винаги се проявява в качествено оригинална форма, съответстваща на дадена форма на движение, и се изразява в съответните мерни единици. От друга страна, той отразява количествено единството на всички форми на движение, тяхната взаимна конвертируемост и неразрушимостта на движението.
Горният закон за еквивалентни трансформации на енергията е физически експериментален закон. Законът за еквивалентните енергийни трансформацииможе да се изрази по различен начин, а именно във формата законът за запазване и преобразуване на енергията:енергията нито се създава, нито се унищожава; при всички процеси и явления общата енергия на всички части на изолирана материална система, участващи в този процес, не се увеличава или намалява, оставайки постоянна.
Законът за запазване и преобразуване на енергията е универсален в смисъл, че е приложим за явления, възникващи в произволно големи тела, представляващи съвкупност от огромен брой молекули, и за явления, протичащи с участието на една или няколко молекули.
За различните форми на механично движение законът за запазване на енергията отдавна се изразява в качествена форма (Декарт - 1640) и количествена форма (Лайбниц - 1697).
За взаимните трансформации на топлина и работа (виж по-долу) законът за запазване на енергията е доказан като естествен научен закон от изследванията на Ю. Р. Майер, Г. Хелмхолц и Д. П. Джоул, извършени през четиридесетте години на XX век. XIX век.
Използвайки закона за еквивалентните трансформации, е възможно да се изразят енергиите на различни форми на движение в единици, характерни за един вид енергия (една форма на движение), и след това да се извършат операции по събиране, изваждане и т.н.
§ 2. Предмет, метод и граници на термодинамиката
Термодинамиката е един от основните клонове на теоретичната физика. Термодинамиката изучава законите на взаимните трансформации на различни видове енергия, свързани с преноса на енергия между телата под формата на топлина и работа.Фокусирайки вниманието си върху топлината и работата като форми на пренос на енергия в различни процеси, термодинамиката включва множество енергийни връзки и зависимости между различни свойства на вещество в кръга на разглеждане и дава много широко приложими обобщения, наречени законите на термодинамиката.
Когато се установяват основните термодинамични закони, енергийните трансформации (често много сложни), които се случват вътре в тялото, обикновено не са подробни. Видовете енергия, присъщи на тялото в даденото му състояние, също не са диференцирани; съвкупността от всички тези видове енергия се разглежда като единна вътрешна енергия на системата .
Предметът на термодинамиката, описан по-горе, определя метода и границите на тази наука. Разграничението между топлина и работа, взето като отправна точка от термодинамиката, и противопоставянето на топлина и работа има смисъл само за тела, състоящи се от много молекули, тъй като за една молекула или за набор от малък брой молекули, концепциите за топлината и работата губят смисъл. Следователно термодинамиката разглежда само тела, състоящи се от голям брой молекули, т.нар. макроскопски системиосвен това, термодинамиката в нейната класическа форма не отчита поведението и свойствата на отделните молекули.
Термодинамичният метод се характеризира и с това, че обект на изследване е тяло или група тела, изолирани от материалния свят в термодинамична система (наричани по-долу просто система).
Системата има определени граници, които я отделят от външния свят (средата).
Системата е хомогенна , ако всеки негов параметър има една и съща стойност във всички части на системата или непрекъснато се променя от точка до точка.
Системата е хетерогенен , ако се състои от няколко макроскопични (състоящи се на свой ред от много молекули) части, разделени една от друга чрез видими интерфейси. На тези повърхности някои параметри се променят рязко. Такава например е системата „твърда сол – наситен воден солен разтвор – наситена водна пара”. Тук, на границите сол - разтвор и разтвор - пара, съставът и плътността се променят рязко.
Наричат се хомогенни части на системата, отделени от другите части чрез видими интерфейси фази . В този случай наборът от отделни хомогенни части на системата, които имат еднакви физически и термодинамични свойства, се счита за една фаза (например набор от кристали от едно вещество или набор от течни капчици, суспендирани в газ и образуващи мъгла). Всяка фаза на системата се характеризира със собствено уравнение на състоянието.
Нарича се система, която не може да обменя материя и енергия с околната среда (под формата на топлина или работа). изолиран .
Нарича се система, която може да обменя материя и енергия с околната среда (под формата на топлина или работа). отворен.
Нарича се система, която не може да обменя материя с околната среда, но може да обменя енергия (под формата на топлина или работа). затворен .
Термодинамиката изучава връзката между такива измерими свойства на материалната система като цяло и нейните макроскопични части (фази), като температура, налягане, маса, плътност и химичен състав на фазите, включени в системата, както и някои други свойства, като връзката между промените в тези свойства.
Съвкупността от свойства, изследвани от термодинамиката (т.нар термодинамични параметри на системата) дефинира термодинамично състояние на системата.Промяната във всички термодинамични свойства (дори и само едно) води до промяна в термодинамичното състояние на системата.
Всички процеси, протичащи в природата, могат да бъдат разделени на спонтанни (естествени) и неспонтанни.
Спонтанни процесиТова са процеси, които не изискват външна енергия. Например преносът на топлина от тяло с по-висока температура към тяло с по-ниска температура, разтварянето на солта във вода и т.н., протичат от само себе си.
Неспонтанни процесиизискват енергия отвън за тяхното протичане, например, разделянето на въздуха на азот и кислород.
Термодинамиката разглежда главно такива състояния на система, при които нейните параметри (температура, налягане, електростатичен потенциал и др.) не се променят спонтанно с времето и имат една и съща стойност във всички точки от обема на отделните фази. Такива състояния се наричат балансиран.
Един от основните постулати на термодинамиката е твърдението, че ходът на всеки спонтанен процес в крайна сметка довежда изолираната система до равновесно състояние, когато нейните свойства вече няма да се променят, т.е. в системата ще се установи равновесие.
Състояния, характеризиращи се с неравномерно и вариращо във времето разпределение на температурата, налягането и състава във фазите са неравновесност. Те се разглеждат от термодинамиката на неравновесните (необратими) процеси, при които освен основните термодинамични закони се използват и допълнителни допускания.
Термодинамиката, изградена въз основа на основните закони на термодинамиката, които се разглеждат като обобщение на опита, често се нарича класическиили феноменологична термодинамика.Термодинамиката осигурява теоретичните основи на теорията на топлинните двигатели; този раздел се нарича техническа термодинамика.Занимава се с изследване на химичните процеси от термодинамична гледна точка химическа термодинамика,което е един от основните клонове на физическата химия.
§ 3. Топлина и работа
Промените във формите на движение при преминаването му от едно тяло в друго и съответните трансформации на енергията са много разнообразни. Формите на прехода на самото движение и свързаните с него преходи на енергия могат да се разделят на две групи.
Първата група включва само една форма на преход на движение чрез хаотични сблъсъци на молекули на две съседни тела, т.е. чрез проводимост (и в същото време чрез излъчване). Мярката на предаденото по този начин движение е топлина .
Втората група включва различни форми на преход на движение, общата черта на които е движението на макроскопични маси под действието на всякакви външни сили, които имат насочен характер. Такива са издигането на тела в гравитационно поле, преминаването на определено количество електричество от по-голям електростатичен потенциал към по-малък, разширяването на газ под налягане и т.н. Общата мярка за движение, предавано по този начин е работа .
Топлината и работата характеризират качествено и количествено две различни форми на предаване на движение от една част на материалния свят в друга.
Предаването на движение е вид сложно движение на материята, чиито две основни форми разграничаваме. Топлината и работата са мерки за тези две сложни форми на движение на материята и трябва да се разглеждат като видове енергия.
Общото свойство на топлината и работата е, че те имат значение само през интервалите от време, в които протичат тези процеси. В хода на такива процеси при някои тела движението под една или друга форма намалява и съответната енергия намалява, докато при други тела движението в същата или друга форма се увеличава и съответните видове енергия се увеличават.
Не говорим за запас от топлина или работа в което и да е тяло, а само за топлината и работата на известен процес. След приключването му не е необходимо да се говори за наличие на топлина или работа в телата.
§ 4. Еквивалентност на топлина и работа
Постоянно еквивалентно съотношение между топлина и работа по време на техните взаимни преходи е установено в класическите експерименти на D.P. Joule (1842-1867). Типичен експеримент на Джаул е както следва.
Джаулово устройство за определяне на механичния еквивалент на топлина.
Тежестите, падащи от известна височина, завъртат бъркалка, потопена във вода в калориметър (тежест и калориметър с вода представляват термодинамична система.) Въртенето на лопатките на бъркалката във вода причинява нагряване на водата в калориметъра; съответното повишаване на температурата се определя количествено.
След като посоченият процес приключи, системата трябва да бъде приведена в първоначалното си състояние. Това може да стане чрез умствен опит. Тежестите се издигат до първоначалната си височина, докато се изразходва външна работа, което увеличава енергията на системата. Освен това топлината се отстранява от калориметъра (прехвърля се в околната среда) чрез охлаждането му до първоначалната температура. Тези операции връщат системата в първоначалното й състояние, т.е. всички измерими свойства на системата придобиват същите стойности, които са имали в първоначалното състояние. Процесът, по време на който свойствата на системата се променят и в края на който тя се връща в първоначалното си състояние, се нарича кръгов (цикличен) процес или цикъл .
Единственият резултат от описания цикъл е отстраняването на работа от околната среда, заобикаляща системата, и пренасянето в тази среда на топлината, взета от калориметъра.
Сравнението на тези две величини, измерени в съответните единици, показва постоянна връзка между тях, независимо от размера на товара, размера на калориметъра и специфичните количества топлина и работа в различни експерименти.
Препоръчително е топлината и работата да се записват в цикличен процес като сума (интеграл) от безкрайно малки (елементарни) нагрявания Ви безкрайно малки (елементарни) работни места У, а началната и крайната граница на интегриране съвпадат (цикъл).
Тогава еквивалентността на топлината и работата в цикличен процес може да се запише по следния начин:
 (I, 1)
(I, 1)
В уравнение (I, 1) знакът  означава интегриране по цикъл. Постоянство на коефициента к
отразява еквивалентността на топлина и работа ( ке механичният еквивалент на топлина). Уравнение (I, 1) изразява закона за запазване на енергията за конкретен, много важен случай на преобразуване на работа в топлина.
означава интегриране по цикъл. Постоянство на коефициента к
отразява еквивалентността на топлина и работа ( ке механичният еквивалент на топлина). Уравнение (I, 1) изразява закона за запазване на енергията за конкретен, много важен случай на преобразуване на работа в топлина.
В изследванията на Джоул, Роуланд (1880), Микулеску (1892) и др. са използвани методите на триене в метали, удар, директно преобразуване на работата на електрически ток в топлина, разтягане на твърди тела и др. к винаги постоянно в рамките на експерименталната грешка.
В това, което следва, винаги се приема, че работят и топлина, с помощта на кое кизразено в едни и същи единици (без значение какви) и коефициентът кслиза.
§ 5. Вътрешна енергия
За некръгов процес равенството (I, 1) не се спазва, тъй като системата не се връща в първоначалното си състояние. Вместо това, равенствата за некръгов процес могат да бъдат записани (пропускайки коефициента к):
 ≠
≠

Тъй като границите на интегриране обикновено са произволни, тогава за елементарни величини У И В:
В У,
следователно:
В – У 0
Означете разликата В – Уза всеки елементарен термодинамичен процес чрез dU:
dU В – У (I, 2)
или за крайния процес:


 –
–
 (I, 2а)
(I, 2а)
Връщайки се към кръговия процес, получаваме (от уравнение I, 1):
 =
=
 –
–
 = 0 (I, 3)
= 0 (I, 3)
По този начин стойността dU е общият диференциал на някаква функция на състоянието на системата. Когато системата се върне в първоначалното си състояние (след циклична промяна), стойността на тази функция придобива първоначалната си стойност.
Функция за състоянието на систематаУ , дефиниран от равенствата (аз, 2) или (аз, 2а) се наричавътрешна енергия системи .
Очевидно изразът (I, 2a) може да се запише по следния начин:
= У 2 – У 1 = ∆ У = – (I, 2b)
У 2 – У 1 = ∆U = Q – W
Това разсъждение обосновава емпирично наличието на определена функция на състоянието на системата, която има значението на общата мярка на всички движения, които системата има.
С други думи, вътрешната енергия включва транслационната и ротационна енергия на молекулите, вибрационната енергия на атомите и групите атоми в молекула, енергията на движение на електрони, вътрешноядрена и други видове енергия, т.е. съвкупността от всички видове енергия на частиците в система, с изключение на потенциалната и кинетичната енергия на самата система.
Да приемем, че цикличният процес е осъществен по такъв начин, че след връщането на системата в първоначалното си състояние вътрешната енергия на системата не приема първоначалната стойност, а се увеличава. В този случай повторението на кръгови процеси би предизвикало натрупване на енергия в системата. Би било възможно тази енергия да се преобразува в работа и да се получи работа по този начин не за сметка на топлина, а „от нищо“, тъй като при кръгов процес работата и топлината са еквивалентни една на друга, което се доказва от директни експерименти .
Невъзможност за завършване на посочения цикъл на изграждане perpetuum mobile (perpetuum mobile) от първи вид,което дава работа, без да се изразходва еквивалентно количество друг вид енергия, се доказва от отрицателния резултат от хиляди години човешки опит. Този резултат води до същото заключение, което получихме в определена, но по-строга форма, анализирайки експериментите на Джоул.
Нека още веднъж формулираме получения резултат. Общата енергия на системата (нейната вътрешна енергия) в резултат на цикличен процес се връща към първоначалната си стойност, т.е. вътрешната енергия на системата в дадено състояние има една определена стойност и не зависи от това какви промени е претърпяла системата преди да дойде в това състояние.
С други думи, вътрешната енергия на системата е еднозначна, непрекъсната и крайна функция на състоянието на системата.
Изменението на вътрешната енергия на системата се определя от израз (I, 2b); изразът (I, 3) е валиден за кръгов процес. При безкрайно малка промяна в някои свойства (параметри) на системата, вътрешната енергия на системата също се променя безкрайно малко. Това е свойство на непрекъсната функция.
В рамките на термодинамиката не е необходимо да се използва обща дефиниция на понятието вътрешна енергия. Формално количествено определение чрез изрази (I, 2) или (I, 2a) е достатъчно за всички по-нататъшни термодинамични разсъждения и заключения.
Тъй като вътрешната енергия на системата е функция от нейното състояние, тогава, както вече беше споменато, увеличаването на вътрешната енергия с безкрайно малки промени в параметрите на състоянията на системата е общият диференциал на функцията на състоянието. Разбиване на интеграла в уравнение (I, 3) на два интеграла по участъците от пътя от състоянието 1 до държавата 2 (път "а") (виж фиг. I) и обратно - от държавата 2
курс за напреднали физически химия 6-ти изпит Преди овладяване на дисциплината „Напред физически химия„трябва да бъде... от физически химия. / Под редакцията на В.В. Буданова, Н.К. Воробьов. – Л.: Химия, 1986. - 352 с. Практическа работа по физически химия ...
Работна програма по дисциплина: "Органична и физична химия" за специалност 060601 Медицинска биохимия, дипломиран квалификационен код (65 специалист) форма на обучение (редовна)
Работна програмаНа амвона В библиотеката 1 Органични и физически химия(органичен химия, част I). В. А. Старцева, Л. Е. Никитина, Н. П. ... На амвона В библиотеката 1 Органични и физически химия(органичен химия, част I). В. А. Старцева, Л. Е. Никитина, Н. П. ...
Изпит No2 по физикохимия
документИзпит No2 по физически химияВариант 2 Каква е температурата.... Изпит No2 по физически химияВариант 3 Избройте физичните и химичните величини... Изпит No2 на физически химияОпция 12 Електроди за определяне. ...
Методическо ръководство за лабораторна работа № 4 по физикохимия за редовни студенти на Химикотехнологичния факултет и Факултета по строителни материали
ИнструментариумСТОЙНОСТИ НА РАВНОВЕСНАТА КОНСТАНТА физически химиячесто има лабораторна работа относно ... стр. 3. Петров Н.А., Черепанов В.А. Ермишина Ю.А. Работилница по физически химия. Инструментариум. Екатеринбург: издателство...
Програмата на приемния изпит по специалност 02. 00. 04 "Физична химия"
ПрограмаРавновесие // М.: Металургия.-1988.-560с. добре физически химия/ АЗ И. Герасимов, В.П. Древинг, Е.И. Ермин и др.: под ... .- 1980.- 180-те години. Горшков B.I., Кузнецов I.A. / Основи физически химия. 2-ро изд. // М.: Издателство на Московския университет...
Съдържанието на статията
ХИМИЯ ФИЗИЧЕСКА,клон на химията, който изучава химичните свойства на веществата въз основа на физичните свойства на съставните им атоми и молекули. Съвременната физическа химия е широка интердисциплинарна област, граничеща с различни клонове на физиката, биофизиката и молекулярната биология. Той има много допирни точки с такива клонове на химическата наука като органичната и неорганичната химия.
Отличителна черта на химическия подход (за разлика от физическия и биологичния) е, че наред с описанието на макроскопичните явления, тяхната природа се обяснява на базата на свойствата на отделните молекули и взаимодействията между тях.
Нови инструментални и методически разработки в областта на физичната химия се използват в други клонове на химията и сродни науки, като фармакология и медицина. Примерите включват електрохимични методи, инфрачервена (IR) и ултравиолетова (UV) спектроскопия, лазерни и магнитни резонансни техники, които се използват широко в терапията и за диагностика на различни заболявания.
Основните раздели на физичната химия традиционно се разглеждат: 1) химична термодинамика; 2) кинетична теория и статистическа термодинамика; 3) въпроси за структурата на молекулите и спектроскопията; 4) химическа кинетика.
Химическа термодинамика.
Химическата термодинамика е пряко свързана с приложението на термодинамиката - науката за топлината и нейните трансформации - към проблема за химическото равновесие. Същността на проблема е формулирана по следния начин: ако има смес от реагенти (система) и са известни физическите условия, в които се намира (температура, налягане, обем), тогава какви спонтанни химични и физични процеси могат да доведат до тази система до равновесие? Първият закон на термодинамиката гласи, че топлината е форма на енергия и че общата енергия на системата (заедно с околната среда) остава непроменена. По този начин този закон е една от формите на закона за запазване на енергията. Според втория закон спонтанно възникващ процес води до увеличаване на общата ентропия на системата и нейната среда. Ентропията е мярка за количеството енергия, което системата не може да използва, за да извърши полезна работа. Вторият закон указва посоката, в която ще върви реакцията без никакви външни влияния. За да промените естеството на реакцията (например нейната посока), трябва да изразходвате енергия под една или друга форма. По този начин той налага строги ограничения върху количеството работа, която може да бъде извършена в резултат на преобразуване на топлинна или химическа енергия, освободена в обратим процес.
Дължим важни постижения в химическата термодинамика на Дж. Гибс, който положи теоретичната основа на тази наука, което направи възможно обединяването на резултатите, получени от много изследователи от предишното поколение, в едно цяло. Подходът, разработен от Гибс, не прави никакви предположения за микроскопичната структура на материята, а разглежда равновесните свойства на системите на макро ниво. Ето защо може да се мисли, че първият и вторият закон на термодинамиката са универсални и ще останат валидни дори когато научим много повече за свойствата на молекулите и атомите.
Кинетична теория и статистическа термодинамика.
Статистическата термодинамика (както и квантовата механика) позволява да се предвиди положението на равновесие за някои реакции в газовата фаза. С помощта на квантовомеханичния подход е възможно да се опише поведението на сложни молекули на редица вещества, които са в течно и твърдо състояние. Има обаче реакции, чиито скорости не могат да бъдат изчислени нито в рамките на кинетичната теория, нито с помощта на статистическата термодинамика.
Истинска революция в класическата статистическа термодинамика се извършва през 70-те години на миналия век. Нови концепции като универсалност (схващането, че членовете на някои широки класове съединения имат едни и същи свойства) и принципа на сходството (оценка на неизвестни количества въз основа на известни критерии) доведоха до по-добро разбиране на поведението на течностите в близост до критичните точка, когато разликата между течност и газ. С помощта на компютър бяха симулирани свойствата на прости (течен аргон) и сложни (вода и алкохол) течности в критично състояние. Съвсем наскоро свойствата на течности като течен хелий (чието поведение е перфектно описано в рамките на квантовата механика) и свободните електрони в молекулярните течности бяха изчерпателно изследвани с помощта на компютърни симулации (СВЪРХОНВОДИМОСТ). Това позволи по-добро разбиране на свойствата на обикновените течности. Компютърните методи, съчетани с най-новите теоретични разработки, се използват интензивно за изследване на поведението на разтвори, полимери, мицели (специфични колоидни частици), протеини и йонни разтвори. За решаване на проблеми на физичната химия, по-специално за описване на някои свойства на системи в критично състояние и за изучаване на проблемите на физиката на високите енергии, все по-често се използва математическият метод на групата за пренормиране.
Структурата на молекулите и спектроскопията.
Органични химици от 19 век. разработи прости правила за определяне на валентността (способността за комбиниране) на много химични елементи. Например, те открили, че валентността на въглерода е 4 (един въглероден атом може да прикачи четири водородни атома, за да образува молекула на метан CH 4), кислород - 2, водород - 1. Въз основа на емпирични идеи, базирани на експериментални данни, бяха направени предположения относно пространственото подреждане на атомите в молекулите (например, молекулата на метана има тетраедрична структура, докато въглеродният атом е в центъра на триъгълна пирамида, а водородът е в четирите й върха). Този подход обаче не позволи да се разкрие механизмът на образуване на химични връзки и следователно да се оцени размерът на молекулите, да се определи точното разстояние между атомите.
С помощта на спектроскопски методи, разработени през 20-ти век, беше определена структурата на водните молекули (H 2 O), етана (C 2 H 6), а след това и на много по-сложни молекули, като протеини. Методите на микровълнова спектроскопия (EPR, NMR) и дифракция на електрони дават възможност да се установят дължините на връзките, ъглите между тях (валентни ъгли) и взаимното подреждане на атомите в прости молекули, и рентгенов дифракционен анализ - подобни параметри за по-големи молекули, които образуват молекулярни кристали. Съставянето на каталози на молекулярните структури и използването на прости концепции за валентност положиха основите на структурната химия (Л. Полинг беше неин пионер) и направи възможно използването на молекулярни модели за обяснение на сложни явления на молекулярно ниво. Ако молекулите нямат определена структура или ако параметрите на връзките C–C и C–H в хромозомите са много различни от тези в молекулите на метан или етан, тогава с помощта на прости геометрични модели, Дж. Уотсън и Ф. Крик не биха могли да създадат в началото на 50-те години на миналия век неговия известен модел с двойна спирала на дезоксирибонуклеинова киселина (ДНК). Чрез изучаване на вибрациите на атомите в молекулите с помощта на IR и UV спектроскопия беше възможно да се установи естеството на силите, които държат атомите в състава на молекулите, което от своя страна доведе до идеята за наличието на вътрешномолекулно движение и направи възможно изследването на термодинамичните свойства на молекулите ( виж по-горе). Това беше първата стъпка към определяне на скоростта на химичните реакции. Освен това, спектроскопските изследвания в UV областта помогнаха да се установи механизмът на образуване на химична връзка на електронно ниво, което направи възможно описването на химични реакции въз основа на идеята за прехода на реагентите във възбудено състояние (често под действието видима или UV светлина). Имаше дори цяла научна област – фотохимия. Ядрено-магнитен резонанс (ЯМР) спектроскопията дава възможност на химиците да изучават отделни етапи на сложни химични процеси и да идентифицират активни центрове в ензимните молекули. Този метод също така позволи да се получат триизмерни изображения на непокътнати клетки и отделни органи. ФОТОХИМИЯ.
Теория на валентността.
Използвайки емпиричните правила за валентност, разработени от органичните химици, периодичната система от елементи и планетарния модел на атома на Ръдърфорд, Г. Луис открива, че ключът към разбирането на химическата връзка е електронната структура на материята. Люис стига до извода, че ковалентна връзка се образува в резултат на социализацията на електрони, принадлежащи на различни атоми; при това той изхожда от идеята, че свързващите електрони са разположени върху строго определени електронни обвивки. Квантовата теория дава възможност да се предскаже структурата на молекулите и естеството на образуваните ковалентни връзки в най-общия случай.
Нашите представи за структурата на материята, които се формират благодарение на успехите на квантовата физика през първата четвърт на 20-ти век, могат да бъдат обобщени по следния начин. Структурата на атома се определя от баланса на електрическите сили на отблъскване (между електрони) и привличане (между електрони и положително заредено ядро). Почти цялата маса на атома е концентрирана в ядрото и неговият размер се определя от количеството пространство, заето от електроните, които се въртят около ядрата. Молекулите се състоят от относително стабилни ядра, държани заедно от бързо движещи се електрони, така че всички химични свойства на веществата могат да бъдат обяснени от гледна точка на електрическото взаимодействие на елементарните частици, които изграждат атоми и молекули. По този начин основните положения на квантовата механика, отнасящи се до структурата на молекулите и образуването на химични връзки, създават основата за емпирично описание на електронната структура на материята, естеството на химичната връзка и реактивността на атомите и молекулите.
С появата на високоскоростните компютри беше възможно да се изчислят (с ниска, но достатъчна точност) силите, действащи между атомите в малките многоатомни молекули. Теорията на валентността, базирана на компютърна симулация, в момента е работещ инструмент за изследване на структурите, природата на химичните сили и реакциите в случаите, когато експериментите са трудни или отнемат време. Това се отнася до изследването на свободните радикали, присъстващи в атмосферата и пламъците или образувани като междинни продукти на реакцията. Има надежда, че някой ден теория, базирана на компютърни изчисления, ще може да отговори на въпроса: как химическите структури „изчисляват“ своето най-стабилно състояние за време от порядъка на пикосекунди, като същевременно получават съответните оценки, поне в някакво приближение , изисква огромно количество машинно време.
Химическа кинетика
се занимава с изследване на механизма на химичните реакции и определяне на скоростта им. На макроскопско ниво реакцията може да бъде представена като последователни трансформации, по време на които от едно вещество се образуват други. Например, привидно проста трансформация
H 2 + (1/2) O 2 → H 2 O
всъщност се състои от няколко последователни етапа:
H + O 2 → OH + O
O + H 2 → HO + H
H + O 2 → HO 2
HO 2 + H 2 → H 2 O + OH
и всеки от тях се характеризира със собствена скоростна константа к. S. Arrhenius предполага, че абсолютната температура ти константа на скоростта на реакцията ксвързани чрез съотношението к = Аопит (- Едействай)/ RT, където НО– предекспоненциален фактор (т.нар. честотен фактор), Еакт - активираща енергия, Ре газовата константа. За измерване кИ тнеобходими са инструменти за проследяване на събития, които се случват за време от около 10–13 s, от една страна, и в продължение на десетилетия (и дори хилядолетия), от друга (геоложки процеси); също така е необходимо да може да се измерват незначителни концентрации на изключително нестабилни реагенти. Задачата на химическата кинетика включва и прогнозиране на химични процеси, протичащи в сложни системи (говорим за биологични, геоложки, атмосферни процеси, горене и химичен синтез).
За изследване на газофазните реакции "в чист вид" се използва методът на молекулярните лъчи; в този случай молекули със строго определени квантови състояния реагират с образуването на продукти, които също са в определени квантови състояния. Такива експерименти дават информация за силите, които предизвикват възникването на определени реакции. Например, при настройка на молекулярния лъч, дори такива малки молекули като CH 3 I могат да бъдат ориентирани по даден начин и скоростта на сблъсък в две „различни“ реакции могат да бъдат измерени:
K + ICH 3 → KI + CH 3
K + CH 3 I → KI + CH 3
където CH3 групата е ориентирана различно по отношение на приближаващия се калиев атом.
Един от въпросите, с които се занимава физическата химия (както и химическата физика), е изчисляването на константите на скоростта на реакцията. Тук широко се използва теорията на преходното състояние, разработена през 30-те години на миналия век, която използва термодинамични и структурни параметри. Тази теория, съчетана с методите на класическата физика и квантовата механика, дава възможност да се симулира хода на реакцията, сякаш се случва в условията на експеримент с молекулярни лъчи. Провеждат се експерименти по лазерно възбуждане на определени химични връзки, които позволяват да се провери правилността на статистическите теории за разрушаването на молекулите. Разработват се теории, които обобщават съвременните физични и математически концепции за хаотичните процеси (например турбулентност). Не сме толкова далече от пълното разбиране на природата както на вътрешно-, така и на междумолекулните взаимодействия, разкриване на механизма на реакциите, протичащи върху повърхности с желани свойства, и установяване на структурата на каталитичните центрове на ензими и комплекси от преходни метали. На микроскопично ниво могат да се отбележат работи по кинетиката на образуване на такива сложни структури като снежинки или дендрити (кристали с дървовидна структура), които стимулират развитието на компютърни симулации, базирани на прости модели на теорията на нелинейната динамика; това открива перспективи за създаване на нови подходи за описание на структурата и развитието на сложни системи.
Началото на физическата химия е поставено в средата на 18 век. Терминът "физическа химия", в съвременното разбиране на методологията на науката и въпросите на теорията на познанието, принадлежи на М. В. Ломоносов, който за първи път прочете "Курса по истинска физическа химия" на студенти от Санкт Петербургския университет . В преамбюла на тези лекции той дава следното определение: „Физическата химия е наука, която трябва, въз основа на разпоредбите и експериментите на учените-физици, да обясни причината за това, което се случва чрез химически операции в сложни тела.“ Ученият в трудовете на своята корпускулярно-кинетична теория на топлината се занимава с въпроси, които напълно отговарят на горните задачи и методи. Именно такъв е характерът на експерименталните действия, които служат за потвърждаване на отделни хипотези и положения на тази концепция. М. В. Ломоносов следва тези принципи в много области на своите изследвания: при разработването и практическото прилагане на основаната от него „наука за стъклото“, в различни експерименти, посветени на потвърждаване на закона за запазване на материята и силата (движението); - в произведения и експерименти, свързани с учението за решенията - той разработи обширна програма за изследване на този физичен и химичен феномен, който е в процес на развитие и до днес.
Това е последвано от прекъсване от повече от сто години и едно от първите физикохимични изследвания в Русия в края на 1850-те е започнато от Д. И. Менделеев.
Следващият курс по физическа химия е преподаван от Н. Н. Бекетов в Харковския университет през 1865 г.
Първата катедра по физическа химия в Русия е открита през 1914 г. във Физико-математическия факултет на Санкт Петербургския университет, през есента студентът на Д. П. Коновалов, М. С. Вревски, започва да чете задължителния курс и практическите часове по физическа химия .
Първото научно списание, предназначено да публикува статии по физическа химия, е основано през 1887 г. от У. Оствалд и Дж. ван'т Хоф.
Предмет на физическа химия
Физическата химия е основната теоретична основа на съвременната химия, използваща теоретичните методи на такива важни раздели на физиката като квантова механика, статистическа физика и термодинамика, нелинейна динамика, теория на полето и др. Тя включва учението за структурата на материята, включително: структурата на молекулите, химическата термодинамика, химическата кинетика и катализа. Като отделни раздели по физична химия се обособяват също електрохимия, фотохимия, физикохимия на повърхностните явления (включително адсорбция), радиационна химия, теория на металната корозия, физикохимия на макромолекулните съединения (виж физика на полимерите) и др. Много близко съседни са и др. към физическата химия и понякога се разглеждат като негови независими раздели от колоидна химия, физико-химичен анализ и квантова химия. Повечето раздели на физическата химия имат доста ясни граници по отношение на обекти и методи на изследване, по отношение на методологичните особености и използвания апарат.
Разликата между физическа химия и химическа физика
Молекулността на елементарната реакция е броят на частиците, които според експериментално установения реакционен механизъм участват в елементарен акт на химично взаимодействие. Мономолекулни реакции- реакции, при които настъпва химическа трансформация на една молекула (изомеризация, дисоциация и др.): H 2 S → H 2 + S Бимолекулярни реакции- реакции, чието елементарно действие се осъществява при сблъсък на две частици (еднакви или различни): CH 3 Br + KOH → CH 3 OH + KBr Тримолекулни реакции- реакции, чийто елементарен акт се осъществява при сблъсък на три частици: O 2 + NO + NO → 2NO 2 Реакциите с молекулност по-голяма от три са неизвестни. За елементарни реакции, проведени при близки концентрации на изходните вещества, стойностите на молекулярността и реда на реакцията са еднакви. Няма ясно дефинирана връзка между понятията молекулярност и реда на реакцията, тъй като редът на реакцията характеризира кинетичното уравнение на реакцията, а молекулярността характеризира механизма на реакцията. Основните области на химическата термодинамика са:
Химическата термодинамика е тясно свързана с такива клонове на химията като
Физико-химичен анализТеорията на физикохимичния анализ се основава на принципите на съответствието и приемствеността, формулирани от Н. С. Курнаков. Принципът на непрекъснатостта гласи, че ако в системата не се образуват нови фази или съществуващите не изчезнат, то при непрекъсната промяна в параметрите на системата, свойствата на отделните фази и свойствата на системата като цяло се променят непрекъснато . Принципът на съответствието гласи, че всеки комплекс от фази съответства на определено геометрично изображение на диаграмата състав-свойство. Теория на реактивността на химичните съединенияВисокоенергийната химия (HVE) изучава химичните реакции и трансформации, които протичат в материята под въздействието на нетоплинна енергия. Механизмите и кинетиката на такива реакции и трансформации се характеризират с по същество неравновесни концентрации на бързи, възбудени или йонизирани частици с енергия, по-голяма от енергията на тяхното топлинно движение и в някои случаи на химическо свързване. Носители на нетоплинна енергия, действащи върху материята: ускорени електрони и йони, бързи и бавни неутрони, алфа и бета частици, позитрони, мюони, пиони, атоми и молекули със свръхзвукови скорости, кванти на електромагнитно излъчване, както и импулсни електрически, магнитни и акустични полета. Процесите на високоенергийната химия се разграничават по времеви етапи във физически, протичащи във време от фемтосекунди или по-малко, през което нетоплинната енергия се разпределя неравномерно в средата и се образува „гореща точка“, физико-химична, по време на които се проявяват неравновесието и нехомогенността в „горещата точка” и накрая химични, при които трансформациите на материята се подчиняват на законите на общата химия. В резултат на това при стайна температура се образуват такива йони и възбудени състояния на атоми и молекули, които не могат да възникнат поради равновесни процеси. Външната проява на CHE е образуването на йони и възбудени състояния на атоми и молекули при стайна температура, при които тези частици не могат да възникнат поради равновесни процеси. Н. Е. Аблесимов формулира релаксационен принцип за управление на свойствата на неравновесните физични и химични системи. В случай, че времената на релаксация са много по-дълги от продължителността на физическото въздействие, е възможно да се контролира освобождаването на химични форми, фази и, като следствие, свойствата на веществата (материалите), като се използва информация за механизмите на релаксация в неравновесни кондензирани системи на физикохимичния етап на релаксационните процеси (включително на брой и по време на работа). Основните раздели на HVE
и други. лазерна химияЙонизиращата способност се притежава от електромагнитно лъчение (рентгенови лъчи, γ-лъчение, синхротронно лъчение) и потоци от ускорени частици (електрони, протони, неутрони, хелиони, тежки йони; фрагменти на делене на тежки ядра и др.), енергията на което надвишава йонизационния потенциал на атоми или молекули (в повечето случаи лежи в диапазона от 10-15 eV). В рамките на радиационната химия се разглеждат някои химични процеси, които са невъзможни при използване на традиционни химически подходи. Йонизиращото лъчение може значително да намали температурата на химичните реакции без използването на катализатори и инициатори. История на радиационната химия Радиационната химия възниква след откриването на рентгеновите лъчи от В. Рентген през 1895 г. и радиоактивността от А. Бекерел през 1896 г., които първи наблюдават радиационните ефекти във фотографските плочи. Първите работи по радиационна химия са извършени през 1899-1903 г. от съпрузите M.Curie и P.Curie. През следващите години най-голям брой изследвания са посветени на радиолизата на вода и водни разтвори. ядрена химияОсновни направления на ядрената химия:
електрохимияЕлектрохимията е клон на химическата наука, който разглежда системите и междуфазните граници, когато през тях протича електрически ток, изучават се процеси в проводници, върху електроди (от метали или полупроводници, включително графит) и в йонни проводници (електролити). Електрохимията изследва процеси |