Ligand ikame reaksiyonları. Konu: Çözeltilerde ve metallerin ve oksitlerin yüzeyinde koordinasyon ve organometalik bileşikleri içeren temel aşamalar
Asitler, bazlar, nükleofilik katalizörler, metal kompleksleri, katı metaller ve bunların bileşiklerinin gaz fazında veya sıvı fazda heterojen ve homojen işlemlerde katalize ettiği organik reaksiyonların temel aşamaları, çeşitli organik ve organometalik ara maddelerin oluşumu ve dönüşümü reaksiyonlarıdır. metal komplekslerinin yanı sıra. Organik ara bileşikler arasında karbenyum iyonları R+, karbonyum RH2+, karbo-anyonlar R-, anyon- ve radikal katyonlar, radikaller ve biradikaller R·, R: ve ayrıca organik donör ve alıcı moleküllerin (DA) moleküler kompleksleri bulunur. bunlara yük transferli kompleksler de denir. Organik reaksiyonların metal kompleksleri (metal kompleksi katalizi) ile homojen ve heterojen katalizinde, ara ürünler, çoğu durumda koordinasyon bileşikleri olan, organik ve inorganik ligandlara sahip karmaşık (koordinasyon) bileşikler, M-C bağına sahip organometalik bileşiklerdir. Katı metal katalizörlerin yüzeyindeki "iki boyutlu" kimya durumunda da benzer bir durum ortaya çıkar. Metal komplekslerinin ve organometalik bileşiklerin ana reaksiyon türlerini ele alalım.
Metal komplekslerini içeren temel aşamalarMetal komplekslerinin reaksiyonları üç gruba ayrılabilir:
a) elektron transfer reaksiyonları;
b) ligand ikame reaksiyonları;
c) koordineli ligandların reaksiyonları.
Elektron transfer reaksiyonları
Elektron transfer reaksiyonlarında iki mekanizma uygulanır: dış küre mekanizması (verici ve alıcının koordinasyon alanlarında değişiklik olmadan) ve metalin koordinasyon alanında değişikliklere yol açan köprüleme (iç küre) mekanizması.
Geçiş metallerinin oktahedral kompleksleri örneğini kullanarak dış küre mekanizmasını ele alalım. Simetrik reaksiyonlar durumunda ( G 0 = 0)
hız sabitleri, iyonun elektronik konfigürasyonuna ve işlem sırasında yeniden yapılanma derecesine bağlı olarak 10-12 ila 10 5 l mol-1 sn-1 arasında çok geniş bir değer aralığında değişir. Bu reaksiyonlarda, en az hareket ilkesi çok açık bir şekilde ortaya çıkıyor - reaksiyon katılımcılarının değerlik kabuğundaki en az değişiklik.
Elektron transfer reaksiyonunda (1) (Co *, Co atomunun bir izotopudur)
(simetrik reaksiyon), Co 2+ (d 7), Co 3+ (d 6)'ya dönüşür. Bu aktarım sırasında elektronik konfigürasyon (değerlik kabuğu) değişmez
Üçlü dejenere bağlanma seviyesindeki 6 elektron değişmeden kalır () ve antibağ seviyesinden e G birinci seviyedeki elektron uzaklaştırılır.
Reaksiyon için ikinci dereceden hız sabiti (1) k 1 = 1,1 lmol-1 sn-1. Phen (fenantrolin) güçlü bir ligand olduğundan maksimum sayı 7'dir. D-elektronlar eşleştirilmiştir (spin-eşleştirilmiş durum). Zayıf bir ligand NH3 durumunda durum kökten değişir. Co(NH3)n2+ (n = 4, 5, 6) spin-eşlenmemiş (yüksek spin) durumdadır.
Daha güçlü olan Co(NH3) 6 3+ kompleksi (Co(NH3) 6 2+ ~ 10 30 kattan daha güçlü), Phen'li kompleks gibi spin-eşleştirilmiş durumdadır. Bu bağlamda, elektron transferi sürecinde değerlik kabuğunun güçlü bir şekilde yeniden yapılandırılması ve bunun sonucunda k= 10-9 lmol-1 sn-1. Co 2+'nın Co 3+'ya %50'ye eşit dönüşüm oranı, Phen ligandı durumunda 1 saniyede, NH3 ~ durumunda ise 30 yılda elde edilir. Böyle bir orana sahip bir aşamanın (resmi olarak temel), reaksiyon mekanizmalarını analiz ederken temel aşamalar kümesinin dışında tutulabileceği açıktır.
Büyüklük G Marcus teorisine göre bir çarpışma kompleksinin oluşumu sırasındaki elektron transfer reaksiyonu için iki bileşen içerir ve
İlk terim, kompleks içindeki M-L bağlarının yeniden düzenlenmesinin enerjisidir (değerlik durumu değiştiğinde bağın uzunluğu ve gücü). Değer, M-L koordinatlarını ve kompleksin yükünü değiştirme sürecinde dış solvasyon kabuğunun yeniden düzenlenmesi enerjisini içerir. Elektronik ortamdaki değişim ne kadar küçük ve M-L uzunluğundaki değişim ne kadar küçük olursa, ligandlar ne kadar büyük olursa o kadar küçük olur ve bunun sonucunda elektron aktarım hızı da o kadar yüksek olur. Genel durumun değeri Marcus denklemi kullanılarak hesaplanabilir.
Nerede. = 0'da.
Küre içi mekanizma durumunda, birinci kompleksin ligandlarından biri ikinci kompleks ile bir köprü kompleksi oluşturarak ligandlardan birini ondan uzaklaştırdığı için elektron transferi işlemi kolaylaştırılır.
Böyle bir prosesin hız sabitleri, Cr(NH3)6 3+'nın indirgenmesine ilişkin sabitlerden 8 kat daha yüksektir. Bu tür reaksiyonlarda indirgeyici maddenin kararsız bir kompleks olması ve oksitleyici madde içindeki ligandın köprüler (Cl-, Br-, I-, N3-, NCS-, bipy) oluşturabilmesi gerekir.
Ligand ikame reaksiyonlarıMetal kompleksi katalizindeki en önemli aşamalardan biri olan Y substratının kompleksle etkileşimi üç mekanizma aracılığıyla gerçekleşir:
a) Ligandın bir solvent ile değiştirilmesi. Bu aşama genellikle kompleksin ayrışması olarak tasvir edilir.
Çoğu durumda prosesin özü, ligand L'nin solvent S ile değiştirilmesidir, bu daha sonra kolayca bir substrat molekülü Y ile değiştirilir.
b) Yeni bir ligandın serbest bir koordinatta eklenmesi ve bir ortak oluşumu ve ardından değiştirilen ligandın ayrışması
c) Ara madde oluşumu olmadan eşzamanlı ikame (tip SN 2)
Pt(II) kompleksleri durumunda reaksiyon hızı çoğunlukla iki yollu denklemle tanımlanır.
Nerede k S Ve k e- (5) (bir solvent ile) ve (6) ligand Y ile reaksiyonlarda meydana gelen proseslerin hız sabitleri. Örneğin,
İkinci yolun son aşaması, üç hızlı temel aşamanın toplamıdır - Cl-'nin ortadan kaldırılması, Y'nin eklenmesi ve H2O molekülünün ortadan kaldırılması.
Geçiş metallerinin düz kare komplekslerinde, II Chernyaev tarafından formüle edilen bir trans etkisi gözlenir - LT'nin, LT ligandına trans pozisyonunda olan bir ligandın ikame oranı üzerindeki etkisi. Pt(II) kompleksleri için trans etkisi ligand serisinde artar:
H2O~NH3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
Kinetik trans-etkinin ve termodinamik trans-etkinin varlığı, Pt(NH3)2Cl2'nin atıl izomerik komplekslerinin sentezlenme olasılığını açıklamaktadır:
Koordineli ligandların reaksiyonları§ Hidrojenin elektrofilik ikamesinin (SE) metalin koordinasyon alanındaki bir metal ile reaksiyonları ve bunların ters işlemleri
SH - H20, ROH, RNH2, RSH, ArH, RCCH.
H2 ve CH4 molekülleri bile bu tip reaksiyonlara katılır
§ M-X bağlantısı yoluyla L'nin tanıtılmasının reaksiyonları
X = R (organometalik kompleks) durumunda, M-R bağına metal koordineli moleküller de dahil edilir (L - CO, RNC, C2H2, C2H4, N2, C02, O2, vb.) .). Ekleme reaksiyonu, nükleofil X'in - veya - tipiyle koordine edilen bir moleküle molekül içi saldırısının sonucudur. Ters reaksiyonlar - ve - eliminasyon reaksiyonları
§ Oksidatif ekleme ve indirgeyici eliminasyon reaksiyonları
M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4-
Görünüşe göre bu reaksiyonlarda her zaman eklenen molekülün bir ön koordinasyonu vardır, ancak bu her zaman tespit edilemez. Bu bağlamda, koordinasyon alanında serbest bir bölgenin veya bir substratla kolayca değiştirilebilen bir solventle ilişkili bir bölgenin varlığı, metal komplekslerinin reaktivitesini etkileyen önemli bir faktördür. Örneğin, Ni'nin bis-alil kompleksleri, katalitik olarak aktif türlerin iyi öncüleridir, çünkü bis-alilin kolay indirgeyici eliminasyonu nedeniyle, çözücü ile sözde bir kompleks ortaya çıkar. “çıplak” nikel. Boş koltukların rolü aşağıdaki örnekte gösterilmektedir:
§ Metal komplekslerine nükleofilik ve elektrofilik katılma reaksiyonları
Organometalik bileşiklerin reaksiyonlarıKatalitik reaksiyonların ara maddeleri olarak, hem M-C, M=C ve MC bağlarına sahip klasik organometalik bileşikler hem de organik ligandın 2, 3, 4, 5 ve 6 tipine göre koordine edildiği veya elektron eksikliği olan element yapıları - CH3 ve C6H6 gruplarını köprüleme, klasik olmayan karbürler (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+, vb.).
Klasik organometalik bileşiklerin bilimsel mekanizmaları arasında çeşitli mekanizmalara dikkat çekiyoruz. Böylece, M-C bağındaki metal atomunun elektrofilik ikamesinin 5 mekanizması kurulmuştur.
Nükleofilik yardımla elektrofilik ikame
AdE Ekleme-Eleme
AdE(C) Sp 2 hibridizasyonunda C atomuna ekleme
AdE(M) Metale oksidatif katkı
Organometalik bileşiklerin demetalasyon reaksiyonlarında karbon atomundaki nükleofilik ikame, bir oksidasyon-indirgeme işlemi olarak gerçekleşir:
Bu aşamada oksitleyici bir maddenin olası katılımı
Böyle bir oksitleyici madde CuCl2, p-benzokinon, N03 - ve diğer bileşikler olabilir. İşte RMX'in karakteristik iki temel aşaması daha:
M-C bağının hidrojenolizi
ve M-C bağının homolizi
Kompleks ve organometalik bileşiklerin tüm reaksiyonları için geçerli olan ve en az hareket ilkesiyle ilişkilendirilen önemli bir kural, Tolman'ın 16-18 elektron kabuğu kuralıdır (Bölüm 2).
Koordinasyon ve organometalik bileşiklerbir yüzeydeModern kavramlara göre metallerin yüzeyinde çözeltilerdeki bileşiklere benzer kompleksler ve organometalik bileşikler oluşur. Yüzey kimyası için, bu tür bileşiklerin oluşumunda çeşitli yüzey atomlarının katılımı ve elbette yüklü parçacıkların yokluğu esastır.
Yüzey grupları herhangi bir atom (H, O, N, C), atom grupları (OH, OR, NH, NH2, CH, CH2, CH3, R), koordineli moleküller CO, N2, CO2, C2H4, C6H6. Örneğin, CO'nun metal bir yüzeye adsorpsiyonu sırasında aşağıdaki yapılar bulunmuştur:
Metal yüzeyindeki C2H4 molekülü, tek merkezli ve ikili bağlı etilen köprüleri olan M-CH2CH2-M komplekslerini oluşturur; esas olarak metal döngüleri
Örneğin Rh yüzeyinde, etilenin adsorpsiyonu sırasında, sıcaklık arttıkça aşağıdaki etilen dönüşüm süreçleri meydana gelir:
Yüzey ara maddelerinin reaksiyonları, oksidatif ekleme, indirgeyici eliminasyon, ekleme, - ve - eliminasyon, M-C ve C-C bağlarının hidrojenolizini ve organometalik tipteki diğer reaksiyonları içerir, ancak serbest iyonların ortaya çıkması yoktur. Tablolar hidrokarbonların metaller üzerindeki yüzey dönüşümlerinin mekanizmalarını ve ara ürünlerini göstermektedir.
Tablo 3.1. Bir C-C bağının bölünmesini içeren katalitik reaksiyonlar.
Tanımlar:
Alkil, metalasikl;
Karben, alil;
Karabin, vinil.
Tablo 3.2. Bir C-C bağının oluşumunu içeren katalitik reaksiyonlar.
Tanımlar: tabloya bakınız. 3.1.
Yukarıdaki organometalik bileşiklerin tamamının metallerin yüzeyinde oluşumu fiziksel yöntemlerle doğrulanmıştır.
Kendini kontrol etmeye yönelik sorular
1) Elektron transfer reaksiyonları sırasında bir metalin değerlik kabuğundaki en küçük değişiklik kuralı nasıl ortaya çıkar?
2) Koordinasyon boşlukları neden alt katmanla etkili etkileşime katkıda bulunuyor?
3) Koordineli ligandların ana reaksiyon türlerini listeler.
4) Organometalik bileşiklerin NX ile reaksiyonlarında elektrofilik yer değiştirme mekanizmalarını verir.
5) Yüzey organometalik bileşiklere örnekler verin.
6) Metal karben yüzey komplekslerinin hidrokarbonların dönüşümüne katılımına örnekler verin.
Derinlemesine çalışma için literatür
1. Temkin O.N., Metal komplekslerinin çözeltilerinde katalitik reaksiyonların kinetiği, M., MITHT, 1980, Bölüm III.
2. Collman J., Higedas L., Norton J., Finke R., Tüketici metallerinin organometalik kimyası, M., Mir, 1989, cilt I, cilt II.
3. Moiseev I.I., -Olefinlerin oksidasyonunda kompleksler, M., Nauka, 1970.
4. Temkin O.N., Shestakov G.K., Treger Yu.A., Asetilen: Kimya. Reaksiyon mekanizmaları. Teknoloji. M., Kimya, 1991, 416 s., bölüm 1.
5. Henrici-Olivet G., Olive S., Koordinasyon ve kataliz, M., Mir, 1980, 421 s.
6. Krylov O.V., Matyshak V.A., Heterojen katalizde ara bileşikler, M., Nauka, 1996.
7. Zaera F., Geçiş Metal Yüzeylerindeki Hidrokarbon Kısımlarının Kimyasına Yönelik Organometalik Bir Kılavuz., Chem. Rev., 1995, 95, 2651 - 2693.
8. Bent B.E., Heterojen Katalizin Yönlerini Taklit Etmek: Vakumda Tek Kristaller Üzerinde Önerilen Yüzey Ara Maddelerinin Üretilmesi, Yalıtılması ve Reaksiyona Girmesi, Chem. Rev., 1996, 96, 1361 - 1390.
Geleneksel olarak komplekslerin kimyasal reaksiyonları değişim, redoks, izomerizasyon ve koordineli ligandlara ayrılır.
Komplekslerin iç ve dış küreye birincil ayrışması, dış küre iyonlarının değişim reaksiyonlarının oluşumunu belirler:
Xm + mNaY = Ym + mNaX.
Komplekslerin iç küresinin bileşenleri, hem ligandları hem de kompleks oluşturucu maddeyi içeren metabolik işlemlere de katılabilir. Ligandların veya merkezi metal iyonunun ikame reaksiyonlarını karakterize etmek için, nükleofilik olan organik bileşiklerin (Şekil 42) reaksiyonları için K. Ingold tarafından önerilen tanımlamaları ve terminolojiyi kullanın. SN ve elektrofilik SE ikameleri:
Z + Y = z +X S N
Z + M"= z + M S E .
İkame reaksiyonunun mekanizmasına göre, bunlar ayrılır (Şekil 43) ilişkisel ( S N 1 ve S E 1 ) ve dissosiyatif ( S N 2 ve S E 2 ), geçiş durumunda artan ve azalan koordinasyon sayısıyla farklılık gösterir.
Bir reaksiyon mekanizmasını birleştirici veya ayrıştırıcı olarak sınıflandırmak, azaltılmış veya arttırılmış koordinasyon sayısına sahip bir ara maddenin tanımlanması gibi deneysel olarak gerçekleştirilmesi zor bir görevdir. Bu bağlamda, reaksiyon mekanizması sıklıkla reaktif konsantrasyonunun reaksiyon hızı üzerindeki etkisi, reaksiyon ürününün geometrik yapısındaki değişiklikler vb. hakkındaki dolaylı verilere dayanarak değerlendirilir.
Komplekslerdeki ligand ikame reaksiyonlarının hızını karakterize etmek için, 1983 Nobel ödüllü G. Taube (Şekil 44), ligand ikame reaksiyonunun süresine bağlı olarak, 1 dakikadan az veya daha fazla "kararsız" ve "inert" terimlerinin kullanılmasını önerdi. . Kararsız veya inert terimleri, ligand ikame reaksiyonlarının kinetiğinin özellikleridir ve komplekslerin stabilitesi veya kararsızlığının termodinamik özellikleriyle karıştırılmamalıdır.
Komplekslerin değişkenliği veya inertliği, kompleks oluşturan iyonun ve ligandların doğasına bağlıdır. Ligand alan teorisine uygun olarak:
1. Oktahedral kompleksler 3 D değerlik dağılımına sahip geçiş metalleri ( n-1)d sigma başına elektron*(Örneğin ) gevşeme MO'ları kararsızdır.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN - .
Ayrıca, kompleksin kristal alanı tarafından stabilizasyon enerjisi ne kadar düşük olursa, kararsızlığı da o kadar büyük olur.
2. Oktahedral kompleksler 3 D serbest sigmalı geçiş metalleri* e g'yi gevşetmek Orbitaller ve düzgün bir değerlik dağılımı ( n -1) t 2 g yörüngelerindeki (t 2 g 3, t 2 g 6) d elektronları eylemsizdir.
[Co III (CN) 6] 3- (t 2 g 6 e g 0) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. Plano-kare ve oktahedral 4 d ve 5 d sigma başına elektronu olmayan geçiş metalleri* Gevşeten MO'lar etkisizdir.
2+ + H20 =
2+ + H20 =
Ligandların doğasının ligand ikame reaksiyonlarının hızı üzerindeki etkisi “ligandların karşılıklı etkisi” modeli çerçevesinde değerlendirilmektedir. Ligandların karşılıklı etki modelinin özel bir durumu, 1926'da I.I. tarafından formüle edilen modeldir. Chernyaev'in trans etkisi kavramı (Şekil 45) - "Kompleks içindeki ligandın kararsızlığı, yer değiştiren ligandın doğasına bağlıdır" - ve ligandların bir takım trans-etkilerini önermektedir: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, Cl - > py , NH3 , OH- , H20 .
Trans etkisi kavramı temel kuralları doğrulamamıza olanak sağladı:
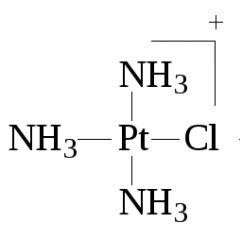
1. Peyrone'nin kuralı- amonyak veya aminlerin tetrakloroplatinat üzerindeki etkisinden dolayı ( II ) potasyum her zaman diklorodiaminplatin cis-konfigürasyonunda elde edilir:
2- + 2NH3 = cis- + 2Cl-.
Reaksiyon iki aşamada ilerlediğinden ve klorür ligandı büyük bir trans etkisine sahip olduğundan, ikinci klorür ligandının amonyakla değiştirilmesi cis-[ oluşumuyla gerçekleşir. Pt (NH3)2Cl2]:
2- + NH3 = -
NH3 = cis -.
2. Jergensen kuralı - hidroklorik asidin platin tetramin klorür üzerindeki etkisi üzerine ( II ) veya benzer bileşikler diklorodi-aminplatinyum trans konfigürasyonunda elde edilir:
[ Pt (NH3) 4 ] 2+ + 2 HC1 = trans-[ Pt (NH3) 2 Cl2] + 2 NH4Cl.
Ligandların bir dizi trans etkisine uygun olarak, ikinci amonyak molekülünün bir klorür ligandıyla değiştirilmesi, trans-[ oluşumuna yol açar. Pt (NH3)2Cl2].
3. Kurnakov'un tiyoüre reaksiyonu - tiyoürenin geometrik trans-[ izomerleri ile reaksiyonunun çeşitli ürünleri Pt (NH3)2Cl2] ve cis-[Pt(NH3)2Cl2]:
cis - + 4Tiyo = 2+ + 2Cl- + 2NH3.
Reaksiyon ürünlerinin farklı doğası, tiyoürenin yüksek trans etkisiyle ilişkilidir. Reaksiyonların ilk aşaması, tiyoüre klorür ligandlarının trans- ve cis-[ oluşumuyla değiştirilmesidir. Pt (NH3) 2 (Tiyo) 2] 2+:
trans-[Pt (NH3) 2 Cl2 ] + 2 Tiyo = trans-[ Pt (NH3) 2 (Tiyo) 2 ] 2+
cis - + 2Tiyo = cis - 2+.
Cis-[Pt (NH3)2'de (Thio ) 2 ] 2+ tiyoüreye trans pozisyonundaki iki amonyak molekülü daha fazla ikameye uğrar, bu da formasyona yol açar 2+ :
cis - 2+ + 2Tiyo = 2+ + 2NH3.
Trans-[Pt (NH3)2'de (Thio ) 2 ] 2+ az trans etkisine sahip iki amonyak molekülü birbirine göre trans konumunda bulunur ve bu nedenle tiyoüre ile değiştirilmez.
Trans etkisinin kalıpları I.I. Chernyaev, kare düzlemsel platin komplekslerinde ligand ikame reaksiyonlarını incelerken ( II ). Daha sonra ligandların trans-etkisinin diğer metallerin komplekslerinde de kendini gösterdiği gösterilmiştir. Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) ve diğer geometrik yapı. Doğru, farklı metaller için ligandların trans-etki serisi biraz farklıdır.
Trans etkisinin olduğu unutulmamalıdır. kinetik etki- Belirli bir ligandın trans etkisi ne kadar büyük olursa, kendisine göre trans pozisyonunda olan başka bir ligandla o kadar hızlı değiştirilir.
Trans etkisinin kinetik etkisiyle birlikte ortada XX yüzyıl A.A. Grinberg ve Yu.N. Kukushkin ligandın trans etkisine bağımlılığını belirledi L cis pozisyonunda bulunan liganddan L . Böylece, ikame reaksiyonu hızının incelenmesi Cl- platin komplekslerindeki amonyak ( II):
[PtCl 4 ] 2- + NH3 = [ PtNH3 Cl 3 ] - + Cl - K = 0,42. 10 4 l/mol. İle
[ PtNH3 Cl 3 ] - + NH 3 = cis-[ Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1,14. 10 4 l/mol. İle
trans-[ Pt (NH3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2,90. 10 4 l/mol. İle
değiştirilen klorür ligandının cis pozisyonunda bir veya iki amonyak molekülünün varlığının reaksiyon hızında tutarlı bir artışa yol açtığını gösterdi. Bu kinetik etkiye denir cis etkisi. Şu anda, ligandların doğasının ligand ikame reaksiyonlarının hızı (trans- ve cis-etkisi) üzerindeki etkisinin her iki kinetik etkisi de genel bir konseptte birleştirilmiştir. ligandların karşılıklı etkisi.
Ligandların karşılıklı etkisinin teorik olarak doğrulanması, karmaşık bileşiklerdeki kimyasal bağlarla ilgili fikirlerin geliştirilmesiyle yakından ilgilidir. 30'lu yıllarda XX yüzyıl A.A. Greenberg ve B.V. Nekrasov, trans etkisini kutuplaşma modeli çerçevesinde değerlendirdi:
1. Trans etkisi, merkezi metal iyonu oldukça polarize olabilen kompleksler için tipiktir.
2. Ligandların trans aktivitesi, ligandın ve metal iyonunun karşılıklı polarizasyon enerjisi ile belirlenir. Belirli bir metal iyonu için ligandın trans etkisi, polarize edilebilirliği ve merkezi iyondan uzaklığı ile belirlenir.
Polarizasyon modeli, halojenür iyonları gibi basit anyonik ligandlara sahip kompleksler için deneysel verilerle tutarlıdır.
1943'te A.A. Greenberg, ligandların trans aktivitesinin onların indirgeyici özellikleriyle ilişkili olduğunu öne sürdü. Elektron yoğunluğunun yer değiştirmiş liganddan metale kayması, metal iyonunun etkin yükünü azaltır, bu da yer değiştirmiş ligand ile kimyasal bağın zayıflamasına yol açar.
Trans etkisi hakkındaki fikirlerin gelişimi, etilen gibi doymamış organik moleküllere dayanan ligandların yüksek trans aktivitesi ile ilişkilidir. Pt(C2H4)Cl3 ] - . Chatt ve Orgel'e göre (Şekil 46), bunun nedenipi-bu tür ligandların metal ile datif etkileşimi ve translokasyonlu ligandlar için ikame reaksiyonlarının birleştirici mekanizması. Saldıran ligandın metal iyonuna koordinasyon Z beş koordinatlı bir trigonal bipiramidal ara maddenin oluşumuna ve ardından ayrılan ligand X'in hızla ortadan kaldırılmasına yol açar. Böyle bir ara maddenin oluşumu şu şekilde kolaylaştırılır:pi-datif ligand-metal ligand etkileşimi e metalin elektron yoğunluğunu azaltır ve daha sonra ligand X'in hızlı bir şekilde değiştirilmesiyle geçiş durumunun aktivasyon enerjisini azaltır.
İle birlikte P alıcı (C2H4, CN-, CO ...) bir datif ligand-metal kimyasal bağı oluşturan ligandlar yüksek bir trans-etkiye sahiptir veSdonör ligandları: H - , CH3 - , C2 H 5 - ... Bu tür ligandların trans etkisi, ligand X'in metal ile donör-alıcı etkileşimi ile belirlenir, bu da elektron yoğunluğunu düşürür ve metalin ayrılan ligandla bağını zayıflatır. Y.
Böylece, trans-aktivite serisindeki ligandların konumu, sigma'nın birleşik etkisi ile belirlenir. bağışçı ve pi-ligandların özellikleri - sigma- bağışçı ve pi-ligandın alıcı özellikleri onun trans-etkisini artırırken,pi-bağışçı olanlar zayıflıyor. Ligand-metal etkileşiminin bu bileşenlerinden hangisinin trans etkisinde baskın olduğu, reaksiyonun geçiş durumunun elektronik yapısının kuantum kimyasal hesaplamalarına dayanarak değerlendirilir.
Metal kompleksi katalizindeki en önemli aşamalardan biri olan Y substratının kompleksle etkileşimi üç mekanizmayla gerçekleşir:
a) Ligandın bir solvent ile değiştirilmesi. Bu aşama genellikle kompleksin ayrışması olarak tasvir edilir.
Çoğu durumda prosesin özü, ligandın bir solvent S ile değiştirilmesidir ve bu daha sonra kolayca bir substrat molekülü Y ile değiştirilir.
b) Yeni bir ligandın serbest bir koordinatta eklenmesi ve bir ortak oluşumu ve ardından değiştirilen ligandın ayrışması
c) Ara madde oluşumu olmadan eşzamanlı ikame (tip SN 2)
Pt(II) kompleksleri durumunda reaksiyon hızı çoğunlukla iki yollu denklemle tanımlanır.
Nerede k S Ve k e(5) (bir solvent ile) ve (6) ligand Y ile reaksiyonlarda meydana gelen proseslerin hız sabitleridir. Örneğin,


İkinci yolun son aşaması, üç hızlı temel aşamanın (Cl'nin ortadan kaldırılması), Y'nin eklenmesi ve H2O molekülünün ortadan kaldırılmasının toplamıdır.
Geçiş metallerinin düz kare komplekslerinde, II Chernyaev tarafından formüle edilen bir trans etkisi gözlenir - LT'nin, trans pozisyonunda bulunan bir ligandın LT ligandına ikame oranı üzerindeki etkisi. Pt(II) kompleksleri için trans etkisi ligand serisinde artar:
H2O~NH3 Kinetik trans-etkinin ve termodinamik trans-etkinin varlığı, Pt(NH3)2Cl2'nin atıl izomerik komplekslerinin sentezlenme olasılığını açıklamaktadır: Hidrojenin elektrofilik ikamesinin (SE) metalin koordinasyon alanındaki bir metal ile reaksiyonları ve bunların ters işlemleri SH – H 2 O, ROH, RNH 2, RSH, ArH, RCCH. H2 ve CH4 molekülleri bile bu tip reaksiyonlara katılır M-X bağlantısı boyunca L'nin eklenmesinin reaksiyonları X=R (organometalik kompleks) durumunda, M-R bağına metal koordineli moleküller de eklenir (L–CO, RNC, C2H2, C2H4, N2, CO2, O2, vb.) .). Ekleme reaksiyonu, bir nükleofilin - veya tipi koordineli bir moleküle molekül içi saldırısının sonucudur. Ters reaksiyonlar – - ve -eliminasyon reaksiyonları Oksidatif katılma ve indirgeyici eliminasyon reaksiyonları M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4– Görünüşe göre bu reaksiyonlarda her zaman eklenen molekülün bir ön koordinasyonu vardır, ancak bu her zaman tespit edilemez. Bu nedenle, koordinasyon küresinde serbest bir bölgenin veya bir substratla kolayca değiştirilebilen bir solventle ilişkili bir bölgenin varlığı, metal komplekslerinin reaktivitesini etkileyen önemli bir faktördür. Örneğin, Ni'nin bis--alil kompleksleri, katalitik olarak aktif türlerin iyi öncüleridir, çünkü bis-alilin kolay indirgeyici eliminasyonundan dolayı, çözücü ile sözde bir kompleks ortaya çıkar. “çıplak” nikel. Boş koltukların rolü aşağıdaki örnekte gösterilmektedir: Metallerin - ve -komplekslerine nükleofilik ve elektrofilik katılma reaksiyonları Katalitik reaksiyonların ara maddeleri olarak hem M-C, M=C ve MC bağlarına sahip klasik organometalik bileşikler hem de organik ligandın 2 , 3 , 4 , 5'e göre koordine edildiği klasik olmayan bileşikler vardır. ve 6 -tipi veya elektron eksikliği olan yapıların bir elemanıdır - CH3 ve C6H6 gruplarını köprüler, klasik olmayan karbürler (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+ vb.). Klasik -organometalik bileşiklerin spesifik mekanizmaları arasında çeşitli mekanizmalara dikkat çekiyoruz. Böylece, M-C bağındaki metal atomunun elektrofilik ikamesinin 5 mekanizması kurulmuştur. Nükleofilik yardımla elektrofilik ikame Ekleme-eleme AdE(C) Sp 2 hibridizasyonunda C atomuna ekleme AdE(M) Metale oksidatif katkı Organometalik bileşiklerin demetalasyon reaksiyonlarında karbon atomundaki nükleofilik ikame, bir redoks işlemi olarak gerçekleşir: Bu aşamada oksitleyici bir maddenin olası katılımı Böyle bir oksitleyici madde CuCl2, p-benzokinon, NO3 – ve diğer bileşikler olabilir. İşte RMX'in karakteristik iki temel aşaması daha: M-C bağının hidrojenolizi ve M-C bağının homolizi Kompleks ve organometalik bileşiklerin tüm reaksiyonları için geçerli olan ve en az hareket ilkesiyle ilişkilendirilen önemli bir kural, Tolman'ın 16-18 elektron kabuğu kuralıdır (Bölüm 2). Sulu çözeltilerdeki ana ikame reaksiyonu olan su moleküllerinin değişimi (22), çok sayıda metal iyonu için incelenmiştir (Şekil 34). Bir metal iyonunun koordinasyon alanında su moleküllerinin çözücü olarak mevcut olan su moleküllerinin büyük kısmı ile değişimi çoğu metal için çok hızlı gerçekleşir ve bu nedenle böyle bir reaksiyonun hızı esas olarak gevşeme yöntemiyle incelenebilir. Yöntem, örneğin sıcaklıktaki keskin bir artışla sistemin dengesini bozmayı içerir. Yeni koşullar altında (daha yüksek sıcaklık) sistem artık dengede olmayacaktır. Daha sonra denge oranı ölçülür. Çözeltinin sıcaklığını değiştirebiliyorsanız 10 -8 saniye, böylece tamamlanması belirli bir süreden daha uzun bir süre gerektiren bir reaksiyonun hızını ölçebilirsiniz. 10 -8 saniye. Çeşitli metal iyonlarındaki koordineli su moleküllerinin SO 2-4, S 2 O 3 2-, EDTA vb. ligandlarla yer değiştirme oranını ölçmek de mümkündür (26). Bu reaksiyonun hızı hidratlanmış metal iyonunun konsantrasyonuna bağlıdır ve gelen ligandın konsantrasyonuna bağlı değildir; bu, bu sistemlerin hızını tanımlamak için birinci dereceden denklemin (27) kullanılmasını mümkün kılar. Çoğu durumda, belirli bir metal iyonu için reaksiyon hızı (27), H 2 O molekülleri veya SO 4 2-, S 2 O 3 2- veya S 2 O 3 2- gibi gelen ligandın (L) doğasına bağlı değildir. EDTA iyonları. Bu gözlem, bu proses için hız denkleminin etkili ligandın konsantrasyonunu içermediği gerçeğiyle birleştiğinde, bu reaksiyonların, yavaş adımın metal iyonu ile su arasındaki bağın kırılmasını içeren bir mekanizma ile ilerlediğini ileri sürmektedir. Ortaya çıkan bileşik muhtemelen yakındaki ligandları hızlı bir şekilde koordine eder. Böcek. Bu bölümün 4'ünde, Al 3+ ve Sc 3+ gibi daha yüksek yüklü hidratlı metal iyonlarının, su moleküllerini M 2+ ve M + iyonlarından daha yavaş değiştirdiği belirtildi; Bu durum, bağların kopmasının tüm sürecin hızını belirleyen aşamada önemli bir rol oynadığını varsaymamıza neden oluyor. Bu çalışmalardan elde edilen sonuçlar kesin değildir ancak hidratlı metal iyonlarının ikame reaksiyonlarında SN 1 işlemlerinin önemli olduğuna inanmak için neden verirler. Muhtemelen en çok çalışılan kompleks bileşikler kobalt(III) aminlerdir. Kararlılıkları, hazırlanma kolaylıkları ve yavaş reaksiyonları onları özellikle kinetik çalışmalar için uygun kılar. Bu komplekslerin çalışmaları yalnızca sulu çözeltilerde gerçekleştirildiğinden, öncelikle bu komplekslerin çözücü moleküller (su) ile reaksiyonlarını düşünmeliyiz. Genel olarak, Co(III) iyonu tarafından koordine edilen amonyak veya amin moleküllerinin, su molekülleri ile çok yavaş bir şekilde değiştirildiği ve genellikle aminler dışındaki ligandların değiştirilmesinin düşünüldüğü bulunmuştur. (28) tipindeki reaksiyonların hızı incelendi ve kobalt kompleksine göre birinci dereceden olduğu bulundu (X, birçok olası anyondan biridir). Sulu çözeltilerde H2O konsantrasyonu her zaman yaklaşık olarak olduğundan 55,5 milyon o zaman su moleküllerinin konsantrasyonunun değiştirilmesinin reaksiyon hızı üzerindeki etkisini belirlemek imkansızdır. Sulu bir çözelti için hız denklemleri (29) ve (30), k'nın basitçe k" = k"ye eşit olması nedeniyle deneysel olarak ayırt edilemez. Bu nedenle reaksiyon hız denkleminden H2O'nun prosesin hız belirleme aşamasına katılıp katılmayacağını söylemek mümkün değildir. Bu reaksiyonun, X iyonunun bir H2O molekülü ile değiştirilmesini içeren SN2 mekanizmasıyla mı, yoksa önce ayrışmayı ve ardından bir H2O molekülünün eklenmesini içeren SN1 mekanizmasıyla mı ilerlediği sorusunun cevabı, mutlaka cevaplanmalıdır. diğer deneysel veriler kullanılarak elde edilebilir. Bu problem iki tür deneyle çözülebilir. Hidroliz oranı (su molekülü başına bir Cl iyonunun değiştirilmesi) trans- +, hidroliz 2+ oranından yaklaşık 10 3 kat daha yüksektir. Kompleksin yükündeki bir artış, metal-ligand bağlarının güçlendirilmesine ve sonuç olarak bu bağların bölünmesinin engellenmesine yol açar. Gelen ligandların çekiciliği ve ikame reaksiyonunun kolaylaştırılması da dikkate alınmalıdır. Kompleksin yükü arttıkça hızda bir azalma bulunduğundan, bu durumda dissosiyatif bir süreç (S N 1) daha olası görünmektedir. Başka bir kanıt yöntemi, benzer bir dizi kompleksin hidrolizinin incelenmesine dayanmaktadır. trans- + . Bu komplekslerde etilendiamin molekülü, karbon atomundaki hidrojen atomlarının CH3 grupları ile değiştirildiği benzer diaminlerle değiştirilir. İkame edilmiş diaminler içeren kompleksler, etilendiamin kompleksinden daha hızlı reaksiyona girer. Hidrojen atomlarının CH3 grupları ile değiştirilmesi ligandın hacmini arttırır, bu da metal atomunun başka bir ligand tarafından saldırıya uğramasını zorlaştırır. Bu sterik engeller, SN2 mekanizması yoluyla reaksiyonu yavaşlatır.Metal atomunun yakınında hacimli ligandların varlığı, ligandlardan birinin çıkarılması metal atomunda birikimlerini azalttığı için ayrışma sürecini destekler. Hacimli ligandlara sahip komplekslerin hidroliz oranında gözlenen artış, reaksiyonun SN1 mekanizmasına göre ilerlediğinin iyi bir kanıtıdır. Dolayısıyla, Co(II) asidoamin kompleksleri üzerine yapılan çok sayıda çalışmanın sonucunda, asido gruplarının su molekülleri ile değiştirilmesinin doğada dissosiyatif bir süreç olduğu ortaya çıktı. Kobalt atom-ligand bağı, su molekülleri komplekse girmeye başlamadan önce belirli bir kritik değere kadar uzatılır. Yükü 2+ ve üzeri olan komplekslerde kobalt-ligand bağının kırılması çok zorlaşır ve su moleküllerinin girişi daha önemli rol oynamaya başlar. Kobalt(III) kompleksindeki asido grubunun (X-) H2O molekülü dışındaki bir grupla (31) yer değiştirmesinin öncelikle bir molekülle yer değiştirmesinden geçtiği bulunmuştur. solvent - su, ardından yeni bir Y grubu (32) ile değiştirilir. Bu nedenle kobalt(III) kompleksleriyle yapılan birçok reaksiyonda reaksiyon hızı (31), hidroliz hızına (28) eşittir. Yalnızca hidroksil iyonu Co(III) aminlerle reaktivitesinde diğer reaktiflerden farklılık gösterir. Reaksiyon tipine göre kobalt(III)'ün amin kompleksleri ile çok hızlı reaksiyona girer (sudan yaklaşık 10 6 kat daha hızlı). temel hidroliz (33). Bu reaksiyonun, ikame edici ligand OH-(34)'e göre birinci dereceden olduğu bulundu. Reaksiyonun genel ikinci sırası ve reaksiyonun alışılmadık derecede hızlı ilerlemesi, OH - iyonunun Co(III) kompleksleri için olağanüstü derecede etkili bir nükleofilik reaktif olduğunu ve reaksiyonun, bir ara ürünün oluşumu yoluyla SN2 mekanizması yoluyla ilerlediğini göstermektedir. Ancak OH-'nin bu özelliği başka bir mekanizmayla da açıklanabilir [denklemler (35), (36)]. Reaksiyon (35)'te 2+ kompleksi bir asit gibi davranır (Brønsted'e göre) ve + kompleksini verir: amido-(içeren)-bileşik - asit 2+'ye karşılık gelen baz. Reaksiyon daha sonra SN1 mekanizması (36) aracılığıyla ilerleyerek beş koordinatlı bir ara ürün oluşturur ve bu ara ürün ayrıca solvent molekülleri ile reaksiyona girerek nihai reaksiyon ürününü (37) üretir. Bu reaksiyon mekanizması, ikinci dereceden bir reaksiyonun hızıyla tutarlıdır ve SN1 mekanizmasına karşılık gelir Hız belirleme aşamasındaki reaksiyon, orijinal komplekse (asit) bir baz konjugatı içerdiğinden, bu mekanizmaya SN adı verilir. 1CB. Bu mekanizmalardan hangisinin deneysel gözlemleri en iyi açıkladığını belirlemek çok zordur. Ancak SN 1CB hipotezini destekleyen ikna edici kanıtlar var. Bu mekanizmayı destekleyen en iyi argümanlar şunlardır: oktahedral Co(III) kompleksleri genellikle SN1 ayrışma mekanizması aracılığıyla reaksiyona girer ve OH-iyonunun neden SN2 sürecine aracılık etmesi gerektiğine dair ikna edici bir argüman yoktur. hidroksil iyonu, Pt(II) ile reaksiyonlarda zayıf bir nükleofilik reaktiftir ve bu nedenle Co(III) ile olağandışı reaktivitesi mantıksız görünmektedir. Sulu olmayan ortamda kobalt(III) bileşikleriyle reaksiyonlar, SN1SV mekanizması tarafından sağlanan beş koordinatlı ara ürünlerin oluşumu için mükemmel kanıtlar sağlar. Son kanıt, Co(III) kompleksinde N - H bağlarının yokluğunda OH - iyonlarıyla yavaş reaksiyona girmesidir. Bu, elbette, kompleksin asit-baz özelliklerinin, reaksiyon hızı açısından OH'nin nükleofilik özelliklerinden daha önemli olduğunu göstermektedir." Amin Co(III) komplekslerinin bazik hidrolizinin bu reaksiyonu, kinetik verilerin Çoğu zaman birden fazla şekilde yorumlanabilir ve olası mekanizmalardan birini veya diğerini dışlamak için oldukça hassas bir deney yapmak gerekir. Şu anda çok sayıda oktahedral bileşiğin ikame reaksiyonları incelenmiştir. Reaksiyon mekanizmalarını dikkate alırsak en yaygın olanı dissosiyatif süreçtir. Bu sonuç beklenmedik bir durum değil çünkü altı ligand, merkez atomun etrafında diğer grupların ona bağlanabilmesi için çok az yer bırakıyor. Yedi koordinatlı bir ara maddenin varlığının gösterildiği veya araya giren bir ligandın etkisinin tespit edildiği yalnızca birkaç örnek vardır. Bu nedenle SN2 mekanizması, oktahedral komplekslerdeki ikame reaksiyonları için olası bir yol olarak tamamen reddedilemez. Koordinasyon bileşiklerinin reaksiyonları her zaman bir metalin kendisine bağlı ligandlarla koordinasyon alanında meydana gelir. Dolayısıyla herhangi bir şeyin gerçekleşebilmesi için ligandların bu alana düşebilmesi gerektiği açıktır. Bu iki şekilde gerçekleşebilir: Koordinasyon doymamışlığını ve 18 elektron kuralını tartıştığımızda ilk yönteme zaten aşina olmuştuk. Burada ikincisini ele alacağız. Ancak genellikle söylenmemiş bir kural vardır - işgal edilen koordinasyon yerlerinin sayısı değişmez. Başka bir deyişle, elektron sayısı ikame sırasında değişmez. Bir tür ligandın diğeriyle değiştirilmesi oldukça mümkündür ve sıklıkla gerçekte meydana gelir. L-ligandını X-ligandına veya tam tersini değiştirirken yalnızca yüklerin doğru şekilde işlenmesine dikkat edelim. Bunu unutursak, metalin oksidasyon durumu değişecektir ve ligandların değiştirilmesi bir oksidasyon-indirgeme işlemi değildir (aksine bir örnek bulursanız veya bulursanız, bana bildirin - otomatik olarak doğru olarak değerlendirilecektir) yanıldığınızı kanıtlayamazsam, bu durumda bile karmaya olumlu bir katkı sağlayacağımı garanti ederim). Daha karmaşık ligandlarda artık zorluk yoktur - sadece oldukça açık bir kuralı hatırlamanız gerekir: ligand bölgelerinin sayısı (yani ligandların veya X veya L tipi ligand merkezlerinin toplam sayısı) korunur. Bu doğrudan elektron sayımının korunumundan kaynaklanır. İşte apaçık örnekler. Son örneğe dikkat edelim. Bu reaksiyonun başlangıç reaktifi demir diklorür FeCl2'dir. Yakın zamana kadar şöyle derdik: “Bu sadece tuz, koordinasyon kimyasının bununla ne alakası var?” Ama artık kendimize böyle bir cehalete izin vermeyeceğiz. Geçiş metallerinin kimyasında "sadece tuzlar" yoktur; her türlü türev, elektron sayımı, d-konfigürasyonu, koordinasyon doygunluğu vb. ile ilgili tüm hususların geçerli olduğu koordinasyon bileşikleridir. Demir diklorürün, yazmaya alışık olduğumuz biçimiyle, konfigürasyonu d 6 ve elektron sayısı 10 olan MX 2 tipinde bir Fe(2+) kompleksi olduğu ortaya çıkacaktır. Yeterli değil! İyi? Sonuçta ligandların örtülü olabileceğini zaten anladık. Reaksiyonu gerçekleştirmek için bir çözücüye ihtiyacımız var ve bu tür reaksiyonlar için bu büyük olasılıkla THF'dir. Kristalli demir tuzunun THF'de çözünmesi, tam olarak donör çözücünün boş alanları işgal etmesi nedeniyle meydana gelir ve bu işlemin enerjisi, kristal kafesin tahribatını telafi eder. Lewis bazlı olması nedeniyle bu "tuzu" metal çözme hizmetlerini sağlamayan bir solventte çözemeyiz. Bu durumda ve milyonlarca benzer durumda, çözüm sadece bir koordinasyon etkileşimidir. Kesinlik sağlamak için, iki klor iyonunun koordinasyon alanında iki X-ligandı şeklinde kaldığı, ancak büyük olasılıkla bunların da yer değiştirdiği FeX 2 L 4 kompleksi formundaki çözünmenin sonucunu yazalım. donör çözücünün molekülleri yüklü bir kompleksin oluşumu FeL 6 2+. Bu durumda o kadar önemli değil. Her iki durumda da, hem solda hem de sağda 18 elektronlu bir kompleksin olduğunu rahatlıkla varsayabiliriz. Organik kimyayı hatırlarsak, doymuş bir karbon atomunda SN1 ve SN2 olmak üzere iki ikame mekanizması vardı. İlkinde, ikame iki aşamada meydana geldi: önce eski ikame edici karbon atomu üzerinde boş bir yörünge bırakarak ayrıldı ve bu daha sonra bir çift elektrona sahip yeni bir ikame edici tarafından işgal edildi. İkinci mekanizma, gidiş ve gelişin aynı anda, uyum içinde gerçekleştirildiğini ve sürecin tek aşamalı olduğunu varsayıyordu. Koordinasyon bileşiklerinin kimyasında da benzer bir şeyi hayal etmek oldukça mümkündür. Ancak doymuş karbon atomunun sahip olmadığı üçüncü bir olasılık ortaya çıkıyor; önce yeni bir ligand ekliyoruz, sonra eskisini ayırıyoruz. Kompleksin zaten 18 elektronu varsa ve koordinasyon doymuşsa, bu üçüncü seçeneğin pek mümkün olmadığı hemen anlaşılıyor. Ancak elektron sayısının 16 veya daha az olması, yani kompleksin doymamış olması oldukça mümkündür. Organik kimyadaki bariz benzetmeyi hemen hatırlayalım: Doymamış bir karbon atomundaki (bir aromatik halkada veya bir karbonil karbonda) nükleofilik ikame, önce yeni bir nükleofilin eklenmesi ve ardından eskisinin ortadan kaldırılmasıyla da meydana gelir. Yani, eğer 18 elektronumuz varsa, o zaman ikame bir soyutlama-toplama olarak gerçekleşir ("akıllı" kelimelerin hayranları, dissosiyatif-ilişkisel veya basitçe dissosiyatif mekanizma terimini kullanır). Başka bir yol, koordinasyon küresinin 20 elektron sayısına kadar genişletilmesini gerektirecektir. Bu kesinlikle imkansız değildir ve hatta bazen bu tür seçenekler dikkate alınır, ancak kesinlikle çok kârsızdır ve böyle bir yoldan şüphelenilmesi durumunda her zaman çok önemli deliller gerekir. Bu hikayelerin çoğunda araştırmacılar sonunda bir şeyi gözden kaçırdıkları veya gözden kaçırdıkları sonucuna vardılar ve çağrışım mekanizması reddedildi. Dolayısıyla, orijinal kompleksin 18 elektronu varsa, önce bir ligandın ayrılması gerekir, ardından yenisinin yerini alması gerekir, örneğin: Eğer çeşitli bölgeleri işgal eden bir hapto-ligandı koordinasyon alanına dahil etmek istiyorsak, öncelikle bunların hepsini boşaltmamız gerekir. Kural olarak, bu yalnızca oldukça ağır koşullar altında meydana gelir; örneğin, krom karbonildeki üç karbonili η6-benzen ile değiştirmek için, karışım zaman zaman salınan karbon monoksiti serbest bırakarak basınç altında saatlerce ısıtılır. Diyagram, 12 elektronlu çok doymamış bir kompleksin oluşumuyla üç ligandın ayrışmasını gösterse de, gerçekte reaksiyon büyük olasılıkla aşamalar halinde meydana gelir, her seferinde bir karbonil kalır ve benzen küreye girerek dokunsallığı giderek arttırır. aşamalar eksi CO - digapto - eksi bir CO - tetrahapto - eksi bir CO - heksagapto daha, böylece 16'dan az elektron elde edilmez. Dolayısıyla, 16 veya daha az elektronlu bir kompleksimiz varsa, o zaman ligandın değiştirilmesi büyük olasılıkla bir ekleme-çıkarma olarak gerçekleşir (derin sesli kelimeleri sevenler için: birleştirici-ayrışmalı veya basitçe birleştirici): önce yeni ligand gelir , sonra eskisi ayrılır. İki bariz soru ortaya çıkıyor: 18 elektron çok iyi olduğu için eski ligand neden ayrılıyor ve bu durumda neden 18 elektronlu komplekslerde olduğu gibi tam tersi olmasın? İlk soruyu cevaplamak kolaydır: Her metalin kendine has alışkanlıkları vardır ve bazı metaller, özellikle de d-kabukları neredeyse tamamen dolu olan geç metaller, 16 elektron sayısını ve buna karşılık gelen yapısal türleri tercih eder ve bu nedenle fazladan ligandı atar. , favori konfigürasyonlarına geri dönüyorlar. Bazen mekânsal faktör de meseleye müdahale ediyor; mevcut ligandlar büyük ve ilave olan ligandlar trafiğin yoğun olduğu saatlerde bir otobüs yolcusu gibi hissettiriyor. Böyle acı çekmektense inip yürüyüşe çıkmak daha kolaydır. Ancak başka bir yolcuyu dışarı itebilirsiniz, yürüyüşe çıkmasına izin verin, biz de gidelim. İkinci soru da basittir; bu durumda ayrışma mekanizmasının öncelikle 14 elektronlu bir kompleks vermesi gerekir ve bu nadiren faydalıdır. İşte bir örnek. Çeşitlilik sağlamak için X ligandını bir L ligandıyla değiştirelim ve böylece oksidasyon durumları ve yükleri konusunda kafamız karışmasın. Bir kez daha tekrarlayalım: ikame sonrasında oksidasyon durumu değişmez ve eğer X-ligandı ayrılırsa, o zaman kaybın metal üzerindeki yük ile telafi edilmesi gerekir. Bunu unutursak oksidasyon sayısı 1 azalır ama bu yanlıştır. Ve bir tuhaf şey daha. Azot üzerindeki yalnız çift nedeniyle bir metal-piridin bağı oluştu. Organik kimyada, bu durumda piridin nitrojeninde kesinlikle bir artı gösteririz (örneğin, protonasyon veya kuaterner bir tuzun oluşması üzerine), ancak bunu piridin veya başka herhangi bir L-ligandıyla koordinasyon kimyasında asla yapmayız. Bu, organik kimyadaki katı ve net yapı çizim sistemine alışkın olan herkes için son derece can sıkıcı bir durumdur, ancak buna alışmanız gerekecek, o kadar da zor değil. Ancak koordinasyon bileşiklerinin kimyasında SN2'nin tam bir analoğu yoktur, uzak bir tane vardır, ancak nispeten nadirdir ve buna gerçekten ihtiyacımız yoktur. Çokça kullanacağımız son derece önemli bir durum olmasaydı, ligand ikamesinin mekanizmalarından hiç söz edemezdik: ligand ikamesi, ister birleştirici ister ayrıştırıcı olsun, eski ligandın ayrışmasını zorunlu olarak gerektirir. Metalin koordinasyon alanında kalmayı tercih ederek hangi ligandların kolayca ayrıldığını ve hangilerinin zayıf ayrıldığını bilmek bizim için çok önemlidir. Birazdan göreceğimiz gibi herhangi bir reaksiyonda ligandların bir kısmı koordinasyon alanında kalır ve değişmez. Bu tür ligandlara genellikle izleyici ligandları denir (eğer bu kadar basit, "bilimsel olmayan" kelimeler istemiyorsanız, yerel transkripsiyondaki izleyici, ligand-izleyicide İngilizce izleyici kelimesini kullanın, ancak size yalvarıyorum izleyici değil - bu dayanılmaz! ). Bazıları ise doğrudan reaksiyona katılarak reaksiyon ürünlerine dönüşür. Bu tür ligandlara aktörler (aktörler değil!), yani aktif olanlar denir. Ligand aktörlerinin metalin koordinasyon alanına kolayca dahil edilmesi ve uzaklaştırılması gerektiği oldukça açıktır, aksi takdirde reaksiyon basitçe takılıp kalacaktır. Ancak birçok nedenden dolayı seyirci ligandlarını koordinasyon alanında bırakmak daha iyidir, ancak en azından metalin etrafında gereksiz yaygaradan kaçınma ihtiyacı gibi sıradan bir nedenden ötürü. İstenilen sürece sadece ligand aktörlerinin ve gerekli miktarda katılması daha iyidir. Gerekenden daha fazla koordinasyon bölgesi varsa, ekstra ligand aktörleri buralara oturabilir ve hatta yan reaksiyonlara katılacak olanlar da hedef ürünün verimini ve seçiciliğini azaltabilir. Ek olarak, izleyici ligandlar hemen hemen her zaman birçok önemli işlevi yerine getirir; örneğin, komplekslerin çözünürlüğünü sağlarlar, metalin doğru değerlik durumunu stabilize ederler, özellikle de oldukça sıradan değilse, bireysel aşamalara yardımcı olurlar, stereoseçicilik sağlarlar, vb. Henüz deşifre etmeyeceğiz çünkü spesifik tepkilere geldiğimizde tüm bunları detaylı olarak tartışacağız. Koordinasyon alanındaki bazı ligandların sıkı bir şekilde bağlanması ve ayrışmaya ve diğer ligandlarla yer değiştirmeye eğilimli olmaması gerektiği ortaya çıktı. Bu tür ligandlara genellikle denir koordinasyon açısından kararlı
. Veya, bağlamdan açıkça anlaşılıyorsa, ligandların bağlarının gücünden bahsettiğimiz ve kendi termodinamik stabilitelerinden değil, ki bu bizi hiç ilgilendirmiyor. Kolayca ve isteyerek girip çıkan ve her zaman başkalarına yol vermeye hazır olan ligandlara denir. koordinasyon değişkeni
veya basitçe kararsız ve burada, neyse ki hiçbir belirsizlik yok. Bu muhtemelen koordinasyon alanında çok kararsız bir molekülün mükemmel bir ligand haline gelebileceği ve tanımı gereği koordinasyon kararlı olabileceği gerçeğinin en çarpıcı örneğidir; çünkü eğer sıcak ve rahat küreyi dışarıda bırakmaya cesaret ederse, hiçbir iyi şey işe yaramaz. onu bekleyin (çıktının maliyeti tam olarak anti-aromatik istikrarsızlaştırmanın enerjisi olacaktır). Siklobutadien ve türevleri anti-aromatikliğin en iyi bilinen örnekleridir. Bu moleküller yalnızca düşük sıcaklıklarda ve oldukça çarpık bir biçimde bulunurlar - antiaromatiklikten mümkün olduğu kadar uzaklaşmak için döngü uzatılmış bir dikdörtgene dönüştürülür, delokalizasyonu ortadan kaldırır ve çift bağların konjugasyonunu maksimum düzeyde zayıflatır (buna başka şekilde denir) 2. türden Jahn-Teller etkisi: dejenere sistem ve siklobütadien karesi dejenere biradiktir, Frost çemberini hatırlayın - bozulur ve dejenerasyonu ortadan kaldırmak için simetriyi azaltır). Ancak komplekslerde siklobutadien ve sübstitüe edilmiş siklobutadienler mükemmel tetrahapto ligandlarıdır ve bu tür ligandların geometrisi, aynı bağ uzunluklarına sahip tam olarak bir karedir. Bunun nasıl ve neden gerçekleştiği ayrı bir hikaye ve çoğu zaman söylendiği kadar açık değil. Kararsız ve kararlı ligandların olduğu alanlar arasında dikenli telli betonarme çit ve güvenlik kulelerinin olmadığını anlamalısınız. Öncelikle metale bağlıdır ve LMKO bu bağlamda iyi çalışır. Örneğin geç geçiş metalleri yumuşak ligandları tercih ederken, erken geçiş metalleri sert ligandları tercih eder. Diyelim ki iyodür, paladyum veya platinin d8 atomlarına çok sıkı tutunur, ancak d0 konfigürasyonunda titanyum veya zirkonyumun koordinasyon alanına nadiren girer. Ancak daha az belirgin özelliklere sahip birçok metal kompleksinde iyodür, tamamen kararsız bir ligand olarak kendini gösterir ve başkalarına kolayca yol açar. Diğer şeyler eşit olmak üzere: Hepsini bir kez daha tekrarlayalım, sadece diğer tarafta Metallerin koordinasyon alanında aşağıdakiler genellikle korunur (koordinasyon açısından kararlıdır): Son durum garip görünüyor, ancak birçok farklı liganda sahip olan ve aralarında kesinlikle kararlı olanların bulunmadığı (şelatlayıcılar veya polihapto-ligandlar olmayan) bir kompleks hayal edin. Daha sonra reaksiyonlarda ligandlar, göreceli olarak değişkenlik sırasına göre değişecektir. En az kararsız olan ve en son kalan. Bu hile örneğin paladyum fosfin kompleksleri kullandığımızda ortaya çıkar. Fosfinler nispeten kararlı ligandlardır, ancak çok sayıda olduğunda ve metal elektron bakımından zengin olduğunda (d8, d10), aktör ligandlara birbiri ardına yer verirler. Ancak son fosfin ligandı genellikle koordinasyon alanında kalır ve bu, bu komplekslerin katıldığı reaksiyonlar açısından çok iyidir. Bu önemli konuya daha sonra tekrar döneceğiz. Heck reaksiyonunda paladyum fosfin kompleksinin ilk koordinasyon alanından yalnızca bir "son" fosfinin kaldığı oldukça tipik bir örnek. Bu örnek bizi geçiş metali komplekslerinin reaksiyonlarındaki en önemli kavrama, ligand kontrolü kavramına çok yaklaştırıyor. Bunu daha sonra tartışacağız. Bazı ligandları diğerleriyle değiştirirken, gelen ligandın reaktivitesini aşırıya kaçmamak önemlidir. Organik moleküllerin reaksiyonlarıyla uğraştığımızda, her reaktandan tam olarak bir molekülün koordinasyon alanına iletilmesi bizim için önemlidir. Bir yerine iki molekül girerse, iki özdeş ligandı içeren yan reaksiyonların oluşma olasılığı yüksektir. Koordinasyon alanının doygunluğu ve beklenen süreç için gerekli olan diğer ligandların buraya dahil edilmesinin imkansızlığı nedeniyle reaktivite kaybı da mümkündür. Bu sorun özellikle karbanyonlar gibi güçlü anyonik nükleofillerin koordinasyon alanına dahil edilmesiyle ortaya çıkar. Bunu önlemek için, bağın yüksek iyonikliğini belirleyen alkali metal katyonu yerine daha az elektropozitif metallerin ve metaloidlerin (çinko, kalay, bor, silikon vb.) kullanıldığı, daha az reaktif türevler kullanılır. Nükleofilik kısım ile kovalent bağlar. Bu tür türevlerin geçiş metali türevleri ile reaksiyonları, prensipte tıpkı nükleofilin anyonik formda olması gibi, ancak daha az komplikasyonla ve hiçbir yan reaksiyon olmadan azaltılmış nükleofillik nedeniyle ligand ikame ürünleri üretir. Bu tür ligand ikame reaksiyonları, nükleofilin metalleri daha elektropozitiften daha az elektropozitife değiştirdiği gerçeğini vurgulamak için genellikle transmetalasyon olarak adlandırılır. Bu nedenle bu isim hoş olmayan bir şizofreni unsuru içeriyor - tüm reaksiyonlara bir geçiş metali açısından bakacağımız konusunda zaten anlaşmış gibiydik, ancak aniden onu tekrar kaybettik ve bu reaksiyona ve sadece bu reaksiyona baktık bir nükleofilin bakış açısından. Sabırlı olmanız gerekecek, terminoloji bu şekilde gelişti ve kabul edildi. Aslında bu kelime, organometalik bileşiklerin ilk kimyasına ve lityum veya organomagnezyum bileşiklerinin çeşitli metallerin ve metaloidlerin halojenürleri üzerindeki etkisinin, başta geçiş olmak üzere tüm organometalik bileşiklerin sentezi için ana yöntemlerden biri olduğu gerçeğine kadar uzanır. ve geçiş metallerinin koordinasyon bileşiklerinin kimyasında şu anda ele aldığımız reaksiyon, her şeyin ortaya çıktığı organometalik kimyanın eski yönteminin basit bir genellemesidir. Yeniden metalleme, geleneksel ikameye hem benzer hem de benzer değildir. Görünüşe göre - geçişsiz bir organometalik reaktifin sadece karşı iyonlu bir karbanyon olduğunu düşünürsek, o zaman karbon-geçişsiz metal bağı iyoniktir. Ancak bu fikir yalnızca en elektropozitif metaller olan magnezyum için doğru gibi görünüyor. Ancak zaten çinko ve kalay için bu fikir gerçeklerden çok uzaktır. Bu nedenle reaksiyona iki σ bağı ve uçlarındaki dört atom girer. Sonuç olarak iki yeni σ bağı oluşur ve dört atom birbirine farklı sırayla bağlanır. Büyük olasılıkla, tüm bunlar dört üyeli bir geçiş durumunda eşzamanlı olarak meydana gelir ve reaksiyonun kendisi, geçiş metallerinin diğer birçok reaksiyonu gibi uyumlu bir karaktere sahiptir. Kelimenin tam anlamıyla her zevke ve her tür simetriye uygun elektronların ve yörüngelerin bolluğu, geçiş metallerini, birkaç atomla geçiş durumlarında eş zamanlı olarak bağları koruyabilme yeteneğine sahip kılar. Yeniden metalleme durumunda, basitçe σ-bağ metatezi olarak adlandırılan, çok genel bir sürecin özel bir durumunu elde ederiz. Bunları yalnızca kendi mekanizmalarıyla tam teşekküllü katalitik reaksiyonlar olan olefinlerin ve asetilenlerin gerçek metatezi ile karıştırmayın. Bu durumda transmetalasyon mekanizmasından veya benzer bir şeyin meydana geldiği başka bir süreçten bahsediyoruz.

Koordineli ligandların reaksiyonları










Organometalik bileşiklerin reaksiyonları



Her türdeki ligandlar herhangi bir kombinasyonla ikame edilebilir
Hapto ligandlarını içeren ikame

Ligandların ikamesi, eklenmesi ve ayrışması yakından ve ayrılmaz bir şekilde bağlantılıdır



Kararlı ve kararsız ligandlar
Bir ligand olarak siklobutadien
Koordinasyona duyarlı ligandlar
Koordinasyon açısından kararlı ligandlar

Yeniden metalleme

Transmetalasyon nasıl oluşur?