Реакції заміщення лігандів. Реакційна здатність комплексів
Загальна хімія: підручник / А. В. Жолнін; під ред. В. А. Попкова, А. В. Жолнін. - 2012. - 400 с .: іл.
Глава 7. КОМПЛЕКСНІ СПОЛУКИ
Глава 7. КОМПЛЕКСНІ СПОЛУКИ
Комплексообразующие елементи є організаторами життя.
К. Б. Яцимірський
Комплексні сполуки - найбільш великий і різноманітний клас сполук. В живих організмах присутні комплексні сполуки біогенних металів з білками, амінокислотами, порфі-рінамі, нуклеїновими кислотами, вуглеводами, макроциклическими сполуками. Найважливіші процеси життєдіяльності протікають за участю комплексних сполук. Деякі з них (гемоглобін, хлорофіл, гемоцианин, вітамін В 12 і ін.) Відіграють значну роль в біохімічних процесах. Багато лікарські препарати містять комплекси металів. Наприклад, інсулін (комплекс цинку), вітамін В 12 (комплекс кобальту), платінол (комплекс платини) і т.д.
7.1. Координаційна ТЕОРІЯ А. Вернер
Будова комплексних сполук
При взаємодії частинок спостерігається взаємна координація частинок, яку можна визначити як процес комплексообразова-ня. Наприклад, процес гідратації іонів закінчується утворенням аквакомплексів. Реакції комплексоутворення супроводжуються перенесенням електронних пар і призводять до утворення або руйнування з'єднань вищого порядку, так званих комплексних (координаційних) сполук. Особливістю комплексних сполук є наявність в них координаційної зв'язку, що виникла по донорно-акцепторного механізму:
Комплексними сполуками називаються сполуки, що існують як в кристалічному стані, так і в розчині, особливістю
яких є наявність центрального атома, оточеного лигандами. Комплексні сполуки можна розглядати як складні сполуки вищого порядку, що складаються з простих молекул, здатних до самостійного існування в розчині.

За координаційної теорії Вернера в комплексному поєднанні розрізняють внутрішнюі зовнішню сфери.Центральний атом з оточуючими його лігандами утворюють внутрішню сферу комплексу. Її зазвичай укладають у квадратні дужки. Все інше в комплексному поєднанні становить зовнішню сферу і пишеться за квадратними дужками. Навколо центрального атома размешается певне число лігандів, яке визначається координаційним числом(Кч). Число координованих лігандів найчастіше дорівнює 6 або 4. Ліганд займає близько центрального атома координаційне місце. При координації змінюються властивості як лігандів, так і центрального атома. Часто координовані ліганди неможливо виявити за допомогою хімічних реакцій, характерних для них у вільному стані. Більш міцно пов'язані частки внутрішньої сфери називаються комплексом (комплексним іоном).Між центральним атомом і лігандами діють сили тяжіння (утворюється ковалентний зв'язок за обмінним і (або) донорно-акцепторного механізму), між лігандами - сили відштовхування. Якщо заряд внутрішньої сфери дорівнює 0, то зовнішня координаційна сфера відсутня.
Центральний атом (комплексоутворювач)- атом або іон, який займає центральне положення в комплексному поєднанні. Роль комплексообразователя найчастіше виконують частинки, що мають вільні орбіталі і досить великий позитивний заряд ядра, а отже, можуть бути акцепторами електронів. Це катіони перехідних елементів. Найбільш сильні комплексообразовате-ли - елементи IB і VIIIB груп. Рідко в якості комплексообразо-
вателей виступають нейтральні атоми d-елементів та атоми неметалів в різного ступеня окислення -. Число вільних атомних орбіталей, що надаються комплексоутворювачем, визначає його координаційне число. Величина координаційної числа залежить від багатьох факторів, але зазвичай вона дорівнює подвоєному заряду іона-комплексоутворювача:

ліганди- іони або молекули, які безпосередньо пов'язані з комплексоутворювачем і є донорами електронних пар. Ці електроноізбиточние системи, що мають вільні і рухливі електронні пари, можуть бути донорами електронів, наприклад:
З'єднання р-елементів виявляють комплексоутворюючі властивості і виступають в комплексному поєднанні як лігандів. Лігандами можуть бути атоми і молекули (білка, амінокислот, нуклеїнових кислот, вуглеводів). За кількістю зв'язків, утворених лігандами з комплексо-освітню, фізкультурно, ліганди діляться на моно-, ди-і полідентатними ліганди.Перераховані вище ліганди (молекули і аніони) є монодії-татнимі, так як вони донори однієї електронної пари. До бідентатно лигандам відносяться молекули або іони, що містять дві функціональні групи, здатні бути донором двох електронних пар:

До полідентатними лигандам можна віднести 6-дентатність ліганд етилендіамінтетраоцтової кислоти:

Число місць, займаних кожним лигандом у внутрішній сфері комплексного з'єднання, називається координаційної ємністю (дентатність) ліганда.Вона визначається числом електронних пар лиганда, які беруть участь в утворенні координаційного зв'язку з центральним атомом.
Крім комплексних з'єднань, координаційна хімія охоплює подвійні солі, кристалогідрати, що розпадаються в водному розчині на складові частини, які в твердому стані в багатьох випадках побудовані аналогічно комплексним, але нестійкі.
Найбільш стійкі і різноманітні комплекси за складом і тих функцій утворюють d-елементи. Особливо велике значення мають комплексні сполуки перехідних елементів: заліза, марганцю, титану, кобальту, міді, цинку і молібдену. Біогенні s-елементи (Na, К, Mg, Са) утворюють комплексні сполуки тільки з лігандами певної циклічної структури, виступаючи також як комплексообразователя. Основна частина р-елементів (N, P, S, О) є активною діючою частиною комплексообразующих частинок (лігандів), в тому числі і біолігандами. У цьому полягає їх біологічна значущість.
Отже, здатність до комплексоутворення - це загальна властивість хімічних елементів періодичної системи, ця здатність зменшується в наступному порядку: f> d> p> s.
7.2. ВИЗНАЧЕННЯ ЗАРЯДУ ОСНОВНИХ ЧАСТИНОК КОМПЛЕКСНОГО З'ЄДНАННЯ
Заряд внутрішньої сфери комплексної сполуки є алгебраїчну суму зарядів утворюють її частинок. Наприклад, величина і знак заряду комплексу визначаються наступним чином. Заряд іона алюмінію дорівнює +3, сумарний заряд шести гідроксид-іонів -6. Отже, заряд комплексу дорівнює (+3) + (-6) \u003d -3 і формула комплексу 3. Заряд комплексного іона чисельно дорівнює сумарному заряду зовнішньої сфери і протилежний йому за знаком. Наприклад, заряд зовнішньої сфери K 3 дорівнює +3. Отже, заряд комплексного іона дорівнює -3. Заряд комплексоутворювача дорівнює за величиною і протилежний за знаком алгебраїчної сумі зарядів всіх інших частинок комплексної сполуки. Звідси, в K 3 заряд іона заліза дорівнює +3, так як сумарний заряд всіх інших частинок комплексної сполуки дорівнює (+3) + (-6) \u003d -3.
7.3. НОМЕНКЛАТУРА КОМПЛЕКСНИХ СПОЛУК
Основи номенклатури розроблені в класичних працях Вернера. Відповідно до них в комплексному поєднанні спочатку називають катіон, а потім аніон. Якщо з'єднання неелектролітного типу, то його називають одним словом. Назва комплексного іона пишеться в одне слово.
Нейтральний ліганд називають так само, як і молекулу, а до лигандам-анионам додають в кінці «о». Для координованої молекули води використовують позначення «аква». Для позначення числа однакових лігандів у внутрішній сфері комплексу в якості приставки перед назвою лігандів використовують грецькі числівники ді-, три-, тетра-, пента-, гекса- і т.д. Приставку Мононитка вживають. Ліганди перераховують в алфавітному порядку. Назва лиганда розглядають як єдине ціле. Після назви ліганда слід найменування центрального атома із зазначенням ступеня окислення, яку позначають римськими цифрами в круглих дужках. Слово аммін (з двома «м») пишеться стосовно аміаку. Для всіх інших амінів вживається тільки одне «м».
C1 3 - гексаммінкобальта (III) хлорид.
C1 3 - аквапентаммінкобальта (III) хлорид.
Cl 2 - пентаметіламмінхлорокобальта (III) хлорид.
Діамміндібромоплатіна (II).
Якщо комплексний іон є аніоном, то його латинська назва має закінчення «am».
(NH 4) 2 - амоній тетрахлоропалладат (II).
K - калій пентабромоаммінплатінат (IV).
K 2 - калій тетрароданокобальтат (II).
Назва складного лиганда зазвичай беруть у круглі дужки.
NO 3 - дихлоро-ди (етилендіамін) кобальту (III) нітрат.
Br - бромо-трис- (трифенілфосфін) платини (II) бромід.
У тих випадках, коли ліганд пов'язує два центральних іона, перед його назвою вживається грецька букваμ.

Такі ліганди називають мостіковиміі перераховують останніми.
7.4. ХІМІЧНИЙ ЗВ'ЯЗОК І БУДОВА КОМПЛЕКСНИХ СПОЛУК
В освіті комплексних сполук важливу роль відіграють донорно-акцепторні взаємодії ліганда і центрального атома. Донором електронної пари, як правило, є ліганд. Акцептором - центральний атом, який має вільні орбіталі. Зв'язок цей міцна і не розривається при розчиненні комплексу (неіо-ногенна), і її називають координаційної.
Поряд з про-зв'язками утворюються π-зв'язку за донорно-акцепторного механізму. При цьому донором є іон металу, який чи свої спарені d-електрони ліганду, що має енергетично вигідні вакантні орбіталі. Такі зв'язку називають датівная. Вони утворюються:
а) за рахунок перекривання вакантних р-орбіталей металу з d-ор-біталью металу, на якій знаходяться електрони, які не набрали σ-зв'язок;
б) при перекривання вакантних d-орбіталей ліганда з заповненими d-орбіталей металу.
Мірою її міцності є ступінь перекривання орбіталей Ліга-та й центрального атома. Спрямованість зв'язків центрального атома визначає геометрію комплексу. Для пояснення спрямованості зв'язків використовуються уявлення про гібридизації атомних орбіталей центрального атома. Гібридні орбіталі центрального атома є результатом змішання нерівноцінних атомних орбіталей, в результаті форма і енергія орбіталей взаємно змінюються, і утворюються орбіталі нової однакової форми і енергії. Число гібридних орбіталей завжди дорівнює числу вихідних. Гібридні хмари розташовуються в атомі на максимальному видаленні один від одного (табл. 7.1).
Таблиця 7.1.Типи гібридизації атомних орбіталей комплексообразовате-ля і геометрія деяких комплексних сполук

Просторова структура комплексу визначається типом гібридизації валентних орбіталей і числом неподіленого електронних пар, що містяться в його валентном енергетичному рівні.
Ефективність донорно-акцепторної взаємодії ліганда і комплексообразователя, а отже, і міцність зв'язку між ними (стійкість комплексу) визначаються їх поляризуемостью, тобто здатністю трансформувати свої електронні оболонки під зовнішнім впливом. За цією ознакою реагенти підрозділяються на «Жорсткі»,або малополярізуемие, і «М'які» -легкополя-різуемие. Полярність атома, молекули або іона залежить від їх розміру і числа електронних шарів. Чим менше радіус і електронів у частинки, тим вона менше поляризується. Чим менше радіус і менше електронів у частинки, тим вона гірше поляризується.
Жорсткі кислоти утворюють з електронегативними атомами О, N, F лігандів (жорстких підстав) міцні (жорсткі) комплекси, а м'які кислоти утворюють з донорними атомами Р, S і I лігандів, що мають низьку електронний торгівельний і високу здатність до поляризації, міцні (м'які) комплекси. Ми спостерігаємо тут прояв загального принципу «подібне з подібним».
Іони натрію, калію внаслідок своєї жорсткості практично не утворюють стійких комплексів з біосубстратами і в фізіологічних середовищах знаходяться в вигляді аквакомплексів. Іони Са 2 + і Mg 2 + утворюють досить стійкі комплекси з білками і тому в фізіологічних середовищах знаходяться як в іонному, так і в зв'язаному стані.
Іони d-елементів утворюють з біосубстратами (білками) міцні комплекси. А м'які кислоти Cd, Pb, Hg сильно токсичні. Вони утворюють міцні комплекси з білками, що містять R-SH сульфа-гідрільние групи:
Ціанід-іон токсичний. М'який ліганд активно взаємодіє з d-металами в комплексах з біосубстратами, активуючи останні.
7.5. ДИСОЦІАЦІЯ КОМПЛЕКСНИХ СПОЛУК. СТІЙКІСТЬ КОМПЛЕКСІВ. Лабільність і інертність КОМПЛЕКСИ
При розчиненні в воді комплексних сполук зазвичай вони розпадаються на іони зовнішньої і внутрішньої сфер, подібно сильних електролітів, так як ці іони пов'язані іоногенні, в основному електростатичними силами. Це оцінюється як первинна дисоціація комплексних сполук.
Вторинна дисоціація комплексного з'єднання - це розпад внутрішньої сфери на складові її компоненти. Цей процес протікає по типу слабких електролітів, так як частинки внутрішньої сфери пов'язані неіоногенні (ковалентним зв'язком). Дисоціація носить ступінчастий характер:

Для якісної характеристики стійкості внутрішньої сфери комплексної сполуки використовують константу рівноваги, яка описує повну її дисоціацію, звану константою нестійкості комплексу(Кн). Для комплексного аніону - вираз константи нестійкості має вигляд:

Чим менше значення Кн, тим більш стійкою є внутрішня сфера комплексної сполуки, тобто тим менше вона дисоціює у водному розчині. Останнім часом замість Кн використовують значення константи стійкості (Ку) - величини, зворотної Кн. Чим більше значення Ку, тим стабільніший комплекс.
Константи стійкості дозволяють прогнозувати напрямок лігандообменних процесів.
У водному розчині іон металу існує у вигляді аквакомплексів: 2 + - гексаакважелезо (II), 2 + - тетрааквамедь (II). При написанні формул гідратованих іонів координовані молекули води гідратної оболонки не вказуємо, але маємо на увазі. Освіта комплексу між іоном металу і будь-яким лігандом розглядаємо як реакцію заміщення молекули води у внутрішній координаційній сфері цим лігандом.
Лігандообменние реакції протікають за механізмом реакцій S N -Типу. наприклад:
Значення констант стійкості, наведені в таблиці 7.2, свідчать про те, що за рахунок процесу комплексоутворення відбувається міцне зв'язування іонів у водних розчинах, що вказує на ефективність використання даного типу реакцій для зв'язування іонів, особливо полідентатними лигандами.
Таблиця 7.2.Стійкість комплексів цирконію

На відміну від реакцій іонного обміну утворення комплексних з'єднань часто не є квазімгновенним процесом. Наприклад, при взаємодії заліза (III) з нітрілтріметіленфосфоновой кислотою рівновага встановлюється через 4 доби. Для кінетичної характеристики комплексів використовуються поняття - лабільний(Швидко вступає в реакцію) і інертний(Повільно вступає в реакцію). Лабільними комплексами, за пропозицією Г. Таубе, вважаються такі, які повністю обмінюються лігандами протягом 1 хв при кімнатній температурі і концентрації розчину 0,1 М. Необхідно чітко розрізняти термодинамічні поняття [міцний (стійкий) / неміцний (нестійкий)] і кінетичні [ інертний і лабільний] комплекси.
У лабільних комплексів заміщення лігандів відбувається швидко і швидко встановлюється рівновага. У інертних комплексів заміщення лігандів протікає повільно.
Так, інертний комплекс 2 + в кислому середовищі термодинамічно нестійкий: константа нестійкості дорівнює 10 -6, а лабільний комплекс 2 дуже стійкий: константа стійкості дорівнює 10 -30. Лабільність комплексів Таубе пов'язує з електронною структурою центрального атома. Інертність комплексів властива, головним чином, іонів з незакінченою d-оболонкою. До інертним відносяться комплекси Со, Сr. Ціанідні комплекси багатьох катіонів із зовнішнім рівнем s 2 p 6 лабільні.
7.6. Хімічні властивості КОМПЛЕКСІВ
Процеси комплексоутворення позначаються практично на властивостях всіх частинок, що утворюють комплекс. Чим вище міцність зв'язків лиганда і комплексообразователя, тим в меншій мірі в розчині проявляються властивості центрального атома і лігандів і тим помітніше позначаються особливості комплексу.
Комплексні сполуки виявляють хімічну і біологічну активність в результаті координаційної ненасиченості центрального атома (маються вільні орбіталі) і наявності вільних електронних пар лігандів. У цьому випадку комплекс має електро-профільними і нуклеофільними властивостями, відмінними від властивостей центрального атома і лігандів.
Необхідно враховувати вплив на хімічну і біологічну активність будови гідратної оболонки комплексу. процес образова-
ня комплексів впливає на кислотно-основні властивості комплексного з'єднання. Освіта комплексних кислот супроводжується збільшенням сили кислоти або підстави відповідно. Так, при утворенні комплексних кислот з простих енергія зв'язку з іонами Н + падає і сила кислоти відповідно зростає. Якщо у зовнішній сфері знаходиться іон ОН -, то зв'язок між комплексним катіоном і гідроксид-іоном зовнішньої сфери зменшується, і основні властивості комплексу збільшуються. Наприклад, гідроксид міді Cu (ОН) 2 - слабке, важко розчинними підставу. При дії на нього аміаку утворюється аміакати міді (OH) 2. Щільність заряду 2 + в порівнянні з Cu 2 + зменшується, зв'язок з іонами ОН - послаблюється і (OH) 2 поводиться як серйозна причина. Кислотно-основні властивості лігандів, пов'язаних з комплексоутворювачем, зазвичай проявляються більш сильно, ніж кислотно-основні властивості їх у вільному стані. Наприклад, гемоглобін (Нb) або оксигемоглобін (НВО 2) виявляють кислотні властивості за рахунок вільних карбоксильних груп білка-глобіну, що є лігандом ННb ↔ Н + + Hb -. У той же час аніон гемоглобіну за рахунок аминогрупп білка глобіну проявляє основні властивості і тому пов'язує кислотний оксид СО 2 з утворенням аніону карбаміногемоглобіна (НbСО 2 -): СО 2 + Hb - ↔ НbСО 2 -.
Комплекси проявляють окисно-відновні властивості за рахунок окислювально-відновних перетворень комплексо-просвітників, що утворює стійкі ступені окислення. Процес комплексоутворення сильно впливає на величини відновлювальних потенціалів d-елементів. Якщо відновлена \u200b\u200bформа катіонів утворює з даними лигандом більш стійкий комплекс, ніж його окислена форма, то величина потенціалу зростає. Зниження величини потенціалу відбувається, коли більш стійкий комплекс утворює окислена форма.Наприклад, під дією окислювачів: нітритів, нітратів, NO 2, H 2 O 2 гемоглобін в результаті окислення центрального атома перетворюється в метгемоглобін.
Шоста орбиталь використовується в освіті оксигемоглобина. Ця ж орбиталь бере участь в утворенні зв'язку з монооксидом вуглецю. В результаті утворюється макроциклічними комплекс з залізом - карбоксигемоглобін. Цей комплекс в 200 разів більш стійкий, ніж комплекс заліза з киснем в геме.

Мал. 7.1.Хімічні перетворення гемоглобіну в організмі людини. Схема з кн .: Слєсарєв В.І. Основи хімії живого, 2000.
Освіта комплексних іонів впливає на каталітичну активність іонів комплексообразователей. У ряді випадків активність збільшується. Це обумовлено утворенням в розчині великих структурних систем, здатних брати участь у створенні проміжних продуктів і зниження енергії активації реакції. Наприклад, якщо до Н 2 О 2 додати Cu 2+ або NH 3, процес розкладання не прискорює. У присутності ж комплексу 2 +, який утворюється в лужному середовищі, розкладання перекису водню прискорюється в 40 млн разів.
Отже, на гемоглобіні можна розглянути властивості комплексних сполук: кислотно-основні, комплексоутворення і окислювально-відновні.
7.7. КЛАСИФІКАЦІЯ КОМПЛЕКСНИХ СПОЛУК
Існує кілька систем класифікації комплексних сполук, які ґрунтуються на різних принципах.
1.За приналежності комплексної сполуки до певного класу сполук:
Комплексні кислоти H 2;
Комплексні підстави OH;
Комплексні солі K 4.
2. За природою ліганда: Аквакомплекси, аміакати, ацідоком-комплекси (як ліганди виступають аніони різних кислот, K 4; гідроксокомплекси (як ліганди - гідроксилу-ні групи, K 3); комплекси з макроциклическими лиганда-ми, всередині яких розміщується центральний атом.
3. За знаком заряду комплексу: катіонні - комплексний катіон в комплексному поєднанні Cl 3; аніонні - комплексний аніон в комплексному поєднанні K; нейтральні - заряд комплексу дорівнює 0. Комплексне з'єднання зовнішньої сфери не має, наприклад. Це формула протипухлинного препарату.
4. За внутрішній структурі комплексу:
а) в залежності від числа атомів комплексоутворювача: моноядерних- до складу комплексної частинки входить один атом комплексообразователя, наприклад Cl 3; багатоядерні- в складі комплексної частинки кілька атомів когось плексообразователя - железопротеіновий комплекс:

б) в залежності від числа видів лігандів розрізняють комплекси: однорідні (Однолігандние),містять один вид лиганда, наприклад 2 +, і різнорідні (Різнолігандні)- два види лігандів або більше, наприклад Pt (NH 3) 2 Cl 2. До складу комплексу входять Ліга-ди NH 3 і Cl -. Для комплексних сполук, що містять у внутрішній сфері різні ліганди, характерна геометрична ізомерія, коли при однаковому складі внутрішньої сфери ліганди в ній розташовуються по-різному щодо один одного.

Геометричні ізомери комплексних сполук відрізняються не тільки за фізичними і хімічними властивостями, але і біологічну активність. Цис-ізомер Pt (NH 3) 2 Cl 2 має яскраво виражену протипухлинну активність, а транс-ізомери - немає;
в) в залежності від дентатність лігандів, що утворюють моноядерних комплекси, можна виділити групи:
Одноядерні комплекси з монодентатно лигандами, наприклад 3+;
Одноядерні комплекси з полідентатними лигандами. Комплексні сполуки з полідентатними лигандами називають хелатними сполуками;
г) циклічні і ациклічні форми комплексних сполук.
7.8. Хелатні комплекси. Комплексони. комплексонати
Циклічні структури, які утворюються в результаті приєднання іона металу до двох донорним атомам або більше, що належить одній молекулі хелатообразующіе агента, називаються хелатними сполуками.Наприклад, гліцинат міді:

У них комплексообразователь як би веде всередину лиганда, охоплений зв'язками, як клешнями, тому вони при інших рівних умовах володіють більш високою стійкістю, ніж сполуки, що не містять циклів. Найбільш стійкі цикли, що складаються з п'яти або шести ланок.Це правило вперше сформульовано Л.А. Чугаєвим. різниця
стійкості хелатного комплексу і стійкості його нециклічного аналога називають хелатньм ефектом.
Як хелатообразующіе агента виступають полідентатними ліганди, які містять 2 типу угруповань:
1) групи, здатні до утворення ковалентних полярних зв'язків за рахунок реакцій обміну (донори протонів, акцептори електронних пар) СН 2 СООН, СН2- РВ (ОН) 2, -CH 2 SO 2 OH, - кислотні групи (центри);
2) групи-донори електронних пар: ≡N,\u003e NH,\u003e C \u003d O, -S-, -OH, - основні групи (центри).
Якщо такі ліганди насичують внутрішню координаційну сферу комплексу і повністю нейтралізують заряд іона металу, то з'єднання називають внутрікомплексньмі.Наприклад, гліцинат міді. В даному комплексі зовнішня сфера відсутня.
Велика група органічних речовин, що містять в молекулі основні і кислотні центри, називається комплексонами.Це багатоосновні кислоти. Хелатні сполуки, що утворюються комплексонами при взаємодії з іонами металів, називають комплексонати,наприклад Комплексонати магнію з етилендіамінтетраоцтової кислотою:
У водному розчині комплекс існує в анионной формі.
Комплексони і комплексонати є простою моделлю більш складних з'єднань живих організмів: амінокислот, поліпептидів, білків, нуклеїнових кислот, ферментів, вітамінів і багатьох інших ендогенних сполук.
В даний час випускається величезний асортимент синтетичних комплексонів з різними функціональними групами. Формули основних комплексонів представлені нижче:


Комплексони при певних умовах можуть надавати неподіленого електронні пари (кілька) для утворення координаційного зв'язку з іоном металу (s-, p- або d-елемента). В результаті утворюються стійкі з'єднання хелатного типу з 4-, 5-, 6- або 8-членів циклами. Реакція протікає в широкому інтервалі pH. Залежно від pH, природи комплексоутворювача, співвідношення його з лігандом утворюються комплексонати різної міцності і розчинності. Хімізм освіти комплексонатов можна уявити рівняннями на прикладі натрієвої солі ЕДТА (Na 2 H 2 Y), який у водному розчині дисоціює: Na 2 H 2 Y → 2Na + + H 2 Y 2, і іон H 2 Y 2 взаємодіє з іонами металів незалежно від ступеня окислення катіона металу, з одного молекулою комплексона взаємодіє найчастіше один іон металу (1: 1). Реакція протікає кількісно (Кр\u003e 10 9).
Комплексони і комплексонати виявляють в широкому інтервалі pH амфотерні властивості, здатність брати участь в реакціях окислення- відновлення, комплексоутворення, утворюють сполуки з різноманітними властивостями в залежності від ступеня окислення металу, його координаційної насиченості, мають електрофільними і нуклеофільними властивостями. Все це визначає здатність зв'язувати велику кількість частинок, що дозволяє малим кількістю реагенту вирішувати великі і різноманітні завдання.
Інша незаперечна перевага комплексонів і комплексонатов - це мала токсичність і здатність перетворювати токсичні частки
в малотоксичні або навіть в біологічно активні. Продукти руйнування комплексонатов не накопичуються в організмі і нешкідливі. Третя особливість комплексонатов - це можливість їх використання як джерела мікроелементів.
Підвищена засвоюваність обумовлена \u200b\u200bтим, що мікроелемент вводиться в біологічно активній формі і має високу мембрано-проникністю.
7.9. Фосфоровмісних комплексонатов металів - ЕФЕКТИВНА ФОРМА ПЕРЕТВОРЕННЯ мікро- та макроелементи В БІОЛОГІЧНО АКТИВНА СТАН І МОДЕЛЬ ДОСЛІДЖЕННЯ БІОЛОГІЧНОЇ ДІЇ ХІМІЧНИХ ЕЛЕМЕНТІВ
поняття біологічна активністьохоплює широке коло явищ. З точки зору хімічного впливу під біологічно активними речовинами (БАР) прийнято розуміти речовини, які можуть діяти на біологічні системи, регулюючи їх життєдіяльність.
Здатність до такого впливу трактують як здатність до прояву біологічної активності. Регуляція може проявлятися в ефектах стимулювання, гноблення, розвитку тих чи інших ефектів. Крайнім виявом біологічної активності є біоцидний дію,коли в результаті впливу речовини-біоциду на організм останній гине. При менших концентраціях в більшості випадків біоциди надають на живі організми летальну, а стимулюючу дію.
В даний час відомо велика кількість таких речовин. Проте у багатьох випадках застосування відомих БАВ використовують недостатньо, нерідко з ефективністю, далекій від максимальної, і застосування нерідко призводить до побічних ефектів, які можуть бути усунені шляхом введення в БАВ модифікаторів.
Фосфорсодержащие комплексонати утворюють з'єднання з різноманітними властивостями в залежності від природи, ступеня окислення металу, координаційної насиченості, складу і будови гідрат-ної оболонки. Все це визначає поліфункціональність комплексо-натов, їх унікальну здатність субстехіометріческого дії,
ефект загального іона і забезпечує широке застосування в медицині, біології, екології та в різних галузях народного господарства.
При координації іоном металу комплексона відбувається перерозподіл електронної щільності. Внаслідок участі непод-ленній електронної пари при донорно-акцепторном взаємодії відбувається зміщення електронної густини лиганда (комплексо-на) до центрального атому. Зниження щодо негативного заряду на ліганд сприяє зменшенню кулонівського відштовхування реагентів. Тому координований ліганд стає більш доступним для атаки нуклеофільних реагентом, що має на реакційному центрі надлишок електронної щільності. Зсув електронної щільності від комплексона до іона металу призводить до відносного збільшення позитивного заряду атома вуглецю, а отже, і до полегшення його атаки нуклеофільних реагентом, гідроксильних іоном. Гідроксильований комплекс серед ферментів, які каталізують процеси метаболізму в біологічних системах, займає одне з центральних місць в механізмі ферментативного дії і детоксикації організму. В результаті многоточечного взаємодії ферменту з субстратом відбувається орієнтація, що забезпечує зближення активних груп в активному центрі та переклад реакції у внутрішньомолекулярний режим, до початку протікання реакції і освіти перехідного стану, що забезпечує ферментативну функцію ФКМ.У молекулах ферменту можуть відбуватися Конформа-ційних зміни. Координація створює додаткові умови для окислювально-відновного взаємодії між центральним іоном і лігандом, так як встановлюється безпосередній зв'язок між окислювачем і відновником, що забезпечує перехід електронів. Для комплексів перехідних металів ФКМ можуть бути характерні переходи електронів типу L-M, M-L, M-L-M, в яких беруть участь орбіталі як металу (M), так і лігандів (L), які відповідно пов'язані в комплексі донорно-акцепторними зв'язками. Комплексони можуть служити містком за яким осцилюють електрони багатоядерних комплексів між центральними атомами одного або різних елементів в різного ступеня окислення (Комплекси перенесення електронів і протонів).Комплексони визначають відновні властивості комплексонатов металів, що дозволяє їм проявляти високі антиоксидантні, адаптогенні властивості, гомеостатические функції.
Отже, комплексони перетворюють мікроелементи в біологічно активну, доступну для організму форму. Вони утворюють стійкі,
більш координаційно насичені частки, нездатні руйнувати біокомплекси, а отже, малотоксичні форми. Комплексонати сприятливо діють при порушенні мікроелементного гомеоста через організму. Іони перехідних елементів в комплексонатной формі виступають в організмі в якості фактора, що визначає високу чутливість клітин, до мікроелементів шляхом їх участі в створенні високого градієнта концентрації, мембранного потенціалу. Комплексонати перехідних металів ФКМ мають біорегуляторних-ми властивостями.
Наявність в складі ФКМ кислотних і основних центрів забезпечує амфотерні властивості і їх участь в підтримці кислотно-лужної рівноваги (стан ізогідріі).
Зі збільшенням числа фосфонових груп в складі комплексона змінюються склад і умови утворення розчинних і нерозчинні комплексів. Збільшення числа фосфонових груп сприяє утворенню малорозчинних комплексів в більш широкому інтервалі pH, зрушує область їх існування в кислу область. Розкладання комплексів відбувається при pH більше 9.
Вивчення процесів комплексоутворення з комплексонами дозволило розробити методики синтезу біорегуляторів:
Стимулятори росту пролонгованої дії в колоїдно-хімічної формі - це поліядерних гомо- і гетерокомплекс-ні сполуки титану і заліза;
Стимулятори росту в водорозчинній формі. Це разноліганд-ні комплексонати титану на основі комплексонів і неорганічного ліганда;
Інгібітори росту - фосфорсодержащие комплексонати s-елементів.
Біологічна дія синтезованих препаратів на ріст і розвиток вивчено в хронічному експерименті на рослинах, тварин і людину.
біорегуляції- це новий науковий напрям, що дозволяє регулювати напрямок і інтенсивність біохімічних процесів, що можна широко використовувати в медицині, тваринництві та рослинництві. Воно пов'язане з розробкою способів відновлення фізіологічної функції організму з метою профілактики і лікування захворювань і вікових патологій. Комплексони і комплексні сполуки на їх основі можна віднести до перспективних біологічно активним сполукам. Вивчення їх біологічної дії в хронічному експерименті показало, що хімія дала в руки медиків,
тваринників, агрономів та біологів новий перспективний засіб, що дозволяє активно впливати на живу клітину, регулювати умови харчування, ріст і розвиток живих організмів.
Дослідження токсичності застосовуваних комплексонів і комплексонатов показало повну відсутність впливу препаратів на кровотворні органи, артеріальний тиск, збудливість, частоту дихання: не відзначено зміна функції печінки, не виявлено токсикологічне вплив на морфологію тканин і органів. Калієва сіль ОЕДФ не володіє токсичністю в дозі, в 5-10 разів перевищує лікувальну (10-20 мг / кг) при дослідженні протягом 181 діб. Отже, комплексони відносяться до малотоксичних сполук. Вони використовуються в якості лікарських препаратів для боротьби з вірусними захворюваннями, отруєннями важкими металами і радіоактивними елементами, порушенням кальцієвого обміну, при ендемічних захворюваннях і порушенні балансу мікроелемента в організмі. Фосфорсодержащие комплек-еони і комплексонати не піддавалося фотолизу.
Прогресуюче забруднення навколишнього середовища важкими металами - продуктами господарської діяльності людини є постійно діючим екологічним фактором. Вони можуть накопичуватися в організмі. Надлишок і недолік їх викликають інтоксикацію організму.
Комплексонати металів, зберігають в організмі хелатообразующіе ефект по ліганду (комплексони) і є незамінними для підтримки металлолігандного гомеостазу. Інкорпоровані важкі метали до певної міри нейтралізуються в організмі, а низька ресорбціонная здатність перешкоджає передачі металів уздовж трофічних ланцюгів, в результаті це призводить до певної «біомініза-ції» їх токсичної дії, що особливо актуально для Уральського регіону. Наприклад, вільний іон свинцю відноситься до тіолових отрут, а міцний Комплексонати свинцю з етилендіамінтетраоцтової кислотою малотоксичний. Тому детоксикація рослин і тварин полягає в застосуванні комплексонатов металів. Вона заснована на двох термодинамічних принципах: їх здатності утворювати міцні зв'язки з токсичними частинками, перетворюючи їх в малорозчинні або стійкі у водному розчині сполуки; їх нездатності руйнувати ендогенні біокомплекси. У зв'язку з цим ми вважаємо важливим напрямком боротьби з екоотравленіямі і отриманням екологічно чистої продукції - це комплексонотерапію рослин і тварин.
Проведено вивчення впливу обробки рослин комплексонату-ми різних металів при інтенсивній технології вирощування
картоплі на мікроелементний склад бульб картоплі. Зразки бульб містили 105-116 мг / кг заліза, 16-20 мг / кг марганцю, 13-18 мг / кг міді і 11-15 мг / кг цинку. Співвідношення і вміст мікроелементів типові для рослинних тканин. Бульби, вирощені із застосуванням і без застосування комплексонатов металів, мають практично однаковий елементний склад. Застосування Хела-тов не створює умови для накопичення важких металів в бульбах. Комплексонати в меншій мірі, ніж іони металів, сорбуються ґрунтом, стійкі проти її мікробіологічного впливу, що дозволяє їм тривалий час утримуватися в грунтовому розчині. Ефект післядії 3-4 роки. Вони добре поєднуються з різними отрутохімікатами. Метал в комплексі має більш низьку токсичність. Фосфорсодержащие комплексонати металів не дратують слизову оболонку очей і не пошкоджують шкіру. Сенсибилизирующие властивості не виявлені, кумулятивні властивості комплексонатов титану не виражені, а у деяких виражені дуже слабо. Коефіцієнт кумуляції дорівнює 0,9-3,0, що вказує на низьку потенційну небезпеку хронічного отруєння препаратами.
В основі фосфоровмісних комплексів лежить фосфоруглеродная зв'язок (С-Р), яка виявлена \u200b\u200bі в біологічних системах. Вона входить до складу фосфоноліпідов, фосфоногліканов і фосфопротеинов клітинних мембран. Ліпіди, що містять амінофосфонових з'єднання, стійкі до ензиматичного гідролізу, забезпечують стабільність, а отже, і нормальне функціонування зовнішніх клітинних мембран. Синтетичні аналоги пірофосфатів - діфос-Фонат (Р-С-Р) або (Р-С-С-Р) в великих дозах порушують обмін кальцію, а в малих нормалізують його. Дифосфонати ефективні при Гіперліпемія і перспективні з позицій фармакології.
Дифосфонати, що містять зв'язку Р-С-Р, є структурними елементами біосистем. Вони біологічно ефективні і є аналогами пірофосфатів. Показано, що дифосфонати є ефективними засобами лікування різних захворювань. Дифосфонати є активними інгібіторами мінералізації та розробці кісток. Комплексони перетворюють мікроелементи в біологічно активну, доступну для організму форму, утворюють стійкі більш координаційно-насичені частки, нездатні руйнувати біокомплекси, а отже, малотоксичні форми. Вони визначають високу чутливість клітин до мікроелементів, беручи участь у формуванні високого градієнта концентрації. Здатні брати участь в утворенні багатоядерних сполук титану гетероядер-
ного типу - комплексів перенесення електронів і протонів, брати участь в біорегуляції обмінних процесів, резистентності організму, здатності утворювати зв'язку з токсичними частинками, перетворюючи їх в малорозчинні або розчинні, стійкі, неруйнівні ендогенні комплекси. Тому їх застосування для детоксикації, елімінації з організму, отримання екологічно чистих продуктів (комплексонотерапіі), а також в промисловості для регенерації та утилізації промислових відходів неорганічних кислот і солей перехідних металів дуже перспективно.
7.10. ЛІГАНДООБМЕННИЕ І МЕТАЛЛООБМЕННИЕ
РІВНОВАГИ. ХЕЛАТОТЕРАПІЯ
Якщо в системі кілька лігандів з одним іоном металу або кілька іонів металу з одним лігандом, здатних до утворення комплексних сполук, то спостерігаються конкуруючі процеси: в першому випадку лігандообменное рівновагу - конкуренція між лігандами за іон металу, у другому випадку металлообменное рівновагу - конкуренція між іонами металу за ліганд. Переважним буде процес утворення найбільш міцного комплексу. Наприклад, в розчині є іони: магнію, цинку, заліза (III), міді, хрому (II), заліза (II) і марганцю (II). При введенні в цей розчин невеликої кількості етилендіамінтетраоцтової кислоти (ЕДТА) відбуваються конкуренція між іонами металів і зв'язування в комплекс заліза (III), так як він утворює з ЕДТА найміцніший комплекс.
В організмі постійно відбуваються взаємодія біометалів (Мб) і біолігандами (Lб), утворення і руйнування життєво необхідних біокомплексів (МбLб):
В організмі людини, тварин і рослин є різні механізми захисту і підтримки даного рівноваги від різних ксенобіотиків (чужорідних речовин), і в тому числі від іонів важких металів. Іони важких металів, не пов'язані в комплекс, і їх гідроксокомплекси є токсичними частками (Мт). У цих випадках, поряд з природним металлолігандним рівновагою, може виникнути нова рівновага, з утворенням більш міцних чужорідних комплексів, що містять метали токсиканти (МтLб) або ліганди-токсиканти (МбLт), які не виконують
необхідні біологічні функції. При попаданні в організм екзогенних токсичних часток виникають суміщені рівноваги і як наслідок - конкуренція процесів. Переважним буде той процес, який призводить до утворення найбільш міцного комплексної сполуки:

Порушення металлолігандного гомеостазу викликають порушення процесу обміну речовин, інгібують активність ферментів, руйнують важливі метаболіти, такі, як АТФ, клітинні мембрани, порушують градієнт концентрації іонів в клітинах. Тому створюються штучні системи захисту. Належне місце в цьому методі займає хелатотерапія (комплексонотерапія).
Хелатотерапія - це виведення токсичних часток з організму, засноване на хелатування їх Комплексонати s-елементів. Препарати, що застосовуються для виведення інкорпорованих в організмі токсичних часток, називають детоксикантом(Lg). Хелатування токсичних часток Комплексонати металів (Lg) перетворює токсичні іони металів (Мт) в нетоксичні (МтLg) пов'язані форми, які підходять для ізоляції та проникнення через мембрани, транспорту і виведення з організму. Вони зберігають у організмі хелатообразующіе ефект як по ліганду (комплексони), так і по йону металу. Це забезпечує металлолігандний гомеостаз організму. Тому застосування комплексонатов в медицині, тваринництві, рослинництві забезпечує детоксикацію організму.
Основні термодинамічні принципи хелатотерапіі можна сформулювати в двох положеннях.
I. детоксикантом (Lg) повинен ефективно зв'язувати іони-токсиканти (Мт, Lт), знову утворюються сполуки (МтLg) повинні бути міцніше, ніж ті, які існували в організмі:
II. Детоксикант не повинен руйнувати життєво необхідні комплексні сполуки (МбLб); з'єднання, які можуть утворюватися при взаємодії детоксиканта і іонів біометалів (MбLg), повинні бути менш міцними, ніж існуючі в організмі:
7.11. ЗАСТОСУВАННЯ комплексона І Комплексонати В МЕДИЦИНІ
Молекули комплексонів практично не піддаються розщепленню або якого-небудь зміни в біологічному середовищі, що є їх важливою фармакологічною особливістю. Комплексони нерозчинні в ліпідах і добре розчиняються у воді, тому вони не проникають або погано проникають через клітинні мембрани, а отже: 1) виводяться кишечником; 2) всмоктування когось плексообразователей відбувається тільки при їх ін'єкції (лише пеницилламин приймають всередину); 3) в організмі комплексони циркулюють переважно у позаклітинному просторі; 4) виведення з організму здійснюється головним чином через нирки. Цей процес відбувається швидко.
Речовини, що усувають наслідки впливу отрут на біологічні структури і инактивирующие отрути за допомогою хімічних реакцій, називають антидот.
Одним з перших антидотів, який застосували в хелатотерапіі, є британський антилюїзит (БАЛ). В даний час застосовують унітіол:
Цей препарат ефективно виводить з організму миш'як, ртуть, хром і вісмут. Найбільш широко використовують при отруєнні цинком, кадмієм, свинцем і ртуттю комплексони і комплексонати. Застосування їх засновано на освіту більш міцних комплексів з іонами металів, ніж комплекси цих же іонів з серосодержащими групами білків, амінокислот і вуглеводів. Для виведення свинцю використовують препарати на основі ЕДТА. Введення в організм у великих дозах препаратів небезпечно, так як вони пов'язують іони кальцію, що призводить до порушення багатьох функцій. Тому застосовують тетацин(СаNa 2 ЕДТА), який використовують для виведення свинцю, кадмію, ртуті, ітрію, церію та інших рідкоземельних металів і кобальту.

З часу першого лікувального використання тетацин в 1952 році цей препарат знайшов широке застосування в клініці професійних захворювань і продовжує залишатися незамінним антидотом. Механізм дії тетацин вельми цікавий. Іони-токсиканти витісняють координований іон кальцію з тетацин в зв'язку з утворенням більш міцних зв'язків з киснем і ЕДТА. Іон кальцію, в свою чергу, витісняє два залишилися іона натрію:

Тетацин вводять в організм у вигляді 5-10% розчину, основою якого є фізіологічний розчин. Так, вже через 1,5 години після внутрішньочеревно ін'єкції в організмі залишається 15% введеної дози тетацин, через 6 год - 3%, а через 2 доби - тільки 0,5%. Ефективно і швидко діє препарат при застосуванні інгаляційного методу введення тетацин. Він швидко всмоктується і довго циркулює в крові. Крім того, тетацин використовують при захисті від газової гангрени. Він пригнічує дію іонів цинку і кобальту, які є активаторами ферменту лецитинази, що є токсином газової гангрени.
Зв'язування токсикантів тетацин в малотоксичний і міцніший хелатний комплекс, який не руйнується і легко виводиться з організму через нирки, забезпечує детоксикацію і збалансоване мінеральне живлення. Близьким за структурою і складом до пре-
параті ЕДТА є натрієво-кальцієва сіль діетілентріамін-пентауксусной кислоти (СаNa 3 ДТПА) - пентацині натрієва сіль діетілентріамінпентафосфоновой кислоти (Na 6 ДТПФ) - трімефа-цин.Пентацин застосовують переважно при отруєннях сполуками заліза, кадмію і свинцю, а також для видалення радіонуклідів (техніці, плутонію, урану).

Натрієва сіль етілендіаміндіізопропілфосфоновой кислоти (СаNa 2 ЕДТФ) фосфіцінуспішно використовується для виведення з організму ртуті, свинцю, Беріл, марганцю, актиноидов і інших металів. Комплексонати вельми ефективні для видалення деяких токсичних аніонів. Наприклад, етилендіамінтетраацетат кобальту (II), який утворює змішано-лігандная комплекс з CN -, може бути рекомендований як антидот при отруєннях ціанідами. Аналогічний принцип лежить в основі способів виведення токсичних органічних речовин, в тому числі пестицидів, що містять функціональні угруповання з донорними атомами, здатними до взаємодії з металом комплексонату.
Ефективним препаратом є сукцімер(Димеркаптобурштинову кислота, дімеркаптосукціновая кислота, Хемет). Він міцно пов'язує практично всі токсиканти (Hg, As, Pb, Cd), але виводить з організму іони біогенних елементів (Cu, Fe, Zn, Co), тому майже не застосовується.
Фосфоровмісні комплексонати є потужними інгібіторами кристаллообразования фосфатів і оксалатів кальцію. Як антікальціфіцірующего препарату при лікуванні сечокам'яної хвороби запропонований ксидифон - калієво-натрієва сіль ОЕДФ. Дифосфонати, крім того, в мінімальних дозах збільшують включення кальцію в кісткову тканину, попереджають патологічний вихід його з кісток. ОЕДФ і інші дифосфонати запобігають різні види остеопорозу, включаючи ниркову остеодистрофією, періоденталь-
ву деструкцію, також деструкцію пересадженою кістки у тварин. Описано також антиатеросклеротичний ефект ОЕДФ.
У США запропонований ряд дифосфонатів, зокрема ОЕДФ, як фармацевтичних препаратів для лікування людини і тварин, які страждають метастазами раком кісток. Регулюючи проникність мембран, дифосфонати сприяють транспортуванні протипухлинних ліків в клітку, а значить, і ефективному лікуванню різних онкологічних захворювань.
Однією з актуальних проблем сучасної медицини є завдання експресному діагностики різних захворювань. В цьому аспекті безсумнівний інтерес представляє новий клас препаратів, що містять катіони, здатні виконувати функції зонда - радіоактивних магніторелаксаціонних і флюоресцентних міток. В якості основних компонентів радіофармацевтичних препаратів використовуються радіоізотопи деяких металів. Хелатування катіонів цих ізотопів комплексонами дозволяє підвищити їх токсикологічну прийнятність для організму, полегшити їх транспортування і забезпечити в певних межах вибірковість концентрації в тих чи інших органах.
Наведені приклади аж ніяк не вичерпують усього різноманіття форм застосування комплексонатов в медицині. Так, дікаліевая сіль етилендіамінтетраацетата магнію використовується для регулювання вмісту рідини в тканинах при патології. ЕДТА застосовується в складі антикоагулянтних суспензій, що використовуються при поділі плазми крові, як стабілізатор аденозинтрифосфату при визначенні глюкози в крові, при освітленні і зберіганні контактних лінз. При лікуванні ревматоїдних захворювань широко використовують дифосфонати. Вони особливо ефективні в якості протівоартріт-них коштів в поєднанні з протизапальними засобами.
7.12. КОМПЛЕКСИ З макроциклічних сполук
Серед природних комплексних сполук особливе місце займають макрокомплекси на основі циклічних поліпептидів, що містять внутрішні порожнини певних розмірів, в яких знаходиться декілька кисневмісних груп, здатних зв'язувати катіони тих металів, в тому числі натрію і калію, розміри яких відповідають розмірам порожнини. Такі речовини, перебуваючи в біологи-

Мал. 7.2.Комплекс валиномицина з іоном K +
чеських матеріалах, забезпечують транспорт іонів через мембрани і тому називаються іонофори.Наприклад, валиномицин транспортує іон калію через мембрану (рис. 7.2).
За допомогою іншого поліпептиду - грамицидина Аздійснюється транспорт катіонів натрію з естафетного механізму. Цей поліпептид згорнуть в «трубочку», внутрішня поверхня якої вистелена кислородсодержащими групами. В результаті виходить
досить великої довжини гідрофільний канал з певним перетином, що відповідає розміру іона натрію. Іон натрію, входячи в гідрофільний канал з одного боку, передається від однієї до іншої кисневим угрупованням, подібно естафеті по іонопроводящему каналу.
Отже, циклічна молекула поліпептиду має внутрішньо-молекулярні порожнину, в яку може увійти субстрат певного розміру, геометрії за принципом ключа і замка. Порожнина таких внутрішніх рецепторів облямована активними центрами (ендорецепто-рами). Залежно від природи іона металу може відбуватися Нековалентні взаємодія (електростатичне, освіту водневих зв'язків, ван-дер-ваальсові сили) з лужними металами і ковалентное зі лужноземельними металами. В результаті цього утворюються супрамолекули- складні асоціати, що складаються з двох частинок або більше, утримуваних разом міжмолекулярними силами.
Найбільш поширені в живій природі тетрадентатние поліпропіленгліколів - порфина і близькі їм за структурою кориноїд.Схематично тетрадентний цикл може бути представлений в наступному вигляді (рис. 7.3), де дуги означають однотипні вуглецеві ланцюги, що з'єднують донорні атоми азоту в замкнутий цикл; R 1, R 2, R 3, Р 4 -углеводородние радикали; М n + - іон металу: в хлорофілі іон Mg 2+, в гемоглобіні іон Fe 2+, в гемоцианин іон Cu 2+, у вітаміні В 12 (кобаламін) іон З 3+.
Донорні атоми азоту розташовані по кутах квадрата (позначені пунктиром). Вони жорстко скоординовані в просторі. Тому
порфірини і кориноїд утворюють міцні комплекси з катіонами різних елементів і навіть лужноземельних металів. Істотно, що незалежно від дентатність лиганда хімічний зв'язок і будова комплексу визначаються донор-ними атомами.Так, наприклад, комплекси міді з NH 3, етилендіаміном і пор-Фірін мають однакове квадратне будова і подібну електронну конфігурацію. Але полідентатними ліганди зв'язуються з іонами металів набагато сильніше, ніж монодентатно ліганди

Мал. 7.3.Тетрадентатний макроцикл
з тими ж донорними атомами. Міцність етилендіамінового комплексів на 8-10 порядків більше, ніж міцність тих же металів з аміаком.
Біонеорганічної комплекси іонів металів з білками називають біокластерамі -комплексами іонів металів з макроциклическими сполуками (рис. 7.4).

Мал. 7.4.Схематичне зображення структури біокластеров певних розмірів білкових комплексів з іонами d-елементів. Типи взаємодій білкової молекули. М n + - іон металу активного центру
Усередині біокластера є порожнина. У неї входить метал, який взаємодіє з донорними атомами зв'язують груп: ВІН -, SH -, COO -, -NH 2, білків, амінокислот. Найбільш відомі металлофер-
менти (карбоангидраза, ксантиноксидаза, цитохроми) представляють собою біокластери, порожнини яких утворюють центри ферментів, що містять Zn, Mo, Fe відповідно.
7.13. багатоядерних КОМПЛЕКСИ
Гетеровалентності і гетероядерні комплекси
Комплекси, до складу яких входить кілька центральних атомів одного або різних елементів, називають багатоядерними.Можливість утворення багатоядерних комплексів визначається здатністю деяких лигандов зв'язуватися з двома або трьома іонами металів. Такі ліганди називаються мостіковимі.відповідно мостіковиміназиваються і комплекси. Принципово можливі і одноатомні містки, наприклад:

У них використовуються неподіленого електронні пари, що належать одному і тому ж атому. Роль містків можуть виконувати багатоатомні ліганди.У таких містках використовуються неподелен-ні електронні пари, що належать різним атомам поліатомного ліганду.

А.А. Грінберг і Ф.М. Пугачів досліджували мостіковие сполуки складу, в яких ліганд пов'язує комплексні сполуки одного і того ж металу, але в різних ступенях окислення. Г. Таубе назвав їх комплексами перенесення електрона.Він досліджував реакції переносу електрона між центральними атомами різних металів. Систематичні дослідження кінетики і механізму окислювально-відновних реакцій призвели до висновку, що перенесення електрона між двома комплексами про-
виходить через що утворюється лігандная місток. Обмін електроном між 2 + і 2 + відбувається через утворення проміжного мостикового комплексу (рис. 7.5). Перенесення електрона відбувається через хлорідний мостіковий ліганд, закінчуючись освітою комплексів 2 +; 2 +.

Мал. 7.5.Перенесення електрона в проміжному багатоядерному комплексі
Велика розмаїтість поліядерних комплексів отримано завдяки використанню органічних лігандів, що містять кілька донорних груп. Умовою їх утворення є таке розташування донорних груп в ліганд, яке не дозволяє замикатися хелатним циклам. Нерідкі випадки, коли ліганд має можливість замикати хелатний цикл і одночасно виступати в ролі містка-вого.
Початком перенесення електрона є перехідні метали, що проявляють декілька стійких ступенів окислення. Це надає іонів титану, заліза і міді ідеальні властивості переносників електронів. Сукупність варіантів освіти гетерова-лентних (ГВК) і гетероядерних комплексів (ГЯК) на основі Ti і Fe представлена \u200b\u200bна рис. 7.6.
реакцію

Реакція (1) називається перехресної реакцією.В обмінних реакціях интермедиатом будуть гетеровалентності комплекси. Всі теоретично можливі комплекси дійсно утворюються в розчині в тих чи інших умовах, що доведено різними фізико-хімічними

Мал. 7.6.Освіта гетеровалентності комплексові гетероядерних комплексів, що містять Ti і Fe
методами. Для здійснення переносу електронів реагенти повинні перебувати в близьких по енергії станах. Ця вимога називається принципом Франка-Кондона. Перенесення електрона може відбуватися між атомами одного перехідного елемента, що знаходяться в різному ступені окислення ГВК, або різних елементів ГЯК, природа металлоцен-тров яких різна. Ці сполуки можна визначити як комплекси перенесення електронів. Вони є зручними переносниками електронів і протонів в біологічних системах. Приєднання і віддача електрона викликає зміни лише електронної конфігурації металу, не змінюючи структуру органічною складовою комплексу.Всі ці елементи мають кілька стійких ступенів окислення (Ti +3 і +4; Fe +2 і +3; Cu +1 і +2). На нашу думку, цим системам надана природою унікальна роль забезпечення оборотності біохімічних процесів з мінімальними енергетичними затратами. До оборотним реакцій відносять реакції, що мають термодинамічні і термохимические константи від 10 -3 до 10 3 та з невеликим значенням ΔG o і Е oпроцесів. У даних умовах вихідні речовини і продукти реакції можуть перебувати в порівнянних концентраціях. При зміні їх в деякому діапазоні легко можна досягти оборотності процесу, тому в біологічних системах багато процесів носять коливальний (хвильової) характер. Окислювально-відновні системи, що мають в своєму складі вищезгадані пари, перекривають широкий діапазон потенціалів, що дозволяє їм вступати у взаємодії, що супроводжуються помірними змінами Δ G oі Е °, з багатьма субстратами.
Ймовірність утворення ГВК і ГЯК значно підвищується, коли розчин містить потенційно мостіковие ліганди, тобто молекули або іони (амінокислот, гидроксикислот, комплексонів і ін.), здатні зв'язати відразу два металоцентри. Можливість делокализации електрона в ГВК сприяє зниженню повної енергії комплексу.
Більш реально сукупність можливих варіантів освіти МВК і ГЯК, в яких природа металоцентрів різна, видно на рис. 7.6. Детальний опис освіти МВК і ГЯК і їх роль в біохімічних системах розглянуті в роботах А.Н. Глібова (1997). Окислювально-відновні пари повинні структурно підлаштуватися один до одного, тоді перенесення стає можливим. Підбираючи компоненти розчину, можна «подовжувати» відстань, на яке переноситься електрон від відновника до окислювача. При узгодженому переміщенні частинок може відбуватися перенесення електрона на великі відстані по хвильовому механізму. Як «коридору» може бути гідратованих білкова ланцюжок і ін. Висока ймовірність перенесення електрона на відстань до 100А. Довжину «коридору» можна збільшити добавками (іонами лужних металів, фоновими електролітами). Це відкриває великі можливості в галузі управління складом і властивостями ГВК і ГЯК. У розчинах вони грають роль своєрідного «чорного ящика», наповненого електронами і протонами. Залежно від обставин він може віддавати їх іншим компонентам або поповнювати свої «запаси». Оборотність реакцій з їх участю дозволяє багаторазово брати участь в циклічних процесах. Електрони переходять від одного металевого центру до іншого, осцилюють між ними. Молекула комплексу залишається несиметричною і може брати участь в окисно-відновних процесах. ГВК і ГЯК активно беруть участь в коливальних процесах в біологічних середовищах. Даний тип реакцій називають коливальними реакціями.Вони виявлені в ферментативном каталізі, синтезі білків і інших біохімічних процесах, що супроводжують біологічним явищам. Сюди відносяться періодичні процеси клітинного метаболізму, хвилі активності в серцевої тканини, в тканини мозку і процеси, що відбуваються на рівні екологічних систем. Важливим етапом обміну речовин є відщеплення водню від поживних речовин. Атоми водню переходять при цьому в іонну стан, а відокремлені від них електрони вступають в дихальний ланцюг і віддають свою енергію на утворення АТФ. Як нами встановлено, комплексонати титану є активними переносниками не тільки електронів, а й протонів. Здатність іонів титану виконувати свою роль в активному центрі ферментів типу каталаз, пероксидаз і цитохромів визначається його високою здатністю до комплексоутворення, формуванню геометрії координованого іона, утворення багатоядерних ГВК і ГЯК різного складу і властивостей в функції pH, концентрації перехідного елемента Ti і органічною складовою комплексу, їх мольного співвідношення. Ця здатність проявляється в підвищенні селективності комплексу
по відношенню до субстратів, продуктів метаболічних процесів, активацією зв'язків в комплексі (фермент) і субстраті за допомогою координації та зміни форми субстрату відповідно до стеріче-ськими вимогами активного центру.
Електрохімічні перетворення в організмі, пов'язані з перенесенням електронів, супроводжуються зміною ступеня окислення частинок і виникненням окислювально-відновного потенціалу в розчині. Велика роль в цих перетвореннях належить багатоядерним комплексам ГВК і ГЯК. Вони є активними регуляторами вільнорадикальних процесів, системою утилізації активних форм кисню, перекису водню, окислювачів, радикалів і беруть участь в окисленні субстратів, а також у підтримці антіоокіслітельного гомеостазу, в захисті організму від окисного стресу.Їх ферментативна дія на біосистеми аналогічно ферментам (цитохром-мам, супероксиддисмутази, каталази, пероксидази, глутатіон-редуктази, дегідрогенази). Все це вказує на високі антиоксидантні властивості комплексонатов перехідних елементів.
7.14. ПИТАННЯ І ЗАВДАННЯ ДЛЯ самоперевірки підготовленості До занять та іспитів
1.Дать поняття про комплексні сполуки. У чому їхня відмінність від подвійних солей, і що у них спільне?
2.Складіть формули комплексних сполук по своїй назві: амоній дігідроксотетрахлороплатінат (IV), тріаммінтрінітроко-Бальт (III), дайте їх характеристику; вкажіть внутрішню і зовнішню координаційну сферу; центральний іон і ступінь його окислення: ліганди, їх число і дентатність; характер зв'язків. Напишіть рівняння дисоціації у водному розчині і вираз для константи стійкості.
3.Общіе властивості комплексних сполук, дисоціація, стійкість комплексів, хімічні властивості комплексів.
4. Як реакційна здатність комплексів характеризується з термодинамічних і кінетичних позицій?
5. Які амінокомплекси будуть міцнішими, ніж тетрааміно-мідь (II), а які менш міцними?
6.Пріведіте приклади макроциклических комплексів, утворених іонами лужних металів; іонами d-елементів.
7.По якою ознакою комплекси відносять до хелатним? Наведіть приклади хелатних і нехелатних комплексних сполук.
8. На прикладі гліцинат міді дайте поняття про внутрішньокомплексних з'єднаннях. Напишіть структурну формулу комплексонату магнію з етилендіамінтетраоцтової кислотою в натрієвої формі.
9.Пріведіте схематично структурний фрагмент будь-якого поліядерними комплексу.
10.Дайте визначення поліядерних, гетероядерних і гетерова-лентних комплексів. Роль перехідних металів в їх освіті. Біологічна роль цих компонентів.
11. Які типи хімічного зв'язку зустрічаються в комплексних зі єднання?
12.Перечислите основні типи гібридизації атомних орбіталей, які можуть виникати у центрального атома в комплексі. Яка геометрія комплексу в залежності від типу гібридизації?
13.Ісходя з електронної будови атомів елементів s-, p- і d-блоків зіставити здатність до комплексоутворення і їх місце в хімії комплексів.
14.Дайте визначення комплексонів і комплексонатов. Наведіть приклади найбільш використовуваних в біології та медицині. Наведіть термодинамічні принципи, на яких заснована хелатотерапія. Застосування комплексонатов для нейтралізації і елімінації ксенобіотиків з організму.
15.Рассмотріте основні випадки порушення металлолігандного гомеостазу в організмі людини.
16.Пріведете приклади біокомплексних з'єднань, що містять залізо, кобальт, цинк.
17.Прімери конкуруючих процесів за участю гемоглобіну.
18.Роль іонів металів у ферментах.
19.Об'ясніте, чому для кобальту в комплексах зі складними лигандами (полідентатними) більш стійка ступінь окислення +3, а в звичайних солях, таких, як нітрати, сульфати, нітрати, ступінь окислення +2?
20.Для міді характерні ступені окислення +1 і +2. Чи може мідь каталізувати реакції з переносом електронів?
21.Может чи цинк каталізувати окислювально-відновні реакції?
22.Как механізм дії ртуті як отрути?
23.Укажіте кислоту і основу в реакції:
AgNO 3 + 2NH 3 \u003d NO 3.
24.Об'ясніте, чому в якості лекарственнних препарату застосовується калієво-натрієва сіль гідроксіетілідендіфосфоновой кислоти, а не ОЕДФ.
25.Какие за допомогою іонів металів, що входять до складу біокомплексних з'єднань, здійснюється транспорт електронів в організмі?
7.15. ТЕСТОВІ ЗАВДАННЯ
1. Ступінь окислення центрального атома в комплексному іоні 2 дорівнює:
а) -4;
б) +2;
в 2;
г) +4.
2. Найбільш стійкий комплексний іон:
а) 2-, Кн \u003d 8,5х10 -15;
б) 2-, Кн \u003d 1,5х10 -30;
в) 2-, Кн \u003d 4х10 -42;
г) 2-, Кн \u003d 1х10 -21.
3. У розчині міститься 0,1 моль сполуки PtCl 4 4NH 3. Реагуючи з AgNO 3, воно утворює 0,2 моль осаду AgCl. Надайте вихідного речовини координаційну формулу:
а) Cl;
б) Cl 3;
в) Cl 2;
г) Cl 4.
4. Яку форму мають комплекси, утворені в результаті sp 3 d 2-гі- брідізаціі?
1) тетраедра;
2) квадрата;
4) тригональной біпіраміди;
5) лінійну.
5. Підберіть формулу для з'єднання пентааммінхлорокобальт (III) сульфат:
а) Na 3 ;
6) [СоСl 2 (NH 3) 4] Сl;
в) До 2 [Со (SСN) 4];
г) SO 4;
д) [Со (Н 2 О) 6] С1 3.
6. Які ліганди є полідентатними?
а) С1 -;
б) H 2 O;
в) етилендіамін;
г) NH 3;
д) SCN -.
7. Комплексообразователи - це:
а) атоми-донори електронних пар;
в) атоми- і іони-акцептори електронних пар;
г) атоми- і іони-донори електронних пар.
8. Найменшою комплексоутворюючої здатністю володіють елементи:
а) s; в) d;
б) p; г) f
9. Ліганди - це:
а) молекули-донори електронних пар;
б) іони-акцептори електронних пар;
в) молекули- і іони-донори електронних пар;
г) молекули- і іони-акцептори електронних пар.
10. Зв'язок у внутрішній координаційній сфері комплексу:
а) ковалентний обмінна;
б) ковалентний донорно-акцепторні;
в) іонна;
г) воднева.
11. Кращим комплексоутворювачем буде:
Комплексні сполуки. Їх будова на основі координаційної теорії А. Вернера. Комплексний іон, його заряд. Катіонні, аніонні, нейтральні комплекси. Номенклатура, приклади.



Реакції заміщення лігандів. Константа нестійкості комплексного іона, константа стійкості.

 До нестойкості- це відношення творів концентрації розпалися іонів на нераспавшегося кількість.
До нестойкості- це відношення творів концентрації розпалися іонів на нераспавшегося кількість.
До вуст \u003d 1 / К нест (зворотна величина)
 Вторинна дисоціація -розпад внутрішньої сфери комплексу на складові її компоненти.
Вторинна дисоціація -розпад внутрішньої сфери комплексу на складові її компоненти.

43.Конкуренція за ліганд або за комплексообразователь: ізольоване і поєднане рівноваги заміщення лігандів. Загальна константа суміщеного рівноваги заміщення лігандів.
В результаті конкуренції протон руйнує досить міцний комплекс, утворюючи слабо дисоціюють речовина - воду.
Cl + NiS0 4 + 4NH 3 ^ S0 4 + AgCl I
Це вже приклад конкуренції лиганда за комплексообразователь, з утворенням більш міцного комплексу (KH + \u003d 9,3-1 (Г 8; К Н [М (Ш 3) 6] 2+ \u003d 1,9-Ю -9) і труднорастворимого з'єднання AgCl - K s \u003d 1,8 10 "10
Уявлення про будову металлоферментов і інших біокомплексних з'єднань (гемоглобін, цитохроми, кобаламина). Фізико-хімічні принципи транспорту кисню гемоглобіном





Кобаламина. Вітамінами B 12 називають групу кобальтвмісних біологічно активних речовин, які називаються кобаламина. До них відносять власне ціанокобаламін, Гідроксікобаламін і дві коферментниє форми вітаміну B 12: метилкобаламін і 5-дезоксиаденозилкобаламін.
Іноді в більш вузькому сенсі вітаміном B 12 називають цианокобаламин, так як саме в цій формі в організм людини надходить основна кількість вітаміну B 12, не випускаючи з виду те, що він не синонім з B 12, і кілька інших з'єднань також володіють B 12 - вітамінною активністю. Вітамін B 12 також називається зовнішнім фактором Касла.
B 12 має найскладнішу в порівнянні з іншими вітамінами хімічну структуру, основою якої є корріновоекольцо. Коррін багато в чому схожий на порфирин (складна хімічна структура, що входить до складу гема, хлорофілу іцітохромов), але відрізняється від порфирина тим, що два піррольних циклу в складі Корріна з'єднані між собою безпосередньо, а не метиленовим містком. У центрі корріновой структури розташовується іон кобальту. Чотири координаційних зв'язку кобальт утворює з атомами азоту. Ще одна координаційна зв'язок з'єднує кобальт сдіметілбензімідазольним нуклеотидів. Остання, шоста координаційна зв'язок кобальту залишається вільною: саме по цьому зв'язку і приєднується ціаногрупи, гідроксильна група, метильний або 5 "-дезоксіаденозільний залишок з утворенням чотирьох варіантів вітаміну B 12, відповідно. Ковалентний зв'язок вуглець-кобальт в структурі цианокобаламина - єдиний відомий в живій природі приклад ковалентного зв'язку перехідний метал-вуглець.
Основна реакція заміщення в водних розчинах - обмін молекул води (22) - була вивчена для великого числа іонів металів (рис. 34). Обмін молекул води координаційної сфери іона металу з основною масою молекул води, присутньої в якості розчинника, для більшості металів протікає дуже швидко, і тому швидкість такої реакції вдалося вивчити головним чином методом релаксації. Метод полягає в порушенні рівноваги системи, наприклад різким підвищенням температури. За нових умов (більш високій температурі) система вже не буде знаходитися в рівновазі. Потім вимірюють швидкість встановлення рівноваги. Якщо можна змінити температуру розчину протягом 10 -8 сек, То можна виміряти швидкість реакції, яка вимагає для свого завершення проміжку часу більше ніж 10 -8 сек.
Можна виміряти також швидкість заміщення координованих молекул води у різних іонів металів лигандами SO 2 4, S 2 O 3 2-, EDTA і ін. (26). Швидкість такої реакції
залежить від концентрації гідратованого іона металу і не залежить від концентрації входить лиганда, що дозволяє використовувати для опису швидкості цих систем рівняння першого порядку (27). У багатьох випадках швидкість реакції (27) для даного іона металу не залежить від природи входить лиганда (L), будь то молекули H 2 O або іони SO 4 2-, S 2 O 3 2- або EDTA.
Це спостереження, а також той факт, що в рівняння швидкості цього процесу не включена концентрація входить лиганда, дозволяють припускати, що ці реакції протікають за механізмом, в якому повільна стадія полягає в розриві зв'язку між іоном металу і водою. Получающееся з'єднання, ймовірно, потім швидко координує знаходяться поблизу ліганди.
У розд. 4 цього розділу було зазначено, що більш високозаряженние гідратованих іони металу, такі, як Al 3+ і Sc 3+, обмінюють молекули води повільніше, ніж іони M 2+ і M +; це дає підставу припускати, що в стадії, що визначає швидкість всього процесу, важливу роль відіграє розрив зв'язків. Висновки, отримані в цих дослідженнях, не остаточні, але вони дають підставу думати, що в реакціях заміщення гідратованих іонів металів важливе значення мають S N 1-процеси.
Ймовірно, найбільш вивченими комплексними сполуками є амміни кобальту (III). Їх стійкість, легкість приготування і повільно поточні з ними реакції роблять їх особливо зручними для кінетичного вивчення. Так як дослідження цих комплексів були проведені виключно у водних розчинах, спочатку слід розглянути реакції цих комплексів з молекулами розчинника - води. Було встановлено, що взагалі молекули аміаку або амінів, координовані іоном Co (III), настільки повільно заміщаються молекулами води, що зазвичай розглядають заміщення інших лігандів, а не амінів.
Була вивчена швидкість реакцій типу (28) і знайдено, що вона першого порядку щодо комплексу кобальту (X - один з безлічі можливих аніонів).
Так як в водних розчинах концентрація H 2 O завжди дорівнює приблизно 55,5 М, То не можна визначити вплив зміни концентрації молекул води на швидкість реакції. Рівняння швидкості (29) і (30) для водного розчину експериментально не помітні, так як до просто одно k "\u003d k". Отже, з рівняння швидкості реакції не можна сказати, чи буде H 2 O брати участь в стадії, що визначає швидкість процесу. Відповідь на питання, чи протікає ця реакція за механізмом S N 2 із заміною іона X на молекулу H 2 O або за механізмом S N 1, який передбачає спочатку дисоціацію з подальшим приєднанням молекули H 2 O, потрібно отримати за допомогою інших експериментальних даних.
Рішення цього завдання можна досягти двома типами експериментів. Швидкість гідролізу (заміщення одного іона Cl - на молекулу води) транс- + приблизно в 10 3 разів більше швидкості гідролізу 2+. Збільшення заряду комплексу призводить до посилення зв'язків метал - ліганд, а отже, і до гальмування розриву цих зв'язків. Слід також враховувати тяжіння входять лігандів і полегшення протікання реакції заміщення. Так як виявлено зменшення швидкості в міру збільшення заряду комплексу, то в даному випадку здається більш ймовірним діссоціатівний процес (S N 1).
Інший спосіб докази заснований на вивченні гідролізу серії комплексів подібних транс- +. У цих комплексах молекула етілендіаміна замінена аналогічними діаміни, в яких атоми водню у атома вуглецю заміщені на групи CH 3. Комплекси, що містять заміщені діаміни, реагують швидше, ніж етилендиамін комплекс. Заміна атомів водню на CH 3 -групи збільшує обсяг лиганда, що ускладнює атаку атома металу іншим лігандом. Ці стерические перешкоди сповільнюють реакцію за механізмом S N 2. Наявність поблизу атома металу об'ємистих лигандов сприяє Диссоціативна процесу, так як видалення одного з лігандів знижує їх скупчення у атома металу. Спостережуване збільшення швидкості гідролізу комплексів з об'ємними лігандами є хорошим доказом протікання реакції за механізмом S N 1.
Отже, в результаті численних досліджень ацідоамінних комплексів Co (II) виявилося, що заміна ацідогрупп молекулами води є за своїм характером діссоціатівним процесом. Зв'язок атом кобальту - ліганд подовжується до деякої критичної величини перш, ніж молекули води почнуть входити в комплекс. У комплексах, що мають заряд 2+ і вище, розрив зв'язку кобальт - ліганд дуже ускладнений, і входження молекул води починає грати більш важливу роль.
Було виявлено, що заміна ацидо-групи (Х -) в комплексі кобальту (III) на іншу групу, ніж молекула H 2 O, (31) проходить спочатку через заміщення її молекулою
розчинника - води з подальшою заміною її на нову групу Y (32).
Таким чином, у багатьох реакціях з комплексами кобальту (III) швидкість реакції (31) дорівнює швидкості гідролізу (28). Тільки іон гідроксилу відрізняється від інших реагентів щодо реакційної здатності з аммін Co (III). Він дуже швидко реагує з аммін комплексами кобальту (III) (приблизно в 10 6 разів швидше, ніж вода) за типом реакції основного гідролізу (33).
Знайдено, що ця реакція першого порядку щодо заміщає лиганда OH - (34). Загальний другий порядок реакції і незвично швидке протікання реакції дозволяють припустити, що іон OH - - виключно ефективний нуклеофільний реагент по відношенню до комплексам Co (III) і що реакція протікає за механізмом S N 2 через утворення проміжного з'єднання.
Однак ця властивість OH - можна також пояснити і іншим механізмом [рівняння (35), (36)]. В реакції (35) комплекс 2+ поводиться як кислота (по Бренстеда), даючи комплекс +, який є амідо- (містить) -З'єднання - підставою, відповідним кислоті 2+.
Потім реакція протікає за механізмом S N 1 (36) з утворенням пятікоордінаціонного проміжного з'єднання, далі реагує з молекулами розчинника, що призводить до кінцевого продукту реакції (37). Цей механізм реакції узгоджується зі швидкістю реакції другого порядку і відповідає механізму S N 1. Так як реакція в стадії, що визначає швидкість, включає підставу, поєднане початкового комплексу - кислоті, то цього механізму дано позначення S N 1Св.
Визначити, який з цих механізмів найкраще пояснює експериментальні спостереження, дуже важко. Однак є переконливі докази, що підтверджують гіпотезу S N 1CB. Кращі аргументи на користь цього механізму такі: октаедричні комплекси Со (III) взагалі реагують по Диссоціативна механізму SN 1, і немає ніяких переконливих доводів, чому б іон OH - повинен обумовити процес SN 2. Встановлено, що іон гідроксилу - слабкий нуклеофільний реагент в реакціях з Pt (II), і тому здається безпричинною його незвичайна реакційна здатність по відношенню до Co (III). Реакції з сполуками кобальту (III) в неводних середовищах служать прекрасним доказом освіти пятікоордінаціонних проміжних сполук, що передбачаються механізмом S N 1 СВ.
Остаточним же доказом є той факт, що при відсутності в комплексі Co (III) зв'язків N - Н він повільно реагує з іонами ОН -. Це, звичайно, дає підставу вважати, що для швидкості реакції кислотно-основні властивості комплексу важливіше нуклеофільних властивостей ОН ". Ця реакція основного гідролізу аммін комплексів Со (III) є ілюстрацією того факту, що кінетичні дані часто можна інтерпретувати не тільки одним способом, і , щоб виключити той чи інший можливий механізм, потрібно здійснити досить тонкий експеримент.
В даний час досліджені реакції заміщення великого числа октаедричних з'єднань. Якщо розглянути їх механізми реакцій, то найчастіше зустрічається діссоціатівний процес. Цей результат не є несподіваним, так як шість лігандів залишають мало місця навколо центрального атома для приєднання до нього інших груп. Відомо лише небагато прикладів, коли доведено виникнення семікоордінаціонного проміжного з'єднання або виявлено вплив що вступає ліганду. Тому S N 2 механізм не можна повністю відкинути як можливого шляху реакцій заміщення в октаедричних комплексах.
Введення до роботи
Актуальність роботи. Комплекси порфиринов з металами в високих ступенях окислення можуть координувати підстави набагато більш ефективно, ніж комплекси М 2+ і утворювати змішані координаційні сполуки, у яких в першій координаційній сфері центрального атома металу поряд з макроциклічним лигандом знаходяться нециклічні ацідоліганди, а іноді і координовані молекули. Питання сумісності лігандів в таких комплексах надзвичайно важливі, тому що саме в вигляді змішаних комплексів порфіріни здійснюють свої біологічні функції. Крім того, реакції оборотного приєднання (перенесення) молекул підстав, які характеризуються помірно високими константами рівноваги, можуть успішно застосовуватися для поділу сумішей органічних ізомерів, для кількісного аналізу, для цілей екології та медицини. Тому дослідження кількісних характеристик і стехиометрии рівноваг додаткової координації на металлопорфиринов (МР) і заміщення простих лігандів в них корисно не тільки з точки зору теоретичних знань властивостей металлопорфиринов як сполук комплексних, але і для вирішення практичного завдання пошуку рецепторів і переносників малих молекул або іонів. До теперішнього часу систематичні дослідження для комплексів високозарядних іонів металів практично відсутні.
Мета роботи. Справжня робота присвячена вивченню реакцій змішаних порфирин-містять комплексів високозарядних катіонів металів Zr IV, Hf IV, Mo V і WV з біоактивними N-підставами: имидазолом (Im), пиридином (Py), піразини (Pyz), бензимідазоли (BzIm), характеристиці стійкості і оптичних властивостей молекулярних комплексів, обгрунтування східчастих механізмів реакцій.
Наукова новизна. Методами модифікованого спектрофотометрического титрування, хімічної кінетики, електронної та коливальної абсорбційної і 1 Н ЯМР спектроскопії вперше отримані термодинамічні характеристики та обґрунтовані стехиометрические механізми реакцій N-основ з металлопорфиринов зі змішаною координаційною сферою (Х) n-2 МТРР (Х - ацідоліганд Cl -, OH -, O 2-, ТРР - діаніон тетрафенілпорфіріна). Встановлено, що в переважній більшості випадків процеси утворення супрамолекули металлопорфирин - підстава протікають поступово і включає кілька оборотних і повільних необоротних елементарних реакцій координації молекул підстав і заміщення ацідолігандов. Для кожної з стадій східчастих реакцій визначені стехіометрії, константи рівноваг або швидкості, порядки повільних реакцій на підставі, спектрально охарактеризовано продукти (УФ, видимі спектри для проміжних продуктів і УФ, видимих \u200b\u200bі ІК - для кінцевих). Вперше отримані кореляційні рівняння, що дозволяють прогнозувати стійкість супрамолекулярних комплексів з іншими підставами. Рівняння використані в роботі для обговорення детального механізму заміщення ОН - в комплексах Mo і W на молекулу підстави. Описано властивості МР, що обумовлюють перспективу використання для детектування, поділу та кількісного аналізу біологічно активних підстав, такі як помірно висока стійкість супрамолекулярних комплексів, чіткий і швидкий оптичний відгук, низький поріг чутливості, секундне час звернення.
Практична значимість роботи. Кількісні результати і обгрунтування стехіометричних механізмів реакцій молекулярного комплексоутворення мають істотне значення для координаційної хімії макрогетероциклических лігандів. В дисертаційній роботі показано, що змішані порфирин-містять комплекси проявляють високу чутливість і селективність щодо біоактивних органічних підстав, протягом декількох секунд або хвилин дають оптичний відгук, придатний для практичного детектування реакцій з підставами - VOCs, компонентами ліків і харчових продуктів, завдяки чому рекомендовані для використання в якості компонентів сенсорів підстав в екології, харчової промисловості, медицині і сільському господарстві.
Апробація роботи. Результати роботи доповідалися і обговорювалися на:
IX Міжнародній конференції з проблем сольватації і комплексоутворення в розчинах, Плесо, 2004; XII Симпозіумі по міжмолекулярної взаємодії і конформації молекул, Пущино, 2004; XXV, XXVI і XXIX наукових сесіях Російського семінару з хімії порфіринів і їх аналогів, Іваново, 2004 і 2006; VI Школі-конференції молодих вчених країн СНД по хімії порфіринів і споріднених сполук, Санкт-Петербург, 2005; VIII науковій школі - конференції з органічної хімії, Казань, 2005; Всеросійській науковій конференції «Природні макроциклічні з'єднання і їх синтетичні аналоги», Сиктивкар, 2007; XVI Міжнародній конференції з хімічної термодинаміки в Росії, Суздаль, 2007; XXIII Міжнародної Чугаєвський конференції з координаційної хімії, Одеса, 2007; International Conference on Porphyrins and Phtalocyanines ISPP-5, 2008; 38th International Conference on Coordination Chemistry, Israel, 2008.
Умовно хімічні реакції комплексів поділяють на обмінні, окислювально-відновні, ізомеризації і координованих лігандів.
Первинна дисоціація комплексів на внутрішню і зовнішню сферу визначає перебіг реакцій обміну зовнішньосферних іонів:
X m + mNaY \u003d Y m + mNaX.
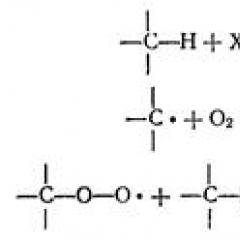
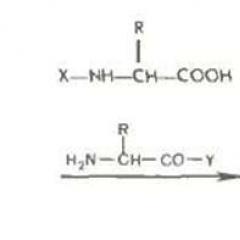
Компоненти внутрішньої сфери комплексів також можуть брати участь в обмінних процесах за участю як лігандів, так і комплексообразователя. Для характеристики реакцій заміщення лігандів або центрального іона металу використовують позначення та термінологію, запропоновану К. Інгольд для реакцій органічних сполук (Рис. 42), нуклеофильногоS N і електрофільногоS E заміщення:
Z + Y \u003d z + X S N
Z + M "\u003d z + M S E.
По механізму реакції заміщення поділяють (Рис. 43) на асоціативний (S N 1 та S E 1 ) І діссоціатівний (S N 2 і S E 2 ), Що розрізняються перехідним станом зі збільшеним і зменшеним координаційним числом.
Віднесення механізму реакції до асоціативного або Диссоціативна є важко експериментально досяжне завдання ідентифікації интермедиата зі зменшеним або збільшеним координаційним числом. У зв'язку з цим, часто про механізм реакції судять на підставі непрямих даних про вплив концентрації реагентів на швидкість реакції, зміні геометричної будови продукту реакції і ін.
Для характеристики швидкості реакцій заміщення лігандів комплексів, нобелівський лауреат 1983 М. Г. Таубе (Рис. 44) запропонував використовувати терміни «лабільний» і «інертний» в залежності від часу протікання реакції заміщення лігандів менш або більш 1 хвилини. Терміни лабільний або інертний є характеристикою кінетики реакцій заміщення лігандів і їх не слід плутати з термодинамічними характеристиками про стійкість або нестійкість комплексів.
Лабільність або інертність комплексів залежить від природи іона комплексоутворювача і лігандів. У згоді з теорією поля лігандів:
1. Октаедричні комплекси 3d перехідних металів з розподілом валентних (n -1) d електронів на сигма* (E g ) Розпушують МО лабільні.
4- (t 2g 6 e g 1) + H 2 O= 3- + CN -.
Причому, чим менше величина енергії стабілізації кристалічним полем комплексу, тим його лабільність більше.
2. Октаедричні комплекси 3d перехідних металів з вільними сигма* Розпушують e g орбиталями і рівномірним розподілом валентних (n -1) d електронів по t 2 g орбиталям (t 2 g 3, t 2 g 6) інертні.
[Co III (CN) 6] 3- (t 2 g 6 e g 0) + H 2 O \u003d
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O \u003d
3. Плоско-квадратні і октаедричні 4d і 5 d перехідних металів, які не мають електронів на сигма* Розпушуючих МО інертні.
2+ + H 2 O \u003d
2+ + H 2 O \u003d
Вплив природи лігандів на швидкість реакцій заміщення лігандів розглядається в рамках моделі «взаємного впливу лігандів». Окремим випадком моделі взаємовпливу лігандів є, сформульована в 1926 р І.І. Черняєва концепція транс-впливу (Рис. 45) - «Лабільність лиганда в комплексі залежить від природи транс-розташованого лиганда» - і запропонувати ряд транс-впливу лігандів:CO, CN -, C 2 H 4\u003e PR 3, H -\u003e CH 3 -, SC (NH 2) 2\u003e C 6 H 5 -, NO 2 -, I -, SCN -\u003e Br -, Cl -\u003e py , NH 3, OH -, H 2 O.
Концепція транс-впливу дозволила обгрунтувати емпіричні правила:
1. правило Пейроні - при дії аміаку або амінів на тетрахлопла-тінат (II ) Калію виходить завжди діхлодіамінплатіна цис-конфігурації:
2 - + 2NH 3 \u003d цис - + 2Cl -.
Оскільки реакція протікає в дві стадії і хлоридні ліганд має великий транс-впливом, то заміщення другого хлоридного лиганда на аміак відбувається з утворенням цис- [Pt (NH 3) 2 Cl 2]:
2 + NH 3 \u003d -
NH 3 \u003d цис -.
2. правило Іергенсена - при дії соляної кислоти на хлорид тетрамміна платини (II ) Або подібні з'єднання виходить діхлороді-аммінплатіна транс-конфігурації:
[Pt (NH 3) 4] 2+ + 2 HCl \u003d транс- [Pt (NH 3) 2 Cl 2] + 2 NH 4 Cl.
Відповідно до ряду транс-впливу лігандів, заміщення другий молекули аміаку на хлоридні ліганд призводить до утворення транс- [Pt (NH 3) 2 Cl 2].
3. Тіосечовина реакція Курнакова - різні продукти реакції тіомо-чевіни з геометричними ізомерами транс- [Pt (NH 3) 2 Cl 2] і цис- [Pt (NH 3) 2 Cl 2]:
цис - + 4Thio \u003d 2 + + 2Cl - + 2NH 3.
Різний характер продуктів реакції пов'язаний з високим транс-впливом тіосечовини. Першою стадією реакцій є заміщення тіосечовина хлоридних лігандів з утворенням транс- і цис [Pt (NH 3) 2 (Thio) 2] 2+:
транс- [Pt (NH 3) 2 Cl 2] + 2 Thio \u003d транс- [Pt (NH 3) 2 (Thio) 2] 2+
цис - + 2Thio \u003d цис - 2+.
У цис- [Pt (NH 3) 2 (Thio ) 2] 2+ дві молекули аміаку знаходяться в транс положенні до тіосечовина піддаються подальшому заміщенню, що і призводить до утворення 2+ :
цис - 2+ + 2Thio \u003d 2 + + 2NH 3.
У транс- [Pt (NH 3) 2 (Thio ) 2] 2+ дві молекули аміаку з малим транс-впливом розташовані в транс положенні один до одного і тому не заміщаються тіосечовина.
Закономірності транс-впливу були відкриті І.І. Черняєва при вивченні реакцій заміщення лігандів в плоско-квадратних комплексах платини (II ). Надалі було показано, що транс-вплив лігандів проявляється і в комплексах інших металів (Pt (IV), Pd (II), Co (III), Cr (III), Rh (III), Ir (III )) І іншого геометричного будови. Правда, ряди транс-впливу лігандів для різних металів не однакові.
Слеудует відзначити, що транс-вплив є кінетичним ефектом- чим більшим транс-впливом володіє даний ліганд, тим з більшою швидкістю заміщається іншою ліганд, що знаходиться по відношенню до нього в транс-положенні.
Поряд з кінетичним ефектом транс-впливу, в серединіXX століття А.А. Грінбергом і Ю.Н. Зозулиним встановлено залежність транс-впливу лігандаL від ліганда, що знаходиться в цис-положенні доL . Так, дослідження швидкості реакції заміщенняCl - аміаком в комплексах платини (II):
[PtCl 4] 2 + NH 3 \u003d [PtNH 3 Cl 3] - + Cl - K \u003d 0.42. 10 4 л / моль. з
[PtNH 3 Cl 3] - + NH 3 \u003d цис- [Pt (NH 3) 2 Cl 2] + Cl - K \u003d 1.14. 10 4 л / моль. з
транс- [Pt (NH 3) 2 Cl 2] + NH 3 \u003d [Pt (NH 3) 3 Cl] + + Cl - K \u003d 2.90. 10 4 л / моль. з
показало, що наявність в цис-положенні до заміщає хлорідному ліганду однієї і двох молекул аміаку призводить до послідовного збільшення швидкості реакції. Цей кінетичний ефект отримав назву цис-вплив. В даний час обидва кінетичних ефекту впливу природи лігандів на швидкість реакцій заміщення лігандів (транс- і цис-вплив) об'єднані в загальній концепції взаємовпливу лігандів.
Теоретичне обґрунтування ефекту взаємного впливу лігандів тісно пов'язане з розвитком уявлень про хімічний зв'язок в комплексних з'єднаннях. У 30-х рокахXX століття А.А. Грінбергом і Б.В. Некрасовим транс-вплив розглянуто в рамках поляризационной моделі:
1. Транс-вплив характерно для комплексів, центральний іон металу яких має велику поляризуемостью.
2. Транс-активність лігандів визначається величиною енергії взаємної поляризації лиганда і іона металу. Для даного іона металу транс-вплив ліганду визначається його поляризуемостью і відстанню від центрального іона.
Поляризаційна модель узгоджується з експериментальними даними для комплексів з простими аніонними лігандами, наприклад, галогенид-іонами.
У 1943 р А.А. Грінберг висунув припущення, що транс-активність лігандів пов'язана з їх відновні властивості. Зсув електронної щільності від транс-активного ліганду до металу зменшує ефективний заряд іона металу, що призводить до ослаблення хімічного зв'язку з транс-розташованим лигандом.
Розвиток уявлень про транс-вплив пов'язано з великою транс-активністю лігандів на основі ненасичених органічних молекул, подібних етилену в [Pt (C 2 H 4) Cl 3 ] -. На думку Чатта і Оргела (Рис. 46), це пов'язано зпідатівная взаємодією таких лігандів з металом і асоціативним механізмом реакцій заміщення транс-розташованих лігандів. Координація до іона металу атакуючого лигандаZ призводить до утворення пятікоордінаціонного тригонально-біпірамі-дального интермедиата з наступним швидким отщеплением минає лиганда Х. Утворенню такого интермедиата сприяєпідатівная ліганд-метал взаємо-дія лигандаY , Яка зменшує електронну щільність металу і знижує енергію активації перехідного стану з послідуючим швидким заміщенням лиганда Х.
Поряд з p акцепторними (C 2 H 4, CN -, CO ...) лігандами, що утворюють датівная ліганд-метал хімічний зв'язок, високим транс-впливом володіють іs донорні ліганди:H -, CH 3 -, C 2 H 5 - ... Транс-вплив таких лігандів визначається донорно-акцепторні взаємодією лиганда Х з металом, що знижує його ЕЛЕКТОН щільність і послабляє зв'язок металу з йдуть лигандомY.
Таким чином, положення лігандів в ряду транс-активності визначаться спільною дією сигма- донорних і пі властивостей лігандів - сигма-донорні і піакцепторні властивості лиганда підсилюють його транс-вплив, тоді якпі донорні - послаблюють. Яка з цих складових ліганд-метал взаємодії переважає в транс-вплив судять на підставі квантово-хімічних розрахунків електронної будови перехідного стану реакції.