Tipos de enlaces químicos en compuestos orgánicos. Estructura de compuestos orgánicos y efectos electrónicos ¿Qué tipos de enlaces ocurren entre átomos de carbono?
Enlace químico - estas son las fuerzas de interacción entre átomos o grupos de átomos, que conducen a la formación de moléculas, iones, etc. Por su naturaleza, un enlace químico son fuerzas electrostáticas. Ellos desempeñan el papel principal en la formación de enlaces químicos entre átomos. electrones de valencia, es decir, electrones del nivel exterior, menos unidos al núcleo. Del curso de química general conoces la existencia de enlaces covalentes e iónicos.
Enlace iónico Es un enlace químico basado en la atracción electrostática de iones. Ocurre cuando hay una gran diferencia en las electronegatividades de los átomos unidos. En los compuestos orgánicos, los enlaces iónicos son bastante raros, por ejemplo, en las sales de ácidos carboxílicos:
Para los compuestos orgánicos, los enlaces covalentes son los más característicos.
Enlace covalente Es un enlace químico formado al compartir electrones entre dos o más núcleos. Hay dos formas de compartir un par de electrones: intercambio y donante-aceptor.
Por intercambio En el mecanismo de formación del enlace interviene un electrón de cada átomo:
norte · +cl · → h : CL
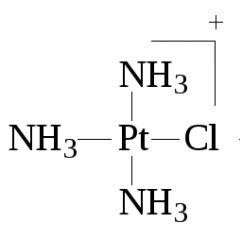
Por donante-aceptador Según el mecanismo, se forma un enlace covalente combinando un par de electrones de un átomo y un orbital libre de otro. Un ejemplo es la interacción de una molécula de amina con un protón para formar un catión de metilamonio:

Clasificación de enlaces covalentes según los métodos de superposición de orbitales atómicos.
Dependiendo del método de superposición de orbitales atómicos, se distinguen los enlaces σ y π. enlaces σ se forman como resultado de la superposición de orbitales a lo largo de una línea que conecta los centros de los núcleos de dos átomos:

π -comunicaciones se forman como resultado de la lateral pag-pag-superposición de orbitales, como resultado de lo cual se forman dos regiones de mayor densidad electrónica:

Tipos de escisión de enlaces covalentes
La ruptura de un enlace covalente puede ocurrir por homolítico o heterolítico mecanismos.
Reacciones homolíticas- reacciones en las que la escisión del enlace se produce de forma simétrica, de modo que cada uno de los fragmentos resultantes pierde un electrón:
Homólisis del griego homosexuales- idéntico,lisis- brecha.
Durante las reacciones homolíticas, se forman radicales libres como intermediarios: partículas que contienen un electrón desapareado, por ejemplo:

Radical- un átomo o grupo de átomos que tiene un electrón desapareado.
Reacciones heterolíticas- reacciones en las que la escisión del enlace se produce de forma asimétrica, de modo que un par de electrones del enlace permanece con uno de los fragmentos resultantes:
Heterólisis - Se trata de una ruptura asimétrica de un enlace covalente, como resultado de lo cual se forman partículas de diferente naturaleza: un catión y un anión.
Si las cargas de tales partículas están en el átomo de carbono, se denominan carbocationes y carbaniones, por ejemplo:
El par de electrones permanece con el átomo más electronegativo.
Los átomos de carbono en los compuestos orgánicos son tetravalentes y pueden estar en tres estados diferentes de hibridación (Tabla 22.1).
Tabla 22.1
Hibridación de átomos de carbono.
En la formación de compuestos orgánicos, la capacidad de los átomos de carbono para conectarse entre sí juega un papel especial para formar cadenas, cadenas ramificadas y ciclos. Los enlaces C-C son significativamente más fuertes que los enlaces entre otros átomos idénticos, lo que explica la estabilidad de las estructuras de carbono:
Los átomos de carbono interconectados se denominan esqueleto de carbono de la molécula.
La configuración espacial de las estructuras de carbono está determinada por la hibridación de los átomos de carbono. Cuando se produce la hibridación ^ de todos los átomos, se forman cadenas en zigzag. Cuando se forma un ciclo, los átomos de carbono se desvían de su disposición plana. En los diagramas se presentan ejemplos:

Si la cadena en zigzag contiene átomos de carbono en el estado 5p 2-hibridación, luego aparecen áreas con una disposición plana de átomos. En presencia de átomos de carbono en estado de hibridación sp, aparecen secciones lineales de la cadena.
A los átomos de carbono terminales, llamados primarios, les quedan tres valencias para la adición de otros átomos y grupos atómicos: H, OH, Cl, NH 2 etc. Los átomos no terminales unidos a dos átomos de carbono se llamansecundario. Se les añaden dos átomos más. No hay átomos de carbono primarios en el ciclo del carbono. Si hay una rama en la cadena, aparece terciarioátomo de carbono. Sólo le queda una valencia para la adición de otros átomos. Finalmente, en una cadena de átomos de carbono pueden surgir dos ramas de un átomo. Un átomo así se llama cuaternario; está unido sólo a átomos de carbono:

En una molécula con un átomo de carbono, este átomo se llamaaislado.
Dependiendo del tipo de hibridación, el carbono forma enlaces simples (a) y múltiples: dobles (a + l) y triples (a + 2l). Los enlaces L pueden ocurrir no sólo entre átomos de carbono, sino también con átomos unidos al carbono. Un tipo especial de enlace químico es conjugado un doble enlace que se produce cuando hay más de dos átomos en la cadena de carbono en el estado de hibridación 5p 2 (ver Fig. 6.26). De la figura se deduce que los electrones desapareados en orbitales p no híbridos pueden formar enlaces entre cualquier átomo de carbono adyacente, y esto conduce a la deslocalización del enlace p a lo largo de toda la cadena de átomos de carbono $p 2. En reacciones químicas, la presencia de un enlace n puede aparecer entre los átomos 1 Y 2, entonces entre átomos 2 y 3, etc
Compuestos en los que existen múltiples enlaces y, en consecuencia,sp 2 -y los átomos de carbono sp se llamaninsaturado. Si se trata de hidrocarburos, entonces el contenido de hidrógeno que contienen es inferior al máximo posible. Estos compuestos presentan una mayor reactividad, ya que la nube de electrones del enlace n se concentra en dos lados de los átomos de C y, por lo tanto, se mueve con bastante facilidad de uno de los dos átomos al otro bajo la influencia de moléculas reactivas.
Las clases más importantes de compuestos orgánicos, además de carbono e hidrógeno, pueden contener oxígeno, nitrógeno, halógenos y azufre. De estos elementos, el hidrógeno tiene una electronegatividad menor que el carbono, mientras que los demás tienen una electronegatividad mayor. Los enlaces covalentes del carbono con ellos son más o menos polares y los átomos tienen cargas eléctricas parciales ± 8. :
La polaridad de los enlaces afecta la reactividad de los compuestos.
Los átomos de carbono tienen la capacidad inherente de formar enlaces estables con varios átomos diferentes a la vez. Esto conduce a muchas combinaciones que rara vez se encuentran en la química inorgánica. Comparemos el carbono y el aluminio. Este último forma cuatro haluros (AIF3, A1C1 3, A1Br 3, AP 3) y el hidruro A1H 3. El carbono puede producir muchas moléculas con la presencia simultánea de diferentes halógenos, así como de hidrógeno y otros átomos de carbono: CH 3 C1, CH 2 C1 2, CH 2 ClBr, CHFClBr, CH 3 CHC1Br, etc. Esta es también una de las razones de la diversidad de compuestos orgánicos.
En química orgánica, las fórmulas estructurales de las moléculas se utilizan ampliamente. Las fórmulas estructurales se pueden representar con distintos grados de especificación y aproximación a la estructura real. Consideremos varios tipos de fórmulas que representan la molécula de propano.

En las moléculas poliatómicas de compuestos orgánicos, es posible la rotación continua de grupos atómicos alrededor de ejes que coinciden con la dirección de los enlaces simples C-C (para abreviar, dicen: rotación alrededor de un enlace C-C). En el caso más simple del etano C 2 H 6, dos grupos CH 3 giran casi libremente entre sí, como dos ruedas montadas libremente sobre un eje:

Las moléculas con cadenas de carbono de cuatro o más átomos se doblan como una oruga durante la rotación interna, creando todo tipo de conformación(posiciones mutuas) de átomos tanto en volumen como en el plano. Una cadena de cinco átomos de carbono tiene tres conformaciones planas:

Entre las tres conformaciones planas surgen conformaciones de transición tridimensionales. La conformación de herradura es favorable para la formación de una estructura cíclica.
Las moléculas orgánicas tienen partes individuales (fragmentos) que difieren en composición. Unidas a la cadena o anillo de carbono principal pueden haber ramas compuestas de carbono e hidrógeno, llamadas radicales hidrocarbonados. Los radicales más simples que ya se encuentran en el texto son metilo-CH3 y etil-C2H5. El cuarto enlace del radical está representado por un guión o punto (CH 3). El resto de elementos, excepto el carbono y el hidrógeno, en las moléculas de los compuestos orgánicos se consideran grupos funcionales. Este término se debe al hecho de que las reacciones químicas ocurren predominantemente con la participación de estos grupos. En los compuestos orgánicos CH 3 COOP y C 2 H 5 NH 2 ya mencionados en el texto, existen grupos funcionales -COOH (carboxilo) con propiedades ácidas y -NH 2 (grupo amino) con propiedades básicas.
La reactividad de los compuestos orgánicos está determinada por el tipo de enlaces químicos y la influencia mutua de los átomos en la molécula. Estos factores, a su vez, están determinados por la interacción de los orbitales atómicos (AO).
La parte del espacio en la que la probabilidad de encontrar un electrón es máxima se llama orbital atómico.
En química orgánica, el concepto de orbitales híbridos del átomo de carbono y otros elementos se utiliza ampliamente. El concepto de hibridación orbital es necesario en los casos en que el número de electrones desapareados en el estado fundamental de un átomo es menor que el número de enlaces que forma. Se postula que diferentes orbitales atómicos de energía similar interactúan entre sí para formar orbitales híbridos de la misma energía. Los orbitales híbridos, debido a su gran superposición, proporcionan un vínculo más fuerte que los orbitales no hibridados. Dependiendo del número de orbitales que hayan entrado en hibridación, un átomo de carbono puede encontrarse en tres tipos de hibridación:
1. Primer estado de valencia, hibridación sp3 (tetraédrica)
Como resultado de una combinación lineal (mezcla) de cuatro AO de un átomo de carbono excitado (uno 2s y tres 2p), surgen cuatro orbitales híbridos sp 3 equivalentes, dirigidos en el espacio a los vértices del tetraedro en ángulos de 109,5?. La forma del orbital híbrido es un ocho tridimensional, una de cuyas palas es mucho más grande que la otra.
2. Segundo estado de valencia, sp2 - hibridación (triangular)
Surge como resultado del desplazamiento de un orbital atómico 2s y dos 2p. Los tres orbitales híbridos sp 2 resultantes están ubicados en el mismo plano en un ángulo de 120°. entre sí, y p no hibridado - AO - en un plano perpendicular a él. En el estado de hibridación sp 2, el átomo de carbono se ubica en moléculas de alqueno, grupos carbonilo y carboxilo.
3. Tercer estado de valencia, sp - hibridación
Surge como resultado de mezclar un 2s y un 2p AO. Los dos orbitales híbridos sp resultantes se ubican linealmente y los dos orbitales p se ubican en dos planos mutuamente perpendiculares. El átomo de carbono en estado híbrido sp se encuentra en moléculas de alquinos y nitrilos.
Hay tres tipos posibles de enlaces que conectan átomos individuales de elementos en un compuesto: electrostáticos, covalentes y metálicos.
Los enlaces electrostáticos incluyen principalmente enlaces iónicos, que ocurren cuando un átomo transfiere uno o varios electrones a otro y los iones resultantes se atraen entre sí.
Los compuestos orgánicos se caracterizan principalmente por enlaces covalentes. Un enlace covalente es un enlace químico formado al compartir los electrones de los átomos unidos.
Para la descripción de la mecánica cuántica de los enlaces covalentes, se utilizan dos enfoques principales: el método del enlace de valencia (VB) y el método de los orbitales moleculares (MO). molécula covalente química
El método BC se basa en la idea del emparejamiento de electrones que se produce cuando los orbitales atómicos se superponen. Un par generalizado de electrones con espines opuestos forma una región con mayor densidad electrónica entre los núcleos de dos átomos, atrayendo ambos núcleos. Se produce un enlace covalente de dos electrones. Según el método BC, los orbitales atómicos conservan su individualidad. Por lo tanto, ambos electrones emparejados permanecen en los orbitales atómicos de los átomos enlazados, es decir, están localizados entre los núcleos.
En la etapa inicial de desarrollo de la teoría electrónica (Lewis), se propuso la idea de un enlace covalente como un par de electrones socializados. Para explicar las propiedades de diferentes átomos para formar un cierto número de enlaces covalentes, se formuló la regla del octeto. Según él, durante la formación de moléculas a partir de átomos del segundo período del sistema periódico, D.I. Mendeleev, la capa exterior se llena con la formación de un sistema estable de 8 electrones (la capa de un gas inerte). Cuatro pares de electrones pueden formar enlaces covalentes o existir como pares libres.
Al pasar a los elementos del tercer período y posteriores, la regla del octeto pierde su fuerza, ya que aparecen orbitales d que tienen bastante baja energía. Por tanto, los átomos de períodos superiores pueden formar más de cuatro enlaces covalentes. Las suposiciones de Lewis sobre un enlace químico como un par social de electrones eran de naturaleza puramente cualitativa.
Según el método MO, los electrones de enlace no se localizan en los AO de ciertos átomos, sino en los MO, que son una combinación lineal de orbitales atómicos (LCAO) de todos los átomos que forman la molécula. El número de MO formados es igual al número de AO superpuestos. Un orbital molecular suele ser un orbital multicéntrico y los electrones que lo llenan están deslocalizados. El llenado de electrones de los OM se produce según el principio de Pauli. Un MO obtenido sumando las funciones de onda de los orbitales atómicos y que tiene una energía menor que los AO que lo forman se llama enlace. La presencia de electrones en este orbital reduce la energía total de la molécula y asegura el enlace de los átomos. Un MO de alta energía obtenido restando funciones de onda se llama antienlazante (antienlazante). Para un orbital antienlazante, la probabilidad de encontrar electrones entre los núcleos es cero. Este orbital está vacío.
Además de los OM vinculantes y antienlazantes, también existen OM no vinculantes, denominados n-MO. Se forman con la participación de AO que llevan un par de electrones que no participan en la formación del enlace. Estos electrones también se denominan pares libres libres o electrones n (se encuentran en átomos de nitrógeno, oxígeno y halógeno).
Hay dos tipos de enlaces covalentes: enlaces y- (sigma) y p- (pi).
Un enlace y es un enlace formado por la superposición axial de cualquier orbital atómico (s-, p- o sp- híbrido) con la superposición máxima ubicada en la línea recta que conecta los núcleos de los átomos enlazados.
Según el método MO, la superposición y conduce a la aparición de dos MO: un y-MO enlazante y un antienlazante y*-MO.
Un enlace p es un enlace formado por superposición lateral (lateral) de un p-AO, con la densidad electrónica máxima ubicada a ambos lados de la línea recta que conecta los núcleos de los átomos. Según el método MO, como resultado de una combinación lineal de dos p-AO, se forma un p-MO vinculante y un p*-MO antienlazante.
Un doble enlace es una combinación de enlaces y y p, y un triple enlace es un enlace y y dos enlaces p.
Las principales características de un enlace covalente son energía, longitud, polaridad, polarizabilidad, direccionalidad y saturabilidad.
La energía de enlace es la cantidad de energía liberada durante la formación de un enlace determinado o necesaria para separar dos átomos unidos. Cuanto mayor es la energía, más fuerte es la conexión.
La longitud del enlace es la distancia entre los centros de los átomos enlazados. Un doble enlace es más corto que un enlace simple y un triple enlace es más corto que un doble enlace.
La polaridad del enlace está determinada por la distribución desigual (polarización) de la densidad electrónica, cuya razón es la diferencia en la electronegatividad de los átomos enlazados. A medida que aumenta la diferencia de electronegatividad entre los átomos unidos, aumenta la polaridad del enlace. Por tanto, se puede imaginar la transición de un enlace covalente apolar a través de un enlace polar a uno iónico. Los enlaces covalentes polares son propensos a la escisión heterolítica.
La polarizabilidad del enlace es una medida del desplazamiento de los electrones del enlace bajo la influencia de un campo eléctrico externo, incluido el de otra partícula que reacciona. La polarizabilidad está determinada por la movilidad de los electrones. Los electrones son más móviles cuanto más alejados están del núcleo.
En los organógenos (carbono, nitrógeno, oxígeno, azufre, halógenos) en la formación de enlaces Y, la participación de orbitales híbridos es energéticamente más favorable, proporcionando una superposición más eficiente.
La superposición de dos AO de un electrón no es la única forma de formar un enlace covalente. Un enlace covalente puede formarse mediante la interacción de un orbital de dos electrones lleno (donante) con un orbital vacante (aceptor). Los donantes son compuestos que contienen orbitales con un par de electrones libres o p - MO. Un enlace covalente formado por un par de electrones de un átomo se llama coordinación o donante-aceptor.
Un tipo de vínculo donante-aceptor es un vínculo semipolar. Por ejemplo, en un grupo nitro, simultáneamente con la formación de un enlace covalente debido a un par solitario de electrones de nitrógeno, aparecen cargas de signo opuesto en los átomos unidos. Debido a la atracción electrostática, se produce un enlace iónico entre ellos. La combinación resultante de enlaces covalentes e iónicos se denomina enlace semipolar. El vínculo donante-aceptor es característico de compuestos complejos. Dependiendo del tipo de donante, se distinguen los complejos n o p.
Un átomo de hidrógeno unido a un átomo fuertemente electronegativo (N, O, F) tiene deficiencia de electrones y es capaz de interactuar con el par solitario de electrones de otro átomo fuertemente electronegativo, ubicado en la misma molécula o en otra. Como resultado, se produce un enlace de hidrógeno. Gráficamente, un enlace de hidrógeno se indica con tres puntos.
La energía del enlace de hidrógeno es baja (10-40 kJ/mol) y está determinada principalmente por interacción electrostática.
Los enlaces de hidrógeno intermoleculares provocan la asociación de compuestos orgánicos, lo que conduce a un aumento del punto de ebullición de los alcoholes (t? punto de ebullición C 2 H 5 OH = 78,3? C; t? punto de ebullición CH 3 OCH 3 = -24? C) , ácidos carboxílicos y muchas otras propiedades físicas (punto de fusión, viscosidad) y químicas (ácido-base).
También pueden aparecer enlaces de hidrógeno intramoleculares, por ejemplo en el ácido salicílico, lo que provoca un aumento de su acidez.
La molécula de etileno es plana, el ángulo entre el enlace H - C - H es de 120°C. Para romper el doble enlace p - p - y hacer posible rotar alrededor del enlace sp 2 - y restante, es necesario gastar una cantidad significativa de energía; Por tanto, la rotación alrededor del doble enlace es difícil y es posible la existencia de isómeros cis y trans.
Un enlace covalente es apolar sólo cuando une átomos que son idénticos o similares en electronegatividad. Cuando los electrones se unen, la densidad del enlace covalente se desplaza hacia el átomo más electronegativo. Esta relación está polarizada. La polarización no se limita a un solo enlace y, sino que se extiende a lo largo de la cadena y provoca la aparición de cargas parciales (y) en los átomos.
Por tanto, el sustituyente “X” provoca la polarización no sólo de su enlace y con el átomo de carbono, sino que también transmite su influencia (exhibe un efecto) a los enlaces y vecinos. Este tipo de influencia electrónica se llama inductiva y se denota j.
El efecto inductivo es la transferencia de la influencia electrónica de un sustituyente a lo largo de una cadena de enlaces Y.
La dirección del efecto inductivo de un sustituyente suele evaluarse cualitativamente comparándolo con el átomo de hidrógeno, cuyo efecto inductivo se considera 0 (el enlace C-H se considera prácticamente no polar).
El sustituyente X, que atrae la densidad electrónica del enlace y con más fuerza que el átomo de hidrógeno, presenta un efecto inductivo negativo -I. Si, en comparación con el átomo de hidrógeno, el sustituyente Y aumenta la densidad electrónica en la cadena, entonces presenta un efecto inductivo positivo, +I. Gráficamente, el efecto inductivo se representa mediante una flecha que coincide con la posición de la línea de valencia y apunta hacia el átomo más electronegativo. El efecto +I lo ejercen grupos alquilo, átomos metálicos y aniones. La mayoría de los sustituyentes tienen un efecto -I. Y cuanto mayor, mayor será la electronegatividad del átomo que forma un enlace covalente con el átomo de carbono. Los grupos insaturados (todos sin excepción) tienen un efecto -I, cuya magnitud aumenta al aumentar los enlaces múltiples.
El efecto inductivo, debido a la débil polarización del enlace Y, decae después de tres o cuatro enlaces Y en el circuito. Su efecto es más fuerte en los dos primeros átomos de carbono más cercanos al sustituyente.
Si una molécula contiene enlaces dobles o triples conjugados, se produce el efecto de conjugación (o efecto mesomérico; efecto M).
El efecto de conjugación es la transferencia de la influencia electrónica de un sustituyente a través de un sistema de enlaces p. Los sustituyentes que aumentan la densidad electrónica en un sistema conjugado exhiben un efecto de conjugación positivo, el efecto +M. El efecto +M lo exhiben sustituyentes que contienen átomos con un par de electrones solitarios o una carga negativa completa. Los sustituyentes que retiran densidad electrónica del sistema conjugado exhiben un efecto de conjugación negativo (mesomérico), el efecto -M. Estos incluyen grupos insaturados y átomos cargados positivamente. La redistribución (desplazamiento) de la nube total de electrones bajo la influencia del efecto M se representa gráficamente mediante flechas curvas, cuyo comienzo muestra qué electrones p o p se desplazan y el final, el enlace o átomo al que se desplazan. estan desplazados
El efecto mesomérico (efecto de conjugación) se transmite a través de un sistema de enlaces conjugados con extensiones significativamente mayores.
Un enlace covalente puede polarizarse y deslocalizarse.
Enlace covalente localizado: los electrones de enlace se comparten entre los dos núcleos de los átomos que se unen.
Un enlace deslocalizado es un enlace covalente cuyo orbital molecular abarca más de 2 átomos. Casi siempre se trata de conexiones p.
La conjugación (mesomería, mesos - promedio) es el fenómeno de alineación de enlaces y cargas en una molécula (partícula) real en comparación con una estructura real, pero inexistente.
Teoría de la resonancia: una molécula o partícula real se describe mediante un conjunto de estructuras de resonancia específicas, que se diferencian entre sí sólo en la distribución de la densidad de electrones.
La química orgánica tiene una importancia educativa y económica excepcionalmente importante.
Las sustancias orgánicas naturales y sus transformaciones subyacen a los fenómenos de la Vida. Por lo tanto, la química orgánica es la base química de la química biológica y la biología molecular, ciencias que estudian los procesos que ocurren en las células de los organismos a nivel molecular. La investigación en esta área nos permite comprender mejor la esencia de los fenómenos naturales vivos.
La industria produce muchos compuestos orgánicos sintéticos para su uso en diversos sectores de la actividad humana: productos derivados del petróleo, combustible para diversos motores, materiales poliméricos (cauchos, plásticos, fibras, películas, barnices, adhesivos, etc.), tensioactivos, colorantes, productos fitosanitarios, medicamentos, sustancias aromatizantes y de perfumería, etc. Sin el conocimiento de los fundamentos de la química orgánica, el hombre moderno no puede utilizar de manera competente todos estos productos de la civilización.
Las materias primas para los compuestos orgánicos son el petróleo y el gas natural, el carbón y el lignito, el esquisto bituminoso, la turba y los productos agrícolas y forestales.
El criterio para dividir los compuestos en orgánicos e inorgánicos es su composición elemental.
Los compuestos orgánicos incluyen sustancias químicas que contienen carbono, por ejemplo:
CH 3 -CN, CH 3 -CH 2 -OH, CS 2, CH 3 COOH, CH 3 -NH 2, CH 3 -NO 2, CH 3 -COOC 2 H 5 .
Los compuestos orgánicos se diferencian de los inorgánicos en una serie de rasgos característicos:
· casi todas las sustancias orgánicas se queman o se destruyen fácilmente cuando se calientan con agentes oxidantes, liberando CO 2 (basándose en esta característica, es posible determinar si la sustancia en estudio es un compuesto orgánico);
· en las moléculas de compuestos orgánicos, el carbono se puede combinar con casi cualquier elemento de la tabla periódica;
Las moléculas orgánicas pueden contener una secuencia de átomos de carbono conectados en cadenas (abiertas o cerradas);
· las moléculas de la mayoría de los compuestos orgánicos no se disocian en iones suficientemente estables;
· las reacciones de los compuestos orgánicos avanzan mucho más lentamente y en la mayoría de los casos no llegan a completarse;
Fenómeno generalizado entre los compuestos orgánicos. isomería ;
· las sustancias orgánicas tienen temperaturas de transición de fase más bajas (pb, mp).
Hay muchos más compuestos orgánicos que inorgánicos.
Principios básicos de la teoría de la estructura química de Butlerov.
1. Los átomos de las moléculas están conectados entre sí en una secuencia determinada según sus valencias. La secuencia de enlaces interatómicos en una molécula se llama Estructura química y se refleja en una fórmula estructural (fórmula de estructura).
2. La estructura química se puede determinar mediante métodos químicos. (Actualmente también se utilizan métodos físicos modernos).
3. Las propiedades de las sustancias dependen de su estructura química.
4. Según las propiedades de una sustancia determinada, se puede determinar la estructura de su molécula y, según la estructura de la molécula, se pueden predecir sus propiedades.
5. Los átomos y grupos de átomos de una molécula se influyen mutuamente entre sí.
Desde el momento en que los investigadores aprendieron a determinar la composición elemental de los compuestos, se observó que a menudo compuestos con la misma composición elemental tienen propiedades químicas y físicas completamente diferentes. La identificación de las razones de este comportamiento estimuló la creación de una teoría de la estructura de los compuestos orgánicos. Esta teoría fue formulada por primera vez por A.M. Butlerov.
La teoría de Butlerov fue la base científica de la química orgánica y contribuyó a su rápido desarrollo. Con base en las disposiciones de la teoría, A.M. Butlerov dio una explicación del fenómeno. isomería , predijo la existencia de varios isómeros y obtuvo algunos de ellos por primera vez.
Estructura del átomo de carbono.
Es obvio que todas las reacciones en las que entran moléculas orgánicas están asociadas con la estructura del átomo de carbono de una molécula en particular y la permutación de sus orbitales de valencia externos durante el proceso de transformación.
En estado no excitado, un átomo de carbono tiene 2 electrones en el orbital s del segundo subnivel (orbitales 2s), así como 2 electrones en dos (de un total de 3) orbitales p del segundo subnivel (2p x y 2p orbitales y):
Así, el carbono tiene 4 electrones en sus orbitales externos que son capaces de formar enlaces. Según la teoría, las formas de los orbitales s y p describen la probabilidad de encontrar un electrón en relación con el núcleo de un átomo. Los orbitales s y p no hibridados tienen la forma de una esfera y una “pesa” uniforme y están ubicados en el espacio de acuerdo con el siguiente diagrama:
Cuando los compuestos se forman a partir de carbono atómico (o como parte de compuestos de carbono), se produce un cambio en la forma y ubicación en el espacio en relación con el núcleo del átomo de los orbitales externos del carbono, llamado hibridación . La hibridación se puede representar esquemáticamente de la siguiente manera:

de cuatro sin hibridar orbitales atómicos s y p que tienen diferentes formas, como resultado hibridación sp 3 (lo que significa cambiar uno s- y tres R-orbitales) se obtienen cuatro iguales por energía y forma hibridado mi Orbitales moleculares con forma de pesas distorsionadas.
Para garantizar un obstáculo estérico mínimo y una repulsión mutua, estos cuatro orbitales equivalentes están ubicados en el espacio a distancias iguales entre sí, dirigidos hacia los vértices del tetraedro (el núcleo del átomo de carbono está ubicado en el centro del tetraedro), y el Los ángulos espaciales entre los orbitales son de aproximadamente 109° 28':

En este estado se pueden formar sin obstáculos cuatro enlaces mediante la superposición de orbitales. En tal hibridación, el carbono está presente (exclusivamente) en la composición de alcanos, cicloalcanos y alcoholes.
Así, por ejemplo, una molécula de etano tiene el siguiente aspecto (las esferas amarillas muestran átomos de hidrógeno, más precisamente, sus orbitales s):

El enlace entre los átomos de carbono se forma mediante la superposición de orbitales hibridados. Este tipo de conexiones se denominan s- bonos (bonos sigma). Alrededor s- conexión, es posible la rotación de fragmentos moleculares.
La hibridación es un cambio en la forma y ubicación en el espacio con respecto al núcleo de un átomo de sus orbitales electrónicos externos, al formar enlaces con otros átomos. Otra definición: hibridación – mezcla orbital , como resultado de lo cual se alinean en forma y energía.
Un átomo de carbono que tiene un enlace múltiple (alquenos -C=C-, compuestos carbonílicos >C =O, ácidos carboxílicos y sus derivados -COOH, -COOR, etc.) tiene diferente hibridación (sp 2), respectivamente, forma y Ubicación en el espacio de los orbitales exteriores:

En el estado de hibridación sp 2 en el carbono, solo hay 3 orbitales hibridados (derivados de un orbital s y dos p), que están ubicados en el mismo plano en un ángulo de 120 ° entre ellos, y el cuarto ( sin hibridar) el orbital p se encuentra perpendicular a este plano. Como resultado se forma un doble enlace. superposición de orbitales no hibridados entre átomos de carbono vecinos (o entre carbono y oxígeno), la figura muestra una molécula de etileno (eteno):

Los enlaces formados por la superposición de orbitales p no hibridados se denominan pag- conexiones. Por tanto, un enlace múltiple (doble) en una molécula de eteno está formado por un enlace sigma y un enlace pi.
Rotación de fragmentos moleculares alrededor. pag- el enlace es, por razones obvias, imposible a temperatura normal (se requiere energía adicional para romper los orbitales p superpuestos), esto determina la presencia de isómeros espaciales (geométricos) en los alquenos, sujeto a algunas condiciones adicionales, que se discutirán a continuación.
en la imagen sin hibridar Los orbitales p están ubicados a distancia, separados artificialmente para una mejor percepción, aunque en realidad se "tocan" entre sí, superponiéndose arriba y abajo, pero formando solo un enlace adicional.
El carbono en el triple enlace (en alquinos y nitrilos) está en el estado hibridación sp :

Un par de orbitales hibridados están situados en línea, en un ángulo de 180° y en direcciones opuestas. Los dos orbitales p no hibridados, según el principio de repulsión mínima y para minimizar el impedimento estérico, se encuentran perpendiculares a esta línea y formando un ángulo de 90° entre sí. El triple enlace de los alquinos se forma como resultado de la superposición de orbitales hibridados (uno s- enlace) y dos orbitales p no hibridados de átomos de carbono vecinos (dos enlaces p). Por ejemplo, así es como se ve el modelo de la molécula de acetileno (etino):

Como resultado de las reacciones, el carbono puede cambiar y mantener su estado de hibridación.
Tipos de enlaces en moléculas de sustancias orgánicas.
El tipo de enlace predominante en las moléculas de compuestos orgánicos es el enlace covalente. Un par de electrones de enlace se comparte aproximadamente por igual entre los átomos cuando se caracterizan los enlaces C-C o C-H. Esto es causado por afinidades electrónicas aproximadamente iguales ( electronegatividad) Átomos de C y H.
En el caso de que el carbono esté unido a un átomo más electronegativo (halógenos, oxígeno, nitrógeno), el enlace puede polarizarse significativamente y se pueden formar cargas parciales positivas (en el carbono) y negativas (en halógenos, oxígeno, nitrógeno) en los átomos. . Sin embargo, el grado de ionicidad de dicho enlace es mínimo.
Debido a la no polaridad de los enlaces C-C y C-H, el método preferido para romperlos es homolítico, cuando un par de electrones se comparte por igual entre los átomos. Cuando un enlace se rompe de esta manera, se forman partículas descargadas pero altamente reactivas con electrones desapareados, llamadas radicales. Las reacciones con formación intermedia de radicales son muy típicas de los alcanos. Tales transformaciones se inician introduciendo desde el exterior energía suficiente para romper el enlace (calentamiento) o compuestos que inician la formación de radicales con calentamiento débil o irradiación ultravioleta (peróxidos, halógenos, compuestos azoicos, iniciadores químicos que generan radicales como resultado de una reacción química). En general, los alcanos y cicloalcanos con anillos no deformados son químicamente relativamente inertes.
Por el contrario, los alquenos son mucho más reactivo. La razón de esto es la insaturación (enlace múltiple) y la disponibilidad de la densidad electrónica suelta de los orbitales p superpuestos. pag- enlaces para la acción de reactivos electrófilos (compuestos con orbitales externos vacíos o deficiente en electrones conexiones). Como resultado, el enlace múltiple desaparece y se unen los electrófilos. Las reacciones proceden con la formación de intermediarios cargados positivamente (carbocationes) o radicales.
Otro grupo de reacciones está asociado con la polarización del enlace carbono-halógeno, oxígeno o nitrógeno. Estas reacciones tienen un mecanismo más complejo y dependen de la estructura del sustrato, reactivo y condiciones de reacción (disolvente, catalizador, etc.).
También hay tipos de reacciones más complejas ( cicloadición o reacción de Diels-Alder), cuyo mecanismo detallado aún no se ha estudiado en todas sus complejidades.
Tipos de reacciones en química orgánica.
Por lo tanto, es posible distinguir solo unos pocos tipos de reacciones en las que entran compuestos orgánicos:
1) reacciones sustitución cuando un átomo (o grupo de átomos) es reemplazado por otro átomo (o grupo de átomos). El esqueleto de carbono permanece sin cambios. Las reacciones proceden de una ruptura preliminar del vínculo seguida de la formación de uno nuevo;
2) reacciones adhesión . Característica de los compuestos que tienen insaturación (enlaces múltiples), por lo que es posible la adición de otras moléculas (hidrógeno, agua, halógenos, oxígeno, haluros de hidrógeno, etc.);
3) reacciones dividiéndose (eliminación), cuando las moléculas (agua, amoniaco, halógenos, haluros de hidrógeno, hidrógeno, CO, CO 2, etc.) se separan de una molécula de un compuesto orgánico. Estas reacciones suelen recibir el nombre del tipo de molécula que se elimina, respectivamente, deshidratación, desaminación, deshalogenación, deshidrohalogenación, deshidrogenación, descarbonilación, descarboxilación etc.;
4) reacciones condensación cuando el esqueleto carbonado de una molécula aumenta de tamaño;
5) reacciones de craqueo (o división), como resultado de las cuales el esqueleto de carbono se divide en moléculas más pequeñas;
6) reacciones oxidación , acompañado de la eliminación de moléculas de hidrógeno (un caso especial de reacción de eliminación), o con la introducción simultánea de moléculas de oxígeno (conversión de alcoholes en aldehídos y cetonas y, además, en ácidos);
7)reacciones isomerización (o reestructuración del esqueleto carbonado o ciclos);
8)reacciones polimerización , como resultado de lo cual se obtienen moléculas de polímero largas y no ramificadas a partir de moléculas pequeñas (monómeros). En la naturaleza viva, hay ejemplos de formación de moléculas poliméricas ramificadas, cuyas unidades estructurales son moléculas orgánicas de monosacáridos (carbohidratos).
Clasificación de compuestos orgánicos.
A pesar de la variedad de compuestos orgánicos, la base de sus moléculas está formada por cadenas y anillos formados a partir de átomos de carbono. Los compuestos que contienen sólo carbono e hidrógeno se llaman hidrocarburos. En este caso, parte de las valencias del carbono se gasta en la formación de enlaces con átomos de carbono vecinos, y las valencias libres unen el carbono con hidrógeno, oxígeno, nitrógeno, azufre y, mucho menos a menudo, con otros átomos del sistema periódico. Muy a menudo, este "esqueleto" de átomos de carbono se conserva como resultado de transformaciones químicas sufridas por una molécula de un compuesto orgánico, lo que facilita enormemente la predicción de la composición de los productos. A menudo, las reacciones se limitan a la sustitución de uno o más átomos de hidrógeno por otro elemento o grupo de átomos (también llamado resto o grupo funcional ), dando como resultado un compuesto orgánico de una clase diferente. Dependiendo del grupo que reemplazó a uno de los átomos de hidrógeno en la molécula de un compuesto orgánico como resultado de la reacción, se distinguen clases de compuestos orgánicos.
A menudo, como resultado de la reacción, un grupo funcional se reemplaza por otro, manteniendo el esqueleto carbonado. Sin embargo, también se conocen numerosas reacciones que van acompañadas de cambios en el esqueleto carbonado de la molécula.
Mesa
Algunos grupos funcionales de compuestos orgánicos.
Grupo funcional |
Nombre del grupo |
Clase de conexión |
Estructura general |
Ejemplos |
- CL , -F, -Br, -I (-X) |
Halógeno |
Haluros |
bromobenceno |
|
Cloruro de etenilo(cloruro de vinilo) |
||||
-ÉL |
Hidroxilo (hidroxi, hidroxi) |
Alcoholes, fenoles |
R-OH |
Fenol |
|
Metanol |
||||
> C=O |
carbonilo (oxo) |
Aldehídos, cetonas |
propanona(acetona) etanal(acetaldehído) |
|
-CONTA |
Carboxilo (carboxi) |
Ácidos carboxílicos |
Ethanovaácido (ácido acético) |
|
- número 2 |
nitro |
Compuestos nitro |
nitrometano |
|
-NH2 |
Aminado |
Aminas |
aminometano(metilamina) |
|
-CN |
ciano |
Nitrilos |
etannitrilo(acetonitrilo) |
Homólogos y series homólogas.
homólogos – compuestos orgánicos (de la misma clase, ver arriba), que se diferencian en uno o más grupos metileno (unidades -CH 2 -). Los homólogos de los alcanos son, por ejemplo, metano, etano, propano, butano, etc., en los que el número de átomos de carbono cambia en uno (o en el mismo número de unidades de metileno).
Los homólogos de los compuestos aromáticos son el benceno, el tolueno, los xilenos, el mesitileno, el etilbenceno y otros. sustituido con alquilo bencenos. Estos compuestos también se diferencian en su fórmula bruta en una o más unidades de metileno (-CH 2 -). En consecuencia, los homólogos son metanol, propanol y etanol, acetona y metiletilcetona, ácidos acético y propiónico, etc.
Isomería de compuestos orgánicos.
La fórmula estructural (fórmula estructural) describe el orden de conexión de los átomos en una molécula, es decir su estructura química. Los enlaces químicos en la fórmula estructural están representados por guiones. El enlace entre el hidrógeno y otros átomos generalmente no se indica (tales fórmulas se denominan fórmulas estructurales abreviadas).
Las fórmulas estructurales difieren de las fórmulas moleculares (brutas), que muestran solo qué elementos y en qué proporción están incluidos en la composición de una sustancia (es decir, composición elemental cualitativa y cuantitativa), pero no reflejan el orden de enlace de los átomos. Por ejemplo, norte-butano e isobutano tienen la misma fórmula molecular C4H10, pero una secuencia diferente de conexiones.
Por tanto, la diferencia entre sustancias se debe no sólo a diferentes composiciones elementales cualitativas y cuantitativas, sino también a diferentes estructuras químicas, que sólo pueden reflejarse mediante fórmulas estructurales. Incluso antes de la creación de la teoría de la estructura, se conocían sustancias con la misma composición elemental, pero con diferentes propiedades. Estas sustancias fueron llamadas isómeros, y este fenómeno en sí – isomería. La base de la isomería, como lo muestra A.M. Butlerov, mintiendo diferencia en estructura Moléculas formadas por el mismo conjunto de átomos. Así, la isomería es el fenómeno de la existencia de compuestos que tienen la misma composición cualitativa y cuantitativa, pero diferentes estructuras y, por tanto, diferentes propiedades.
Por ejemplo, cuando una molécula contiene 4 átomos de carbono y 10 átomos de hidrógeno, pueden existir dos compuestos isoméricos:

Dependiendo de la naturaleza de las diferencias en la estructura de los isómeros, existen estructural Y espacial isomería.
Isomería estructural
Isómeros estructurales – compuestos de la misma composición cualitativa y cuantitativa, que difieren en el orden de enlace de los átomos, es decir, estructura química.
Por ejemplo, la composición C4H8 corresponde a 5 isómeros estructurales:
Entre los compuestos orgánicos, es teóricamente posible la existencia de un número colosal de isómeros únicamente estructurales. Así, entre los alcanos que contienen sólo átomos de carbono e hidrógeno, el número de posibles isómeros aumenta exponencialmente al aumentar el número de átomos de carbono. Si para un compuesto de composición C 4 H 10 solo son posibles dos isómeros, entonces para los pentanos C 5 H 12 el número de tales isómeros aumenta a tres, C 6 H 14 tiene 5 isómeros, C 7 H 16 - 9 isómeros, C 8 Isómeros H 18 - 18, isómeros C 9 H 20 - 35 y para el compuesto de pentacosano C 25 H 52, es teóricamente posible la existencia de hasta 36.797.588 isómeros.
Utilizando el ejemplo anterior, se pueden distinguir los siguientes isómeros:
- posiciones de doble enlace (buteno-1 y buteno-2);
- esqueleto de carbono (butenos-1 y -2 e isobutileno);
- tamaños de ciclo (ciclobutano y metilciclopropano);
- interclase isómeros (alquenos y cicloalcanos).
Los isómeros interclases son, por ejemplo, el etanol y el dimetiléter, que tienen la misma fórmula bruta C 2 H 6 O, pero estructuras completamente diferentes y pertenecen a diferentes clases. Se diferencian no sólo en sus propiedades químicas (el dimetiléter, más inerte, no reacciona con el sodio metálico, a diferencia del etanol), sino también en sus propiedades físicas. El etanol es un líquido a temperatura normal, mientras que el dimetil éter es un gas.
Compuestos orgánicos cíclicos y acíclicos.
Se puede observar que entre los isómeros estructurales de los compuestos orgánicos puede haber moléculas que contengan Ciclos construidos a partir de átomos de carbono. números diferentes (y a menudo más de uno de esos ciclos en la molécula). Sobre esta base distinguen Alí cíclico conexiones (que contienen ciclos, o simplemente conexiones cíclicas) y A cíclico compuestos (que no contienen ciclos, pero se construyen exclusivamente a partir de cadenas de átomos de carbono, a menudo ramificadas).
Compuestos carbocíclicos contienen sólo átomos de carbono en el anillo. Se dividen en dos grupos con propiedades químicas significativamente diferentes: alifáticos cíclicos (abreviados alicíclico) Y aromático conexiones.
Compuestos heterocíclicos contener en el ciclo, además de átomos de carbono, uno o más átomos de otros elementos – heteroátomos(del griego heteros– otro, otro) – oxígeno, nitrógeno, azufre, etc.
Isomería espacial
Isómeros espaciales (isómeros geométricos, estereoisómeros) con la misma composición y la misma estructura química, se diferencian en la disposición espacial de los átomos en la molécula.
Los isómeros espaciales son óptico (espejo) y cis-trans- isómeros. En el ejemplo mostrado arriba, el 2-buteno, que existe en la naturaleza como qi Con - Y trance- butenos-2:

La isomería espacial ocurre, en particular, cuando el carbono tiene cuatro sustituyentes diferentes:

Si intercambias dos de ellos, obtendrás otro isómero espacial de la misma composición. Las propiedades fisicoquímicas de dichos isómeros difieren significativamente. Los compuestos de este tipo se distinguen por su capacidad para rotar en cierta cantidad el plano de luz polarizada transmitida a través de una solución de dichos compuestos. En este caso, un isómero gira el plano de luz polarizada en una dirección y su isómero gira en la dirección opuesta. Debido a tales efectos ópticos, este tipo de isomería se llama isomería óptica .
Se pueden encontrar más detalles sobre la isomería óptica en la sección sobre compuestos orgánicos que contienen oxígeno y nitrógeno.
La isomería óptica es un caso especial de isomería espacial. Los isómeros ópticos son moléculas que difieren en la disposición espacial de grupos y átomos, teniendo la misma composición y el mismo orden de enlaces atómicos. Las soluciones de tales compuestos son capaces de girar un cierto ángulo el plano de luz polarizada transmitida a través de ellos.
1.3.3. Nomenclatura de compuestos orgánicos.
Debido a la presencia de una gran cantidad de compuestos orgánicos, el sistema de su designación (nombre) adquiere gran importancia, ya que mediante el nombre se puede establecer fácilmente su estructura (estructura química) y, en consecuencia, todas las propiedades químicas y físicas. Por tanto, el nombre debe reflejar la estructura química del compuesto orgánico con la mayor precisión posible, incluida la capacidad de identificar isómeros estructurales y geométricos. Hasta la fecha han surgido tres tipos de nomenclatura de compuestos orgánicos:
1. trivial ;
2. racional ;
3. sistemático (o sustitución, o nomenclatura IUPAC ).
La presencia de nombres triviales está asociada a la historia. Anteriormente, los investigadores solían nombrar compuestos basándose en la fuente de su aislamiento o en algunas propiedades organolépticas y fisicoquímicas. Los nombres triviales a veces circulan con los mismos derechos (si no con más frecuencia) que los nombres sistemáticos. Por ejemplo, todavía se utilizan los nombres de ácido acético, ácido fórmico, lactosa, urea y muchos otros nombres.
Nomenclatura racional
Este tipo de nomenclatura se ha generalizado como resultado del hecho de que algunos compuestos pueden denominarse como algún tipo de compuesto original, del cual se diferencian por los sustituyentes. Un ejemplo sería neopentano (“nuevo pentano”), un hidrocarburo de la clase de los alcanos con la composición C5H12. El nombre “neopentano” se considera trivial y no dice absolutamente nada sobre su estructura. Según el segundo tipo de nomenclatura, este hidrocarburo se puede denominar tetrametilmetano. Nombre tetrametilmetano Ya es mucho más informativo en términos de información sobre la estructura de la molécula. Puedes imaginar una molécula de metano en la que los cuatro átomos de hidrógeno son reemplazados por grupos metilo.
Sistemático el mismo nombre para neopentano es el nombre 2,2-dimetilpropano , compilado de acuerdo con las reglas desarrolladas por la Unión Internacional de Química Pura y Aplicada (IUPAC - Unión internacional de Química Pura Aplicada). La fórmula estructural del neopentano se proporciona a continuación:
Una consideración detallada de las reglas para nombrar compuestos orgánicos la haremos más adelante, al considerar clases individuales de compuestos orgánicos, ya que cada caso tiene sus propias características.
La sustitución de átomos de hidrógeno en las moléculas de alcano por cualquier heteroátomo (halógeno, nitrógeno, azufre, oxígeno, etc.) o grupo provoca una redistribución de la densidad electrónica. La naturaleza de este fenómeno es diferente. Depende de las propiedades del heteroátomo (su electronegatividad) y del tipo de enlaces por los que se propaga esta influencia.
Efecto inductivo
Si la influencia de un diputado se transfiere mediante la participación s- bonos, entonces hay un cambio gradual en el estado electrónico de los bonos. Esta polarización se llama efecto inductivo (yo) , está representado por una flecha en la dirección del cambio de densidad electrónica. La densidad electrónica siempre se desplaza hacia el átomo o grupo de átomos MÁS ELECTRÓNEGATIVO:
CH3-CH2 -->Cl,
HOCH2-CH2 -->Cl,
CH3-CH2 --> COOH,
CH3-CH2 --> NO 2, etc.
El efecto inductivo se debe al deseo de un átomo o grupo de átomos de suministrar o retirar densidad electrónica, y por tanto puede ser positivo o negativo. Un efecto inductivo negativo lo exhiben elementos que son más electronegativos que el carbono, es decir, halógenos, oxígeno, nitrógeno y otros, así como grupos con carga positiva en el elemento asociado al carbono. El efecto inductivo negativo disminuye de derecha a izquierda en un período y de arriba a abajo en un grupo del sistema periódico:
F > O > N,
F > Cl > Br > J.
En el caso de sustituyentes completamente cargados, el efecto inductivo negativo aumenta al aumentar la electronegatividad del átomo unido al carbono:
>O + - >> N +< .
En el caso de sustituyentes complejos, el efecto inductivo negativo está determinado por la naturaleza de los átomos que forman el sustituyente. Además, el efecto inductivo depende de la naturaleza de la hibridación de los átomos. Por tanto, la electronegatividad de los átomos de carbono depende de la hibridación de los orbitales de los electrones y cambia en la siguiente dirección:
sp3< sp2 < sp .
Los elementos que son menos electronegativos que el carbono exhiben un efecto inductivo positivo; grupos con carga negativa completa; grupos alquilo. El efecto +I disminuye en la serie:
(SN 3 ) 3 C -> (CH3)2CH->CH3-CH2->CH3->H-.
El efecto inductivo del sustituyente decae rápidamente a medida que aumenta la longitud de la cadena.
Mesa
Cuadro resumen de sustituyentes y sus efectos electrónicos.
X - halógeno) |
Efectos |
capítulo 3 >CH3-CH2->(CH3)2CH- >>CH2X |
Yo, +M |
(CH3)3C- |
Yo, M = 0 |
Átomo unido apag- X- (halógeno ), -O - , -OH, -OR, -NH 2 , -NHR, -NR 2 , -SH, -SR, |
–Yo, +M |
adjunto apag- CHX 2, -CX 3, -C=N=S |
-SOY |
Más carbono electronegativo (en comparación con sp3): CH=C N- , -S = (pero transmite fácilmente el efecto M en cualquier dirección) |
–Yo, M = 0 |
|
N + H 3, -N + R 3, (-S + R 2, -O + H 2), |
–Yo, M = 0 |
efecto mesomérico
La presencia de un sustituyente con un par de electrones libres o un orbital p vacante unido a un sistema que contiene electrones p conduce a la posibilidad de mezclar los orbitales p del sustituyente (ocupado o vacante) con orbitales p y una redistribución de la densidad electrónica en los compuestos. Este efecto se llama mesomérico .
El cambio en la densidad electrónica suele ser insignificante y las longitudes de los enlaces permanecen prácticamente sin cambios. Un ligero cambio en la densidad electrónica se juzga por los momentos dipolares, que son pequeños incluso en el caso de grandes efectos de conjugación en los átomos externos del sistema conjugado.
El efecto mesomérico se representa mediante una flecha curva dirigida hacia el cambio en la densidad electrónica. La densidad electrónica siempre se desplaza hacia un lado. átomo más electronegativo Ubicado en el borde de la estructura y conectado con el resto de la estructura. conexión múltiple:

Dependiendo de la dirección de desplazamiento de la nube de electrones, el efecto mesomérico puede ser positivo (+M), un átomo o cuando un grupo de átomos transfiere electrones al sistema pi:
y negativo (- M) cuando un grupo de átomos extrae electrones del sistema pi:

El efecto mesomérico positivo (+M) disminuye con un aumento de la electronegatividad del átomo que lleva un par de electrones solitarios, debido a una disminución en la tendencia a donarlo, así como con un aumento en el volumen del átomo. El efecto mesomérico positivo de los halógenos cambia en la siguiente dirección:
F> Cl > br> j (+M -efecto).
Los grupos con pares libres de electrones en el átomo unido al conjugado tienen un efecto mesomérico positivo. Pi-sistema:
- NH2( NHR, NR 2) > OH( O ) > X (halógeno) (+efecto M).
El efecto mesomérico positivo disminuye si el átomo está unido a un grupo aceptor de electrones:
-NH 2 > -NH-CO-CH 3 .
El efecto mesomérico negativo aumenta al aumentar la electronegatividad del átomo y alcanza valores máximos si el átomo aceptor lleva carga:
>C=O + H >> >C=O.
Se observa una disminución del efecto mesomérico negativo si el grupo aceptor se conjuga con un grupo donante:
-ARRULLO - << - СО -NH2< -CO-OR < -CO-H(R) << -CO- CO- < -CO-X ( halógeno ) (– efecto M).
Mesa
Sustituyente o grupo de átomos ( X - halógeno) |
Efectos |
capítulo 3 >CH3-CH2->(CH3)2CH- >>CH2X |
Yo, +M |
(CH3)3C- |
Yo, M = 0 |
Átomo unido apag-sistema, tiene un par de electrones solitarios: X- (halógeno |
–Yo, +M |
adjunto apag-En el sistema, el átomo, a su vez, está conectado a un átomo más electronegativo: N=O, -NO 2 , -SO 3 H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, - CHX 2, -CX 3, -C=N=S |
-SOY |
|
CH=C N- , -S = CH (etinilo), -C 6 H 4 - (fenileno) |
–Yo, M = 0 |
Un átomo que no tiene orbitales p, pero con una carga total positiva. |
–Yo, M = 0 |
Hiperconjugación o superconjugación
Un efecto similar al mesomérico positivo ocurre cuando el hidrógeno en un enlace múltiple se reemplaza por un grupo alquilo. Este efecto está dirigido hacia el enlace múltiple y se llama hiperconjugación(superconjugado):
El efecto se asemeja a uno mesomérico positivo, ya que dona electrones al conjugado. pag- sistema:

La superconjugación disminuye en la secuencia:
CH 3 >CH3-CH2 > (CH3)2CH > (CH3)3C.
Para mostrar el efecto hiperconjugación es necesario tener al menos un átomo de hidrógeno en el átomo de carbono adyacente al sistema p. El grupo terc-butilo no presenta este efecto y, por tanto, su efecto mesomérico es cero.
Mesa
Cuadro resumen de sustituyentes y sus efectos electrónicos.
Sustituyente o grupo de átomos ( X - halógeno) |
Efectos |
capítulo 3 >CH3-CH2->(CH3)2CH- >>CH2X |
Yo, +M |
(CH3)3C- |
Yo, M = 0 |
Átomo unido apag-sistema, tiene un par de electrones solitarios: X- (halógeno ), -O - , -OH, -OR, -NH 2 , -NHR, -NR 2 , -SH, -SR, |
–Yo, +M |
adjunto apag-En el sistema, el átomo, a su vez, está conectado a un átomo más electronegativo: N=O, -NO 2 , -SO 3 H, -COOH, -CO-H, -CO-R, -CO-OR, -CN, - CHX 2, -CX 3, -C=N=S |
-SOY |
Más carbono electronegativo: CH=C N- , -S = CH (etinilo), -C 6 H 4 - (fenileno) (pero transmite fácilmente el efecto M en cualquier dirección) |
–Yo, M = 0 |
Un átomo que no tiene orbitales p pero tiene una carga positiva total. N + H 3, -N + R 3, (-S + R 2, -O + H 2), |
La mayoría de los compuestos orgánicos contienen sólo unos pocos elementos básicos: carbono, hidrógeno, nitrógeno, oxígeno, azufre y, con mucha menos frecuencia, otros elementos. Así, toda la diversidad de compuestos orgánicos está determinada, por un lado, por su composición cualitativa y cuantitativa, y por otro, por el orden y naturaleza de los enlaces entre átomos. 1.1 Electronegatividad de los elementos. La electronegatividad de un átomo es su capacidad para atraer elementos. Los valores de electronegatividad no son constantes significativas, sino que sólo muestran la capacidad relativa de los átomos para atraer más o menos electrones cuando se forman con otros átomos. Los átomos ubicados en la serie de electronegatividad frente al carbono y que tienen un valor de electronegatividad inferior a 2,5 aumentan la densidad electrónica en el átomo de carbono al formar un enlace con él. Por el contrario, los átomos cuyo valor de electronegatividad supera 2,5 reducen la densidad electrónica en el átomo de carbono al formar un enlace. 1.2 Enlace iónico La configuración electrónica de cualquier átomo se puede formar de dos maneras diferentes. Uno de ellos es la transferencia de electrones: los átomos de un elemento ceden electrones, que van a los átomos de otro elemento. En este caso, el llamado enlace iónico (electrovalente, heteropolar): Un átomo que dona electrones se convierte en un ion positivo ( catión); un átomo que ha aceptado un electrón se convierte en un ion negativo ( anión). Las características distintivas de los compuestos iónicos son la reacción instantánea, disociación y solvatación de iones en soluciones acuosas, altos puntos de fusión y ebullición, solubilidad en disolventes polares, conductividad eléctrica de soluciones y masas fundidas. Un enlace heteropolar se produce entre átomos que difieren mucho en electronegatividad. 1.3 Enlace covalente Cuando interactúan átomos de electronegatividad igual o similar, no se produce transferencia de electrones. La formación de una configuración electrónica para tales átomos se produce debido a la generalización de dos, cuatro o seis electrones mediante la interacción de átomos. Cada uno de los pares generalizados de electrones forma uno. enlace covalente (homeopolar): Los parámetros físicos más importantes de un enlace covalente son aquellos que caracterizan su simetría, tamaño, propiedades eléctricas y termoquímicas. Longitud del enlace- esta es la distancia de equilibrio entre los centros de los núcleos y depende de con qué otros átomos están asociados. Por tanto, la longitud del enlace C-C, dependiendo del entorno, varía dentro del rango de 0,154 – 0,14 nm. Ángulos de enlace– ángulos entre líneas que conectan átomos unidos. El conocimiento de las longitudes y ángulos de los enlaces es necesario para construir un modelo espacial correcto, una idea de la distribución de la densidad electrónica y se utiliza en los cálculos químicos cuánticos. Energía de romper un enlace químico. es la energía gastada en romper este enlace o liberada durante su formación por mol de partículas. En el caso de moléculas que contienen dos o más enlaces idénticos, se distingue la energía de rotura de uno de estos enlaces o la energía media de rotura de estos enlaces. Cuanto mayor sea la energía del enlace químico, más fuerte será el enlace. Un enlace se considera fuerte o fuerte si su energía supera los 500 kJ/mol y débil si su energía es inferior a 100 kJ/mol. Si la interacción de los átomos libera energía menos de 15 kJ/mol, entonces se considera que no se forma un enlace químico, pero se observa interacción intermolecular. La fuerza de la unión generalmente disminuye a medida que aumenta la longitud de la unión. Polaridad de los enlaces químicos.– característica de un enlace químico, que muestra un cambio en la distribución de la densidad electrónica en el espacio alrededor de los núcleos en comparación con la distribución de la densidad electrónica en los átomos neutros que forman este enlace. El conocimiento de la polaridad del enlace es necesario para juzgar la distribución de la densidad electrónica en una molécula y, por tanto, la naturaleza de su reactividad. Polarizabilidad del enlace se expresa en el desplazamiento de los electrones del enlace bajo la influencia de un campo eléctrico externo, incluido el de otra partícula que reacciona. La polarizabilidad está determinada por la movilidad de los electrones. Los electrones son más móviles cuanto más alejados están del núcleo. 1.4 Rompiendo lazos La ruptura de un enlace covalente entre dos átomos puede ocurrir de diferentes maneras: Cuando A cada átomo se separa con un electrón, dando como resultado la formación de partículas llamadas radicales, que son altamente reactivas debido a la presencia de un electrón desapareado; tal brecha se llama escisión homolítica comunicaciones. En casos b Y V un átomo puede contener ambos electrones, dejando al otro átomo sin electrones, lo que da como resultado iones negativos y positivos, respectivamente. Si los átomos R y X no son idénticos, puede producirse una división a lo largo de uno de estos caminos, dependiendo de qué átomo (R o X) contenga un par de electrones. Este tipo de brechas se llaman escisión heterolítica y conducir a la formación de un par iónico. Comparte con amigos o guarda para ti mismo:
|