Reacciones de sustitución de ligandos. Tema: Etapas elementales que involucran coordinación y compuestos organometálicos en soluciones y en la superficie de metales y óxidos.
Las etapas elementales de reacciones orgánicas catalizadas por ácidos, bases, catalizadores nucleofílicos, complejos metálicos, metales sólidos y sus compuestos en procesos heterogéneos y homogéneos en fase gaseosa o líquida son reacciones de formación y transformación de diversos intermedios orgánicos y organometálicos, como así como complejos metálicos. Los compuestos intermedios orgánicos incluyen iones carbenio R + , carbonio RH 2 + , carboaniones R-, aniones y cationes radicales, radicales y birradicales R·, R:, así como complejos moleculares de moléculas orgánicas donadoras y aceptoras (DA), que también se llaman complejos con transferencia de carga. En la catálisis homogénea y heterogénea por complejos metálicos (catálisis de complejos metálicos) de reacciones orgánicas, los intermedios son compuestos complejos (de coordinación) con ligandos orgánicos e inorgánicos, compuestos organometálicos con un enlace M-C, que en la mayoría de los casos son compuestos de coordinación. Una situación similar ocurre en el caso de la química “bidimensional” en la superficie de catalizadores metálicos sólidos. Consideremos los principales tipos de reacciones de complejos metálicos y compuestos organometálicos.
Etapas elementales que involucran complejos metálicos.Las reacciones de complejos metálicos se pueden dividir en tres grupos:
a) reacciones de transferencia de electrones;
b) reacciones de sustitución de ligandos;
c) reacciones de ligandos coordinados.
Reacciones de transferencia de electrones.
En las reacciones de transferencia de electrones se implementan dos mecanismos: el mecanismo de la esfera exterior (sin cambios en las esferas de coordinación del donante y el aceptor) y el mecanismo de puente (esfera interior), que conduce a cambios en la esfera de coordinación del metal.
Consideremos el mecanismo de la esfera exterior usando el ejemplo de complejos octaédricos de metales de transición. En el caso de reacciones simétricas ( GRAMO 0 = 0)
Las constantes de velocidad varían en una gama muy amplia de valores: de 10-12 a 10 5 l mol-1 seg-1, dependiendo de la configuración electrónica del ion y el grado de su reestructuración durante el proceso. En estas reacciones, el principio del menor movimiento se manifiesta muy claramente: el menor cambio en la capa de valencia de los participantes de la reacción.
En la reacción de transferencia de electrones (1) (Co* es un isótopo del átomo de Co)
(reacción simétrica), Co 2+ (d 7) pasa a Co 3+ (d 6). La configuración electrónica (carcasa de valencia) no cambia durante esta transferencia.
6 electrones en el nivel de enlace triple degenerado permanecen sin cambios (), y desde el nivel de antienlazante mi gramo Se elimina un electrón de nivel uno.
Constante de velocidad de segundo orden para la reacción (1) k 1 = 1,1 lmol-1 seg-1. Dado que Phen (fenantrolina) es un ligando fuerte, el número máximo es 7 d-los electrones están emparejados (estado de espín emparejado). En el caso de un ligando débil NH3 la situación cambia radicalmente. Co(NH 3) n 2+ (n = 4, 5, 6) está en un estado de espín no apareado (espín alto).
El complejo más fuerte Co(NH 3) 6 3+ (más fuerte que Co(NH 3) 6 2+ ~ 10 30 veces) está en un estado de espín emparejado, como el complejo con Phen. En este sentido, en el proceso de transferencia de electrones, la capa de valencia debe reconstruirse fuertemente y, como resultado, k= 10-9 lmol-1 seg-1. La tasa de conversión de Co 2+ en Co 3+, igual al 50%, se alcanza en el caso del ligando Phen en 1 segundo, y en el caso del NH 3 ~ en 30 años. Es obvio que una etapa con tal velocidad (formalmente elemental) puede excluirse del conjunto de etapas elementales al analizar los mecanismos de reacción.
Magnitud GRAMO para la reacción de transferencia de electrones durante la formación de un complejo de colisión, según la teoría de Marcus, incluye dos componentes y
El primer término es la energía de reorganización de los enlaces M-L dentro del complejo (la longitud y fuerza del enlace cuando cambia el estado de valencia). El valor incluye la energía de reordenamiento de la capa de solvatación exterior en el proceso de cambio de las coordenadas M-L y la carga del complejo. Cuanto menor es el cambio en el entorno electrónico y menor es el cambio en la longitud de M-L, menor es; cuanto más grandes son los ligandos, más pequeños y, como resultado, mayor es la velocidad de transferencia de electrones. El valor para el caso general se puede calcular usando la ecuación de Marcus.
Dónde. En = 0 .
En el caso del mecanismo intraesfera, el proceso de transferencia de electrones se facilita, ya que uno de los ligandos del primer complejo forma un complejo puente con el segundo complejo, desplazando a uno de los ligandos del mismo.
Las constantes de velocidad de tal proceso son 8 órdenes de magnitud mayores que las constantes para la reducción de Cr(NH 3) 6 3+. En tales reacciones, el agente reductor debe ser un complejo lábil y el ligando en el agente oxidante debe ser capaz de formar puentes (Cl-, Br-, I-, N 3 -, NCS-, bipy).
Reacciones de sustitución de ligandosUna de las etapas más importantes en la catálisis de complejos metálicos, la interacción del sustrato Y con el complejo, se produce a través de tres mecanismos:
a) Reemplazo del ligando por un disolvente. Esta etapa suele representarse como la disociación del complejo.
La esencia del proceso en la mayoría de los casos es la sustitución del ligando L por el disolvente S, que luego se reemplaza fácilmente por una molécula de sustrato Y.
b) Unión de un nuevo ligando en una coordenada libre con la formación de un asociado seguida de la disociación del ligando reemplazado
c) Sustitución sincrónica (tipo S N 2) sin formación intermedia
En el caso de los complejos de Pt(II), la velocidad de reacción suele describirse mediante la ecuación de dos caminos
Dónde k S Y k Y- constantes de velocidad de los procesos que ocurren en las reacciones (5) (con un disolvente) y (6) con el ligando Y. Por ejemplo,
La última etapa de la segunda ruta es la suma de tres etapas elementales rápidas: la eliminación de Cl-, la adición de Y y la eliminación de la molécula de H 2 O.
En los complejos cuadrados planos de metales de transición, se observa un efecto trans, formulado por I. I. Chernyaev: la influencia de LT en la tasa de sustitución de un ligando que se encuentra en una posición trans con respecto al ligando LT. Para los complejos de Pt(II), el efecto trans aumenta en la serie de ligandos:
H2O~NH3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
La presencia del efecto trans cinético y la influencia trans termodinámica explica la posibilidad de sintetizar complejos isoméricos inertes de Pt(NH 3) 2 Cl 2:
Reacciones de ligandos coordinados.§ Reacciones de sustitución electrófila (SE) de hidrógeno con un metal en la esfera de coordinación del metal y sus procesos inversos.
SH - H 2 O, ROH, RNH 2, RSH, ArH, RCCH.
Incluso las moléculas de H 2 y CH 4 participan en reacciones de este tipo.
§ Reacciones de introducción de L a través de la conexión M-X
En el caso de X = R (complejo organometálico), en el enlace M-R también se introducen moléculas coordinadas por metales (L - CO, RNC, C 2 H 2, C 2 H 4, N 2, CO 2, O 2, etc. .). La reacción de inserción es el resultado de un ataque intramolecular del nucleófilo X a una molécula coordinada por - o - tipo. Reacciones inversas - - y - reacciones de eliminación.
§ Reacciones de adición oxidativa y eliminación reductora.
M2 (C2H2) M2 4+ (C2H2) 4-
Al parecer, en estas reacciones siempre hay una coordinación preliminar de la molécula añadida, pero esto no siempre se puede detectar. En este sentido, un factor importante que afecta la reactividad de los complejos metálicos es la presencia de un sitio libre en la esfera de coordinación o un sitio asociado con un disolvente, que es fácilmente reemplazado por un sustrato. Por ejemplo, los complejos de bis-alilo de Ni son buenos precursores de especies catalíticamente activas, ya que debido a la fácil eliminación reductiva del bis-alilo aparece un complejo con el disolvente, el llamado. Níquel “desnudo”. El papel de los asientos vacíos se ilustra con el siguiente ejemplo:
§ Reacciones de adición nucleofílica y electrófila a - y - complejos metálicos
Reacciones de compuestos organometálicos.Como intermediarios de reacciones catalíticas existen tanto compuestos organometálicos clásicos con enlaces M-C, M=C y MC, como compuestos no clásicos en los que el ligando orgánico está coordinado según el tipo 2, 3, 4, 5 y 6, o está estructuras de elementos deficientes en electrones: grupos puente CH 3 y C 6 H 6, carburos no clásicos (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+, etc.).
Entre los mecanismos científicos de los compuestos organometálicos clásicos, destacamos varios mecanismos. Así, se han establecido 5 mecanismos de sustitución electrófila del átomo metálico en el enlace M-C.
sustitución electrofílica con asistencia nucleofílica
Eliminación de adición de AdE
AdE(C) Adición al átomo de C en la hibridación sp 2
AdE(M) Adición oxidativa al metal.
La sustitución nucleófila en el átomo de carbono en reacciones de desmetalación de compuestos organometálicos ocurre como un proceso de oxidación-reducción:
Posible participación de un agente oxidante en esta etapa.
Un agente oxidante de este tipo puede ser CuCl 2, p-benzoquinona, NO 3 y otros compuestos. Aquí hay dos etapas elementales más características de RMX:
hidrogenólisis del enlace M-C
y homólisis del enlace M-C
Una regla importante que se aplica a todas las reacciones de compuestos complejos y organometálicos y que está asociada con el principio del mínimo movimiento es la regla de la capa de electrones 16-18 de Tolman (Sección 2).
Coordinación y compuestos organometálicos.en una superficieSegún los conceptos modernos, en la superficie de los metales se forman complejos y compuestos organometálicos similares a los compuestos en solución. Para la química de superficies, es fundamental la participación de varios átomos de la superficie en la formación de dichos compuestos y, por supuesto, la ausencia de partículas cargadas.
Los grupos de superficie pueden ser cualquier átomo (H, O, N, C), grupos de átomos (OH, OR, NH, NH 2, CH, CH 2, CH 3, R), moléculas coordinadas CO, N 2, CO 2, C2H4, C6H6. Por ejemplo, durante la adsorción de CO sobre una superficie metálica, se encontraron las siguientes estructuras:
La molécula C 2 H 4 en la superficie del metal forma complejos con un centro y puentes de etileno desconectados M-CH 2 CH 2 -M, es decir. ciclos esencialmente metálicos
En la superficie de Rh, por ejemplo, durante la adsorción de etileno, ocurren los siguientes procesos de conversión de etileno a medida que aumenta la temperatura:
Las reacciones de los intermedios de superficie incluyen las etapas de adición oxidativa, eliminación reductora, inserción y eliminación, hidrogenolisis de enlaces M-C y C-C y otras reacciones de tipo organometálico, pero sin aparición de iones libres. Las tablas muestran los mecanismos e intermediarios de las transformaciones superficiales de hidrocarburos en metales.
Tabla 3.1. Reacciones catalíticas que implican la ruptura de un enlace C-C.
Designaciones:
Alquilo, metalaciclo;
Carbeno, alilo;
Carabina, vinilo.
Tabla 3.2. Reacciones catalíticas que implican la formación de un enlace C-C.
Designaciones: ver tabla. 3.1.
La formación de todos los compuestos organometálicos anteriores en la superficie de los metales se ha confirmado mediante métodos físicos.
Preguntas para el autocontrol
1) ¿Cómo se manifiesta la regla del cambio más pequeño en la capa de valencia de un metal durante las reacciones de transferencia de electrones?
2) ¿Por qué las vacantes de coordinación contribuyen a una interacción efectiva con el sustrato?
3) Enumere los principales tipos de reacciones de ligandos coordinados.
4) Dar los mecanismos de sustitución electrófila en las reacciones de compuestos organometálicos con NX.
5) Dar ejemplos de compuestos organometálicos de superficie.
6) Dar ejemplos de la participación de los complejos superficiales de carbeno metálico en las transformaciones de hidrocarburos.
Literatura para un estudio en profundidad.
1. Temkin O.N., Cinética de reacciones catalíticas en soluciones de complejos metálicos, M., MITHT, 1980, Parte III.
2. Collman J., Higedas L., Norton J., Finke R., Química organometálica de metales de consumo, M., Mir, 1989, volumen I, volumen II.
3. Moiseev I.I., -Complejos en la oxidación de olefinas, M., Nauka, 1970.
4. Temkin O.N., Shestakov G.K., Treger Yu.A., Acetileno: Química. Mecanismos de reacciones. Tecnología. M., Química, 1991, 416 págs., sección 1.
5. Henrici-Olivet G., Olive S., Coordinación y catálisis, M., Mir, 1980, 421 p.
6. Krylov O.V., Matyshak V.A., Compuestos intermedios en catálisis heterogénea, M., Nauka, 1996.
7. Zaera F., Guía organometálica para la química de los grupos de hidrocarburos en superficies de metales de transición., Chem. Rev., 1995, 95, 2651 - 2693.
8. Bent B.E., Imitación de aspectos de catálisis heterogénea: generación, aislamiento y reacción de intermediarios de superficie propuestos en monocristales al vacío, Chem. Rev., 1996, 96, 1361 - 1390.
Convencionalmente, las reacciones químicas de complejos se dividen en intercambio, redox, isomerización y ligandos coordinados.
La disociación primaria de complejos en las esferas interior y exterior determina la aparición de reacciones de intercambio de iones de la esfera exterior:
X m + mNaY = Y m + mNaX.
Los componentes de la esfera interna de los complejos también pueden participar en procesos metabólicos en los que participan tanto los ligandos como el agente complejante. Para caracterizar reacciones de sustitución de ligandos o del ion metálico central, utilice las designaciones y terminología propuestas por K. Ingold para reacciones de compuestos orgánicos (Fig.42), nucleofílicos. S N y electrófilo S E sustituciones:
Z + Y = z +X S N
Z + M"= z + M S E .
Según el mecanismo de la reacción de sustitución, se dividen (Fig.43) en asociativos ( S N 1 y S E 1 ) y disociativo ( S N 2 y S E 2 ), que se diferencian en el estado de transición con un número de coordinación aumentado y disminuido.
Clasificar un mecanismo de reacción como asociativo o disociativo es una tarea difícil de lograr experimentalmente para identificar un intermedio con un número de coordinación reducido o aumentado. En este sentido, el mecanismo de reacción a menudo se juzga sobre la base de datos indirectos sobre el efecto de la concentración de reactivos en la velocidad de reacción, cambios en la estructura geométrica del producto de reacción, etc.
Para caracterizar la velocidad de las reacciones de sustitución de ligandos en complejos, el premio Nobel de 1983 G. Taube (Fig.44) propuso utilizar los términos "lábil" e "inerte" dependiendo del tiempo de la reacción de sustitución de ligandos, menos o más de 1 minuto. . Los términos lábil o inerte son características de la cinética de las reacciones de sustitución de ligandos y no deben confundirse con las características termodinámicas de la estabilidad o inestabilidad de los complejos.
La labilidad o inercia de los complejos depende de la naturaleza del ion complejante y de los ligandos. De acuerdo con la teoría del campo de ligandos:
1. Complejos octaédricos 3 d metales de transición con distribución de valencia ( norte-1) re electrones por sigma*(p.ej ) los MO que se aflojan son lábiles.
4- (t 2g 6 mi g 1) + H 2 O= 3-+CN-.
Además, cuanto menor es la energía de estabilización por el campo cristalino del complejo, mayor es su labilidad.
2. Complejos octaédricos 3 d metales de transición con sigma libre* aflojando, por ejemplo orbitales y una distribución uniforme de valencia ( n -1) los electrones d en los orbitales t 2 g (t 2 g 3, t 2 g 6) son inertes.
[Co III (CN) 6] 3- (t 2 g 6 e g 0) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 e g 0) + H 2 O =
3. Planocuadrado y octaédrico 4 d y 5 d Metales de transición que no tienen electrones per sigma.* Los MO aflojados son inertes.
2+ + H2O =
2+ + H2O =
La influencia de la naturaleza de los ligandos en la velocidad de las reacciones de sustitución de ligandos se considera en el marco del modelo de "influencia mutua de ligandos". Un caso especial del modelo de influencia mutua de ligandos es el formulado en 1926 por I.I. El concepto de influencia trans de Chernyaev (Fig.45) - "la labilidad del ligando en el complejo depende de la naturaleza del ligando translocado" - y propone una serie de influencias trans de los ligandos: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, Cl - > py , NH 3 , OH - , H 2 O .
El concepto de influencia trans nos permitió justificar las reglas generales:
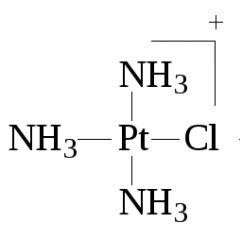
1. La regla de Peyrone- debido a la acción del amoníaco o de las aminas sobre el tetracloroplatinato ( II ) El potasio siempre se obtiene con configuración cis de diclorodiaminaplatino:
2 - + 2NH 3 = cis - + 2Cl - .
Dado que la reacción se desarrolla en dos etapas y el ligando cloruro tiene una gran influencia trans, la sustitución del segundo ligando cloruro por amoníaco se produce con la formación de cis-[ Pt (NH 3 ) 2 Cl 2 ]:
2- + NH 3 = -
NH3 = cis-.
2. La regla de Jergensen - por la acción del ácido clorhídrico sobre el cloruro de tetramina de platino ( II ) o compuestos similares se obtiene diclorodiaminoplatino configuración trans:
[ Pt (NH 3 ) 4 ] 2+ + 2 HCl = trans-[ Pt (NH 3 ) 2 Cl 2 ] + 2 NH 4 Cl .
De acuerdo con la serie de influencias trans de los ligandos, la sustitución de la segunda molécula de amoníaco por un ligando de cloruro conduce a la formación de trans-[ Pt (NH 3 ) 2 Cl 2 ].
3. Reacción de tiourea de Kurnakov - diversos productos de la reacción de la tiourea con isómeros geométricos de trans-[ Pt (NH 3 ) 2 Cl 2 ] y cis-[ Pt (NH 3 ) 2 Cl 2 ]:
cis - + 4Tio = 2+ + 2Cl - + 2NH3.
La diferente naturaleza de los productos de reacción se debe a la elevada influencia trans de la tiourea. La primera etapa de las reacciones es la sustitución de los ligandos de cloruro de tiourea con la formación de trans- y cis-[ Pt (NH 3 ) 2 (Tio) 2 ] 2+ :
trans-[Pt (NH 3) 2 Cl 2 ] + 2 Tio = trans-[ Pt (NH 3) 2 (Tio) 2 ] 2+
cis - + 2Tío = cis - 2+.
En cis-[Pt (NH 3 ) 2 (Tio ) 2 ] 2+ dos moléculas de amoníaco en posición trans a tiourea sufren una sustitución adicional, lo que conduce a la formación 2+ :
cis - 2+ + 2Tío = 2+ + 2NH 3 .
En trans-[Pt (NH 3 ) 2 (Tio ) 2 ] 2+ dos moléculas de amoníaco con poca influencia trans se encuentran en posición trans entre sí y por lo tanto no son reemplazadas por tiourea.
Los patrones de influencia trans fueron descubiertos por I.I. Chernyaev al estudiar reacciones de sustitución de ligandos en complejos de platino cuadrados-planos ( II ). Posteriormente, se demostró que la influencia trans de los ligandos también se manifiesta en complejos de otros metales ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III) )) y otra estructura geométrica. Es cierto que las series de transinfluencia de ligandos para diferentes metales son algo diferentes.
Cabe señalar que la influencia trans es efecto cinético- cuanto mayor es la influencia trans de un ligando determinado, más rápido es reemplazado por otro ligando que se encuentra en una posición trans con respecto a él.
Junto con el efecto cinético de la influencia trans, en el medio XX siglo a.a. Grinberg y Yu.N. Kukushkin estableció la dependencia de la transinfluencia del ligando. l desde el ligando ubicado en posición cis hasta l . Así, el estudio de la velocidad de la reacción de sustitución. Cl- amoníaco en complejos de platino( II):
[PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0,42. 104 l/mol. Con
[ PtNH 3 Cl 3 ] - + NH 3 = cis- [ Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1,14. 104 l/mol. Con
trans-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2,90 . 104 l/mol. Con
demostraron que la presencia de una o dos moléculas de amoníaco en la posición cis del ligando de cloruro reemplazado conduce a un aumento constante en la velocidad de reacción. Este efecto cinético se llama influencia cis. Actualmente, ambos efectos cinéticos de la influencia de la naturaleza de los ligandos en la velocidad de las reacciones de sustitución de ligandos (efecto trans y cis) se combinan en un concepto general. influencia mutua de ligandos.
La fundamentación teórica del efecto de la influencia mutua de los ligandos está estrechamente relacionada con el desarrollo de ideas sobre los enlaces químicos en compuestos complejos. en los años 30 XX siglo a.a. Greenberg y B.V. Nekrasov consideró la influencia trans en el marco del modelo de polarización:
1. El efecto trans es típico de complejos cuyo ión metálico central es altamente polarizable.
2. La actividad trans de los ligandos está determinada por la energía de polarización mutua del ligando y el ion metálico. Para un ion metálico determinado, la influencia trans del ligando está determinada por su polarizabilidad y su distancia del ion central.
El modelo de polarización es consistente con datos experimentales para complejos con ligandos aniónicos simples, como los iones haluro.
En 1943 A.A. Greenberg planteó la hipótesis de que la actividad trans de los ligandos está relacionada con sus propiedades reductoras. El cambio en la densidad electrónica del ligando translocado al metal reduce la carga efectiva del ion metálico, lo que conduce a un debilitamiento del enlace químico con el ligando translocado.
El desarrollo de ideas sobre la influencia trans está asociado con la alta actividad trans de ligandos basados en moléculas orgánicas insaturadas como el etileno en [ Pt(C2H4)Cl3 ] - . Según Chatt y Orgel (Fig. 46), esto se debe aPi-la interacción dativa de tales ligandos con el metal y el mecanismo asociativo de reacciones de sustitución para ligandos translocados. Coordinación con el ion metálico del ligando atacante. z conduce a la formación de un intermedio bipiramidal trigonal de cinco coordenadas seguido de una rápida eliminación del ligando saliente X. La formación de dicho intermedio se ve facilitada porPi-interacción ligando dativo-ligando metálico Y , que reduce la densidad electrónica del metal y reduce la energía de activación del estado de transición con el posterior reemplazo rápido del ligando X.
Junto con pag aceptor (C 2 H 4 , CN - , CO ...) los ligandos que forman un enlace químico ligando dativo-metal tienen una alta influencia trans ysligandos donantes: H - , CH 3 - , C 2 H 5 - ... La transinfluencia de tales ligandos está determinada por la interacción donante-aceptor del ligando X con el metal, que reduce su densidad electrónica y debilita el enlace del metal con el ligando saliente. y.
Por tanto, la posición de los ligandos en la serie de actividad trans está determinada por la acción combinada de sigma- donante y Pi-propiedades de los ligandos - sigma- donante y Pi-las propiedades aceptoras del ligando mejoran su influencia trans, mientras quePi-los donantes se debilitan. Cuál de estos componentes de la interacción ligando-metal predomina en el efecto trans se juzga sobre la base de cálculos químicos cuánticos de la estructura electrónica del estado de transición de la reacción.
Una de las etapas más importantes en la catálisis de complejos metálicos (la interacción del sustrato Y con el complejo) se produce mediante tres mecanismos:
a) Reemplazo del ligando por un disolvente. Esta etapa suele representarse como la disociación del complejo.
La esencia del proceso en la mayoría de los casos es la sustitución del ligando por un disolvente S, que luego se reemplaza fácilmente por una molécula de sustrato Y.
b) Unión de un nuevo ligando en una coordenada libre con la formación de un asociado seguida de la disociación del ligando reemplazado
c) Sustitución sincrónica (tipo S N 2) sin formación intermedia
En el caso de los complejos de Pt(II), la velocidad de reacción suele describirse mediante la ecuación de dos caminos
Dónde k S Y k Y son las constantes de velocidad de los procesos que ocurren en las reacciones (5) (con un disolvente) y (6) con el ligando Y. Por ejemplo,


La última etapa de la segunda ruta es la suma de tres etapas elementales rápidas -la eliminación del Cl-, la adición de Y y la eliminación de la molécula de H 2 O.
En los complejos cuadrados planos de metales de transición, se observa un efecto trans, formulado por I. I. Chernyaev: la influencia de LT en la tasa de sustitución de un ligando ubicado en una posición trans con respecto al ligando LT. Para los complejos de Pt(II), el efecto trans aumenta en la serie de ligandos:
H2O~NH3 La presencia del efecto trans cinético y la transinfluencia termodinámica explica la posibilidad de sintetizar complejos isoméricos inertes de Pt(NH 3) 2 Cl 2: Reacciones de sustitución electrófila (S E) de hidrógeno con un metal en la esfera de coordinación del metal y sus procesos inversos. SH – H 2 O, ROH, RNH 2, RSH, ArH, RCCH. Incluso las moléculas de H 2 y CH 4 participan en reacciones de este tipo. Reacciones de introducción de L a lo largo de la conexión M-X. En el caso de X=R (complejo organometálico), en el enlace M-R también se introducen moléculas coordinadas por metales (L–CO, RNC, C 2 H 2, C 2 H 4, N 2, CO 2, O 2, etc. .). La reacción de inserción es el resultado de un ataque intramolecular de un nucleófilo a una molécula coordinada de tipo o . Reacciones inversas: reacciones de eliminación y Reacciones de adición oxidativa y eliminación reductora. M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4– Al parecer, en estas reacciones siempre hay una coordinación preliminar de la molécula añadida, pero esto no siempre se puede detectar. Por tanto, la presencia de un sitio libre en la esfera de coordinación o un sitio asociado con un disolvente que sea fácilmente reemplazado por un sustrato es un factor importante que afecta la reactividad de los complejos metálicos. Por ejemplo, los complejos bis--alilo de Ni son buenos precursores de especies catalíticamente activas, ya que debido a la fácil eliminación reductora del bis-alilo aparece un complejo con el disolvente, el llamado. Níquel “desnudo”. El papel de los asientos vacíos se ilustra con el siguiente ejemplo: Reacciones de adición nucleofílica y electrófila a complejos y de metales. Como intermediarios de reacciones catalíticas existen tanto compuestos organometálicos clásicos con enlaces M-C, M=C y MC, como compuestos no clásicos en los que el ligando orgánico está coordinado según 2 , 3 , 4 , 5. y tipo 6, o es un elemento de estructuras deficientes en electrones: puente entre grupos CH 3 y C 6 H 6, carburos no clásicos (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+, etcétera). Entre los mecanismos específicos de los compuestos -organometálicos clásicos, destacamos varios mecanismos. Así, se han establecido 5 mecanismos de sustitución electrófila del átomo metálico en el enlace M-C. sustitución electrofílica con asistencia nucleofílica AdEAdición-eliminación AdE(C) Adición al átomo de C en la hibridación sp 2 AdE(M) Adición oxidativa al metal. La sustitución nucleófila en el átomo de carbono en reacciones de desmetalación de compuestos organometálicos ocurre como un proceso redox: Posible participación de un agente oxidante en esta etapa. Un agente oxidante de este tipo puede ser CuCl 2, p-benzoquinona, NO 3 y otros compuestos. Aquí hay dos etapas elementales más características de RMX: hidrogenólisis del enlace M-C y homólisis del enlace M-C Una regla importante que se aplica a todas las reacciones de compuestos complejos y organometálicos y que está asociada con el principio del mínimo movimiento es la regla de la capa de electrones 16-18 de Tolman (Sección 2). La principal reacción de sustitución en soluciones acuosas, el intercambio de moléculas de agua (22), se ha estudiado para una gran cantidad de iones metálicos (Fig. 34). El intercambio de moléculas de agua en la esfera de coordinación de un ion metálico con la mayor parte de las moléculas de agua presentes como disolvente ocurre muy rápidamente para la mayoría de los metales y, por lo tanto, la velocidad de dicha reacción podría estudiarse principalmente mediante el método de relajación. El método implica alterar el equilibrio del sistema, por ejemplo mediante un fuerte aumento de temperatura. En nuevas condiciones (temperatura más alta), el sistema ya no estará en equilibrio. Luego se mide la tasa de equilibrio. Si puede cambiar la temperatura de la solución dentro de 10 -8 seg, entonces puedes medir la velocidad de una reacción que requiere más de un período de tiempo para completarse 10 -8 seg. También es posible medir la tasa de sustitución de moléculas de agua coordinadas en varios iones metálicos con ligandos SO 2-4, S 2 O 3 2-, EDTA, etc. (26). La velocidad de esta reacción. Depende de la concentración del ion metálico hidratado y no depende de la concentración del ligando entrante, lo que permite utilizar la ecuación de primer orden (27) para describir la velocidad de estos sistemas. En muchos casos, la velocidad de reacción (27) para un ion metálico dado no depende de la naturaleza del ligando entrante (L), ya sean moléculas de H 2 O o SO 4 2-, S 2 O 3 2-, o Iones EDTA. Esta observación, junto con el hecho de que la ecuación de velocidad para este proceso no incluye la concentración del ligando influyente, sugiere que estas reacciones se desarrollan mediante un mecanismo en el que el paso lento implica romper el enlace entre el ion metálico y el agua. Es probable que el compuesto resultante coordine rápidamente los ligandos cercanos. Insecto. 4 de este capítulo se afirmó que los iones metálicos hidratados más cargados, como Al 3+ y Sc 3+, intercambian moléculas de agua más lentamente que los iones M 2+ y M +; Esto da motivos para suponer que la ruptura de vínculos juega un papel importante en la etapa que determina el ritmo de todo el proceso. Las conclusiones obtenidas en estos estudios no son concluyentes, pero dan motivos para creer que los procesos S N 1 son importantes en las reacciones de sustitución de iones metálicos hidratados. Probablemente los compuestos complejos más estudiados sean las aminas de cobalto (III). Su estabilidad, facilidad de preparación y reacciones lentas los hacen particularmente adecuados para estudios cinéticos. Dado que los estudios de estos complejos se llevaron a cabo exclusivamente en soluciones acuosas, primero debemos considerar las reacciones de estos complejos con moléculas de solvente: el agua. Se descubrió que, en general, las moléculas de amoníaco o de amina coordinadas por el ion Co(III) son reemplazadas tan lentamente por moléculas de agua que generalmente se considera la sustitución de ligandos distintos de las aminas. Se estudió la velocidad de reacciones de tipo (28) y se encontró que era de primer orden en relación con el complejo de cobalto (X es uno de muchos aniones posibles). Dado que en soluciones acuosas la concentración de H 2 O es siempre aproximadamente 55,5 millones, entonces es imposible determinar el efecto de cambiar la concentración de moléculas de agua en la velocidad de reacción. Las ecuaciones de velocidad (29) y (30) para una solución acuosa no se pueden distinguir experimentalmente, ya que k es simplemente igual a k" = k". Por lo tanto, es imposible decir a partir de la ecuación de velocidad de reacción si el H2O participará en el paso del proceso que determina la velocidad. La respuesta a la pregunta de si esta reacción se produce mediante el mecanismo S N 2 con la sustitución del ion X por una molécula de H 2 O o mediante el mecanismo S N 1, que implica primero una disociación seguida de la adición de una molécula de H 2 O, debe obtenerse utilizando otros datos experimentales. Este problema se puede resolver mediante dos tipos de experimentos. Tasa de hidrólisis (reemplazo de un ion Cl - por molécula de agua) trance- + es aproximadamente 10 3 veces mayor que la tasa de hidrólisis 2+. Un aumento de la carga del complejo conduce al fortalecimiento de los enlaces metal-ligando y, en consecuencia, a la inhibición de la escisión de estos enlaces. También se debe tener en cuenta la atracción de los ligandos entrantes y la facilitación de la reacción de sustitución. Dado que se encontró una disminución en la velocidad a medida que aumentaba la carga del complejo, en este caso parece más probable un proceso disociativo (S N 1). Otro método de prueba se basa en el estudio de la hidrólisis de una serie de complejos similares trance- + . En estos complejos, la molécula de etilendiamina se reemplaza por diaminas similares, en las que los átomos de hidrógeno en el átomo de carbono se reemplazan por grupos CH 3. Los complejos que contienen diaminas sustituidas reaccionan más rápido que el complejo de etilendiamina. Reemplazar átomos de hidrógeno con grupos CH 3 aumenta el volumen del ligando, lo que hace más difícil que el átomo de metal sea atacado por otro ligando. Estos impedimentos estéricos ralentizan la reacción a través del mecanismo S N 2. La presencia de ligandos voluminosos cerca del átomo metálico promueve el proceso disociativo, ya que la eliminación de uno de los ligandos reduce su acumulación en el átomo metálico. El aumento observado en la velocidad de hidrólisis de complejos con ligandos voluminosos es una buena evidencia de que la reacción se desarrolla según el mecanismo S N 1. Entonces, como resultado de numerosos estudios de complejos de acidoamina Co (II), resultó que la sustitución de grupos ácido por moléculas de agua es un proceso de naturaleza disociativa. El enlace átomo-ligando de cobalto se extiende hasta un cierto valor crítico antes de que las moléculas de agua comiencen a ingresar al complejo. En complejos con una carga de 2+ y superior, es muy difícil romper el enlace cobalto-ligando y la entrada de moléculas de agua comienza a jugar un papel más importante. Se ha descubierto que la sustitución del grupo ácido (X -) en el complejo de cobalto(III) por un grupo distinto de la molécula de H2O, (31) pasa primero por su sustitución por una molécula disolvente - agua, seguido de su sustitución por un nuevo grupo Y (32). Por tanto, en muchas reacciones con complejos de cobalto (III), la velocidad de reacción (31) es igual a la velocidad de hidrólisis (28). Sólo el ion hidroxilo se diferencia de los demás reactivos por su reactividad con las aminas Co(III). Reacciona muy rápidamente con complejos de amina de cobalto (III) (aproximadamente 10 6 veces más rápido que el agua) según el tipo de reacción. hidrólisis básica (33). Se encontró que esta reacción era de primer orden con respecto al ligando de sustitución OH - (34). El segundo orden general de la reacción y el progreso inusualmente rápido de la reacción sugieren que el ion OH - es un reactivo nucleofílico excepcionalmente eficiente para los complejos de Co (III) y que la reacción procede a través del mecanismo S N 2 mediante la formación de un intermedio. Sin embargo, esta propiedad del OH - también puede explicarse por otro mecanismo [ecuaciones (35), (36)]. En la reacción (35), el complejo 2+ se comporta como un ácido (según Brønsted), dando el complejo +, que es amido-(que contiene)-compuesto - base correspondiente al ácido 2+. Luego, la reacción procede a través del mecanismo S N 1 (36) para formar un intermedio de cinco coordenadas, que reacciona aún más con las moléculas de disolvente para producir el producto de reacción final (37). Este mecanismo de reacción es consistente con la velocidad de una reacción de segundo orden y corresponde al mecanismo S N 1. Dado que la reacción en la etapa que determina la velocidad involucra una base conjugada con el complejo original, el ácido, este mecanismo recibe la designación S N 1 CB. Es muy difícil determinar cuál de estos mecanismos explica mejor las observaciones experimentales. Sin embargo, existe evidencia convincente que respalda la hipótesis S N 1CB. Los mejores argumentos a favor de este mecanismo son los siguientes: los complejos octaédricos de Co(III) generalmente reaccionan mediante el mecanismo disociativo S N 1, y no existe ningún argumento convincente de por qué el ion OH - debería mediar en el proceso S N 2. Se ha establecido que el ion hidroxilo es un reactivo nucleofílico débil en reacciones con Pt(II) y, por tanto, su reactividad inusual con Co(III) parece irrazonable. Las reacciones con compuestos de cobalto (III) en medios no acuosos proporcionan evidencia excelente de la formación de intermedios de cinco coordenadas proporcionada por el mecanismo S N 1 SV. La prueba final es el hecho de que, en ausencia de enlaces N - H en el complejo Co(III), éste reacciona lentamente con los iones OH -. Esto, por supuesto, sugiere que las propiedades ácido-base del complejo son más importantes que las propiedades nucleofílicas del OH para la velocidad de la reacción". Esta reacción de hidrólisis básica de complejos de amina Co(III) ilustra el hecho de que los datos cinéticos A menudo puede interpretarse de más de una manera, y para excluir uno u otro posible mecanismo es necesario llevar a cabo un experimento bastante delicado. Actualmente se han estudiado reacciones de sustitución de una gran cantidad de compuestos octaédricos. Si consideramos sus mecanismos de reacción, el más común es el proceso disociativo. Este resultado no es inesperado ya que seis ligandos dejan poco espacio alrededor del átomo central para que otros grupos se unan a él. Sólo hay unos pocos ejemplos en los que se ha demostrado la aparición de un intermedio de siete coordenadas o se ha detectado la influencia de un ligando interviniente. Por lo tanto, el mecanismo S N 2 no puede descartarse por completo como una posible vía para reacciones de sustitución en complejos octaédricos. Las reacciones de los compuestos de coordinación siempre ocurren en la esfera de coordinación de un metal con ligandos unidos a ella. Por lo tanto, es obvio que para que suceda algo, los ligandos deben poder caer en esta esfera. Esto puede pasar de dos maneras: Ya nos familiarizamos con el primer método cuando analizamos la insaturación de coordinación y la regla de los 18 electrones. Nos ocuparemos del segundo aquí. Pero normalmente existe una regla tácita: el número de puestos de coordinación ocupados no cambia. En otras palabras, el recuento de electrones no cambia durante la sustitución. La sustitución de un tipo de ligando por otro es bastante posible y, a menudo, ocurre en la realidad. Sólo prestemos atención al correcto manejo de las cargas al cambiar el ligando L por el ligando X y viceversa. Si nos olvidamos de esto, entonces el estado de oxidación del metal cambiará y el reemplazo de ligandos no es un proceso de oxidación-reducción (si encuentra o se le ocurre un ejemplo opuesto, hágamelo saber; se acreditará automáticamente). lejos, si no puedo probar que estabas equivocado, e incluso en este caso, te garantizo una contribución positiva al karma). Con ligandos más complejos no hay más dificultades; sólo hay que recordar una regla bastante obvia: se mantiene el número de sitios de ligando (es decir, el número total de ligandos o centros de ligando de tipo X o L). Esto se deriva directamente de la conservación del conteo de electrones. He aquí ejemplos evidentes. Prestemos atención al último ejemplo. El reactivo inicial para esta reacción es dicloruro de hierro FeCl 2 . Hasta hace poco hubiéramos dicho: “Es sólo sal, ¿qué tiene que ver la química de coordinación con ella?” Pero ya no nos permitiremos semejante ignorancia. En la química de los metales de transición no existen “simples sales”, sino que todos los derivados son compuestos de coordinación, a los que se aplican todas las consideraciones sobre el recuento de electrones, la configuración d, la saturación de coordinación, etc. El dicloruro de hierro, como estamos acostumbrados a escribirlo, resultaría ser un complejo Fe(2+) de tipo MX 2 con configuración d 6 y número de electrones 10. ¡No es suficiente! ¿Bien? Después de todo, ya hemos descubierto que los ligandos pueden estar implícitos. Para realizar la reacción necesitamos un disolvente y, para este tipo de reacciones, lo más probable es que sea THF. La disolución de la sal de hierro cristalina en THF se produce precisamente porque el disolvente donante ocupa espacios libres y la energía de este proceso compensa la destrucción de la red cristalina. No podríamos disolver esta "sal" en un disolvente que no proporcione los servicios de solvatación de metales debido a la basicidad de Lewis. En este caso, y en un millón de casos similares, la solvatación es simplemente una interacción de coordinación. Escribimos, solo para mayor precisión, el resultado de la solvatación en forma del complejo FeX 2 L 4, en el que dos iones de cloro permanecen en la esfera de coordinación en forma de dos ligandos X, aunque lo más probable es que también sean desplazados por moléculas del disolvente donante con formación de un complejo cargado FeL 6 2+. En este caso no es tan importante. De cualquier manera, podemos asumir con seguridad que tenemos un complejo de 18 electrones tanto a la izquierda como a la derecha. Si recordamos la química orgánica, entonces había dos mecanismos de sustitución en un átomo de carbono saturado: SN1 y SN2. En la primera, la sustitución se produjo en dos etapas: el antiguo sustituyente primero se fue, dejando un orbital vacío en el átomo de carbono, que luego fue ocupado por un nuevo sustituyente con un par de electrones. El segundo mecanismo suponía que la salida y la llegada se llevaban a cabo simultáneamente, en concierto, y que el proceso era de una sola etapa. En la química de los compuestos de coordinación, es muy posible imaginar algo similar. Pero aparece una tercera posibilidad, que el átomo de carbono saturado no tenía: primero agregamos un nuevo ligando y luego separamos el viejo. Inmediatamente queda claro que esta tercera opción es difícilmente posible si el complejo ya tiene 18 electrones y está saturado de coordinación. Pero es muy posible si el número de electrones es 16 o menos, es decir, el complejo está insaturado. Recordemos de inmediato la analogía obvia de la química orgánica: la sustitución nucleófila en un átomo de carbono insaturado (en un anillo aromático o en un carbono carbonilo) también ocurre primero como la adición de un nuevo nucleófilo y luego la eliminación del anterior. Entonces, si tenemos 18 electrones, entonces la sustitución ocurre como una abstracción-suma (los fanáticos de las palabras "inteligentes" usan el término disociativo-asociativo o simplemente mecanismo disociativo). Otra forma requeriría expandir la esfera de coordinación a 20 electrones. Esto no es absolutamente imposible, e incluso a veces se consideran estas opciones, pero ciertamente no es muy rentable y siempre, en caso de sospecha de este camino, se requieren pruebas muy importantes. En la mayoría de estas historias, los investigadores finalmente concluyeron que habían pasado por alto o se habían perdido algo, y el mecanismo asociativo fue rechazado. Entonces, si el complejo original tiene 18 electrones, primero debe salir un ligando y luego uno nuevo debe ocupar su lugar, por ejemplo: Si queremos introducir un haptoligando que ocupe varios sitios en la esfera de coordinación, primero debemos vaciarlos todos. Como regla general, esto ocurre solo en condiciones bastante severas, por ejemplo, para reemplazar tres carbonilos en el carbonilo de cromo con η 6 -benceno, la mezcla se calienta bajo presión durante muchas horas, liberando de vez en cuando el monóxido de carbono liberado. Aunque el diagrama muestra la disociación de tres ligandos con la formación de un complejo muy insaturado con 12 electrones, en realidad lo más probable es que la reacción se produzca por etapas, dejando un carbonilo a la vez, y el benceno entrando en la esfera, aumentando gradualmente la hapticidad, a través de la etapas menos CO - digapto - menos un CO más - tetrahapto - menos un CO más - hexagapto, de manera que no se obtienen menos de 16 electrones. Entonces, si tenemos un complejo con 16 electrones o menos, entonces lo más probable es que el reemplazo del ligando ocurra como una adición-eliminación (para aquellos a quienes les gustan las palabras profundas: asociativo-disociativo o simplemente asociativo): el nuevo ligando llega primero , entonces el viejo se va. Surgen dos preguntas obvias: por qué se va el viejo ligando, porque 18 electrones son muy buenos, y por qué no hacer lo contrario en este caso, como en los complejos de 18 electrones. La primera pregunta es fácil de responder: cada metal tiene sus propios hábitos, y algunos metales, especialmente los tardíos, con capas d casi completamente llenas, prefieren el recuento de 16 electrones y los tipos estructurales correspondientes y, por lo tanto, descartan el ligando sobrante. , volviendo a su configuración favorita. A veces también interfiere el factor espacial: los ligandos existentes son grandes y el adicional se siente como un pasajero de autobús en hora punta. Es más fácil bajarse y dar un paseo que sufrir así. Sin embargo, puedes empujar a otro pasajero, dejarlo caminar y nos iremos. La segunda pregunta también es sencilla: en este caso, el mecanismo disociativo tendría que dar primero un complejo de 14 electrones, lo que rara vez resulta beneficioso. He aquí un ejemplo. Para variar, reemplacemos el ligando X con un ligando L, y no nos confundiremos sobre los estados de oxidación y las cargas. Una vez más: tras la sustitución, el estado de oxidación no cambia, y si el ligando X se ha ido, entonces la pérdida debe ser compensada por la carga del metal. Si nos olvidamos de esto, entonces el número de oxidación disminuiría en 1, pero esto es incorrecto. Y una cosa más extraña. Se formó un enlace metal-piridina debido al par solitario del nitrógeno. En química orgánica, en este caso definitivamente mostraríamos una ventaja en el nitrógeno de piridina (por ejemplo, tras la protonación o formación de una sal cuaternaria), pero nunca hacemos esto en química de coordinación ni con piridina ni con ningún otro ligando L. Esto es terriblemente molesto para todos los que están acostumbrados al sistema estricto e inequívoco de dibujar estructuras en química orgánica, pero tendrás que acostumbrarte, no es tan difícil. Pero no existe un análogo exacto del SN2 en la química de los compuestos de coordinación; existe uno lejano, pero es relativamente raro y realmente no lo necesitamos. No podríamos hablar en absoluto de los mecanismos de sustitución de ligandos si no fuera por una circunstancia sumamente importante que utilizaremos mucho: la sustitución de ligandos, ya sea asociativa o disociativa, presupone necesariamente la disociación del antiguo ligando. Y es muy importante para nosotros saber qué ligandos salen fácilmente y cuáles salen mal, prefiriendo permanecer en la esfera de coordinación del metal. Como veremos pronto, en cualquier reacción algunos de los ligandos permanecen en la esfera de coordinación y no cambian. Estos ligandos generalmente se denominan ligandos espectadores (si no desea palabras tan simples y "poco científicas", use la palabra inglesa espectador en la transcripción local espectador, ligando espectador, pero, se lo ruego, no espectador, ¡esto es insoportable!) . Y algunos participan directamente en la reacción, convirtiéndose en productos de reacción. Estos ligandos se denominan actores (¡no actores!), es decir, activos. Está bastante claro que los ligandos-actores deben introducirse y retirarse fácilmente en la esfera de coordinación del metal; de lo contrario, la reacción simplemente se estancará. Pero es mejor dejar a los ligandos espectadores en la esfera de la coordinación por muchas razones, pero al menos por una tan banal como la necesidad de evitar alborotos innecesarios en torno al metal. Es mejor que sólo los actores ligandos y en las cantidades requeridas puedan participar en el proceso deseado. Si hay más sitios de coordinación disponibles de los necesarios, es posible que se asienten en ellos actores de ligando adicionales, e incluso aquellos que participarán en reacciones secundarias, lo que reducirá el rendimiento del producto objetivo y la selectividad. Además, los ligandos espectadores casi siempre realizan muchas funciones importantes, por ejemplo, aseguran la solubilidad de los complejos, estabilizan el estado de valencia correcto del metal, especialmente si no es del todo normal, ayudan a las etapas individuales, proporcionan estereoselectividad, etc. No lo descifraremos todavía, porque discutiremos todo esto en detalle cuando lleguemos a reacciones específicas. Resulta que algunos de los ligandos en la esfera de coordinación deberían estar estrechamente unidos y no ser propensos a disociarse y reemplazarse por otros ligandos. Estos ligandos suelen denominarse coordinadamente estable
. O simplemente estable, si del contexto se desprende claramente que estamos hablando de la fuerza de los enlaces de los ligandos, y no de su propia estabilidad termodinámica, lo que no nos concierne en absoluto. Y los ligandos que entran y salen fácil y voluntariamente, y siempre están listos para dar paso a otros, se llaman coordinación lábil
, o simplemente lábil, y aquí, afortunadamente, no hay ambigüedades. Este es probablemente el ejemplo más sorprendente del hecho de que en la esfera de coordinación una molécula muy inestable puede convertirse en un excelente ligando y, por definición, en una coordinación estable, aunque sólo sea porque si se atreve a abandonar la esfera cálida y acogedora del exterior, nada bueno le saldrá. espérelo (a costa de la producción será precisamente la energía de la desestabilización anti-aromática). El ciclobutadieno y sus derivados son los ejemplos más conocidos de antiaromaticidad. Estas moléculas existen solo a bajas temperaturas y en una forma muy distorsionada: para alejarse lo más posible de la antiaromaticidad, el ciclo se distorsiona en un rectángulo alargado, eliminando la deslocalización y debilitando al máximo la conjugación de dobles enlaces (esto también se llama el efecto Jahn-Teller de segundo tipo: sistema degenerado, y el cuadrado de ciclobutadieno es un birradical degenerado, recuerde el círculo de Frost: está distorsionado y reduce la simetría para eliminar la degeneración). Pero en los complejos, el ciclobutadieno y los ciclobutadienos sustituidos son excelentes ligandos tetrahapto, y la geometría de dichos ligandos es exactamente un cuadrado, con longitudes de enlace idénticas. Cómo y por qué sucede esto es una historia aparte, y no tan obvia como a menudo se cree. Es necesario comprender que no existe una valla de hormigón armado con alambre de púas y torres de seguridad entre las zonas de ligandos lábiles y estables. En primer lugar, depende del metal y LMKO funciona bien en este contexto. Por ejemplo, los metales de transición tardíos prefieren ligandos blandos, mientras que los metales de transición tempranos prefieren los duros. Digamos que el yoduro se adhiere muy firmemente a los átomos d 8 de paladio o platino, pero rara vez ingresa a la esfera de coordinación del titanio o circonio en la configuración d 0. Pero en muchos complejos metálicos con características menos pronunciadas, el yoduro se manifiesta como un ligando completamente lábil, que fácilmente da paso a otros. Siendo el resto de las cosas iguales: Repitámoslo todo de nuevo, solo que del otro lado. En la esfera de coordinación de los metales generalmente se conservan (coordinacionalmente estables): La última condición parece extraña, pero imagina un complejo que tiene muchos ligandos diferentes, entre los cuales no hay ninguno absolutamente estable (ni quelantes ni polihaptoligandos). Luego, en las reacciones, los ligandos cambiarán, relativamente hablando, en orden de labilidad relativa. Los menos lábiles y los últimos en quedarse. Este truco ocurre, por ejemplo, cuando utilizamos complejos de paladio-fosfina. Las fosfinas son ligandos relativamente estables, pero cuando hay muchos y el metal es rico en electrones (d 8, d 10), dan paso, uno tras otro, a ligandos actores. Pero el último ligando de fosfina suele permanecer en la esfera de coordinación, lo que es muy bueno desde el punto de vista de las reacciones en las que participan estos complejos. Volveremos sobre esta importante cuestión más adelante. He aquí un ejemplo bastante típico en el que sólo queda una “última” fosfina de la esfera de coordinación inicial del complejo de paladio-fosfina en la reacción de Heck. Este ejemplo nos acerca mucho al concepto más importante en las reacciones de los complejos de metales de transición: el concepto de control de ligandos. Lo discutiremos más tarde. Al reemplazar algunos ligandos por otros, es importante no exagerar la reactividad del ligando entrante. Cuando se trata de reacciones de moléculas orgánicas, es importante para nosotros llevar exactamente una molécula de cada reactivo a la esfera de coordinación. Si entran dos moléculas en lugar de una, existe una alta probabilidad de que se produzcan reacciones secundarias en las que intervengan dos ligandos idénticos. También es posible una pérdida de reactividad debido a la saturación de la esfera de coordinación y la imposibilidad de introducir en ella otros ligandos necesarios para el proceso esperado. Este problema surge especialmente cuando se introducen en la esfera de coordinación nucleófilos aniónicos fuertes, por ejemplo, carbaniones. Para evitarlo se utilizan derivados menos reactivos, en los que, en lugar del catión de metal alcalino, que determina la alta ionicidad del enlace, se utilizan metales y metaloides menos electropositivos (zinc, estaño, boro, silicio, etc.), formando enlaces covalentes con la parte nucleofílica. Las reacciones de tales derivados con derivados de metales de transición producen productos de sustitución de ligandos, en principio como si el nucleófilo estuviera en forma aniónica, pero debido a la nucleofilicidad reducida con menos complicaciones y sin reacciones secundarias. Estas reacciones de sustitución de ligandos suelen denominarse transmetalación para enfatizar el hecho obvio de que el nucleófilo parece cambiar los metales, de más electropositivos a menos electropositivos. Este nombre, por lo tanto, contiene un elemento de esquizofrenia desagradable: parecía que ya habíamos acordado que miraríamos todas las reacciones desde el punto de vista de un metal de transición, pero de repente volvimos a perder el control y miramos esta reacción y solo esta reacción. desde el punto de vista de un nucleófilo. Habrá que tener paciencia, así es como se ha desarrollado y se acepta la terminología. De hecho, esta palabra se remonta a la química temprana de los compuestos organometálicos y al hecho de que la acción de los compuestos de litio o organomagnesio sobre haluros de varios metales y metaloides es uno de los principales métodos para la síntesis de todos los compuestos organometálicos, principalmente los de intransición. , y la reacción que estamos considerando ahora en química de compuestos de coordinación de metales de transición es simplemente una generalización del antiguo método de química organometálica del que surgió todo. La remetalación es similar y no similar a la sustitución convencional. Parece que si consideramos que un reactivo organometálico sin transición es simplemente un carbanión con un contraión, entonces el enlace carbono-metal sin transición es iónico. Pero esta idea parece ser cierta sólo para los metales más electropositivos: el magnesio. Pero ya en el caso del zinc y el estaño esta idea está muy lejos de la realidad. Por tanto, en la reacción entran dos enlaces σ y cuatro átomos en sus extremos. Como resultado, se forman dos nuevos enlaces σ y cuatro átomos se unen entre sí en diferente orden. Lo más probable es que todo esto ocurra simultáneamente en un estado de transición de cuatro miembros, y la reacción en sí tiene un carácter concertado, como tantas otras reacciones de metales de transición. La abundancia de electrones y orbitales para literalmente todos los gustos y todo tipo de simetrías hace que los metales de transición sean capaces de mantener simultáneamente enlaces en estados de transición con varios átomos. En el caso de la remetalación, obtenemos un caso especial de un proceso muy general, que se denomina simplemente metátesis del enlace σ. No los confunda únicamente con la verdadera metátesis de olefinas y acetilenos, que son reacciones catalíticas en toda regla con sus propios mecanismos. En este caso hablamos del mecanismo de transmetalación u otro proceso en el que ocurre algo similar.

Reacciones de ligandos coordinados.










Reacciones de compuestos organometálicos.



Los ligandos de cualquier tipo pueden sustituirse en cualquier combinación.
Sustitución que involucra ligandos hapto.

La sustitución, adición y disociación de ligandos están estrecha e inextricablemente vinculadas.



Ligandos estables y lábiles.
Ciclobutadieno como ligando
Ligandos lábiles de coordinación.
Ligandos coordinativamente estables

Remetalación

¿Cómo ocurre la transmetalación?