Las sustancias más asombrosas. Registros químicos ¿Cuáles son los dos elementos químicos más ligeros?
Presentamos una selección de registros químicos del Libro Guinness de los Récords.
Debido al hecho de que constantemente se descubren nuevas sustancias, esta colección no es constante.
Registros químicos para sustancias inorgánicas
- El elemento más abundante en la corteza terrestre es el oxígeno O. Su contenido en peso es el 49% de la masa de la corteza terrestre.
- El elemento más raro de la corteza terrestre es el astato At. Su contenido en toda la corteza terrestre es de solo 0,16 gramos. El segundo más raro es Francium Fr.
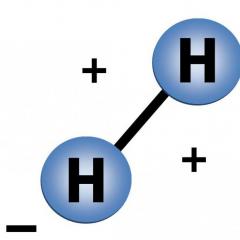
- El elemento más abundante en el universo es el hidrógeno H. Aproximadamente el 90% de todos los átomos del universo son hidrógeno. El segundo más común en el universo es el helio He.
- El agente oxidante estable más fuerte es un complejo de difluoruro de criptón y pentafluoruro de antimonio. Debido a su fuerte efecto oxidante (oxida casi todos los elementos a los estados de oxidación más altos, incluido el oxígeno en el aire), le resulta muy difícil medir el potencial del electrodo. El único disolvente que reacciona con él con la suficiente lentitud es el fluoruro de hidrógeno anhidro.
- La sustancia más densa del planeta Tierra es el osmio. La densidad del osmio es 22,587 g / cm 3.
- El metal más ligero es el litio Li. La densidad del litio es de 0,543 g / cm 3.
- El compuesto más denso es el carburo de reparto W 2 C. La densidad del carburo de reparto es de 17,3 g / cm 3.
- En la actualidad, los aerogeles de grafeno son los sólidos con menor densidad. Son un sistema de grafeno y nanotubos llenos de espacios de aire. El más ligero de estos aerogeles tiene una densidad de 0,00016 g / cm 3. El sólido anterior de menor densidad es el aerogel de silicio (0,005 g / cm 3). El aerogel de silicio se usa para recolectar micrometeoritos presentes en las colas de los cometas.
- El gas más ligero y, al mismo tiempo, el no metálico más ligero es el hidrógeno. La masa de 1 litro de hidrógeno es solo 0.08988 g. Además, el hidrógeno es también el no metal de bajo punto de fusión a presión normal (el punto de fusión es -259,19 0 С).
- El líquido más ligero es el hidrógeno líquido. La masa de 1 litro de hidrógeno líquido es de solo 70 gramos.
- El gas inorgánico más pesado a temperatura ambiente es el hexafluoruro de tungsteno WF 6 (el punto de ebullición es de +17 0 C). La densidad del hexafluoruro de tungsteno como gas es de 12,9 g / l. Entre los gases con un punto de ebullición por debajo de 0 ° C, el récord lo tiene el hexafluoruro de telurio TeF 6 con una densidad de gas a 25 ° C de 9,9 g / l.
- El metal más caro del mundo es Californian Cf. El precio de 1 gramo de isótopo 252 Cf alcanza los 500 mil dólares estadounidenses.
- Helio Es la sustancia con el punto de ebullición más bajo. Su punto de ebullición es -269 0 С. El helio es la única sustancia que no tiene un punto de fusión a presión normal. Incluso en el cero absoluto, permanece líquido y solo se puede obtener en forma sólida bajo presión (3 MPa).
- El metal más refractario y la sustancia con el punto de ebullición más alto es el tungsteno W. El punto de fusión del tungsteno es +3420 0 С, y el punto de ebullición es +5680 0 С.
- El material más refractario es una aleación de carburos de hafnio y tántalo (1: 1) (punto de fusión +4215 0 С)
- El metal de menor punto de fusión es el mercurio. El punto de fusión del mercurio es -38,87 0 С. El mercurio también es el líquido más pesado, su densidad a 25 ° C es 13,536 g / cm 3.
- El metal más resistente a los ácidos es el iridio. Hasta ahora, no se conocen ácidos o mezclas de los mismos en los que se disuelva el iridio. Sin embargo, se puede disolver en álcalis con agentes oxidantes.
- El ácido estable más fuerte es una solución de pentafluoruro de antimonio en fluoruro de hidrógeno.
- El metal más duro es el cromo Cr.
- El metal más blando a 25 ° C es el cesio.
- El material más duro sigue siendo el diamante, aunque ya hay una docena de sustancias que se acercan a él en dureza (carburo y nitruro de boro, nitruro de titanio, etc.).
- El metal más conductor a temperatura ambiente es la plata Ag.
- La velocidad más baja del sonido en helio líquido es de 2,18 K, es de solo 3,4 m / s.
- La velocidad más alta del sonido en un diamante es de 18.600 m / s.
- El isótopo con la vida media más corta es el Li-5, que decae en 4,4 · 10-22 segundos (explosión de protones). Debido a una vida tan corta, no todos los científicos reconocen el hecho de su existencia.
- El isótopo con la vida media medida más larga es el Te-128, con una vida media de 2,2 × 1024 años (desintegración doble beta).
- El xenón y el cesio tienen los isótopos más estables (36 cada uno).
- El boro y el yodo tienen los nombres más cortos para un elemento químico (3 letras cada uno).
- Los nombres más largos del elemento químico (once letras cada uno) tienen protactinium Pa, rutherfordium Rf, darmstadtium Ds.
Registros químicos de materia orgánica
- El gas orgánico más pesado a temperatura ambiente y el gas más pesado entre todos a temperatura ambiente es N- (octafluorobut-1-iliden) -O-trifluorometilhidroxilamina (pe +16 C). Su densidad como gas es de 12,9 g / l. Entre los gases con un punto de ebullición por debajo de 0 ° C, el récord lo tiene el perfluorobutano con una densidad de gas a 0 ° C de 10,6 g / l.
- La sustancia más amarga es el sacarinato de denatonio. La combinación de benzoato de denatonio con sacarina de sodio dio a la sustancia 5 veces más amarga que el poseedor del récord anterior (benzoato de denatonio).
- La materia orgánica menos tóxica es el metano. Con un aumento en su concentración, la intoxicación ocurre debido a la falta de oxígeno y no como resultado de una intoxicación.
- El adsorbente más fuerte para el agua se obtuvo en 1974 a partir de un derivado de almidón, acrilamida y ácido acrílico. Esta sustancia es capaz de retener agua, cuya masa es 1300 veces la suya.
- El adsorbente más fuerte para los productos derivados del petróleo es el aerogel de carbono. 3,5 kg de esta sustancia pueden absorber 1 tonelada de aceite.
- Los compuestos más ofensivos son el etilselenol y el butil mercaptano; su olor se asemeja a una combinación de olores de repollo podrido, ajo, cebollas y aguas residuales al mismo tiempo.
- La sustancia más dulce es el ácido N - ((2,3-metilendioxifenilmetilamino) - (4-cianofenilimino) metil) aminoacético (lugduname). Esta sustancia es 205.000 veces más dulce que una solución de sacarosa al 2%. Hay varios análogos con dulzura similar. La sustancia industrial más dulce es la talina (un complejo de taumatina y sales de aluminio), que es entre 3500 y 6000 veces más dulce que la sacarosa. Recientemente, el neotame ha aparecido en la industria alimentaria con un dulzor 7000 veces superior al de la sacarosa.
- La enzima más lenta es la nitrogenasa, que cataliza la asimilación del nitrógeno atmosférico por las bacterias de los nódulos. El ciclo completo de conversión de una molécula de nitrógeno en 2 iones de amonio toma un segundo y medio.
- La sustancia orgánica con mayor contenido de nitrógeno es la bis (diazotetrazolil) hidracina C2H2N12, que contiene un 86,6% de nitrógeno, o tetraazidometano C (N3) 4, que contiene un 93,3% de nitrógeno (dependiendo de si esta última se considera orgánica o no) ... Son explosivos extremadamente sensibles a los golpes, la fricción y el calor. De las sustancias inorgánicas, el registro pertenece, por supuesto, al nitrógeno gaseoso, y de los compuestos, al ácido hidrazoico HN 3.
- El nombre químico más largo tiene 1578 caracteres en inglés y es una secuencia de nucleótidos modificada. Esta sustancia se llama Adenosene. N - 2′-O- (tetrahidrometoxipiranil) adenilil- (3 '→ 5 ′) - 4-desamino-4- (2,4-dimetilfenoxi) -2′-O- (tetrahidrometoxipiranil) citidilil- (3' → 5 ′ ) -4-deamino-4- (2,4-dimetilfenoxi) -2'-O- (tetrahidrometoxipiranil) citidilil- (3 '→ 5') - N - 2'-O- (tetrahidrometoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) guanilil- (3' → 5 ′) - N- -2′- O- (tetrahidrometoxipiranil) guanilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) adenilil- (3' → 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) citidilil- (3 ' → 5 ') - 4-desamino-4- (2,4-dimetilfenoxi) -2'-O- (tetrahidrometoxipiranil) citidilil- (3' → 5 ') - 4-desamino-4- (2,4-dimetilfenoxi) -2′-O- (tetrahidrometoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) guanilil- (3' → 5 ′) - 4-desamino- 4- (2,4- dimetilfenoxi) -2′-O- (tetrahidrometoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) citidilil- (3' → 5 ′) - N --2′-O- ( tetrahidrometoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) adenilil- (3' → 5 ′) - N - 2′-O- (tetrahidro metoxipiranil) citidilil- (3 '→ 5 ′) - N - 2′-O- (tetrahidrometoxipiranil) citidilil- (3' → 5 ′) - N - 2 ′, 3′-O- (metoximetileno) -octadecakis (2- éster de clorofenilo. cinco'-.
- El nombre químico más largo es ADN aislado de mitocondrias humanas y consta de 16569 pares de bases. El nombre completo de este compuesto contiene unos 207.000 caracteres.
- El sistema del mayor número de líquidos inmiscibles, nuevamente estratificados en componentes después de la mezcla, contiene 5 líquidos: aceite mineral, aceite de silicona, agua, alcohol bencílico y N-perfluoroetil perfluoropiridina.
- El líquido orgánico más denso a temperatura ambiente es el diyodometano. Su densidad es de 3,3 g / cm3.
- Las sustancias orgánicas individuales más refractarias son algunos compuestos aromáticos. De los condensados, este es tetrabenzheptaceno (punto de fusión +570 C), y de los no condensados, es p-septifenilo (punto de fusión +545 C). Hay compuestos orgánicos para los que el punto de fusión no se mide con precisión, por ejemplo, para el hexabenzocoroneno se indica que su punto de fusión es superior a 700 C. El producto de la reticulación por temperatura del poliacrilonitrilo se descompone a una temperatura de aproximadamente 1000 C.
- La sustancia orgánica con el punto de ebullición más alto es el hexatriaconilciclohexano. Hierve a + 551 ° C.
- El alcano más largo es C390H782 no contaminante. Fue sintetizado especialmente para estudiar la cristalización del polietileno.
- La proteína más larga es la titina, la proteína muscular. Su longitud depende del tipo de organismo vivo y la localización. La titina de ratón, por ejemplo, tiene 35.213 residuos de aminoácidos (peso molecular 3.906.488 Da), la titina humana tiene una longitud de hasta 33.423 residuos de aminoácidos (peso molecular 3.713.712 Da).
- El genoma más largo es el genoma de la planta Paris japonica. Contiene 150,000,000,000 pares de bases, 50 veces más que los humanos (3,200,000,000 pares de bases).
- La molécula más grande es el ADN del primer cromosoma humano. Contiene alrededor de 10,000,000,000 de átomos.
- El explosivo individual con la tasa de detonación más alta es el 4,4'-dinitroazofuroxano. Su velocidad de detonación medida fue de 9700 m / s. Según datos no verificados, el perclorato de etilo tiene una tasa de detonación aún mayor.
- El explosivo individual con mayor calor de explosión es el dinitrato de etilenglicol. Su calor de explosión es de 6606 kJ / kg.
- El ácido orgánico más fuerte es el pentacianociclopentadieno.
- La base más fuerte es posiblemente 2-metilciclopropenil-litio. La base no iónica más fuerte es el fosfaceno, una estructura bastante compleja.
El universo esconde muchos secretos en sus profundidades. Durante mucho tiempo, la gente ha intentado desentrañar la mayor cantidad de ellos posible y, a pesar de que esto no siempre es posible, la ciencia avanza a pasos agigantados, lo que nos permite conocer cada vez más nuestros orígenes. Entonces, por ejemplo, muchos estarán interesados en lo que es lo más común en el Universo. La mayoría de la gente pensará inmediatamente en el agua, y en parte tendrá razón, porque el elemento más común es el hidrógeno.
El elemento más abundante del universo.
Es extremadamente raro que las personas tengan que lidiar con hidrógeno puro. Sin embargo, en la naturaleza, se encuentra muy a menudo en conexión con otros elementos. Por ejemplo, al reaccionar con el oxígeno, el hidrógeno se convierte en agua. Y esto está lejos de ser el único compuesto que contiene este elemento, se encuentra en todas partes, no solo en nuestro planeta, sino también en el espacio.
Cómo apareció la Tierra
Hace muchos millones de años, el hidrógeno, sin exagerar, se convirtió en un material de construcción para todo el Universo. Después de todo, después del Big Bang, que se convirtió en la primera etapa en la creación del mundo, no existía nada excepto este elemento. elemental, ya que consta de un solo átomo. Con el tiempo, el elemento más abundante del universo comenzó a formar nubes, que luego se convirtieron en estrellas. Y ya dentro de ellos, se produjeron reacciones, como resultado de lo cual aparecieron nuevos elementos más complejos que dieron origen a los planetas.
Hidrógeno
Este elemento representa aproximadamente el 92% de los átomos del universo. Pero se encuentra no solo en la composición de estrellas, gas interestelar, sino también elementos comunes en nuestro planeta. La mayoría de las veces existe en forma unida y el compuesto más común es, por supuesto, el agua.

Además, el hidrógeno es parte de una serie de compuestos de carbono que forman el petróleo y el gas natural. 
Producción
A pesar de que es el elemento más común en todo el mundo, sorprendentemente puede ser peligroso para los humanos, ya que en ocasiones se enciende cuando reacciona con el aire. Para comprender cuán importante jugó el hidrógeno en la creación del Universo, basta con darse cuenta de que sin él no habría aparecido nada vivo en la Tierra.
Un elemento químico es un término colectivo que describe un conjunto de átomos de una sustancia simple, es decir, uno que no se puede dividir en ningún constituyente más simple (en términos de la estructura de sus moléculas). Imagine recibir un trozo de hierro puro y pedirle que lo descomponga en componentes hipotéticos utilizando cualquier dispositivo o método que los químicos hayan inventado. Sin embargo, no hay nada que pueda hacer, la plancha nunca se dividirá en algo más simple. Una sustancia simple, el hierro, corresponde al elemento químico Fe.
Definición teórica
El hecho experimental señalado anteriormente se puede explicar utilizando la siguiente definición: un elemento químico es un conjunto abstracto de átomos (¡no moléculas!) De la sustancia simple correspondiente, es decir, átomos del mismo tipo. Si hubiera una forma de ver cada uno de los átomos individuales en la pieza de hierro puro mencionado anteriormente, entonces todos serían iguales: átomos de hierro. Por el contrario, un compuesto químico como el óxido de hierro siempre contiene al menos dos tipos diferentes de átomos: átomos de hierro y átomos de oxígeno.
Términos que debes conocer
Masa atomica: la masa de protones, neutrones y electrones que forman un átomo de un elemento químico.
Número atómico: el número de protones en el núcleo de un átomo de un elemento.
Símbolo químico: una letra o un par de letras latinas que representan la designación de este elemento.
Compuesto químico: sustancia que consta de dos o más elementos químicos combinados entre sí en una determinada proporción.
Metal: elemento que pierde electrones en reacciones químicas con otros elementos.
Metaloide: un elemento que reacciona a veces como un metal y a veces como un no metal.
No metal: elemento que busca obtener electrones en reacciones químicas con otros elementos.
Tabla periódica de elementos químicos: sistema de clasificación de elementos químicos según su número atómico.
Elemento sintético: uno que se obtiene artificialmente en un laboratorio y, por regla general, no se produce en la naturaleza.

Elementos naturales y sintéticos
Noventa y dos elementos químicos se encuentran naturalmente en la Tierra. El resto se obtuvo artificialmente en laboratorios. Un elemento químico sintético es típicamente el producto de reacciones nucleares en aceleradores de partículas (dispositivos usados para aumentar la velocidad de partículas subatómicas como electrones y protones) o reactores nucleares (dispositivos usados para controlar la energía liberada en reacciones nucleares). El primer elemento sintético obtenido con número atómico 43 fue el tecnecio, descubierto en 1937 por los físicos italianos C. Perrier y E. Segre. Aparte del tecnecio y el prometio, todos los elementos sintéticos tienen núcleos más grandes que los del uranio. El último elemento químico sintético en obtener su nombre es el livermorium (116), y antes fue el flerovium (114).

Dos docenas de elementos comunes e importantes.
| Nombre | Símbolo | Porcentaje de todos los átomos * | Propiedades de los elementos químicos (en condiciones normales de habitación) |
|||
| En el universo | En la corteza terrestre | En agua de mar | En el cuerpo humano |
|||
| Aluminio | Alabama | - | 6,3 | - | - | Metal plateado y ligero |
| Calcio | California | - | 2,1 | - | 0,02 | Parte de minerales naturales, conchas, huesos. |
| Carbón | DE | - | - | - | 10,7 | La base de todos los organismos vivos. |
| Cloro | Cl | - | - | 0,3 | - | Gas venenoso |
| Cobre | Cu | - | - | - | - | Solo metal rojo |
| Oro | Au | - | - | - | - | Solo metal amarillo |
| Helio | Él | 7,1 | - | - | - | Gas muy ligero |
| Hidrógeno | H | 92,8 | 2,9 | 66,2 | 60,6 | El más ligero de todos los elementos; gas |
| Yodo | I | - | - | - | - | No metal; utilizado como antiséptico |
| Hierro | Fe | - | 2,1 | - | - | Metal magnético; utilizado para la producción de hierro y acero |
| Dirigir | Pb | - | - | - | - | Metal suave y pesado |
| Magnesio | Mg | - | 2,0 | - | - | Metal muy ligero |
| Mercurio | Hg | - | - | - | - | Metal liquido; uno de los dos elementos líquidos |
| Níquel | Ni | - | - | - | - | Metal resistente a la corrosión; usado en monedas |
| Nitrógeno | norte | - | - | - | 2,4 | Gas, el principal componente del aire. |
| Oxígeno | ACERCA DE | - | 60,1 | 33,1 | 25,7 | Gas, segundo en importancia componente de aire |
| Fósforo | R | - | - | - | 0,1 | No metal; importante para las plantas |
| Potasio | A | - | 1.1 | - | - | Metal; importante para las plantas; comúnmente conocido como "potasa" |
* Si no se especifica ningún valor, el elemento es inferior al 0,1 por ciento.
El Big Bang como causa fundamental de la formación de la materia
¿Cuál fue el primer elemento químico del universo? Los científicos creen que la respuesta a esta pregunta se encuentra en las estrellas y los procesos mediante los cuales se forman las estrellas. Se cree que el universo se originó en algún momento entre 12 y 15 mil millones de años. Hasta este momento, no se piensa en nada de lo que existe, excepto en la energía. Pero sucedió algo que convirtió esta energía en una gran explosión (llamada Big Bang). En los segundos posteriores al Big Bang, la materia comenzó a formarse.
Las primeras formas más simples de materia que aparecieron fueron los protones y los electrones. Algunos de ellos se combinan para formar átomos de hidrógeno. Este último consta de un protón y un electrón; es el átomo más simple que puede existir.

Lentamente, durante largos períodos de tiempo, los átomos de hidrógeno comenzaron a agruparse en regiones específicas del espacio, formando densas nubes. El hidrógeno de estas nubes fue arrastrado a formaciones compactas por las fuerzas gravitacionales. Eventualmente, estas nubes de hidrógeno se volvieron lo suficientemente densas como para formar estrellas.
Estrellas como reactores químicos de nuevos elementos
Una estrella es simplemente una masa de materia que genera la energía de reacciones nucleares. La más común de estas reacciones es una combinación de cuatro átomos de hidrógeno para formar un átomo de helio. Una vez que las estrellas comenzaron a formarse, el helio se convirtió en el segundo elemento en aparecer en el universo.
A medida que las estrellas envejecen, pasan de reacciones nucleares de hidrógeno-helio a otros tipos de reacciones nucleares. En ellos, los átomos de helio forman átomos de carbono. Posteriormente, los átomos de carbono forman oxígeno, neón, sodio y magnesio. Más tarde, el neón y el oxígeno se combinan entre sí para formar magnesio. A medida que continúan estas reacciones, se forman más y más elementos químicos.
Los primeros sistemas de elementos químicos.
Hace más de 200 años, los químicos comenzaron a buscar formas de clasificarlos. A mediados del siglo XIX se conocían unos 50 elementos químicos. Una de las cuestiones que los químicos han buscado resolver. reducido a lo siguiente: un elemento químico es una sustancia completamente diferente de cualquier otro elemento? ¿O algunos elementos están relacionados con otros de alguna manera? ¿Existe una ley común que los una?
Los químicos han propuesto varios sistemas de elementos químicos. Así, por ejemplo, el químico inglés William Prout en 1815 sugirió que las masas atómicas de todos los elementos son múltiplos de la masa del átomo de hidrógeno, si la tomamos igual a la unidad, es decir, deben ser números enteros. En ese momento, J. Dalton ya había calculado las masas atómicas de muchos elementos en relación con la masa del hidrógeno. Sin embargo, si este es aproximadamente el caso del carbono, nitrógeno, oxígeno, entonces el cloro con una masa de 35,5 no encaja en este esquema.
El químico alemán Johann Wolfgang Dobereiner (1780-1849) demostró en 1829 que tres elementos del llamado grupo de los halógenos (cloro, bromo y yodo) pueden clasificarse según sus masas atómicas relativas. El peso atómico del bromo (79,9) resultó ser casi exactamente el promedio de los pesos atómicos del cloro (35,5) y el yodo (127), es decir, 35,5 + 127 ÷ 2 = 81,25 (cerca de 79,9). Este fue el primer acercamiento a la construcción de uno de los grupos de elementos químicos. Dobereiner descubrió dos tríadas más de elementos, pero no pudo formular una ley periódica general.
Cómo apareció la tabla periódica de elementos químicos.
La mayoría de los primeros esquemas de clasificación no tuvieron mucho éxito. Luego, alrededor de 1869, dos químicos hicieron casi un descubrimiento, y casi al mismo tiempo. El químico ruso Dmitry Mendeleev (1834-1907) y el químico alemán Julius Lothar Meyer (1830-1895) propusieron organizar elementos que tienen propiedades físicas y químicas similares en un sistema ordenado de grupos, filas y períodos. Al mismo tiempo, Mendeleev y Meyer señalaron que las propiedades de los elementos químicos se repiten periódicamente en función de sus pesos atómicos.
Hoy en día, Mendeleev es generalmente considerado como el descubridor de la ley periódica porque dio un paso que Meyer no dio. Cuando todos los elementos se ubicaron en la tabla periódica, aparecieron algunos huecos en ella. Mendeleev predijo que estos son lugares para elementos que aún no se han descubierto.
Sin embargo, fue aún más lejos. Mendeleev predijo las propiedades de estos elementos aún por descubrir. Sabía dónde estaban en la tabla periódica, por lo que podía predecir sus propiedades. Es de destacar que todos los elementos químicos predichos por Mendeleev, el futuro galio, escandio y germanio, fueron descubiertos menos de diez años después de que publicó la ley periódica.
Forma corta de la tabla periódica
Ha habido intentos de calcular cuántas versiones de la representación gráfica de la tabla periódica fueron propuestas por diferentes científicos. Resultó más de 500. Además, el 80% del número total de opciones son tablas, y el resto son formas geométricas, curvas matemáticas, etc. Como resultado, cuatro tipos de tablas han encontrado una aplicación práctica: corta, semi-larga , largo y escalera (piramidal). Este último fue propuesto por el gran físico N. Bohr.
La siguiente figura muestra la forma abreviada.

En él, los elementos químicos están dispuestos en orden ascendente de número atómico de izquierda a derecha y de arriba a abajo. Entonces, el primer elemento químico de la tabla periódica, el hidrógeno, tiene el número atómico 1 porque el núcleo de los átomos de hidrógeno contiene uno y solo un protón. Del mismo modo, el oxígeno tiene un número atómico de 8, ya que los núcleos de todos los átomos de oxígeno contienen 8 protones (consulte la figura siguiente).

Los principales fragmentos estructurales de la tabla periódica son períodos y grupos de elementos. En seis periodos se llenan todas las celdas, el séptimo aún no se completa (aunque los elementos 113, 115, 117 y 118 se han sintetizado en laboratorios, aún no han sido registrados oficialmente y no tienen nombre).
Los grupos se subdividen en subgrupos principal (A) y secundario (B). Los elementos de los primeros tres períodos, cada uno de los cuales contiene una fila-fila, se incluyen exclusivamente en los subgrupos A. Los otros cuatro períodos incluyen dos filas.
Los elementos químicos del mismo grupo tienden a tener propiedades químicas similares. Entonces, el primer grupo está formado por metales alcalinos, el segundo, metales alcalinotérreos. Los elementos ubicados en el mismo período tienen propiedades que cambian lentamente de un metal alcalino a un gas noble. La siguiente figura muestra cómo una de las propiedades, el radio atómico, cambia para los elementos individuales de la tabla.
Forma de período largo de la tabla periódica
Se muestra en la figura siguiente y se divide en dos direcciones, fila y columna. Hay siete líneas de período, como en la forma abreviada, y 18 columnas llamadas grupos o familias. De hecho, el aumento del número de grupos de 8 en la forma corta a 18 en la forma larga se obtiene colocando todos los elementos en los periodos a partir del 4, no en dos, sino en una línea.
Se utilizan dos sistemas de numeración diferentes para los grupos, como se muestra en la parte superior de la tabla. El sistema de números romanos (IA, IIA, IIB, IVB, etc.) ha sido tradicionalmente popular en los Estados Unidos. Otro sistema (1, 2, 3, 4, etc.) se utiliza tradicionalmente en Europa y se recomendó su uso en los EE. UU. Hace varios años.

El aspecto de las tablas periódicas en las figuras anteriores es un poco engañoso, al igual que cualquier tabla publicada. La razón de esto es que los dos grupos de elementos que se muestran en la parte inferior de las tablas deberían estar ubicados dentro de ellos. Los lantánidos, por ejemplo, pertenecen al período 6 entre el bario (56) y el hafnio (72). Además, los actínidos pertenecen al período 7 entre el radio (88) y el ruterfordio (104). Si se insertaran en una mesa, sería demasiado ancho para caber en una hoja de papel o en un gráfico de pared. Por tanto, es habitual colocar estos elementos en la parte inferior de la tabla.
Los más comunes
Litosfera. Oxígeno (O), 46,60% en peso. Descubierto en 1771 por Karl Scheele (Suecia).
Atmósfera. Nitrógeno (N), 78,09% en volumen, 75,52% en peso. Descubierto en 1772 por Rutherford (Gran Bretaña).
Universo. Hidrógeno (H), 90% de la sustancia total. Descubierto en 1776 por Henry Cavendish (Gran Bretaña).
El más raro (de 94)
Litosfera.
Astatina (At): 0,16 g en la corteza terrestre. Descubierto en 1940 por Corson (EE. UU.) Con colaboradores. El isótopo astato 215 (215At) de origen natural (descubierto en 1943 por B. Karlik y T. Bernert, Austria) existe en una cantidad de solo 4,5 nanogramos.
Atmósfera.
Radón (Rn): solo 2,4 kg (6 · 10–20 volumen de una parte por 1 millón). Inaugurado en 1900 por Dornom (Alemania). Se cree que la concentración de este gas radiactivo en las áreas de depósitos de granito es la causa de varios cánceres. La masa total de radón en la corteza terrestre, a partir de la cual se reponen las reservas atmosféricas de gas, es de 160 toneladas.
Lo más fácil
Gas:
El hidrógeno (H) tiene una densidad de 0,00008989 g / cm3 a una temperatura de 0 ° C y una presión de 1 atm. Descubierto en 1776 por Cavendish (Gran Bretaña).
Metal.
El litio (Li), con una densidad de 0,5334 g / cm3, es el más ligero de todos los sólidos. Descubierto en 1817 por Arfvedson (Suecia).
Densidad máxima
El osmio (Os), con una densidad de 22,59 g / cm3, es el más pesado de todos los sólidos. Inaugurado en 1804 por Tennant (Gran Bretaña).
Gas más pesado
Es radón (Rn), cuya densidad es de 0.01005 g / cm3 a 0 ° C. Inaugurado en 1900 por Dornom (Alemania).
Recibido por última vez
Elemento 108, o unniloktia (Uno). Este nombre provisional fue dado por la Unión Internacional de Química Pura y Aplicada (IUPAC). Obtenido en abril de 1984 por G. Münzenberg y colaboradores (Alemania Occidental), quienes observaron solo 3 átomos de este elemento en el laboratorio de la Heavy Ion Research Society en Darmstadt. En junio del mismo año se informó que este elemento también había sido recibido por Yu.Ts. Oganesyan con colegas del Instituto Conjunto de Investigaciones Nucleares, Dubna, URSS.
Se produjo un solo átomo de unificación (Une) bombardeando bismuto con iones de hierro en el laboratorio de la Heavy Ion Research Society, Darmstadt, Alemania Occidental, el 29 de agosto de 1982. Tiene el mayor número ordinal (elemento 109) y la mayor masa atómica. (266) ... Según los datos más preliminares, los científicos soviéticos observaron la formación de un isótopo del elemento 110 con una masa atómica de 272 (tentativamente llamado ununnilium (Uun)).
El más limpio
Helio-4 (4He), obtenido en abril de 1978 por P.V. McLintock de la Universidad de Lancaster, EE. UU., Tiene menos de 2 partes de impurezas por 1015 partes de volumen.
Lo más difícil
Carbono (C). En forma alotrópica, el diamante tiene una dureza según el método Knoop - 8400. Se conoce desde tiempos prehistóricos.
El más caro
California (Cf) se vendía a $ 10 el microgramo en 1970. Inaugurado en 1950 por Seaborg (EE. UU.) Con empleados.
El mas flexible
Oro (Au). A partir de 1 g, puede sacar un cable de 2,4 km de largo. Conocido desde 3000 AC.
Mayor resistencia a la tracción
Boro (V) - 5,7 GPa. Inaugurado en 1808 por Gay-Lussac y Thénard (Francia) y H. Davy (Gran Bretaña).
Punto de fusión / ebullición
Más bajo.
Entre los no metales, el helio-4 (4He) tiene el punto de fusión más bajo –272,375 ° С a una presión de 24,985 atm y el punto de ebullición más bajo –268,928 ° С. El helio fue descubierto en 1868 por Lockyer (Gran Bretaña) y Jansen (Francia). El hidrógeno monoatómico (H) debe ser un gas superfluido no licuable. Entre los metales, los parámetros correspondientes para el mercurio (Hg) son –38,836 ° С (punto de fusión) y 356,661 ° С (punto de ebullición).
El más alto.
Entre los no metales, el punto de fusión y el punto de ebullición más alto es el del carbono (C) conocido desde tiempos prehistóricos: 530 ° C y 3870 ° C. Sin embargo, parece controvertido que el grafito sea estable a altas temperaturas. Al pasar a 3720 ° C de un estado sólido a un estado de vapor, el grafito se puede obtener como líquido a una presión de 100 atm y una temperatura de 4730 ° C. Entre los metales, los parámetros correspondientes para el tungsteno (W) son 3420 ° C (punto de fusión) y 5860 ° C (punto de ebullición). Descubierto en 1783 por H.H. y F. d "Eluyaram (España).
Isótopos
La mayoría de los isótopos(36 cada uno) para xenón (Xe), descubierto en 1898 por Ramsay y Travers (Gran Bretaña), y para cesio (Cs), descubierto en 1860 por Bunsen y Kirchhoff (Alemania). La cantidad más pequeña (3: protio, deuterio y tritio) en hidrógeno (H) fue descubierta en 1776 por Cavendish (Gran Bretaña).
El mas estable
El telurio-128 (128Te), según los datos de desintegración beta doble, tiene una vida media de 1,5 × 1024 años. Tellur (Te) fue descubierto en 1782 por Müller von Reichenstein (Austria). El isótopo 128Те fue descubierto por primera vez en su estado natural en 1924 por F. Aston (Gran Bretaña). Los datos sobre su superestabilidad fueron nuevamente confirmados en 1968 por los estudios de E. Alexander Jr., B. Srinivasan y O. Manuel (EE. UU.). El registro de desintegración alfa pertenece al samario-148 (148Sm) - 8 1015 años. El récord de desintegración beta pertenece al isótopo de cadmio 113 (113Cd) - 9 × 1015 años. Ambos isótopos fueron descubiertos en su estado natural por F. Aston, respectivamente, en 1933 y 1924. La radiactividad de 148Sm fue descubierta por T. Wilkins y A. Dempster (EE.UU.) en 1938, y la radiactividad de 113Cd fue descubierta en 1961 por D. Watt y R. Glover (Gran Bretaña).
Más inestable
La vida útil del litio-5 (5Li) está limitada a 4,4 · 10–22 s. El isótopo fue descubierto por primera vez por E. Titterton (Australia) y T. Brinkley (Gran Bretaña) en 1950.
El mas venenoso
Entre las sustancias no radiactivas, las restricciones más estrictas se establecen para el berilio (Be): la concentración máxima permitida (MPC) de este elemento en el aire es de solo 2 μg / m3. Entre los isótopos radiactivos existentes en la naturaleza o producidos por instalaciones nucleares, las restricciones más estrictas sobre el contenido en el aire se establecen para el torio-228 (228Th), que fue descubierto por primera vez por Otto Hahn (Alemania) en 1905 (2.4 · 10-16 g / m3), y en términos de contenido en agua - para radio-228 (228Ra), descubierto por O. Gahn en 1907 (1.1 · 10-13 g / l). Ecológicamente, tienen vidas medias significativas (es decir, más de 6 meses).
Todos sabemos que el hidrógeno llena nuestro Universo en un 75%. Pero, ¿sabes qué otros elementos químicos existen que no son menos importantes para nuestra existencia y juegan un papel importante en la vida de las personas, los animales, las plantas y toda nuestra Tierra? ¡Los elementos de este ranking dan forma a todo nuestro universo!
10. Azufre (prevalencia en relación con el silicio - 0,38)
Este elemento químico aparece bajo el símbolo S en la tabla periódica y se caracteriza por el número atómico 16. El azufre es muy natural.
9. Hierro (prevalencia en relación con el silicio - 0,6)

Se designa con el símbolo Fe, número atómico - 26. El hierro se encuentra muy a menudo en la naturaleza, juega un papel especialmente importante en la formación de la capa interna y externa del núcleo de la Tierra.
8. Magnesio (prevalencia en relación con el silicio - 0,91)

En la tabla periódica, el magnesio se encuentra bajo el símbolo Mg, y su número atómico es 12. Lo más sorprendente de este elemento químico es que se libera con mayor frecuencia durante la explosión de estrellas en el proceso de su transformación en cuerpos de supernova. .
7. Silicio (prevalencia en relación con el silicio - 1)

Designado como Si. El número atómico del silicio es 14. Este metaloide azul grisáceo se encuentra muy raramente en la corteza terrestre en su forma pura, pero es bastante común en otras sustancias. Por ejemplo, incluso se puede encontrar en plantas.
6. Carbono (prevalencia en relación con el silicio - 3,5)

El carbono en la tabla de elementos químicos de Mendeleyev aparece bajo el símbolo C, su número atómico es 6. La modificación alotrópica más famosa del carbono es una de las piedras preciosas más codiciadas del mundo: los diamantes. El carbono se utiliza activamente en otros fines industriales para fines más cotidianos.
5. Nitrógeno (abundancia en relación con el silicio - 6,6)

Símbolo N, número atómico 7. Descubierto por primera vez por el médico escocés Daniel Rutherford, el nitrógeno se encuentra más comúnmente en forma de ácido nítrico y nitratos.
4. Neón (abundancia en relación con el silicio - 8,6)

Se designa con el símbolo Ne, número atómico - 10. No es ningún secreto que este elemento químico en particular está asociado con un hermoso resplandor.
3. Oxígeno (prevalencia en relación con el silicio - 22)

Un elemento químico bajo el símbolo O y con número atómico 8, ¡el oxígeno es indispensable para nuestra existencia! Pero esto no significa que esté presente solo en la Tierra y sirva solo para los pulmones humanos. El universo está lleno de sorpresas.
2. Helio (abundancia en relación con el silicio - 3.100)

El símbolo del helio es He, el número atómico es 2. Es incoloro, inodoro e insípido, no tóxico y su punto de ebullición es el más bajo entre todos los elementos químicos. ¡Y gracias a él, las bolas se disparan hacia arriba!
1. Hidrógeno (abundancia en relación con el silicio - 40.000)

Verdadero número uno en nuestra lista, el hidrógeno se encuentra en la tabla periódica bajo el símbolo H y tiene el número atómico 1. Es el elemento químico más ligero de la tabla periódica y el elemento más abundante en todo el universo estudiado.