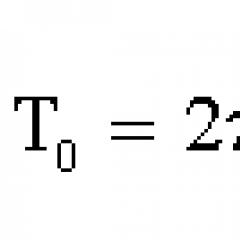Prezentacja na temat: Podstawowe przepisy teleinformatyczne. Prezentacja fizyki na temat „podstawowych zasad teorii kinetyki molekularnej”. Eksperymenty potwierdzające to stanowisko
Temat: Podstawowe przepisy teleinformatyczne
Nowe pytania w temacie:
1. MKT
2. Atom
3. Cząsteczka
4. Podstawowe przepisy teleinformatyczne
5. Dyfuzja
6. Ruchy Browna
7. Względna masa cząsteczkowa
8. Ilość substancji
9. 1 mol
10. Liczba Avogadro
11. Masa molowa
12. Koncentracja cząsteczek

MKT
A) Teoria kinetyki molekularnej
B) Teoria procesów termicznych wyjaśniająca właściwości ciał makroskopowych
(Łomonosow M.V.)

Atom
A) Najmniejsza niepodzielna cząstka
B) Odkryty przez Demokryta
B) Atom składa się z jądra i otaczającą chmurę elektronów.
D) Jądro atomu składa się z protonów i neutronów, a otaczająca je chmura składa się z elektronów

Cząsteczka
A) Cząstka obojętna elektrycznie
B) Ma podstawowe właściwości chemiczne substancji
B) Składa się z atomów połączonych ze sobą wiązaniami chemicznymi

Podstawowe przepisy teleinformatyczne
1) Wszystkie substancje składają się z cząstek (atomów i cząsteczek)
2) Cząstki są w ciągłym ruchu
3) Cząsteczki oddziałują ze sobą, tj. między nimi istnieją siły przyciągające i odpychające

I. Wszystkie substancje składają się z cząstek
Eksperymenty potwierdzające to stanowisko:
1. Kruszenie mechaniczne
2. Rozpuszczanie substancji
3. Uciskanie i rozciąganie ciał
Cząstki
Cząsteczki
atomy
elektrony
rdzeń
protony
neutrony

CZĄSTECZKI PORUSUJĄ SIĘ CIĄGLE I CHAOTYCZNIE
DOŚWIADCZENIA POTWIERDZAJĄCE TO POZYCJĘ:
- A) DYFUZJA
- B) RUCH BROWNIA
- C) TENDENCJA GAZU DO ZAJMOWANIA CAŁEJ OBJĘTOŚCI

Dyfuzja
A) Penetracja cząsteczek jednej substancji do przestrzeni międzycząsteczkowych innej substancji
B) Dyfuzja zależy od temperatury

RUCH Browna
RUCH TERMICZNY CZĄSTEK ZAWIESZONYCH W CIECZY LUB GAZU WYSTĘPUJE CHAOTYCZNIE I NIEOGRANICZONY DŁUGI CZAS

CZĄSTECZKI oddziałujące ze sobą są przyciągane i odpychane
Eksperymenty potwierdzające to stanowisko:
- Klejenie
- Zwilżanie

Względna masa cząsteczkowa (RMM)
Stosunek masy cząsteczki do jednej dwunastej (1/12) masy atomu węgla
- M R – OMM
- M 0 - masa jednej cząsteczki
- M 0c – masa atomu węgla

ILOŚĆ SUBSTANCJI
Wartość pokazująca, ile razy liczba cząsteczek w substancji jest większa od liczby cząsteczek w 12 gramach węgla
ν – ilość substancji (mol)
N – liczba cząsteczek w substancji
N A – Liczba Avogadro
M – masa molowa (kg/mol)

1 mol
A) Ilość substancji zawierająca taką samą liczbę cząsteczek, jaka jest zawarta w 12 gramach węgla
B) Jednostka miary ilości substancji

NUMER AVOGADRA
Liczba pokazująca, ile cząsteczek znajduje się w 1 molu substancji
N A = 6,02 · 10 23 kret -1

Masa cząsteczkowa
Masa substancji wzięta w ilości jednego mola
M – masa molowa (kg/mol)
M 0 – masa jednej cząsteczki

STĘŻENIE
Liczba pokazująca, ile cząstek znajduje się w jednostkowej objętości substancji
N - koncentracja (m.in -3 )
V – objętość (m 3 )
N – liczba cząsteczek

Kontrola
1. Na jakim zjawisku fizycznym się opiera? proces solenia warzyw, ryb, mięsa? W którym przypadku proces jest szybszy?
Jeśli Czy solanka jest zimna czy gorąca?
- Dlaczego syrop z czasem staje się słodszy? smak owoców?
- Dlaczego cukier i inne produkty są porowate Nie można przechowywać w pobliżu substancji zapachowych?

- Zapach miotły brzozowej rozprzestrzenia się szybciej w gorącej kąpieli niż w chłodnym pomieszczeniu. Dlaczego?
- Jak myślisz, co może się wydarzyć w wyniku wojny nuklearnej?
- Jak wytłumaczyć zniknięcie dymu w powietrzu?

1. CELE
- 1. Znajdź masę cząsteczki wody, jeśli jej masa cząsteczkowa wynosi 18 g/mol.
( M 0 =0,003*10 -23 kg)
- 2. Ile cząsteczek znajduje się w 10 gramach aluminium? M ( Al) = 27 g/mol.
( N =2,2* 10 23 )
2. Testowanie
na temat „Podstawowe postanowienia ILC”

- § 4.1, 4.2, podsumowanie
- Zadanie:
- Jaka ilość substancji znajduje się w 15 gramach miedzi, jeśli jej masa molowa wynosi 64 g/mol?

Względna masa cząsteczkowa (lub atomowa) substancji M r jest stosunkiem masy cząsteczki (lub atomu) m 0 danej substancji do 1/12 masy atomu węgla m 0C M r (H 2 O) = 2 1 + 16 = 18 (a.u.m.) Obliczmy M r wody H 2 O (w tym celu skorzystamy z układu okresowego) Mendelejew Jednostka masy atomowej (a.m.u.) 1,66 kg

Jeden mol to ilość substancji zawierająca taką samą liczbę cząsteczek lub atomów, ile jest atomów w węglu o masie 12 g. 1 mol dowolnej substancji zawiera tę samą liczbę atomów lub cząsteczek. Ta liczba atomów jest oznaczona jako NA i na cześć włoskiego naukowca (XIX w.) nazywana jest stałą Avogadro. N A = 6,10 23 mol -1






4. Zatem ciśnienie gazu na ścianie: P = = _______ Równanie to, wyprowadzone po raz pierwszy przez niemieckiego fizyka R. Clausiusa, nazywane jest podstawowym równaniem molekularnej teorii kinetyki gazu doskonałego. Ustala związek pomiędzy parametrami mikroskopowymi a wielkościami makroskopowymi (mierzalnymi).







Do parametrów makroskopowych zalicza się: ___ (________), ___ (_________) Równowaga termiczna to... Temperatura charakteryzuje stopień... Temperaturę mierzy się za pomocą... Strona Skala Celsjusza (C) jest wyznaczana przez dwa punkty: ...

Doświadczenie strony: Wnioski: W 0C: W 100C:



Zadanie. Dane: Rozwiązanie: Odpowiedź: szt.



Strona Eksperymentalne potwierdzenie wzoru: Eksperyment Sterna (1920)



Ankieta po lekcji: 1. Jak zmieni się pierwiastkowa średnia prędkość cząsteczek, gdy temperatura wzrośnie 4-krotnie? 2. Które cząsteczki w atmosferze poruszają się szybciej: cząsteczki azotu czy tlenu? Dlaczego? 3. Co to jest zero absolutne w skali Celsjusza? 4. Jak powiązane są objętość, ciśnienie i liczba cząsteczek różnych gazów w równowadze termicznej?


Wniosek: - Równanie Clapeyrona R – uniwersalna stała gazowa Problem, 928











Dyktowanie fizyczne Opcja 1 Opcja 2



Równowaga dynamiczna to stan, w którym _______ Para nasycona - para, _______ Stężenie ________ nasyconej _____ przy stałej ________ nie zależy od jej ____ Ponieważ p=nkT, ciśnienie ________ pary _____________ na zajmowaną przez nią objętość. Prężność pary nasyconej (p vp) to prężność pary, przy której ______ jest w równowadze ze swoim _________.

Temperatura krytyczna to maksymalna _____, przy której _____ zamieni się w __ P n.d. w 100C równa się Pa (760 mmHg) Ciśnienie mieszaniny: Składniki




Odparowanie. Kondensacja. Wrzenie. Parowanie to zjawisko zamiany cieczy w parę. I. - parowanie z powierzchni cieczy, któremu towarzyszy absorpcja energii. Zależy od: Temperatura (tC - I.) Pole powierzchni cieczy Rodzaj cieczy K. - odparowanie w całej objętości cieczy w określonym tC (temperatura wrzenia). Podczas gotowania temperatura się nie zmienia! (t=stała)

Podczas parowania wylatują tylko szybkie cząsteczki, które są w stanie pokonać przyciąganie innych cząsteczek, a temperatura spada (tC). temperatura wrzenia zależy od ciśnienia otoczenia i obecności zanieczyszczeń. Wewnątrz bańki znajduje się para nasycona, tj. ciśnienie Ppara = Woda. t P para V bąbelek Fa unosi się w górę Przykłady: „Dmuchanie na herbatę”, „jest zimno, gdy jest mokro”. Przykłady: „Sól dodaje się po ugotowaniu”, „w górach woda wrze w temperaturze 80 ° C”.


§Wilgotność powietrza Po co o tym wiedzieć? Książki Tkaniny Produkty Urządzenia elektryczne itp. Wilgotność powietrza to zawartość pary wodnej w atmosferze. W ciągu 1 roku z powierzchni Ziemi wyparowują miliardy ton wody! Ciśnienie cząstkowe wody P to ciśnienie wytwarzane przez parę wodną w całkowitym ciśnieniu atmosferycznym.

Wilgotność bezwzględna – ilość pary wodnej na jednostkę objętości (gęstość pary wodnej). Wilgotność względna – stosunek bezwzględny. wilgotność ρ do gęstości ρ 0 pary nasyconej w danej temperaturze, wyrażonej w %. P – ciśnienie cząstkowe P 0 – ciśnienie pary nasyconej. P 0 i ρ 0 można znaleźć w tabeli




„Mono” – jeden. Monokryształ to ciało stałe, którego cząstki tworzą pojedynczą sieć krystaliczną. Przykładem monokryształów są szeroko rozpowszechnione sześciokątne kryształy kwarcu. Kryształy diamentu, turmalinu itp. są mniej powszechne. Wszystkie mają charakterystyczny kształt wielościanów h ttp:// /…

Anizotropia to zależność właściwości fizycznych substancji od kierunku. W płaszczyźnie A znajduje się wiele cząstek, są one umieszczone blisko siebie i zachodzi silne oddziaływanie. W płaszczyźnie B jest mniej cząstek, odległość między nimi jest większa; cząstki płaszczyzny oddziałują ze sobą słabo

Grafit i diament są wykonane z węgla...

Szafir (korund) zawiera zanieczyszczenia tytanu i żelaza. Na szafirach tworzą się mikroukłady.

Ustępując jedynie diamentowi wśród minerałów naturalnych, szafir posiada wyjątkowo wysoką twardość – 9 punktów w skali twardości na 10 możliwych. Za pomocą proszków szafirowych można wiercić, polerować, ostrzyć kamień i metal

Diament jest najtwardszym tworem natury. Około 80% wszystkich wydobywanych diamentów wykorzystuje się w przemyśle.

Diamenty ze względu na swoją twardość wykorzystywane są do obróbki materiałów supertwardych, eksploracji i wydobycia. Przed 1430 rokiem diamentów nie używano jako biżuterii. Wyznacznikiem trendów była dla nich Francuzka Agnes Sorel. ...

Wśród kamieni szlachetnych rubin zajmuje drugie miejsce po diamencie pod względem siły. Niektóre egzemplarze rubinu, wyróżniające się szczególną czystością koloru, są cenione nawet bardziej niż diamenty o tej samej wadze...

Ze względu na wysoką twardość rubin jest szeroko stosowany w przemyśle. Używając rubinu, możesz wytworzyć intensywną czerwoną wiązkę światła, miliony razy jaśniejszą od słońca. Lasery rubinowe są wykorzystywane w badaniach naukowych do badania atmosfery...

Szmaragdowy kryształ Kolor zależy od zawartości tlenku chromu... ...

Złoża szmaragdów są nieliczne. W starożytnym świecie wydobycie prowadzono wyłącznie w Egipcie. Za jedne z najlepszych w naszych czasach uważa się kopalnie w górach Copi w górach Kolumbii, które hiszpańscy zdobywcy zdobyli w XVI wieku. ...

Polikryształ to ciało stałe składające się z losowo zorientowanych monokryształów... W naturze częściej spotykane są losowo skondensowane monokryształy. Przykładami polikryształów są: sól kamienna (ryc. 1), kwarc (ryc. 2), cukier, lód, żelazo, miedź.

Wśród ciał, które powszechnie uważa się za stałe, ponieważ zachowują swój kształt i objętość oraz mają wytrzymałość, są też takie, które znacznie różnią się od kryształów. Cząsteczki w nich są ułożone w taki sam sposób jak w cieczy. Ciała amorficzne obejmują szkło, żywicę, kalafonię i tworzywa sztuczne. ...

KryształyCiała amorficzne Cząstki ułożone są w sposób uporządkowany, ściśle określony. W ułożeniu cząstek nie ma żadnego porządku. Cząsteczki „skaczą” Topnieją w określonej temperaturze Nie mają określonej temperatury topnienia Anizotropowe Izotropowe Mają charakterystyczny kształt wielościanu Nie mają odpowiedniego cięcia


Ciekłe kryształy to substancje, które jednocześnie mają właściwości cieczy (płynność) i kryształów (anizotropia). Strukturalnie są to ciecze podobne do galarety, składające się z wydłużonych cząsteczek, uporządkowanych w określony sposób w całej objętości tej cieczy. Stan zewnętrzny ciekłych kryształów po podgrzaniu może zmienić się ze stałego w ciekłokrystaliczny i całkowicie przekształcić się w postać ciekłą dalszy wzrost temperatury.

Zastosowanie ciekłych kryształów Wybierając skład substancji ciekłokrystalicznej tworzone są wskaźniki dla różnych zakresów temperatur i dla różnych konstrukcji. Na przykład wskaźnik ciekłokrystaliczny na skórze pacjenta szybko diagnozuje ukryty stan zapalny, a nawet guz. Ciekłe kryształy służą do wykrywania oparów szkodliwych związków chemicznych oraz promieniowania gamma i ultrafioletowego niebezpiecznego dla zdrowia człowieka. Ciśnieniomierze i detektory ultradźwiękowe zostały stworzone w oparciu o ciekłe kryształy. Jednak najbardziej obiecującym obszarem zastosowania substancji ciekłokrystalicznych jest technologia informacyjna. Obecnie kolorowe ekrany LCD są stosowane w telefonach komórkowych, monitorach i telewizorach. Mają małą grubość, niski pobór mocy, wysoką rozdzielczość i jasność. ...

Pierwszy na świecie rezerwat mineralogiczny powstał z inicjatywy V. I. Wernadskiego, N. M. Fedorowskiego i A. E. Fersmana na Uralu (w górach Ilmen, niedaleko miasta Miass) w pierwszych latach władzy radzieckiej...

Powierzchnia rezerwatu wynosi 303,7 km². Długość grzbietu Ilmen z północy na południe wynosi 41 km. Najwyższym szczytem jest Góra Ilmentau (747,3 m) Sieć hydrologiczna Rezerwatu stanowi 9% powierzchni Rezerwatu znajduje się 30 jezior Najgłębsze jezioro Big Kisegach 34 m Najdłuższa rzeka B. Cheremshanka 9,8 km Minerały, skały Minerały 264 Odkryto po raz pierwszy na świecie w Ilmeny 16 Skały ponad 70 Kopalnie ponad 400

Rosja, rok 1842, 8 października. W kopalni Carewo-Aleksandrowski w pobliżu miasta Miass na południowym Uralu znaleziono bryłkę złota o wadze 36 kg i 16 g. Obecnie w Diamencie można zobaczyć „Wielki Trójkąt” – tak nazywa się unikalny okaz Fundusz Kremla Moskiewskiego. Uważany jest za największy zachowany na świecie. O ile stopni się nagrzeje, jeśli otrzyma J ciepła? Ciepło właściwe złota wynosi 0,13 kJ/(kg·K). Odpowiedź: 4°C. ...

W 1813 roku na jednym z dopływów Uralu Iset, gdzie wydobywano ubogie, złotonośne żyły kwarcu, młoda dziewczyna, Katya Bogdanova, znalazła dużą bryłkę platyny i przyniosła ją urzędnikowi. Jaka jest masa bryłki platyny znalezionej na Uralu w 1904 r., jeśli potrzeba J energii, aby ją ogrzać o 20°C? Ciepło właściwe platyny wynosi 0,14 kJ/(kg * K). Odpowiedź: 8,395 kg.

1. Na jakie trzy rodzaje dzielimy ciała stałe ze względu na charakter ułożenia cząstek? Co decyduje o tym, czy ciała stałe należą do jednego z tych typów? 2. Jaka jest różnica między mono- i polikryształami? 3. Jakie ciała zaliczamy do amorficznych? 4. Drewno jest anizotropowe. Czy jest to ciało krystaliczne? 5. Czy zawód dmuchacza szkła powstałby, gdyby szkło było ciałem krystalicznym, a nie amorficznym?

1. Szklaną kostkę i kostkę wyciętą z monokryształu kwarcu umieszcza się w gorącej wodzie. Czy kostki zachowają swój kształt? 2. Sześcian wycięty z pojedynczego kryształu może zamienić się w równoległościan. Dlaczego jest to możliwe? 3. Żelazną misę możesz upuścić dziesięć tysięcy razy, ale nie możesz upuścić ani razu porcelanowego wazonu. W końcu dziesięć tysięcy razy potrzebujesz dziesięciu tysięcy wazonów. Dlaczego? ...





Powód: oddziaływania cząsteczek cieczy na cząstkę nie kompensują się wzajemnie. Charakter ruchu zależy od rodzaju cieczy, wielkości i kształtu cząstek oraz temperatury. Ruchy Browna to losowy, ciągły ruch drobnych cząstek ciała stałego zawieszonych w cieczy lub gazie pod wpływem cząsteczek cieczy lub gazu. Charakter ruchu zależy od rodzaju cieczy, wielkości i kształtu cząstek oraz temperatura. R.Brown 1827





Względna masa cząsteczkowa (lub atomowa) substancji M r jest stosunkiem masy cząsteczki (lub atomu) m 0 danej substancji do 1/12 masy atomu węgla m 0C M r (H 2 O) = 2 1 + 16 = 18 a.u. Obliczmy M r wody H 2 O (w tym celu korzystamy z układu okresowego) Mendelejew Jednostka masy atomowej (amu) 1,66 kg

Jeden mol to ilość substancji zawierająca taką samą liczbę cząsteczek lub atomów, ile jest atomów w węglu o masie 12 g. 1 mol dowolnej substancji zawiera tę samą liczbę atomów lub cząsteczek. Ta liczba atomów jest oznaczona jako NA i na cześć włoskiego naukowca (XIX w.) nazywana jest stałą Avogadro. N A = 6,10 23 mol -1

Podstawowe przepisy teleinformatyczne. Rozmiary cząsteczek i atomów. Skupiony stan substancji.
(wprowadzenie do tematu „Termodynamika”)

Podstawowe zasady teorii kinetyki molekularnej
- Wszystkie substancje, bez (wyjątku), składają się z cząstek.
Celem ICT jest wyjaśnienie właściwości ciał makroskopowych i praw procesów termicznych w oparciu o koncepcję, że wszystkie ciała składają się z pojedynczych chaotycznie poruszających się i oddziałujących cząstek.





Rozmiary cząsteczek i atomów.
Kropla oleju na powierzchni cieczy nie rozprzestrzeni się na całej wolnej powierzchni; tworzy warstwę o grubości tylko jednej cząsteczki - „warstwę monomolekularną”. Jeśli przyjmiemy objętość kropli 1 mm 3, wówczas rozprzestrzeni się ona na maksymalną powierzchnię nie większą niż 0,6 m 2, a następnie obliczymy:
d=0,001 cm 3: 6000 cm 2 ≈1,7×10⁻⁷cm.
Średnica cząsteczki wody wynosi w przybliżeniu 3 × 10⁻⁸ cm, wówczas w 1 cm 3 znajdują się 3,7 × 10 22 cząsteczki. Masa cząsteczki wyniesie 2,7 × 10⁻ 23 g.
- Masę wszystkich cząsteczek i atomów porównuje się do 1/12 masy atomu węgla.
- Względną masę cząsteczkową określa się ze wzoru:
M r = m m / m do/ 12
Gdzie m jest masą cząsteczki substancji,
m c jest masą atomu węgla.
- Względna masa atomowa Ar jest stosunkiem masy atomu do 1/12 masy atomu węgla.

Wzory i definicje na ten temat.
1 amu = mc / 12 = 1,66 × 10 -27 kg
Liczbę cząsteczek w jednym molu substancji nazywa się stałą Avogadra: N a = 6,02 × 10 23 mol -1
Prawo Avogadra: równe objętości różnych gazów w tych samych warunkach zawsze zawierają tę samą liczbę cząstek.
Jednostką ilości substancji ν jest mol.
Mol- to ilość substancji zawierająca taką samą liczbę cząsteczek (atomów), jaka znajduje się w 12 g węgla.
Masę cząsteczek substancji można określić w następujący sposób:
Masa cząsteczkowa M - Jest to masa 1 mola substancji.
m m = M / N a; m m = m / N; m m = ρ / n
Masa substancji m = M× ν
m to masa substancji, N to liczba cząsteczek,
Jednostka SI masy molowej
n to stężenie cząsteczek.
kg/mol M = M r × 10 -3
Liczbę cząsteczek substancji można określić w następujący sposób:
N = N a × ν; N = m / m m; N=n×V
Objętość V M jednego mola substancji określa się według wzoru:
V = M / ρ ρ – gęstość materii

Stan materii
- Solidny
- Płyn
- Gazowy
Najobficiej występującą substancją na Ziemi jest woda. Rozważmy to we wszystkich stanach i pamiętajmy,
że sama cząsteczka taka nie jest
Zmiany.

Stan stały materii
Cząsteczki znajdują się w określonych odległościach od siebie,
powodując oscylację
ruch na stanowisku
balansować. Interakcja
istnieje między nimi bardzo silna więź,
Dlatego w stanie stałym ciała zachowują swój kształt i objętość.
(na zdjęciu cząsteczka lodu
i zdjęcie lodowego miasta).

Płynny stan materii
Cząsteczki znajdują się bardzo blisko siebie, co sprawia, że ciecze są praktycznie
nieściśliwy. Poruszaj nimi
brudne i poruszają się
w całej objętości, powoduje to płynność
substancji w tym stanie skupienia.
Przyciąganie między cząsteczkami jest słabe,
dlatego płyny łatwo się rozlewają
porcje. W rezultacie ciecze zachowują swoją objętość, ale łatwo przybierają kształt pojemnika.

Gazowy stan skupienia
Cząsteczki znajdują się wystarczająco daleko od siebie, co pozwala im rozpraszać się na duże odległości i
nie wchodź w interakcję pomiędzy
się. Dlatego gazy nie
mieć stałą objętość
starają się wypełnić całą daną im przestrzeń. W rezultacie gazy nie mają własnego kształtu i objętości.

Konsolidacja
1.Sformułować główne postanowienia ICT.
2. Podaj fakty potwierdzające ważność tych postanowień.
3. Rozwiąż zadanie: określ masę molową cukru
4. Ile cząsteczek znajduje się w 210 g azotu?
Uczniowie mogą zostać poproszeni o rozwiązanie problemów w domu.

1. Wszystkie substancje, bez (wyjątku), składają się z cząstek.
Wszystkie cząstki poruszają się losowo.
Wszystkie cząstki materii oddziałują ze sobą.
2. Kruszenie, parowanie, rozpuszczanie, dyfuzja, ruchy Browna, rozprzestrzenianie się cieczy, pojawienie się sprężystości, odkształcenie, zachowanie kształtu i objętości ciał stałych, tarcie.
3. M r (C 12 H 22 O 11) = 12A r (C) + 22A r (H) + 11 A r (O)
M r = 12 12 + 22 + 11 16 = 342 (amu)
M = M r 10-3 = 0,342 (kg/mol).
4. m(N 2) = 0,21 kg
N = m / m N 2 m N 2 = M / N za N = m N za /m