Reakcje podstawienia ligandów. Temat: Etapy elementarne obejmujące związki koordynacyjne i metaloorganiczne w roztworach oraz na powierzchni metali i tlenków
Elementarne etapy reakcji organicznych katalizowanych przez kwasy, zasady, katalizatory nukleofilowe, kompleksy metali, metale stałe i ich związki w heterogenicznych i jednorodnych procesach w fazie gazowej lub w fazie ciekłej to reakcje powstawania i transformacji różnych półproduktów organicznych i metaloorganicznych, jak jak również kompleksy metali. Do organicznych związków pośrednich zaliczają się jony karbenu R+, węgla RH2+, karboaniony R-, kationy anionowe i rodnikowe, rodniki i birodniki R·, R:, a także kompleksy molekularne organicznych cząsteczek donora i akceptora (DA), zwane także kompleksami z przeniesieniem ładunku. W jednorodnej i heterogenicznej katalizie kompleksami metali (kataliza kompleksów metali) reakcji organicznych, półproduktami są związki złożone (koordynacyjne) z ligandami organicznymi i nieorganicznymi, związki metaloorganiczne z wiązaniem M-C, które w większości przypadków są związkami koordynacyjnymi. Podobna sytuacja ma miejsce w przypadku „dwuwymiarowej” chemii na powierzchni stałych katalizatorów metalicznych. Rozważmy główne rodzaje reakcji kompleksów metali i związków metaloorganicznych.
Etapy elementarne z udziałem kompleksów metaliReakcje kompleksów metali można podzielić na trzy grupy:
a) reakcje przeniesienia elektronu;
b) reakcje podstawienia liganda;
c) reakcje skoordynowanych ligandów.
Reakcje przeniesienia elektronu
W reakcjach przeniesienia elektronu realizowane są dwa mechanizmy - mechanizm sfery zewnętrznej (bez zmian w sferach koordynacyjnych donora i akceptora) oraz mechanizm mostkujący (sfery wewnętrznej), prowadzący do zmian w sferze koordynacyjnej metalu.
Rozważmy mechanizm sfery zewnętrznej na przykładzie oktaedrycznych kompleksów metali przejściowych. W przypadku reakcji symetrycznych ( G 0 = 0)
stałe szybkości zmieniają się w bardzo szerokim zakresie wartości - od 10-12 do 10 5 l mol-1 s-1, w zależności od konfiguracji elektronowej jonu i stopnia jego restrukturyzacji w trakcie procesu. W reakcjach tych bardzo wyraźnie manifestuje się zasada najmniejszego ruchu - najmniejsza zmiana powłoki walencyjnej uczestników reakcji.
W reakcji przeniesienia elektronu (1) (Co * jest izotopem atomu Co)
(reakcja symetryczna), Co 2+ (d 7) przechodzi do Co 3+ (d 6). Konfiguracja elektroniczna (powłoka walencyjna) nie zmienia się podczas tego transferu
6 elektronów na poziomie wiązania potrójnie zdegenerowanego pozostaje niezmienione (), oraz na poziomie antywiązania mi G elektron poziomu pierwszego zostaje usunięty.
Stała szybkości reakcji drugiego rzędu (1) k 1 = 1,1 lmol-1 s-1. Ponieważ Phen (fenantrolina) jest silnym ligandem, maksymalna liczba wynosi 7 D-elektrony są sparowane (stan spinowy). W przypadku słabego liganda NH 3 sytuacja zmienia się radykalnie. Co(NH 3) n 2+ (n = 4, 5, 6) znajduje się w stanie niesparowanym (wysokim spinie).
Silniejszy kompleks Co(NH 3) 6 3+ (silniejszy niż Co(NH 3) 6 2+ ~ 10 30 razy) znajduje się w stanie sparowanym spinowo, podobnie jak kompleks z Phen. W związku z tym w procesie przenoszenia elektronów powłoka walencyjna powinna zostać silnie zrekonstruowana i w efekcie k= 10-9 lmol-1 s-1. Stopień konwersji Co 2+ do Co 3+ wynoszący 50% osiąga się w przypadku ligandu Phen w ciągu 1 sekundy, a w przypadku NH 3 ~ w ciągu 30 lat. Jest oczywiste, że etap o takiej szybkości (formalnie elementarny) można wykluczyć ze zbioru etapów elementarnych przy analizie mechanizmów reakcji.
Ogrom G dla reakcji przeniesienia elektronu podczas tworzenia kompleksu kolizyjnego, zgodnie z teorią Marcusa, obejmuje dwa składniki i
Pierwszy człon to energia reorganizacji wiązań M-L w obrębie kompleksu (długość i siła wiązania przy zmianie stanu wartościowości). Wartość ta obejmuje energię przegrupowania zewnętrznej powłoki solwatacyjnej w procesie zmiany współrzędnych M-L oraz ładunek kompleksu. Im mniejsza zmiana w środowisku elektronicznym i im mniejsza zmiana długości M-L, tym mniejsza, a im większe ligandy, tym mniejsza i w rezultacie większa szybkość transferu elektronów. Wartość dla przypadku ogólnego można obliczyć za pomocą równania Marcusa
Gdzie. W = 0 .
W przypadku mechanizmu wewnątrzsferycznego proces przenoszenia elektronów jest ułatwiony, ponieważ jeden z ligandów pierwszego kompleksu tworzy kompleks pomostowy z drugim kompleksem, wypierając z niego jeden z ligandów
Stałe szybkości takiego procesu są o 8 rzędów wielkości wyższe niż stałe redukcji Cr(NH 3) 6 3+. W takich reakcjach środek redukujący musi być labilnym kompleksem, a ligand w środku utleniającym musi być zdolny do tworzenia mostków (Cl-, Br-, I-, N 3 -, NCS-, bipy).
Reakcje podstawienia ligandówJeden z najważniejszych etapów katalizy kompleksowej metalu, interakcja substratu Y z kompleksem, zachodzi poprzez trzy mechanizmy:
a) Zastąpienie ligandu rozpuszczalnikiem. Ten etap jest zwykle przedstawiany jako dysocjacja kompleksu
Istotą procesu w większości przypadków jest zastąpienie ligandu L rozpuszczalnikiem S, który następnie można łatwo zastąpić cząsteczką substratu Y
b) Przyłączenie nowego ligandu w wolnej współrzędnej z utworzeniem skojarzenia, po którym następuje dysocjacja zastąpionego liganda
c) Substytucja synchroniczna (typ S N 2) bez tworzenia się pośredniego
W przypadku kompleksów Pt(II) szybkość reakcji bardzo często opisuje się równaniem dwudrogowym
Gdzie k S I k Y- stałe szybkości procesów zachodzących w reakcjach (5) (z rozpuszczalnikiem) i (6) z ligandem Y. Np.
Ostatni etap drugiej drogi jest sumą trzech szybkich etapów elementarnych – eliminacji Cl-, dodania Y i eliminacji cząsteczki H2O.
W płaskokwadratowych kompleksach metali przejściowych obserwuje się efekt trans sformułowany przez I.I. Czerniajewa - wpływ LT na szybkość podstawienia liganda znajdującego się w pozycji trans do liganda LT. W przypadku kompleksów Pt(II) efekt trans wzrasta w szeregu ligandów:
H2O~NH3< Cl- ~ Br- < I- ~ NO 2 - ~ C 6 H 5 - < CH 3 - <
< PR 3 ~ AsR 3 ~ H- < олефин ~ CO ~ CN-.
Obecność kinetycznego efektu trans i termodynamicznego trans-wpływu wyjaśnia możliwość syntezy obojętnych izomerycznych kompleksów Pt(NH 3) 2 Cl 2:
Reakcje skoordynowanych ligandów§ Reakcje podstawienia elektrofilowego (SE) wodoru metalem w sferze koordynacyjnej metalu i ich procesy odwrotne
SH - H2O, ROH, RNH2, RSH, ArH, RCCH.
W reakcjach tego typu biorą udział nawet cząsteczki H2 i CH4
§ Reakcje wprowadzenia L przez połączenie M-X
W przypadku X = R (kompleks metaloorganiczny) do wiązania M-R wprowadzane są również cząsteczki skoordynowane z metalem (L - CO, RNC, C 2 H 2, C 2 H 4, N 2, CO 2, O 2 itp. .). Reakcja insercji jest wynikiem wewnątrzcząsteczkowego ataku nukleofila X na cząsteczkę koordynowaną przez typ - lub -. Reakcje odwrotne - - i - reakcje eliminacji
§ Reakcje addycji utleniającej i eliminacji redukcyjnej
M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4-
Najwyraźniej w tych reakcjach zawsze następuje wstępna koordynacja dodanej cząsteczki, ale nie zawsze można to wykryć. Pod tym względem obecność wolnego miejsca w sferze koordynacyjnej lub miejsca związanego z rozpuszczalnikiem, które można łatwo zastąpić podłożem, jest ważnym czynnikiem wpływającym na reaktywność kompleksów metali. Przykładowo kompleksy bis-allilowe Ni są dobrymi prekursorami związków aktywnych katalitycznie, gdyż dzięki łatwej redukcyjnej eliminacji bis-allilu powstaje kompleks z rozpuszczalnikiem, tzw. „goły” nikiel. Rolę pustych miejsc ilustruje następujący przykład:
§ Reakcje addycji nukleofilowej i elektrofilowej do - i - kompleksów metali
Reakcje związków metaloorganicznychJako produkty pośrednie reakcji katalitycznych występują zarówno klasyczne związki metaloorganiczne posiadające wiązania M-C, M=C i MC, jak i związki nieklasyczne, w których ligand organiczny jest skoordynowany według typu 2, 3, 4, 5 i 6, czyli jest struktury pierwiastkowe z niedoborem elektronów - mostkujące grupy CH 3 i C 6 H 6, nieklasyczne węgliki (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+ itp.).
Wśród naukowych mechanizmów klasycznych związków metaloorganicznych zauważamy kilka mechanizmów. W ten sposób ustalono 5 mechanizmów podstawienia elektrofilowego atomu metalu przy wiązaniu M-C.
podstawienie elektrofilowe z pomocą nukleofilową
AdE Dodawanie-eliminacja
AdE(C) Dodatek do atomu C w hybrydyzacji sp 2
AdE(M) Utleniający dodatek do metalu
Podstawienie nukleofilowe przy atomie węgla w reakcjach demetalizacji związków metaloorganicznych zachodzi w procesie utleniania i redukcji:
Możliwy udział utleniacza na tym etapie
Takim środkiem utleniającym może być CuCl2, p-benzochinon, NO3 - i inne związki. Oto jeszcze dwa podstawowe etapy charakterystyczne dla RMX:
wodoroliza wiązania M-C
i homoliza wiązania M-C
Ważną zasadą, która ma zastosowanie do wszystkich reakcji związków złożonych i metaloorganicznych i jest związana z zasadą najmniejszego ruchu, jest reguła Tolmana 16-18 powłok elektronowych (rozdział 2).
Związki koordynacyjne i metaloorganicznena powierzchniWedług współczesnych koncepcji na powierzchni metali tworzą się kompleksy i związki metaloorganiczne podobne do związków w roztworach. W przypadku chemii powierzchni niezbędny jest udział kilku atomów powierzchniowych w tworzeniu takich związków i oczywiście brak naładowanych cząstek.
Grupami powierzchniowymi mogą być dowolne atomy (H, O, N, C), grupy atomów (OH, OR, NH, NH 2, CH, CH 2, CH 3, R), skoordynowane cząsteczki CO, N 2, CO 2, C2H4, C6H6. Przykładowo podczas adsorpcji CO na powierzchni metalu stwierdzono następujące struktury:
Cząsteczka C 2 H 4 tworzy na powierzchni metalu -kompleksy z jednym centrum i dipołączonymi mostkami etylenowymi M-CH 2 CH 2 -M, tj. zasadniczo cykle metali
Na przykład na powierzchni Rh podczas adsorpcji etylenu wraz ze wzrostem temperatury zachodzą następujące procesy konwersji etylenu:
Reakcje półproduktów powierzchniowych obejmują etapy addycji utleniającej, eliminacji redukcyjnej, insercji, - i -eliminacji, wodorolizy wiązań M-C i C-C oraz inne reakcje typu metaloorganicznego, ale bez pojawienia się wolnych jonów. W tablicach przedstawiono mechanizmy i półprodukty przemian powierzchniowych węglowodorów na metalach.
Tabela 3.1. Reakcje katalityczne polegające na rozerwaniu wiązania CC.
Oznaczenia:
Alkil, metalocykl;
karben, allil;
Karabinek, winyl.
Tabela 3.2. Reakcje katalityczne polegające na utworzeniu wiązania CC.
Oznaczenia: patrz tabela. 3.1.
Tworzenie się wszystkich powyższych związków metaloorganicznych na powierzchni metali zostało potwierdzone metodami fizycznymi.
Pytania do samokontroli
1) Jak objawia się zasada najmniejszej zmiany powłoki walencyjnej metalu podczas reakcji przeniesienia elektronu?
2) Dlaczego wolne miejsca koordynacyjne przyczyniają się do efektywnej interakcji z podłożem?
3) Wymień główne typy reakcji skoordynowanych ligandów.
4) Podaj mechanizmy podstawienia elektrofilowego w reakcjach związków metaloorganicznych z NX.
5) Podaj przykłady powierzchniowych związków metaloorganicznych.
6) Podaj przykłady udziału powierzchniowych kompleksów karbenów metali w przemianach węglowodorów.
Literatura do pogłębionych studiów
1. Temkin O.N., Kinetyka reakcji katalitycznych w roztworach kompleksów metali, M., MITHT, 1980, część III.
2. Collman J., Higedas L., Norton J., Finke R., Organometallic chemia of Consumer Metals, M., Mir, 1989, t. I, t. II.
3. Moiseev I.I., -Complexes in utlenianie olefin, M., Nauka, 1970.
4. Temkin O.N., Shestakov G.K., Treger Yu.A., Acetylen: Chemia. Mechanizmy reakcji. Technologia. M., Chemia, 1991, 416 s., sekcja 1.
5. Henrici-Olivet G., Olive S., Koordynacja i kataliza, M., Mir, 1980, 421 s.
6. Krylov O.V., Matyshak V.A., Związki pośrednie w katalizie heterogenicznej, M., Nauka, 1996.
7. Zaera F., Przewodnik metaloorganiczny po chemii cząsteczek węglowodorów na powierzchniach metali przejściowych., Chem. Rev., 1995, 95, 2651 - 2693.
8. Bent B.E., Mimicking Aspects of Heterogeneous Catalies: Generating, Isolating, and Reacting Proposed Surface Intermediates on Single Crystals in Vacuum, Chem. Obj., 1996, 96, 1361 - 1390.
Konwencjonalnie reakcje chemiczne kompleksów dzieli się na wymianę, redoks, izomeryzację i ligandy skoordynowane.
Pierwotna dysocjacja kompleksów na sferę wewnętrzną i zewnętrzną determinuje występowanie reakcji wymiany jonów sfery zewnętrznej:
X m + mNaY = Y m + mNaX.
Składniki wewnętrznej sfery kompleksów mogą także brać udział w procesach metabolicznych z udziałem zarówno ligandów, jak i czynnika kompleksującego. Aby scharakteryzować reakcje podstawienia ligandów lub centralnego jonu metalu, należy zastosować oznaczenia i terminologię zaproponowaną przez K. Ingolda dla reakcji związków organicznych (ryc. 42), nukleofilowych S N i elektrofilowe Podstawienia SE:
Z + Y = z +X S N
Z + M"= z + M S mi.
Zgodnie z mechanizmem reakcji podstawienia dzieli się je (ryc. 43) na asocjacyjne ( S N 1 i S E 1 ) i dysocjacyjne ( S N 2 i S E 2 ), różniących się stanem przejściowym zwiększoną i zmniejszoną liczbą koordynacyjną.
Klasyfikacja mechanizmu reakcji jako asocjacyjnego lub dysocjacyjnego jest trudnym, możliwym do wykonania eksperymentalnie zadaniem identyfikacji półproduktu o zmniejszonej lub zwiększonej liczbie koordynacyjnej. W związku z tym mechanizm reakcji często ocenia się na podstawie pośrednich danych na temat wpływu stężenia odczynników na szybkość reakcji, zmian w strukturze geometrycznej produktu reakcji itp.
Aby scharakteryzować szybkość reakcji podstawienia ligandu w kompleksach, laureat Nagrody Nobla z 1983 r. G. Taube (ryc. 44) zaproponował użycie terminów „labilny” i „obojętny” w zależności od czasu reakcji podstawienia ligandu, mniejszego lub dłuższego niż 1 minuta . Terminy labilny lub obojętny charakteryzują kinetykę reakcji podstawienia ligandu i nie należy ich mylić z termodynamicznymi cechami stabilności lub niestabilności kompleksów.
Labilność lub obojętność kompleksów zależy od charakteru jonu kompleksującego i ligandów. Zgodnie z teorią pola ligandów:
1. Kompleksy oktaedryczne 3 D metale przejściowe z rozkładem wartościowości ( n -1) d elektronów na sigma*(np ) rozluźniające MO są labilne.
4- (t 2g 6 mi g 1) + H 2 O= 3- + CN-.
Ponadto im niższa energia stabilizacji przez pole krystaliczne kompleksu, tym większa jest jego labilność.
2. Kompleksy oktaedryczne 3 D metale przejściowe z wolną sigmą* rozluźnienie np orbitale i równomierny rozkład wartościowości ( n -1) d elektrony w orbitali t 2 g (t 2 g 3, t 2 g 6) są obojętne.
[Co III (CN) 6] 3- (t 2 g 6 mi g 0) + H 2 O =
[Cr III (CN) 6] 3- (t 2 g 3 mi sol 0) + H 2 O =
3. Planokwadratowy i ośmiościenny 4 d i 5 d metale przejściowe, które nie mają elektronów na sigma* rozluźniające MO są obojętne.
2+ + H2O =
2+ + H2O =
Wpływ charakteru ligandów na szybkość reakcji podstawienia ligandów rozpatrywany jest w ramach modelu „wzajemnego wpływu ligandów”. Szczególnym przypadkiem modelu wzajemnego oddziaływania ligandów jest model sformułowany w 1926 roku przez I.I. Koncepcja wpływu trans Czerniajewa (ryc. 45) - „labilność ligandu w kompleksie zależy od charakteru translokowanego ligandu” – i proponują szereg trans-wpływów ligandów: CO, CN -, C 2 H 4 > PR 3, H - > CH 3 -, SC (NH 2) 2 > C 6 H 5 -, NO 2 -, I -, SCN - > Br -, Cl - > py , NH3 , OH - , H 2O .
Koncepcja wpływu trans pozwoliła nam uzasadnić praktyczne zasady:
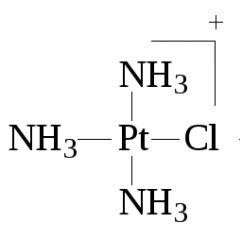
1. Reguła Peyrone’a- w wyniku działania amoniaku lub amin na tetrachloroplatynian ( II ) potas zawsze otrzymuje się w konfiguracji cis dichlorodiaminoplatyny:
2 - + 2NH3 = cis - + 2Cl - .
Ponieważ reakcja przebiega dwuetapowo, a ligand chlorkowy ma duży wpływ trans, zastąpienie drugiego ligandu chlorkowego amoniakiem następuje z utworzeniem cis-[ Pt (NH 3 ) 2Cl 2 ]:
2- + NH 3 = -
NH3 = cis-.
2. Reguła Jergensena - po działaniu kwasu solnego na chlorek tetraaminy platyny ( II ) lub podobne związki otrzymuje się w konfiguracji trans dichlorodi-aminoplatyny:
[ Pt (NH 3 ) 4 ] 2+ + 2 HCl = trans-[ Pt (NH 3 ) 2 Cl 2 ] + 2 NH 4 Cl .
Zgodnie z szeregiem trans-wpływów ligandów, zastąpienie drugiej cząsteczki amoniaku ligandem chlorkowym prowadzi do powstania trans-[ Pt(NH3)2Cl2].
3. Reakcja tiomocznikowa Kurnakowa - różne produkty reakcji tiomocznika z izomerami geometrycznymi trans-[ Pt (NH 3 ) 2 Cl 2 ] i cis-[ Pt (NH 3 ) 2 Cl 2 ]:
cis - + 4Tio = 2+ + 2Cl - + 2NH3.
Różny charakter produktów reakcji związany jest z dużym wpływem trans tiomocznika. Pierwszym etapem reakcji jest zastąpienie ligandów chlorku tiomocznika utworzeniem trans- i cis-[ Pt (NH 3 ) 2 (Tio ) 2 ] 2+ :
trans-[Pt (NH 3) 2Cl 2 ] + 2 Tio = trans-[ Pt (NH 3) 2 (Tio) 2 ] 2+
cis - + 2Tio = cis - 2+.
W cis-[Pt(NH3)2(Tio ) 2 ] 2+ dwie cząsteczki amoniaku w pozycji trans do tiomocznika ulegają dalszej podstawieniu, co prowadzi do powstania 2+ :
cis - 2+ + 2Tio = 2+ + 2NH3.
W trans-[Pt(NH3)2(Tio ) 2 ] 2+ dwie cząsteczki amoniaku o niewielkim wpływie trans znajdują się w pozycji trans wobec siebie i dlatego nie są zastępowane przez tiomocznik.
Wzorce wpływu trans odkrył I.I. Czerniajewa podczas badania reakcji podstawienia ligandów w kwadratowo-płaskich kompleksach platyny ( II ). Następnie wykazano, że wpływ trans ligandów objawia się także w kompleksach innych metali ( Pt(IV), Pd(II), Co(III), Cr(III), Rh(III), Ir(III )) i inna struktura geometryczna. To prawda, że szereg trans-wpływów ligandów na różne metale jest nieco inny.
Należy zauważyć, że wpływ trans jest efekt kinetyczny- im większy wpływ trans danego liganda, tym szybciej jest on zastępowany przez inny ligand znajdujący się względem niego w pozycji trans.
Wraz z kinetycznym efektem wpływu trans, pośrodku XX wiek AA Grinberg i Yu.N. Kukushkin ustalił zależność trans-wpływu ligandu L od liganda znajdującego się w pozycji cis do L . Zatem badanie szybkości reakcji podstawienia Cl- amoniak w kompleksach platyny ( II):
[PtCl 4 ] 2- + NH 3 = [ PtNH 3 Cl 3 ] - + Cl - K = 0,42. 10 4 l/mol. Z
[ PtNH 3 Cl 3 ] - + NH 3 = cis- [ Pt (NH 3 ) 2 Cl 2 ] + Cl - K = 1,14. 10 4 l/mol. Z
trans-[ Pt (NH 3 ) 2 Cl 2 ] + NH 3 = [ Pt (NH 3 ) 3 Cl ] + + Cl - K = 2,90 . 10 4 l/mol. Z
wykazali, że obecność jednej lub dwóch cząsteczek amoniaku w pozycji cis zastąpionego ligandu chlorkowego prowadzi do stałego wzrostu szybkości reakcji. Ten efekt kinetyczny nazywa się wpływ cis. Obecnie oba efekty kinetyczne wpływu charakteru ligandów na szybkość reakcji podstawienia ligandów (efekt trans i cis) łączą się w ogólnej koncepcji wzajemne oddziaływanie ligandów.
Teoretyczne uzasadnienie efektu wzajemnego oddziaływania ligandów jest ściśle związane z rozwojem koncepcji wiązań chemicznych w związkach złożonych. W latach 30 XX wiek AA Greenberg i B.V. Niekrasow rozważał wpływ trans w ramach modelu polaryzacji:
1. Efekt trans jest typowy dla kompleksów, których centralny jon metalu jest silnie polaryzowalny.
2. Aktywność trans ligandów zależy od energii wzajemnej polaryzacji ligandu i jonu metalu. Dla danego jonu metalu wpływ trans ligandu zależy od jego polaryzowalności i odległości od jonu centralnego.
Model polaryzacji jest zgodny z danymi eksperymentalnymi dla kompleksów z prostymi ligandami anionowymi, takimi jak jony halogenkowe.
W 1943 roku A.A. Greenberg postawił hipotezę, że aktywność trans ligandów jest związana z ich właściwościami redukującymi. Przesunięcie gęstości elektronowej z translokowanego ligandu na metal zmniejsza efektywny ładunek jonu metalu, co prowadzi do osłabienia wiązania chemicznego z translokowanym ligandem.
Rozwój idei wpływu trans wiąże się z wysoką aktywnością trans ligandów opartych na nienasyconych cząsteczkach organicznych, takich jak etylen, w [ Pt(C2H4)Cl3 ] - . Według Chatta i Orgela (ryc. 46) jest to spowodowane:Liczba Pi-celowe oddziaływanie takich ligandów z metalem i mechanizm asocjacyjny reakcji substytucji translokowanych ligandów. Koordynacja z jonem metalu atakującego ligandu Z prowadzi do powstania pięciokoordynacyjnego trygonalnego bipiramidalnego związku pośredniego, po którym następuje szybka eliminacja opuszczającego liganda X. Tworzenie takiego związku pośredniego ułatwiaLiczba Pi-celowe oddziaływanie ligand-metal ligand Y , co zmniejsza gęstość elektronową metalu i zmniejsza energię aktywacji stanu przejściowego, a następnie szybką wymianę liganda X.
Wraz z P akceptor (C 2 H 4 , CN - , CO ...) ligandy tworzące celowe wiązanie chemiczne ligand-metal mają wysoki wpływ trans iSligandy dawcy: H - , CH 3 - , C 2 H 5 - ... O wpływie trans takich ligandów decyduje oddziaływanie donor-akceptor ligandu X z metalem, co obniża jego gęstość elektronową i osłabia wiązanie metalu z opuszczającym ligandem Y.
Zatem pozycja ligandów w szeregu trans-aktywności jest określona przez połączone działanie sigma- dawca i Liczba Pi-właściwości ligandów - sigma- dawca i Liczba Pi-właściwości akceptorowe ligandu zwiększają jego wpływ trans, podczas gdyLiczba Pi-dawcy słabną. To, który z tych składników oddziaływania ligand-metal dominuje w efekcie trans, ocenia się na podstawie obliczeń kwantowo-chemicznych struktury elektronowej stanu przejściowego reakcji.
Jeden z najważniejszych etapów katalizy metalokompleksowej – interakcja substratu Y z kompleksem – zachodzi poprzez trzy mechanizmy:
a) Zastąpienie ligandu rozpuszczalnikiem. Ten etap jest zwykle przedstawiany jako dysocjacja kompleksu
Istotą procesu w większości przypadków jest zastąpienie liganda rozpuszczalnikiem S, który następnie można łatwo zastąpić cząsteczką substratu Y
b) Przyłączenie nowego ligandu w wolnej współrzędnej z utworzeniem skojarzenia, po którym następuje dysocjacja zastąpionego liganda
c) Substytucja synchroniczna (typ S N 2) bez tworzenia się pośredniego
W przypadku kompleksów Pt(II) szybkość reakcji bardzo często opisuje się równaniem dwudrogowym
Gdzie k S I k Y są stałymi szybkości procesów zachodzących w reakcjach (5) (z rozpuszczalnikiem) i (6) z ligandem Y. Na przykład,


Ostatni etap drugiej drogi jest sumą trzech szybkich etapów elementarnych – eliminacji Cl –, dodania Y i eliminacji cząsteczki H 2 O.
W płaskich kwadratowych kompleksach metali przejściowych obserwuje się efekt trans sformułowany przez I.I. Czerniajewa - wpływ LT na szybkość podstawienia liganda znajdującego się w pozycji trans do liganda LT. W przypadku kompleksów Pt(II) efekt trans wzrasta w szeregu ligandów:
H2O~NH3 Obecność kinetycznego efektu trans i termodynamicznego trans-wpływu wyjaśnia możliwość syntezy obojętnych izomerycznych kompleksów Pt(NH 3) 2 Cl 2: Reakcje podstawienia elektrofilowego (SE) wodoru metalem w sferze koordynacyjnej metalu i ich procesy odwrotne SH – H 2 O, ROH, RNH 2, RSH, ArH, RCCH. W reakcjach tego typu biorą udział nawet cząsteczki H2 i CH4 Reakcje wprowadzenia L wzdłuż połączenia M-X W przypadku X=R (kompleks metaloorganiczny) do wiązania M-R wprowadzane są również cząsteczki skoordynowane z metalem (L–CO, RNC, C 2 H 2, C 2 H 4, N 2, CO 2, O 2 itp. .). Reakcja insercji jest wynikiem wewnątrzcząsteczkowego ataku nukleofila na cząsteczkę skoordynowaną typu lub . Reakcje odwrotne – reakcje - i -eliminacji Reakcje addycji oksydacyjnej i redukcyjnej eliminacji M 2 (C 2 H 2) M 2 4+ (C 2 H 2) 4– Najwyraźniej w tych reakcjach zawsze następuje wstępna koordynacja dodanej cząsteczki, ale nie zawsze można to wykryć. Dlatego obecność wolnego miejsca w sferze koordynacyjnej lub miejsca związanego z rozpuszczalnikiem, które można łatwo zastąpić podłożem, jest ważnym czynnikiem wpływającym na reaktywność kompleksów metali. Przykładowo kompleksy bis--allilowe Ni są dobrymi prekursorami związków aktywnych katalitycznie, gdyż dzięki łatwej redukcyjnej eliminacji bis-allilu powstaje kompleks z rozpuszczalnikiem, tzw. „goły” nikiel. Rolę pustych miejsc ilustruje następujący przykład: Reakcje addycji nukleofilowej i elektrofilowej do - i -kompleksów metali Półproduktami reakcji katalitycznych są zarówno klasyczne związki metaloorganiczne posiadające wiązania M-C, M=C i MC, jak i związki nieklasyczne, w których ligand organiczny jest skoordynowany według 2 , 3 , 4 , 5 i 6 -lub jest elementem struktur z niedoborem elektronów - mostkujących grupy CH 3 i C 6 H 6, węgliki nieklasyczne (Rh 6 C(CO) 16, C(AuL) 5 +, C(AuL) 6 2+ itd.). Wśród specyficznych mechanizmów działania klasycznych związków -organometalicznych zauważamy kilka mechanizmów. W ten sposób ustalono 5 mechanizmów podstawienia elektrofilowego atomu metalu przy wiązaniu M-C. podstawienie elektrofilowe z pomocą nukleofilową Dodatek-eliminacja AdE(C) Dodatek do atomu C w hybrydyzacji sp 2 AdE(M) Utleniający dodatek do metalu Podstawienie nukleofilowe na atomie węgla w reakcjach demetalizacji związków metaloorganicznych zachodzi jako proces redoks: Możliwy udział utleniacza na tym etapie Takim utleniaczem może być CuCl 2, p-benzochinon, NO 3 – i inne związki. Oto jeszcze dwa podstawowe etapy charakterystyczne dla RMX: wodoroliza wiązania M-C i homoliza wiązania M-C Ważną zasadą, która ma zastosowanie do wszystkich reakcji związków złożonych i metaloorganicznych i jest związana z zasadą najmniejszego ruchu, jest reguła Tolmana 16-18 powłok elektronowych (rozdział 2). Główną reakcję podstawienia w roztworach wodnych, wymianę cząsteczek wody (22), badano dla dużej liczby jonów metali (ryc. 34). Wymiana cząsteczek wody w sferze koordynacyjnej jonu metalu z większością cząsteczek wody występujących w postaci rozpuszczalnika w przypadku większości metali zachodzi bardzo szybko, dlatego też szybkość takiej reakcji można badać głównie metodą relaksacyjną. Metoda polega na zaburzeniu równowagi układu np. poprzez gwałtowny wzrost temperatury. W nowych warunkach (wyższa temperatura) układ nie będzie już w równowadze. Następnie mierzy się szybkość równowagi. Jeśli możesz zmienić temperaturę roztworu w środku 10 -8 sek, wówczas można zmierzyć szybkość reakcji, która wymaga więcej niż pewnego czasu 10 -8 sek. Można także zmierzyć stopień podstawienia skoordynowanych cząsteczek wody w jonach różnych metali za pomocą ligandów SO 2-4, S 2 O 3 2-, EDTA itp. (26). Szybkość tej reakcji zależy od stężenia uwodnionego jonu metalu i nie zależy od stężenia przychodzącego ligandu, co pozwala na wykorzystanie równania pierwszego rzędu (27) do opisania szybkości tych układów. W wielu przypadkach szybkość reakcji (27) dla danego jonu metalu nie zależy od charakteru przychodzącego ligandu (L), czy będą to cząsteczki H 2 O, czy SO 4 2-, S 2 O 3 2-, czy jony EDTA. Ta obserwacja, w połączeniu z faktem, że równanie szybkości tego procesu nie uwzględnia stężenia dopływającego ligandu, sugeruje, że reakcje te przebiegają według mechanizmu, w którym powolny etap polega na zerwaniu wiązania pomiędzy jonem metalu i wodą. Powstały związek prawdopodobnie szybko koordynuje pobliskie ligandy. W rozdz. 4 tego rozdziału stwierdzono, że bardziej naładowane uwodnione jony metali, takie jak Al 3+ i Sc 3+, wymieniają cząsteczki wody wolniej niż jony M 2+ i M +; Daje to podstawy do przypuszczenia, że zerwanie wiązań odgrywa ważną rolę na etapie determinującym tempo całego procesu. Wnioski uzyskane w tych badaniach nie są jednoznaczne, dają jednak podstawy sądzić, że procesy S N 1 odgrywają ważną rolę w reakcjach podstawienia uwodnionych jonów metali. Prawdopodobnie najlepiej zbadanymi związkami złożonymi są aminy kobaltu(III). Ich stabilność, łatwość przygotowania i powolne reakcje czynią je szczególnie odpowiednimi do badań kinetycznych. Ponieważ badania tych kompleksów prowadzono wyłącznie w roztworach wodnych, należy najpierw rozważyć reakcje tych kompleksów z cząsteczkami rozpuszczalnika – wody. Stwierdzono, że na ogół cząsteczki amoniaku lub amin koordynowane przez jon Co(III) są tak wolno zastępowane cząsteczkami wody, że zwykle rozważa się zastąpienie ligandów innych niż aminy. Zbadano szybkość reakcji typu (28) i stwierdzono, że jest ona pierwszego rzędu w stosunku do kompleksu kobaltu (X jest jednym z wielu możliwych anionów). Ponieważ w roztworach wodnych stężenie H2O jest zawsze w przybliżeniu 55,5 mln, wówczas nie da się określić wpływu zmiany stężenia cząsteczek wody na szybkość reakcji. Równania szybkości (29) i (30) dla roztworu wodnego nie są rozróżnialne eksperymentalnie, ponieważ k jest po prostu równe k" = k". Dlatego na podstawie równania szybkości reakcji nie można stwierdzić, czy H2O będzie uczestniczyć w etapie decydującym o szybkości procesu. Odpowiedź na pytanie, czy reakcja ta przebiega na zasadzie mechanizmu S N 2 z zastąpieniem jonu X cząsteczką H 2 O, czy też na zasadzie mechanizmu S N 1 polegającego najpierw na dysocjacji, a następnie dodaniu cząsteczki H 2 O, musi można uzyskać stosując inne dane eksperymentalne. Problem ten można rozwiązać za pomocą dwóch typów eksperymentów. Szybkość hydrolizy (zastąpienie jednego jonu Cl na cząsteczkę wody) trans- + jest około 10 3 razy większa niż szybkość hydrolizy 2+. Wzrost ładunku kompleksu prowadzi do wzmocnienia wiązań metal-ligand, a w konsekwencji do zahamowania rozszczepienia tych wiązań. Należy również wziąć pod uwagę przyciąganie przychodzących ligandów i ułatwianie reakcji podstawienia. Ponieważ szybkość maleje wraz ze wzrostem ładunku kompleksu, w tym przypadku bardziej prawdopodobny wydaje się proces dysocjacji (SN 1). Inna metoda dowodu opiera się na badaniu hydrolizy szeregu podobnych kompleksów trans- + . W tych kompleksach cząsteczkę etylenodiaminy zastępuje się podobnymi diaminami, w których atomy wodoru przy atomie węgla zastępuje się grupami CH3. Kompleksy zawierające podstawione diaminy reagują szybciej niż kompleks etylenodiaminy. Zastąpienie atomów wodoru grupami CH3 zwiększa objętość ligandu, co utrudnia atak atomu metalu przez inny ligand. Te przeszkody przestrzenne spowalniają reakcję poprzez mechanizm S N 2. Obecność dużych ligandów w pobliżu atomu metalu sprzyja procesowi dysocjacji, ponieważ usunięcie jednego z ligandów zmniejsza ich akumulację przy atomie metalu. Obserwowany wzrost szybkości hydrolizy kompleksów z ligandami o dużej objętości jest dobrym dowodem na to, że reakcja przebiega zgodnie z mechanizmem S N 1. Zatem w wyniku licznych badań kompleksów kwasoaminowych Co(II) okazało się, że zastępowanie grup kwasowych cząsteczkami wody ma charakter procesu dysocjacyjnego. Wiązanie atom kobaltu z ligandem wydłuża się do pewnej wartości krytycznej, zanim cząsteczki wody zaczną wchodzić do kompleksu. W kompleksach o ładunku 2+ i wyższym rozerwanie wiązania kobalt-ligand jest bardzo trudne, a coraz większą rolę zaczyna odgrywać wnikanie cząsteczek wody. Stwierdzono, że zastąpienie grupy acido (X -) w kompleksie kobaltu(III) grupą inną niż cząsteczka H2O, (31) najpierw następuje poprzez jej zastąpienie cząsteczką rozpuszczalnik - woda, a następnie zastąpienie go nową grupą Y (32). Zatem w wielu reakcjach z kompleksami kobaltu(III) szybkość reakcji (31) jest równa szybkości hydrolizy (28). Jedynie jon hydroksylowy różni się od pozostałych reagentów reaktywnością z aminami Co(III). Reaguje bardzo szybko z kompleksami aminowymi kobaltu(III) (około 10,6 razy szybciej niż woda) w zależności od rodzaju reakcji zasadowa hydroliza (33). Stwierdzono, że reakcja ta jest pierwszego rzędu w odniesieniu do ligandu podstawiającego OH - (34). Ogólny drugi rząd reakcji i niezwykle szybki postęp reakcji sugerują, że jon OH - jest wyjątkowo skutecznym odczynnikiem nukleofilowym dla kompleksów Co(III) i że reakcja przebiega poprzez mechanizm SN 2 poprzez utworzenie związku pośredniego. Jednak tę właściwość OH - można wyjaśnić także innym mechanizmem [równania (35), (36)]. W reakcji (35) kompleks 2+ zachowuje się jak kwas (według Brønsteda), dając kompleks +, który jest amido-(zawierający) związek - zasada odpowiadająca kwasowi 2+. Reakcja następnie przebiega poprzez mechanizm SN1 (36), tworząc pięciokoordynacyjny związek pośredni, który dalej reaguje z cząsteczkami rozpuszczalnika, tworząc końcowy produkt reakcji (37). Ten mechanizm reakcji jest zgodny z szybkością reakcji drugiego rzędu i odpowiada mechanizmowi S N 1. Ponieważ reakcja na etapie determinującym szybkość obejmuje koniugat zasady z pierwotnym kompleksem - kwasem, mechanizmowi temu nadano oznaczenie S N 1CB. Ustalenie, który z tych mechanizmów najlepiej wyjaśnia obserwacje eksperymentalne, jest bardzo trudne. Istnieją jednak przekonujące dowody potwierdzające hipotezę S N 1CB. Najlepszymi argumentami przemawiającymi za tym mechanizmem są: oktaedryczne kompleksy Co(III) na ogół reagują poprzez mechanizm dysocjacji S N 1 i nie ma przekonującego argumentu, dlaczego jon OH - miałby pośredniczyć w procesie S N 2. Ustalono, że jon hydroksylowy jest słabym odczynnikiem nukleofilowym w reakcjach z Pt(II), dlatego jego niezwykła reaktywność z Co(III) wydaje się nieuzasadniona. Reakcje ze związkami kobaltu(III) w środowisku niewodnym dostarczają doskonałych dowodów na powstawanie pięciokoordynacyjnych związków pośrednich zapewnianych przez mechanizm S N 1 SV. Ostatecznym dowodem jest fakt, że przy braku wiązań N – H w kompleksie Co(III), powoli reaguje on z jonami OH –. To oczywiście sugeruje, że właściwości kwasowo-zasadowe kompleksu są ważniejsze niż właściwości nukleofilowe OH dla szybkości reakcji.” Ta reakcja zasadowej hydrolizy kompleksów amin Co(III) ilustruje fakt, że dane kinetyczne często można interpretować na więcej niż jeden sposób, a aby wykluczyć ten czy inny możliwy mechanizm, konieczne jest przeprowadzenie dość subtelnego eksperymentu. Obecnie badane są reakcje podstawienia dużej liczby związków oktaedrycznych. Jeśli weźmiemy pod uwagę mechanizmy ich reakcji, najczęstszym jest proces dysocjacji. Wynik ten nie jest nieoczekiwany, ponieważ sześć ligandów pozostawia niewiele miejsca wokół atomu centralnego, aby inne grupy mogły się do niego przyczepić. Istnieje tylko kilka przykładów, w których wykazano występowanie siedmiokoordynacyjnego związku pośredniego lub wykryto wpływ pośredniego ligandu. Dlatego nie można całkowicie odrzucić mechanizmu SN 2 jako możliwej ścieżki reakcji podstawienia w kompleksach oktaedrycznych. Reakcje związków koordynacyjnych zawsze zachodzą w sferze koordynacyjnej metalu ze związanymi w niej ligandami. Zatem oczywistym jest, że aby w ogóle cokolwiek się wydarzyło, ligandy muszą mieć możliwość wpadnięcia w tę sferę. Może się to zdarzyć na dwa sposoby: Pierwszą metodę poznaliśmy już przy omawianiu nienasycenia koordynacyjnego i reguły 18 elektronów. Tutaj zajmiemy się tym drugim. Zwykle jednak obowiązuje niepisana zasada – liczba zajętych miejsc koordynacyjnych się nie zmienia. Innymi słowy, liczba elektronów nie zmienia się podczas podstawienia. Zastąpienie jednego rodzaju liganda innym jest całkiem możliwe i często występuje w rzeczywistości. Zwróćmy uwagę tylko na prawidłowe obchodzenie się z ładunkami przy zmianie liganda L na ligand X i odwrotnie. Jeśli o tym zapomnimy, wówczas zmieni się stopień utlenienia metalu, a wymiana ligandów nie jest procesem utleniająco-redukującym (jeśli znajdziesz lub wymyślisz odwrotny przykład, daj mi znać - zostanie to automatycznie zaliczone poprawnie daleko, jeśli nie będę w stanie udowodnić, że się myliłeś, nawet w tym przypadku gwarantuję pozytywny wkład w karmę). Przy bardziej złożonych ligandach nie ma już trudności - trzeba tylko pamiętać o dość oczywistej zasadzie: liczba miejsc ligandów (czyli całkowita liczba ligandów lub centrów ligandów typu X lub L) zostaje zachowana. Wynika to bezpośrednio z zasady zachowania liczenia elektronów. Oto oczywiste przykłady. Zwróćmy uwagę na ostatni przykład. Reagentem wyjściowym w tej reakcji jest dichlorek żelaza FeCl2. Do niedawna powiedzielibyśmy: „To tylko sól, co ma z tym wspólnego chemia koordynacyjna?” Ale nie pozwolimy sobie już na taką ignorancję. W chemii metali przejściowych nie ma „tylko soli”, wszelkie pochodne są związkami koordynacyjnymi, do których odnoszą się wszystkie rozważania dotyczące zliczania elektronów, konfiguracji d, nasycenia koordynacyjnego itp. Dichlorek żelaza, jak zwykliśmy to pisać, okazałby się kompleksem Fe(2+) typu MX 2 o konfiguracji d 6 i liczbie elektronów 10. Za mało! Cienki? Przecież już ustaliliśmy, że ligandy mogą być ukryte. Do przeprowadzenia reakcji potrzebny jest rozpuszczalnik, a do takich reakcji najprawdopodobniej jest to THF. Rozpuszczanie krystalicznej soli żelaza w THF następuje właśnie dlatego, że rozpuszczalnik donorowy zajmuje wolne przestrzenie, a energia tego procesu kompensuje zniszczenie sieci krystalicznej. Nie bylibyśmy w stanie rozpuścić tej „soli” w rozpuszczalniku, który nie zapewnia usług solwatacji metali ze względu na zasadowość Lewisa. W tym przypadku i w milionie podobnych solwatacja jest po prostu interakcją koordynacyjną. Zapiszmy dla pewności wynik solwatacji w postaci kompleksu FeX 2 L 4, w którym dwa jony chloru pozostają w sferze koordynacyjnej w postaci dwóch ligandów X, chociaż najprawdopodobniej są one również wypierane przez cząsteczki rozpuszczalnika donorowego z utworzenie naładowanego kompleksu FeL 6 2+. W tym przypadku nie jest to aż tak istotne. Tak czy inaczej, możemy bezpiecznie założyć, że mamy kompleks 18 elektronów zarówno po lewej, jak i po prawej stronie. Jeśli pamiętamy chemię organiczną, to przy nasyconym atomie węgla istniały dwa mechanizmy podstawienia - SN1 i SN2. W pierwszym podstawienie przebiegało dwuetapowo: najpierw stary podstawnik opuścił, pozostawiając wolny orbital na atomie węgla, który następnie został zajęty przez nowy podstawnik z parą elektronów. Drugi mechanizm zakładał, że odejście i przyjście odbywa się jednocześnie, w porozumieniu, a proces ten jest jednoetapowy. W chemii związków koordynacyjnych całkiem możliwe jest wyobrażenie sobie czegoś podobnego. Ale pojawia się trzecia możliwość, której nie miał nasycony atom węgla – najpierw przyłączamy nowy ligand, potem odłączamy stary. Od razu staje się jasne, że ta trzecia opcja jest prawie niemożliwa, jeśli kompleks ma już 18 elektronów i jest nasycony koordynacją. Ale jest to całkiem możliwe, jeśli liczba elektronów wynosi 16 lub mniej, to znaczy kompleks jest nienasycony. Przypomnijmy od razu oczywistą analogię z chemii organicznej - podstawienie nukleofilowe przy nienasyconym atomie węgla (w pierścieniu aromatycznym lub przy węglu karbonylowym) również następuje najpierw jako dodanie nowego nukleofilu, a następnie eliminacja starego. Tak więc, jeśli mamy 18 elektronów, wówczas podstawienie następuje w formie dodania abstrakcji (fani „inteligentnych” słów używają terminu mechanizm dysocjacyjno-asocjacyjny lub po prostu mechanizm dysocjacyjny). Inny sposób wymagałby rozszerzenia sfery koordynacyjnej do liczby 20 elektronów. Nie jest to całkowicie niemożliwe i czasami rozważa się nawet takie opcje, ale na pewno jest to bardzo nieopłacalne i za każdym razem, gdy istnieje podejrzenie takiej ścieżki, wymagane są bardzo istotne dowody. W przypadku większości tych historii badacze ostatecznie doszli do wniosku, że coś przeoczyli lub przeoczyli, i mechanizm skojarzeń został odrzucony. Jeśli więc pierwotny kompleks ma 18 elektronów, to najpierw musi opuścić jeden ligand, a następnie na jego miejsce musi zająć się nowy, na przykład: Jeśli chcemy wprowadzić hapto-ligand zajmujący kilka miejsc do sfery koordynacyjnej, musimy najpierw opuścić je wszystkie. Z reguły dzieje się to tylko w dość trudnych warunkach, np. w celu zastąpienia trzech karbonylków w karbonylu chromu η 6-benzenem mieszaninę ogrzewa się pod ciśnieniem przez wiele godzin, uwalniając od czasu do czasu uwolniony tlenek węgla. Chociaż diagram przedstawia dysocjację trzech ligandów z utworzeniem bardzo nienasyconego kompleksu z 12 elektronami, w rzeczywistości reakcja najprawdopodobniej zachodzi etapami, pozostawiając po jednym karbonylu, a benzen wnika do kuli, stopniowo zwiększając haptyczność, poprzez etapy minus CO - digapto - minus jeszcze jeden CO - tetrahapto - minus jeszcze jeden CO - hexagapto, tak że nie uzyskuje się mniej niż 16 elektronów. Jeśli więc mamy kompleks z 16 elektronami lub mniej, to wymiana liganda najprawdopodobniej przebiega w formie addycji-eliminacji (dla tych, którzy lubią głęboko brzmiące słowa: asocjacyjno-dysocjacyjny lub po prostu asocjacyjny): nowy ligand pojawia się najpierw , wtedy stary odchodzi. Nasuwają się dwa oczywiste pytania: dlaczego stary ligand odchodzi, skoro 18 elektronów jest bardzo dobrze, i dlaczego w tym przypadku nie zrobić odwrotnie, jak w kompleksach 18-elektronowych. Na pierwsze pytanie łatwo jest odpowiedzieć: każdy metal ma swoje własne nawyki, a niektóre metale, zwłaszcza późne, z prawie całkowicie wypełnionymi powłokami d, preferują liczbę 16 elektronów i odpowiadające im typy strukturalne, a zatem wyrzucają dodatkowy ligand , wracając do swojej ulubionej konfiguracji. Czasami na sprawę wpływa również czynnik przestrzenny, istniejące ligandy są duże, a dodatkowy sprawia wrażenie pasażera autobusu w godzinach szczytu. Łatwiej zejść i pójść na spacer, niż tak cierpieć. Można jednak wypchnąć innego pasażera, pozwolić mu się przespacerować i pojedziemy. Drugie pytanie też jest proste – w tym przypadku mechanizm dysocjacyjny musiałby najpierw dać kompleks 14-elektronowy, a to rzadko jest korzystne. Oto przykład. Dla urozmaicenia zamieńmy ligand X na ligand L, a nie będziemy mylić co do stopni utlenienia i ładunków. Jeszcze raz: po podstawieniu stopień utlenienia nie zmienia się, a jeśli ligand X odejdzie, stratę należy zrekompensować ładunkiem metalu. Jeśli o tym zapomnimy, stopień utlenienia zmniejszy się o 1, ale jest to błędne. I jeszcze jedna dziwna rzecz. Wiązanie metal-pirydyna powstało z powodu wolnej pary na azocie. W chemii organicznej w tym przypadku zdecydowanie wykazalibyśmy plus na azocie pirydyny (na przykład po protonowaniu lub utworzeniu soli czwartorzędowej), ale nigdy nie robimy tego w chemii koordynacyjnej ani z pirydyną, ani z żadnymi innymi L-ligandami. Jest to strasznie denerwujące dla każdego, kto jest przyzwyczajony do ścisłego i jednoznacznego systemu rysowania struktur w chemii organicznej, ale trzeba się do tego przyzwyczaić, nie jest to takie trudne. Ale nie ma dokładnego analogu SN2 w chemii związków koordynacyjnych, jest odległy, ale jest stosunkowo rzadki i tak naprawdę go nie potrzebujemy. Nie moglibyśmy w ogóle mówić o mechanizmach podstawienia ligandu, gdyby nie jedna niezwykle ważna okoliczność, z której będziemy często korzystać: podstawienie liganda, czy to asocjacyjne, czy dysocjacyjne, koniecznie zakłada dysocjację starego liganda. Bardzo ważne jest dla nas, aby wiedzieć, które ligandy opuszczają łatwo, a które słabo, woląc pozostać w sferze koordynacyjnej metalu. Jak wkrótce się przekonamy, w każdej reakcji część ligandów pozostaje w sferze koordynacyjnej i nie ulega zmianie. Takie ligandy nazywane są zwykle ligandami spektatorowymi (jeśli nie chcesz takich prostych, „nienaukowych” słów, użyj angielskiego słowa spectator w lokalnej transkrypcji spectator, ligand-spectator, ale błagam, nie spectator - to jest nie do zniesienia! ). A niektóre bezpośrednio uczestniczą w reakcji, zamieniając się w produkty reakcji. Takie ligandy nazywane są aktorami (nie aktorami!), czyli aktywnymi. Jest całkiem jasne, że ligand-aktorzy muszą być łatwo wprowadzani i usuwani do sfery koordynacyjnej metalu, w przeciwnym razie reakcja po prostu utknie. Ale ligandy widza lepiej pozostawić w sferze koordynacyjnej z wielu powodów, ale przynajmniej z tak banalnego, jak potrzeba uniknięcia niepotrzebnego zamieszania wokół metalu. Lepiej, aby w pożądanym procesie uczestniczyli tylko aktorzy ligandowi i w wymaganych ilościach. Jeśli dostępnych jest więcej miejsc koordynacyjnych niż to konieczne, mogą się w nich znajdować dodatkowi aktorzy ligandowi, a nawet ci, którzy będą uczestniczyć w reakcjach ubocznych, zmniejszając wydajność docelowego produktu i selektywność. Ponadto ligandy widza prawie zawsze spełniają wiele ważnych funkcji, na przykład zapewniają rozpuszczalność kompleksów, stabilizują prawidłowy stan wartościowości metalu, zwłaszcza jeśli nie jest on całkiem zwyczajny, pomagają poszczególnym etapom, zapewniają stereoselektywność itp. Nie będziemy tego jeszcze rozszyfrowywać, bo omówimy to wszystko szczegółowo, gdy dojdziemy do konkretnych reakcji. Okazuje się, że część ligandów w sferze koordynacyjnej powinna być ściśle związana i nie ulegać dysocjacji i zastępowaniu przez inne ligandy. Takie ligandy są zwykle nazywane koordynacyjnie stabilny
. Lub po prostu stabilny, jeśli z kontekstu jasno wynika, że mówimy o sile wiązań ligandów, a nie o ich własnej stabilności termodynamicznej, co nas w ogóle nie dotyczy. Nazywa się to ligandami, które łatwo i chętnie wchodzą i wychodzą i zawsze są gotowe ustąpić miejsca innym labilność koordynacyjna
, czyli po prostu labilne i tu na szczęście nie ma żadnych dwuznaczności. To chyba najbardziej uderzający przykład tego, że w sferze koordynacyjnej bardzo niestabilna cząsteczka może stać się doskonałym ligandem, a z definicji koordynacją stabilną, choćby dlatego, że jeśli odważy się opuścić ciepłą i przytulną sferę na zewnątrz, nic dobrego się nie stanie. poczekaj na to (kosztem produkcji będzie właśnie energia destabilizacji antyaromatycznej). Najbardziej znanymi przykładami działania przeciwaromatycznego są cyklobutadien i jego pochodne. Cząsteczki te istnieją jedynie w niskich temperaturach, i to w mocno zniekształconej formie – aby jak najdalej oddalić się od antyaromatyczności, cykl zostaje zniekształcony do wydłużonego prostokąta, usuwając delokalizację i maksymalnie osłabiając koniugację wiązań podwójnych (tzw. efekt Jahna-Tellera II rodzaju: układ zdegenerowany, a kwadrat cyklobutadienu jest zdegenerowanym biradykiem, pamiętajmy o kole Frosta - jest zniekształcony i zmniejsza symetrię, aby usunąć degenerację). Ale w kompleksach cyklobutadien i podstawione cyklobutadieny są doskonałymi ligandami tetrahapto, a geometria takich ligandów jest dokładnie kwadratowa, z identycznymi długościami wiązań. Jak i dlaczego tak się dzieje, to osobna historia i nie tak oczywista, jak się często przedstawia. Trzeba zrozumieć, że pomiędzy obszarami ligandów labilnych i stabilnych nie ma żelbetowego ogrodzenia z drutem kolczastym i wieżami bezpieczeństwa. Po pierwsze, zależy to od metalu, a LMKO sprawdza się w tym kontekście. Na przykład metale późne przejściowe preferują miękkie ligandy, podczas gdy wczesne metale przejściowe preferują twarde. Powiedzmy, że jodek bardzo ściśle przylega do atomów d 8 palladu lub platyny, ale rzadko w ogóle wchodzi do sfery koordynacyjnej tytanu lub cyrkonu w konfiguracji d 0. Jednak w wielu kompleksach metali o mniej wyraźnych cechach jodek objawia się jako całkowicie labilny ligand, łatwo ustępując miejsca innym. Inne rzeczy są równe: Powtórzmy to wszystko jeszcze raz, tylko z drugiej strony W sferze koordynacyjnej metali ogólnie zachowane są (stabilne koordynacyjnie): Ostatni warunek wygląda dziwnie, ale wyobraźmy sobie kompleks, który ma wiele różnych ligandów, wśród których nie ma absolutnie stabilnych (żadnych chelatorów ani polihapto-ligandów). Następnie w reakcjach ligandy ulegną zmianie, mówiąc względnie, w kolejności względnej labilności. Najmniej labilny i ostatni, który pozostanie. Ten trik ma miejsce na przykład wtedy, gdy stosujemy kompleksy palladu i fosfiny. Fosfiny są stosunkowo stabilnymi ligandami, jednak gdy jest ich dużo, a metal jest bogaty w elektrony (d 8, d 10), to jeden po drugim ustępują ligandom aktorów. Natomiast ostatni ligand fosfinowy zwykle pozostaje w sferze koordynacyjnej, co jest bardzo dobre z punktu widzenia reakcji, w których biorą udział te kompleksy. Do tej ważnej kwestii powrócimy później. Oto dość typowy przykład, gdy z początkowej sfery koordynacyjnej kompleksu palladowo-fosfinowego w reakcji Hecka pozostaje tylko jedna, „ostatnia” fosfina. Przykład ten bardzo przybliża nas do najważniejszej koncepcji w reakcjach kompleksów metali przejściowych – koncepcji kontroli ligandów. Omówimy to później. Zastępując niektóre ligandy innymi, ważne jest, aby nie przesadzić z reaktywnością przychodzącego liganda. Gdy mamy do czynienia z reakcjami cząsteczek organicznych ważne jest dla nas dostarczenie do sfery koordynacyjnej dokładnie jednej cząsteczki każdego reagenta. Jeśli zamiast jednej dostaną się dwie cząsteczki, istnieje duże prawdopodobieństwo wystąpienia reakcji ubocznych z udziałem dwóch identycznych ligandów. Utrata reaktywności możliwa jest także na skutek nasycenia sfery koordynacyjnej i braku możliwości wprowadzenia do niej innych ligandów niezbędnych dla oczekiwanego procesu. Problem ten szczególnie często pojawia się, gdy do sfery koordynacyjnej wprowadza się silne anionowe nukleofile, na przykład karboaniony. Aby tego uniknąć stosuje się mniej reaktywne pochodne, w których zamiast kationu metalu alkalicznego, który decyduje o dużej jonowości wiązania, stosuje się metale i metaloidy mniej elektrododatnie (cynk, cyna, bor, krzem itp.), tworząc wiązania kowalencyjne z częścią nukleofilową. W reakcjach takich pochodnych z pochodnymi metali przejściowych powstają produkty podstawienia ligandu, w zasadzie tak, jakby nukleofil był w postaci anionowej, ale ze względu na zmniejszoną nukleofilowość przy mniejszych komplikacjach i braku reakcji ubocznych. Takie reakcje podstawienia ligandu są zwykle nazywane transmetalacją, aby podkreślić oczywisty fakt, że nukleofil wydaje się zmieniać metale - bardziej elektrododatnie na mniej elektrododatnie. Nazwa ta zawiera zatem element nieprzyjemnej schizofrenii – wydawało się, że już ustaliliśmy, że na wszystkie reakcje będziemy patrzeć z punktu widzenia metalu przejściowego, ale nagle znowu to straciliśmy i patrzymy na tę reakcję i tylko na tę reakcję z punktu widzenia nukleofila. Będziesz musiał uzbroić się w cierpliwość, tak rozwinęła się i jest akceptowana terminologia. Tak naprawdę słowo to wywodzi się z wczesnej chemii związków metaloorganicznych i faktu, że działanie związków litu lub magnezoorganicznych na halogenki różnych metali i metaloidów jest jedną z głównych metod syntezy wszystkich związków metaloorganicznych, przede wszystkim przejściowych , a reakcja, którą obecnie rozważamy w chemii związków koordynacyjnych metali przejściowych, jest po prostu uogólnieniem starożytnej metody chemii metaloorganicznej, z której to wszystko wyrosło. Remetalacja jest podobna do konwencjonalnej substytucji i nie podobna. Wygląda na to, że jeśli uznamy nieprzejściowy odczynnik metaloorganiczny za po prostu karboanion z przeciwjonem, wówczas wiązanie węgiel-metal nieprzejściowy jest jonowe. Ale pomysł ten wydaje się być prawdziwy tylko w przypadku metali najbardziej elektrododatnich - magnezu. Ale już w przypadku cynku i cyny pomysł ten jest bardzo daleki od prawdy. Dlatego w reakcji biorą udział dwa wiązania σ i cztery atomy na ich końcach. W rezultacie powstają dwa nowe wiązania σ i cztery atomy łączą się ze sobą w innej kolejności. Najprawdopodobniej wszystko to zachodzi jednocześnie w czteroczłonowym stanie przejściowym, a sama reakcja ma charakter uzgodniony, podobnie jak wiele innych reakcji metali przejściowych. Obfitość elektronów i orbitali dla dosłownie wszystkich gustów i wszystkich rodzajów symetrii sprawia, że metale przejściowe są w stanie jednocześnie utrzymywać wiązania w stanach przejściowych z kilkoma atomami. W przypadku remetalacji otrzymujemy szczególny przypadek bardzo ogólnego procesu, który nazywa się po prostu metatezą wiązania σ. Nie mylić ich tylko z prawdziwą metatezą olefin i acetylenów, które są pełnoprawnymi reakcjami katalitycznymi z własnymi mechanizmami. W tym przypadku mówimy o mechanizmie transmetalacji lub innym procesie, w którym zachodzi coś podobnego.

Reakcje skoordynowanych ligandów










Reakcje związków metaloorganicznych



Ligandy dowolnego typu można podstawić w dowolnej kombinacji
Substytucja z udziałem ligandów hapto

Podstawianie, dodawanie i dysocjacja ligandów są ze sobą ściśle i nierozerwalnie powiązane



Stabilne i labilne ligandy
Cyklobutadien jako ligand
Koordynacyjne labilne ligandy
Koordynacyjnie stabilne ligandy

Remetalacja

Jak zachodzi transmetalacja?