Zmiany funkcji termodynamicznych podczas adsorpcji. Termodynamika adsorpcji
Oddziaływanie polimerów z cieczami i gazami
Procesy interakcji polimerów z cieczami drobnocząsteczkowymi odgrywają ważną rolę w procesach powstawania gotowych produktów (np. włókien z roztworu), modyfikacji właściwości (plastyfikacji) materiału, a także w procesie eksploatacji warunków tych produktów w różnych środowiskach płynnych. Oddziaływanie wyraża się w absorpcji cieczy przez polimer i nazywa się sorpcja. Jeżeli sorpcja zachodzi w objętości materiału polimerowego, nazywa się to wchłanianie. Jeżeli absorpcja zachodzi w warstwach powierzchniowych, wówczas proces ten nazywa się adsorpcja.
Sorpcja
Mechanizm adsorpcji wynika z obecności sił napięcia powierzchniowego na granicy ośrodków (ryc. 5.1) w wyniku różnicy sił oddziaływania międzycząsteczkowego między nimi. Prowadzi to do akumulacji nadmiaru energii na powierzchni substancji, która ma tendencję do przyciągania cząsteczek powierzchniowych (cząsteczek adsorbent) i słabiej oddziałujące cząsteczki (molecules adsorpcyjny) wewnątrz wolumenu. Ilość adsorpcji w dużej mierze zależy od powierzchni właściwej adsorbentu. Numerycznie adsorpcja wyrażana jest liczbą moli zaadsorbowanej substancji na jednostkę masy adsorbentu - x/m.
Badanie sorpcji pozwala uzyskać cenne informacje o strukturze polimeru i stopniu upakowania jego cząsteczek.
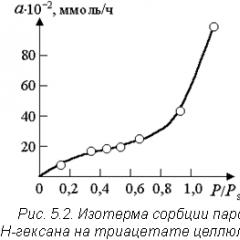
Zazwyczaj procesy sorpcji opisuje się za pomocą krzywych zależności ilości zaadsorbowanej substancji od jej stężenia (lub ciśnienia) w fazie gazowej w stałej temperaturze (izotermy sorpcji, rys. 5.2.). Tutaj wartość R/R s jest stosunkiem prężności pary adsorbentu do ciśnienia jego pary nasyconej w danej temperaturze.

W obszarze niskich prężności pary liniowe prawo Henry'ego jest spełnione:
Gdzie A- ilość zaadsorbowanej substancji; jestem- ograniczenie adsorpcji, proporcjonalnie do powierzchni czynnej adsorbentu; P- ciśnienie sorbatu; k- stała adsorpcji. Na ryc. 5.2 o zakończeniu adsorpcji jednocząsteczkowej decyduje wyjście izotermy sorpcji na półkę w zakresie ciśnień względnych 0,4 ÷ 0,5.
W obecności wielocząsteczkowej adsorpcji i kondensacji na powierzchni porowatego adsorbentu ( R/R s > 0,6 na ryc. 5.2) użyj równania uniwersalnego
 | (5.3) |
Termodynamika procesu adsorpcji
Ponieważ z reguły interakcja międzycząsteczkowa cząsteczek adsorbentu jest mniej intensywna niż adsorbentu, adsorpcja zachodzi wraz ze spadkiem swobodnej energii powierzchniowej (Δ F < 0) и выделением тепла (уменьшением энтальпии ΔN < 0). При равновесии процессов адсорбции и десорбции ΔF= 0. Wartość obliczona w procesie adsorpcji charakteryzuje liczbę i aktywność grup na powierzchni adsorbentu, które są zdolne do reakcji z absorbentem. Podczas adsorpcji entropia układu również maleje (Δ S < 0), поскольку молекулы абсорбтива ограничивают подвижность молекул полимера, уменьшая возможное число конформаций: ΔS = k ln( W 2 / W 1), gdzie jest stałą Boltzmanna, W 2 i W 1 - prawdopodobieństwo termodynamiczne stanu końcowego i początkowego układu.
Bieżąca strona: 6 (książka ma łącznie 19 stron) [dostępny fragment do czytania: 13 stron]
Czcionka:
100% +
34. Charakter sił adsorpcji
Oddziaływanie cząsteczek adsorbentu z powierzchnią adsorbentu podczas tzw. Adsorpcja fizyczna może mieć różne przyczyny. Wówczas potencjał decydujący o oddziaływaniu jednej cząsteczki adsorbentu z jednym atomem adsorbentu niepolarnego można wyrazić następująco:
θ = −Kr 6 +br 12 ,
gdzie r jest odległością między środkami cząstek; C – stała przyciągania dyspersji; B jest stałą charakteryzującą energię sił odpychających.
Jest całkiem oczywiste, że na stosunkowo dużych odległościach powinny przeważać siły przyciągania, a na małych odległościach powinny przeważać siły odpychania. Ponadto w pewnych odległościach siły te muszą być równe, co będzie odpowiadać minimum energii swobodnej. Należy jednak zauważyć, że podczas adsorpcji siły dyspersji działają jednocześnie pomiędzy każdą cząstką niepolarną.
Ponieważ energia oddziaływania cząstek może szybko maleć wraz z odległością, do określenia potencjału sił adsorpcji wystarczy wykonanie sumowania na najbliższych atomach adsorbentu. Ważne jest, aby podczas adsorpcji złożonych cząsteczek niepolarnych energię potencjalną można było w przybliżeniu obliczyć jako sumę wszystkich potencjalnych energii adsorpcji jednostek molekularnych.
Jeżeli adsorbent składa się z jonów, wówczas działanie znanych już sił dyspersyjnych można uzupełnić działaniem indukcyjnych sił przyciągania dipoli, które indukowane są w cząsteczkach adsorbentu przez pole elektryczne, co z kolei utworzone przez jony sieci adsorbentu.
Przy takim oddziaływaniu udział sił indukcyjnych w oddziaływaniu adsorpcyjnym może być proporcjonalny do polaryzowalności cząsteczki adsorbentu i kwadratu natężenia pola na tej powierzchni adsorbentu.
Jeżeli adsorpcja polarnych cząsteczek adsorbentu zachodzi na polarnym adsorbencie, to dipole w tym przypadku polaryzują atomy adsorbentu, tj. Wydaje się, że indukują w nich momenty elektryczne. Z powodu tego wpływu oddziaływanie indukcyjne jest dodawane do oddziaływania dyspersyjnego.
Samo oddziaływanie indukcyjne jest zwykle małe i w zależności od dipola cząsteczki adsorbentu i polaryzowalności adsorbentu może osiągać duże wartości. Jeżeli cząsteczki są adsorbowane na adsorbencie, który ma na powierzchni jony lub dipole, powstaje tzw. oddziaływanie jonów lub dipoli adsorbentu z polem elektrostatycznym samego adsorbentu.
W tym przypadku cząsteczki adsorbentu mogą być nawet zorientowane w polu adsorbentu i zachodzi orientacyjne oddziaływanie kulombowskie. Zwykle zdarza się, że energie oddziaływań indukcyjnych i orientacyjnych są mniejsze od energii oddziaływań dyspersyjnych, dlatego przyjmuje się, że o energii przyciągania międzycząsteczkowego decyduje energia przyciągania dyspersyjnego.
Adsorpcja może być również spowodowana utworzeniem wiązania wodorowego. Wiązanie tego typu może powstać podczas adsorpcji na adsorbentach zawierających na powierzchni grupy hydroksylowe cząsteczek, takich jak woda, alkohole, amoniak i aminy. Kiedy tworzy się wiązanie wodorowe, energia oddziaływania adsorbentu z adsorbentem może być dość duża, a ciepło wydzielające się podczas takiej adsorpcji jest znacznie większe niż ciepło adsorpcji substancji o podobnym kształcie i wielkości cząsteczek , ale nie tworzą wiązania wodorowego.
Należy zauważyć, że znając opis termodynamiczny warstwy powierzchniowej na granicy adsorbent-adsorbent, jej strukturę, charakter różnego rodzaju sił i dynamikę procesu, można przystąpić do badań bardziej złożonej adsorpcji procesy.
35. Adsorpcja jako samoistne stężenie na granicy faz substancji zmniejszające napięcie międzyfazowe
Surfaktanty dzielą się na dwie duże grupy: aktywne i nieaktywne Substancje.
W warstwie powierzchniowej mogą gromadzić się środki powierzchniowo czynne i następuje dodatnia adsorpcja G > 0.
Substancje tego typu muszą posiadać napięcie powierzchniowe, które z kolei musi być mniejsze od napięcia powierzchniowego rozpuszczalnika, w przeciwnym razie akumulacja substancji w warstwie powierzchniowej będzie niekorzystna i musi charakteryzować się stosunkowo słabą rozpuszczalnością. Przy dostatecznie dobrej rozpuszczalności cząsteczki środka powierzchniowo czynnego mają tendencję do przemieszczania się z powierzchni w głąb roztworu. W rezultacie środki powierzchniowo czynne będą preferencyjnie wypychane z większości cieczy na powierzchnię.
Ale wraz z gromadzeniem się substancji na granicy roztworu w cząsteczkach tych substancji, które słabo ze sobą oddziałują, oddziaływanie międzycząsteczkowe w warstwie powierzchniowej zmniejszy się, a napięcie powierzchniowe spadnie.
Środki powierzchniowo czynne w stosunku do warstwy wodnej występuje wiele rodzajów związków organicznych, kwasy tłuszczowe z dość dużą grupą węglowodorową, sole tych kwasów (mydła), kwasy sulfonowe i ich sole, a także różnego rodzaju alkohole i aminy. Charakterystyczną cechą większości cząsteczek jest ich difilowość: cząsteczka składa się z dwóch części grupy polarnej i niepolarnego rodnika węglowodorowego. Grupa polarna, która ma znaczny moment dipolowy i silnie nawilża, może określić powinowactwo środka powierzchniowo czynnego do środowiska wodnego. Ale rodnik węglowodorowy jest przyczyną zmniejszającą rozpuszczalność tych związków.
Powierzchniowo nieaktywne środki powierzchniowo czynne- tego typu substancje mają tendencję do opuszczania powierzchni cieczy do jej objętości, co powoduje tzw. ujemna adsorpcja G < 0. Поверностно-инактивные вещества также обладают значительным поверхностным натяжением, значительно большим, чем натяжение у растворителя (иначе эти вещества способны самопроизвольно накапливаться в поверхностном слое), также обладают высокой растворимостью, что способствует их стремлению уйти с поверхности жидкости в объем. Взаимодействие между молекулами поверхностно-инактивного вещества и растворителя всегда больше, чем взаимодействие между самими молекулами растворителя, поэтому они и стремятся перейти в объем раствора. Substancje nieaktywne powierzchniowo W odniesieniu do wody występuje wiele elektrolitów nieorganicznych: kwasy, zasady, sole. Cząsteczki surfaktantów nie mają części hydrofobowej i mogą rozpaść się w wodzie na silnie nawilżające jony.
Przykłady Surfaktanty to także niektóre związki organiczne, w których niepolarna część cząsteczki jest nieobecna lub jest bardzo mała. Substancje te obejmują kwas mrówkowy i aminooctowy.
W rozpuszczalnikach niewodnych elektrolity nieorganiczne mogą również zwiększać napięcie powierzchniowe, w zależności od rozpuszczalnika.
Na przykład po wprowadzeniu jodku sodu do metanolu napięcie powierzchniowe znacznie wzrasta, w przypadku etanolu napięcie powierzchniowe jest około 2 razy większe. Aktywność powierzchniowa substancji może zależeć nie tylko od charakteru substancji, ale także od właściwości rozpuszczalnika. Jeśli jakikolwiek rozpuszczalnik ma wysokie napięcie powierzchniowe, wówczas ta substancja rozpuszczona może wykazywać znaczną aktywność powierzchniową.
36. Teorie adsorpcji
Rozważmy najpopularniejsze teorie adsorpcji, które opisują określone typy adsorpcji na granicy faz ciało stałe-gaz lub ciało stałe-roztwór.
Teoria adsorpcji jednocząsteczkowej I. Langmuira.
1. Adsorpcja ma charakter lokalny i jest spowodowana siłami zbliżonymi do chemicznych.
2. Adsorpcja zachodzi tylko na centrach aktywnych - występach lub zagłębieniach na powierzchni adsorbentu, charakteryzujących się obecnością wolnych wartościowości. Aktywne centra uważa się za niezależne i identyczne.
3. Każde centrum aktywne może oddziaływać tylko z jedną cząsteczką adsorbatu; Na powierzchni może utworzyć się tylko jedna warstwa zaadsorbowanych cząsteczek.
4. Proces adsorpcji jest odwracalny i zrównoważony; zaadsorbowana cząsteczka jest zatrzymywana przez miejsce aktywne przez pewien czas, po czym ulega desorbcji; Po pewnym czasie ustala się równowaga dynamiczna.
Maksymalna możliwa wartość adsorpcji G o osiąga się pod warunkiem, że wszystkie centra aktywne zostaną zajęte przez cząsteczki adsorbatu. Równanie izotermy adsorpcji monocząsteczkowej odnoszące się do wielkości adsorpcji G ze stężeniem adsorbatu Z, ma postać:
Gdzie B– stała wartość dla danej pary „adsorbent – adsorbat” (stosunek stałych szybkości desorpcji i adsorpcji), liczbowo równa stężeniu adsorbatu, przy którym zajęta jest połowa centrów aktywnych.

Wykres izotermy adsorpcji Langmuira pokazano na rysunku 2. Stała B określić graficznie, rysując styczną do izotermy adsorpcji w tym punkcie Z= 0. Opisując w równaniu proces adsorpcji gazu, stężenie można zastąpić proporcjonalną wartością ciśnienia cząstkowego. Teoria adsorpcji monocząsteczkowej I. Langmuira ma zastosowanie do opisu procesów adsorpcji gazów i substancji rozpuszczonych przy niskich ciśnieniach (stężeniach) adsorbatu.
Teoria adsorpcji wielocząsteczkowej Polyaniego opisuje izotermy adsorpcji w kształcie litery S, których kształt wskazuje na możliwe oddziaływanie zaadsorbowanych cząsteczek z adsorbatem.
1. Adsorpcja jest spowodowana siłami fizycznymi.
2. Powierzchnia adsorbentu jest jednorodna, nie ma tam centrów aktywnych; siły adsorpcji tworzą ciągłe pole siłowe w pobliżu powierzchni adsorbentu.
3. Siły adsorpcji działają w odległości większej niż wielkość cząsteczki adsorbatu, tzn. na powierzchni adsorbentu, która podczas adsorpcji jest wypełniona cząsteczkami adsorbatu, występuje pewna objętość adsorpcji.
4. Przyciąganie cząsteczki adsorbatu przez powierzchnię adsorbentu nie zależy od obecności innych cząsteczek w objętości adsorpcyjnej, dzięki czemu możliwa jest adsorpcja wielocząsteczkowa.
5. Siły adsorpcji nie zależą od temperatury, dlatego objętość adsorpcji nie zmienia się wraz ze zmianą temperatury.
Równanie Freundlicha. Powierzchnia adsorbentu jest niejednorodna, pomiędzy zaadsorbowanymi cząsteczkami zachodzi interakcja, a centra aktywne nie są od siebie całkowicie niezależne. G.Freundlicha zasugerowali, że liczba moli zaadsorbowanego gazu lub rozpuszczonej substancji na jednostkę masy adsorbentu (tzw. adsorpcja właściwa X/M), musi być proporcjonalna do ciśnienia równowagowego (dla gazu) lub stężenia równowagowego (dla substancji zaadsorbowanych z roztworu) adsorbentu, podniesionego do pewnej potęgi, która jest zawsze mniejsza od jedności:
X / M = AP N; X / M = AC N.
Wykładniki N i współczynnik proporcjonalności A ustalone eksperymentalnie.
37. Termodynamika procesu adsorpcji. Równanie adsorpcji Gibbsa
Aby zbadać zjawisko adsorpcji na granicy faz „roztwór-gaz”, konieczne jest ustalenie związku pomiędzy nadmiarem zaadsorbowanej substancji w warstwie na powierzchni ( G), stężenie środka powierzchniowo czynnego w roztworze ( Z) i napięcie powierzchniowe ( σ ) na granicy faz „roztwór – gaz”. Bardziej celowe jest rozważenie zjawiska z termodynamicznego punktu widzenia i powiązanie adsorpcji rozpuszczonej substancji ze zmianą energii swobodnej powierzchni lub jej napięcia powierzchniowego. To połączenie zostało nawiązane W. Gibbsa V 1876, któremu nadano nazwę „Równanie adsorpcji Gibbsa”:
G = – Z / CZ X dσ/DC.
Nadal możesz to sobie wyobrazić równanie Gibbsa, w oparciu o termodynamikę, wykorzystując potencjał izobaryczno-izotermiczny G, potencjały chemiczne µ 1 I μ2, a także używać N 1 I N 2 liczba moli składników. Po przeanalizowaniu tego pod kątem entropii S, tom V i ciśnienie P, możemy napisać następujące równanie:
dG=– SDT+VdP+σds+ μ 1 dzień 1 + μ 2 dzień 2.
Przyrównajmy to do zera, a biorąc pod uwagę stałą temperaturę i ciśnienie, upraszczamy to do równania postaci:
SD σ + n 1 d μ 1 + n 2 re μ 1 = 0.
Biorąc pod uwagę fakt, że dla roztworów rozcieńczonych potencjał chemiczny drugiego składnika wyraża się w następujący sposób:
μ 2 = μ 2 0 +CZ ln C,
i przy założeniu, że temperatura jest stała
dμ 2 =RTdnc,
podstawiając to równanie do
![]()
otrzymujemy pożądane równanie adsorpcji Gibbsa. Na podstawie równania widać, że jeśli napięcie powierzchniowe σ wzrasta wraz z koncentracją Z, wówczas stężenie substancji rozpuszczonej na warstwie powierzchniowej jest mniejsze niż w większości roztworu (tzw. adsorpcja ujemna), a jeżeli napięcie powierzchniowe σ maleje wraz ze wzrostem stężenia Z, wówczas stężenie w warstwie jest większe niż w objętości (adsorpcja dodatnia) i wreszcie jeśli σ nie zależy od Z, to stężenie substancji w warstwie na powierzchni i w objętości jest takie samo. Równanie Gibbsa wyprowadzono wykorzystując termodynamikę. W praktyce równanie to jest trudne do zweryfikowania, co wynika z trudności określenia stężenia substancji rozpuszczonej na powierzchni warstwy. Doświadczony sposób B. McBena stwierdzili, że za pomocą urządzenia odcięto z powierzchni roztworu bardzo cienką warstwę cieczy. Dalsze wyznaczenie wszystkich parametrów równania Gibbsa wykazało, że ustalone eksperymentalnie wartości adsorpcji, w granicach błędu eksperymentalnego, pokrywały się z wartościami obliczonymi za pomocą równania Gibbsa. Ze względu na jednorodność i gładkość powierzchni dowolnej cieczy, zwykłe koncepcje centrów aktywnych są całkowicie nieodpowiednie do badania adsorpcji na jej powierzchni. W temperaturze krytycznej różnica między sąsiednimi fazami zanika, a napięcie powierzchniowe z reguły staje się równe zeru. Adsorpcja gazów i par ma tak szerokie zastosowanie praktyczne, że w literaturze, zwłaszcza technicznej, można spotkać się z tą koncepcją, która ma zastosowanie jedynie w odniesieniu do procesów zachodzących na powierzchni ciał stałych.
Koncepcja ta, podobnie jak najbardziej ogólne prawa adsorpcji, jak rozważane równanie Gibbsa, ma zastosowanie do wszystkich granic faz. Korzystając z równania Gibbsa i wszystkich wynikających z niego zapisów, po wyznaczeniu wartości Γ, można skonstruować izotermę adsorpcji.
38. Cechy adsorpcji na materiałach mikroporowatych. Teoria potencjału Polyany’ego. Potencjał adsorpcji
Teoria Polyaniego uwzględnia niezlokalizowaną adsorpcję fizyczną, która jest bezpośrednio spowodowana siłami van der Waalsa pomiędzy adsorbentem a adsorbatem (można to uznać za pierwszą pozycję). Drugim stanowiskiem tej teorii jest koncepcja pola siłowego (potencjalnego) adsorbentu, które rozciąga się na znaczną odległość od powierzchni; warstwa adsorpcyjna pojawiająca się w tym polu jest wielocząsteczkowa. Jeśli weźmiemy pod uwagę adsorpcję gazów, to gęstość tej warstwy maleje wzdłuż pewnej normalnej od powierzchni. Jeśli weźmiemy pod uwagę adsorpcję pary, wówczas na powierzchni tworzy się warstwa cieczy o określonej grubości. Pole w teorii Polyaniego rozpatrywane jest jako szereg powierzchni ekwipotencjalnych, każda powierzchnia odpowiada pewnej wartości potencjalnej ε , a każda kolejna powierzchnia będzie mniejsza od poprzedniej. Każda taka powierzchnia w przestrzeni wycina warstwy o określonej objętości, oznaczone jako v ja. Zadaniem teorii Polyanyiego jest znalezienie przejścia od zwykłych współrzędnych izotermy ( x, s) do parametrów pola ε ja I v ja, z dalszym ustaleniem powiązania pomiędzy tymi podstawowymi parametrami. Pierwsza część problemu, którą postawił Polyany, jest dość złożona i w wielu przypadkach nie może mieć określonych rozwiązań, ale w przypadku adsorpcji pary ta część problemu jest rozwiązywana w pierwszym przybliżeniu w bardzo prosty sposób. W przypadku warstwy adsorpcyjnej cieczy wypełniona część objętości będzie równa:
v ja = x(M/d),
Gdzie D– gęstość substancji w stanie ciekłym.
W swojej teorii M. Polyany wprowadza kolejny zapis dotyczący braku tzw. przesiewanie pola podczas adsorpcji, wartość ε w tej teorii przestrzeń jest wartością stałą (coś w rodzaju potencjału grawitacyjnego) niezależnie od tego, czy pomiędzy danym punktem a powierzchnią stałą istnieją określone cząsteczki adsorbatu, czy też cała przestrzeń jest wolna. Polyani wprowadza tę koncepcję potencjał adsorpcji ε , który reprezentuje izotermiczną pracę sprężania pary podczas przenoszenia jej spod ciśnienia równowagowego R w fazie objętościowej od powierzchni do obszaru warstwy powierzchniowej o ciśnieniu pary nasyconej p 0 wówczas wyrażenie określające potencjał będzie wyglądać następująco:
ε = CZ ln R 0 / R.
Korzystając z tego równania, możesz przejść od współrzędnych x, p do współrzędnych ε I w i uzyskać krzywą, którą nazywa się „charakterystyczną”. Polyani odkrył w swoich eksperymentach, że takie krzywe, zbudowane z danych eksperymentalnych otrzymanych izoterm, mają następującą właściwość: są niezmienne względem T, czyli innymi słowy, wszystkie krzywe tego typu mieszczą się na jednej krzywej ε −ε .
M. Polyany przyjął to stanowisko jako postulat, tj.:
Ta właściwość Polyaniego ma ogromne znaczenie praktyczne; może skonstruować rodzinę izoterm z jednej eksperymentalnej izotermy adsorpcji.
Teoria Polanyi'ego nie dostarcza analitycznego wyrażenia izotermy ani funkcji potencjalnej objętości, ale pozwala obliczyć współrzędne dla dowolnej temperatury, jeśli znana jest co najmniej jedna izoterma. Wynik ten jest bardzo ważny dla obliczeń technologicznych, ponieważ dla podobnych gazów na tym samym adsorbencie krzywe adsorpcji mogą być do siebie zbliżone i w wielu przypadkach można je łączyć.
39. Charakterystyczna krzywa adsorpcji. Niezmienniczość temperaturowa i powinowactwo krzywych charakterystycznych
Pole sił powstające na powierzchni adsorbentu może być pod wieloma względami podobne do pola grawitacyjnego. W polu adsorpcji można sobie wyobrazić powierzchnie potencjalne, czyli takie, które charakteryzują się tym samym potencjałem adsorpcyjnym. Zgodnie z koncepcją potencjału adsorpcyjnego θ należy rozumieć jako nic innego jak pracę wykonaną przeciwko siłom adsorpcji podczas przemieszczania 1 mola adsorbentu z określonego punktu pola do określonej fazy gazowej. Maksymalny potencjał adsorpcji będzie występował na granicy „adsorbent – objętość adsorpcji”. Jednak na granicy „objętość – faza gazowa” (w tym miejscu kończy się działanie sił adsorpcji) potencjał adsorpcji powinien być równy zeru. Zmianę potencjału adsorpcji wraz ze zmianą objętości adsorpcji można przedstawić w postaci krzywych. Po raz pierwszy dokonał tego M. Polyani. Tego typu krzywe nie zależą od temperatury i mogą być charakterystyczne dla każdego konkretnego adsorbentu. Tego typu krzywe są zwykle nazywane charakterystycznymi krzywymi adsorpcji. Teoria adsorpcji wielocząsteczkowej zakłada, że równanie stanu gazu ma zastosowanie do objętości adsorpcji. W konsekwencji izotermy charakteryzujące zależność gęstości adsorbentu od objętości dla różnych temperatur przypominają izotermy zależności ciśnienia od objętości. W niskich temperaturach siły adsorpcji powierzchniowej mogą powodować kondensację pary w ciecz o określonej gęstości. W temperaturach niższych od krytycznych podczas kondensacji cała objętość adsorpcji zostanie wypełniona cieczą. W tym przypadku krzywa adsorpcji będzie przebiegać niemal równolegle do osi odciętych, co jest związane z małą ściśliwością cieczy. Następnie krzywa adsorpcji na granicy „objętość – faza gazowa” gwałtownie spada i odpowiednio gęstość adsorbentu osiąga pewną gęstość fazy gazowej. W temperaturach wyższych od temperatury krytycznej adsorbent może zachowywać się jak gaz doskonały, a wykres będzie wyrażony jako izoterma gazu doskonałego, pod warunkiem, że pV = CZ. W takich warunkach zaadsorbowany gaz będzie miał maksymalną gęstość na samej powierzchni adsorbentu i minimalną w bezpośrednim sąsiedztwie fazy gazowej. Ponadto w tym przypadku należy zauważyć, że gęstość adsorbentu w warstwie adsorpcyjnej nigdzie nie osiąga gęstości samej cieczy. A jeśli temperatura jest bardzo bliska krytyczna, zależność gęstości od objętości zostanie wyrażona krzywą zbliżoną wyglądem do izotermy opisanej Równanie van der Waalsa. W tej sytuacji część zaadsorbowanej substancji będzie w zaadsorbowanej objętości znajdować się w stanie ciekłym, a część zaadsorbowanej substancji będzie w stanie gazowym. Wtedy krzywa obniży się najostrzej w odcinku odpowiadającym przejściu ze stanu ciekłego do gazowego. Jeśli z eksperymentalnej izotermy adsorpcji jednego z adsorpcji zbudujesz krzywą charakterystyczną i znając odpowiednie współczynniki powinowactwa dla innego adsorbentu, możesz znaleźć izotermę adsorpcji i skonstruować ją dla innego adsorbentu. Potencjalna teoria adsorpcji umożliwia obliczenie różnych izoterm adsorpcji różnych par na tym samym adsorbencie, wykorzystując krzywą charakterystyczną otrzymaną z izotermy adsorpcji jednej pary, ponieważ stosunek potencjału adsorpcji nie zależy od objętości adsorpcji .
Podobieństwo(z łac. affinis - „pokrewny”) - chromatografia powinowactwa. Metoda oczyszczania i rozdziału białek opiera się na ich selektywnym oddziaływaniu z ligandem kowalencyjnie związanym z obojętnym nośnikiem (chromatografia powinowactwa). Pomiar powinowactwa substancji toksycznej do receptora jest zasadniczo badaniem eksperymentalnym zależności pomiędzy ilością substancji dodanej do podłoża inkubacyjnego a ilością kompleksu substancja toksyczna-receptor utworzonego w wyniku interakcji.
Termodynamika procesów adsorpcji.
| Nazwa parametru | Oznaczający |
| Temat artykułu: | Termodynamika procesów adsorpcji. |
| Rubryka (kategoria tematyczna) | Edukacja |
Podstawowe definicje i metody klasyfikacji procesów adsorpcji.
Adsorpcja odnosi się do zjawisk zachodzących w wyniku spontanicznego spadku energii powierzchniowej.
Adsorpcja– proces samoistnej odwracalnej lub nieodwracalnej redystrybucji składników układu heterogenicznego pomiędzy warstwą powierzchniową a objętością fazy jednorodnej.
W układach wieloskładnikowych korzystnie jest przenieść na warstwę wierzchnią składnik, który silniej zmniejsza napięcie międzyfazowe. W układach jednoskładnikowych podczas tworzenia warstwy powierzchniowej następuje zmiana jej struktury (pewna orientacja atomów i cząsteczek, polaryzacja), zwana autoadsorpcja.
Faza gęstsza, na której zlokalizowane są oddziaływania adsorpcyjne, nazywana jest fazą gęstszą adsorbent. Substancję rozdzieloną pomiędzy objętość fazy jednorodnej a warstwę powierzchniową oznaczono terminem „” adsorbatʼʼ.
W niektórych przypadkach proces adsorpcji jest odwracalny. W takim przypadku pod pewnymi warunkami część zaadsorbowanych cząsteczek w wyniku molekularnych zjawisk kinetycznych może przejść z warstwy powierzchniowej do fazy objętościowej. Odwrotny proces adsorpcji nazywa się desorpcja.
Metody klasyfikacji procesów adsorpcji.
Klasyfikacja procesów adsorpcji ze względu na stan skupienia oddziałujących faz. Biorąc pod uwagę zależność od stanu skupienia faz sąsiednich, wyróżnia się następujące typy procesów adsorpcji:
Adsorpcja gazów na stałych adsorbentach;
Adsorpcja substancji rozpuszczonych na granicy faz „ciało stałe-ciecz” i „ciecz-ciecz”;
Adsorpcja środków powierzchniowo czynnych na granicy faz ciecz-gaz.
Klasyfikacja procesów adsorpcji ze względu na mechanizm oddziaływania adsorbentu i adsorbatu. Adsorpcję można rozpatrywać jako oddziaływanie cząsteczek adsorbatu z centrami aktywnymi adsorbentu. Zgodnie z mechanizmem ich interakcji dzieli się następujące rodzaje adsorpcji:
1) adsorpcja fizyczna (molekularna).– oddziaływanie cząsteczek adsorbatu z adsorbentem odbywa się pod wpływem sił van der Waalsa, wiązań wodorowych (bez reakcji chemicznych);
2) adsorpcja chemiczna (chemisorpcja)– przyłączenie cząsteczek adsorbatu do centrów aktywnych adsorbentu następuje w wyniku różnego rodzaju reakcji chemicznych (z wyjątkiem reakcji wymiany jonowej);
3) Adsorpcja jonowymienna (wymiana jonowa) – redystrybucja substancji adsorbowanej pomiędzy roztworem a fazą stałą (wymiennik jonowy) zgodnie z mechanizmem reakcji wymiany jonowej.
Aby ilościowo opisać procesy adsorpcji, stosuje się dwie wielkości.
1) Absolutna adsorpcja– ilość (mol) lub masa (kg) adsorbatu na jednostkę powierzchni lub masę adsorbentu. Oznaczenie – A; wymiar: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) Adsorpcja Gibbsa (nadmiarowa).– nadmiar substancji adsorbatu w warstwie powierzchniowej o określonej grubości w stosunku do jej ilości w objętości fazy jednorodnej, na jednostkę powierzchni lub masy adsorbentu. Oznaczenie – G; wymiar: mol/m 2, mol/kᴦ.
Zależność pomiędzy adsorpcją bezwzględną i nadmiarową można zilustrować za pomocą równania:
Г = А – с * h (3.1)
gdzie c jest równowagowym stężeniem substancji w objętości fazy, mol/m3;
h jest grubością warstwy wierzchniej, umownie przyjmowaną jako 10 -9 m.
W wieloskładnikowych układach heterogenicznych, gdy jeden lub drugi składnik jest redystrybuowany pomiędzy objętością fazy jednorodnej a warstwą powierzchniową, obowiązuje równanie na nadmiar energii wewnętrznej powierzchni:
U = T * S + s * s + Sm i * n ja (3.2)
Redukując wszystkie wyrazy równania do jednostkowego pola powierzchni międzyfazowej, otrzymujemy:
U s = T * S s + s + Sm i * Г ja (3.3)
gdzie Г i = n i / s jest nadmiarem i-tego składnika w warstwie powierzchniowej, czyli adsorpcją Gibbsa.
Dla układu jednoskładnikowego równanie (3.3) będzie miało postać:
G s = s + m * G (3.4)
gdzie G s = U s - T * S s – powierzchnia energii Gibbsa lub praca tworzenia na jednostkę powierzchni;
m * G – zagęszczenie substancji zaadsorbowanej w warstwie powierzchniowej.
Na podstawie równania (3.4) można stwierdzić, że podczas adsorpcji praca tworzenia powierzchni międzyfazowej polega na pracy tworzenia powierzchni (rozerwaniu wiązań kohezyjnych w objętości fazy adsorbatu) i zagęszczeniu substancji w warstwie powierzchniowej.
W stanie równowagi dynamicznej pomiędzy adsorbentem a adsorbatem, zmiana energii Gibbsa układu heterogenicznego ΔG = 0, termodynamikę procesu adsorpcji opisuje równanie zwane Podstawowe równanie adsorpcji Gibbsa:
Ds = S° i * dm i (3,5)
Równanie to jest uniwersalne, gdyż obowiązuje dla wszystkich typów procesów adsorpcji
Szczególne przypadki równania adsorpcji Gibbsa.
1) Adsorpcja z roztworów.
Dla potencjału chemicznego i-tego składnika układu podczas adsorpcji na granicy faz „ciecz – ciało stałe” i „ciecz – gaz” obowiązują następujące równania:
m ja = m ja 0 + R*T*ln a ja (3.6)
dm i = R*T* d ln a i (3.7)
gdzie m i 0 jest potencjałem chemicznym i-tego składnika układu w warunkach standardowych;
a i jest aktywnością i-tego składnika systemu w warunkach standardowych.
Na tej podstawie równanie adsorpcji Gibbsa przyjmuje postać:
Г i = - a i / R*T * (ds / da i) (3.8)
Dla roztworów nieelektrolitów bierzemy a i = c i, wówczas:
Г i = - с / R*T * (ds / dс) (3.9)
Dla roztworów elektrolitów:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
gdzie с ± jest średnim stężeniem jonowym roztworu;
n jest współczynnikiem stechiometrycznym.
2) Adsorpcja substancji z fazy gazowej.
Zgodnie z równaniem Mendelejewa-Clayperona:
Р = с * R*T (3.11)
W związku z tym równanie Gibbsa dotyczące adsorpcji gazów na stałych adsorbentach zapisuje się w następującej formie:
Г i = - Р / R*T * (ds / dР) (3.12)
W praktyce równanie adsorpcji Gibbsa pozwala na podstawie pomiarów napięcia powierzchniowego przy różnych wartościach stężenia cieczy lub równowagowego ciśnienia gazu obliczyć wielkość adsorpcji substancji w warstwie międzyfazowej, dla której wyznacza się napięcie powierzchniowe.
Termodynamika procesów adsorpcji. - koncepcja i rodzaje. Klasyfikacja i cechy kategorii „Termodynamika procesów adsorpcji”. 2017, 2018.