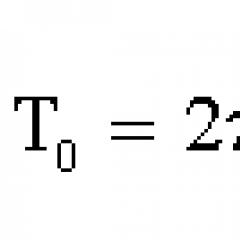Presentación sobre el tema: Disposiciones básicas de las TIC. Presentación sobre física sobre el tema "Los principios básicos de la teoría cinética molecular" Experimentos que prueban esta posición.
Tema: Disposiciones básicas de las TIC.
Preguntas de nuevo tema:
1. MKT
2. Átomo
3. Molécula
4. Disposiciones básicas de las TIC
5. Difusión
6. movimiento browniano
7. Peso molecular relativo
8. Cantidad de sustancia
9. 1 mol
10. El número de Avogadro
11. Masa molar
12. Concentración de moléculas

MKT
A) Teoría cinética molecular
B) Teoría de los procesos térmicos que explican las propiedades de los cuerpos macroscópicos.
(Lomonósov M.V.)

Átomo
A) La partícula indivisible más pequeña
B) Descubierto por Demócrito
B) Un átomo está formado por granos y la nube de electrones circundante.
D) El núcleo de un átomo está formado por protones y neutrones, y la nube que lo rodea está formada por electrones.

Molécula
A) Partícula eléctricamente neutra
B) Tiene las propiedades químicas básicas de una sustancia.
B) Está formado por átomos conectados entre sí mediante enlaces químicos.

Disposiciones básicas de las TIC.
1) Todas las sustancias están formadas por partículas (átomos y moléculas).
2) Las partículas están en movimiento continuo.
3) Las partículas interactúan entre sí, es decir. entre ellos hay fuerzas atractivas y repulsivas

I. Todas las sustancias están formadas por partículas.
Experimentos que prueban esta posición:
1. Trituración mecánica
2. Disolución de una sustancia
3. Compresión y estiramiento de cuerpos.
Partículas
moléculas
átomos
electrones
centro
protones
neutrones

LAS PARTÍCULAS SE MUEVEN CONTINUA Y CAÓTICAMENTE
EXPERIMENTOS QUE DEMUESTRAN ESTA POSICIÓN:
- A) DIFUSIÓN
- B) MOVIMIENTO BROWNIANO
- C) LA TENDENCIA DEL GAS A OCUPAR TODO EL VOLUMEN

Difusión
A) Penetración de moléculas de una sustancia en los espacios intermoleculares de otra sustancia.
B) La difusión depende de la temperatura.

MOVIMIENTO BROWNIANO
EL MOVIMIENTO TÉRMICO DE PARTÍCULAS SUSPENDIDAS EN UN LÍQUIDO O GAS OCURRE CAÓTICAMENTE Y POR TIEMPOS ILIMITADOS

LAS PARTÍCULAS QUE INTERACTUAN ENTRE SÍ SON ATRAÍDAS Y REPULSADAS
Experimentos que confirman esta posición:
- Pegado
- Mojada

Peso molecular relativo (RMM)
La relación entre la masa de una molécula y una doceava parte (1/12) de la masa de un átomo de carbono.
- METRO r – OMM
- metro 0 - masa de una molécula
- metro 0c – masa de un átomo de carbono

CANTIDAD DE SUSTANCIA
Valor que muestra cuántas veces el número de moléculas de una sustancia es mayor que el número de moléculas de 12 gramos de carbono.
ν – cantidad de sustancia (mol)
norte – número de moléculas en una sustancia
norte A - El número de Avogadro
METRO – masa molar (kg/mol)

1 mol
A) La cantidad de una sustancia que contiene la misma cantidad de moléculas que contienen 12 gramos de carbono.
B) Unidad de medida de la cantidad de sustancia

EL NÚMERO DE AVOGADRO
Un número que muestra cuántas moléculas hay en 1 mol de una sustancia.
norte A = 6,02 · 10 23 lunar -1

Masa molar
La masa de una sustancia tomada en la cantidad de un mol.
M – masa molar (kg/mol)
metro 0 – masa de una molécula

CONCENTRACIÓN
Un número que muestra cuántas partículas contiene una unidad de volumen de una sustancia.
norte – concentración (m -3 )
V – volumen (m 3 )
norte – número de moléculas

Control
1. ¿En qué fenómeno físico se basa? ¿Proceso de salazón de verduras, pescado, carne? ¿En qué caso el proceso es más rápido?
Si ¿La salmuera está fría o caliente?
- ¿Por qué el almíbar se vuelve más dulce con el tiempo? sabor a fruta?
- ¿Por qué el azúcar y otros productos porosos ¿No se puede almacenar cerca de sustancias olorosas?

- El olor a escoba de abedul se propaga más rápido en un baño caliente que en una habitación fresca. ¿Por qué?
- ¿Qué crees que podría pasar como resultado de una guerra nuclear?
- ¿Cómo se puede explicar la desaparición del humo en el aire?

1. OBJETIVOS
- 1. Encuentra la masa de una molécula de agua si su masa molecular es 18 g/mol.
( metro 0 =0,003*10 -23 kg)
- 2. ¿Cuántas moléculas hay en 10 gramos de aluminio? METRO ( Al) = 27 g/mol.
( norte =2,2* 10 23 )
2. Pruebas
sobre el tema “Disposiciones básicas de la CDI”

- § 4.1, 4.2, resumen
- Tarea:
- ¿Qué cantidad de sustancia contienen 15 gramos de cobre si su masa molar es 64 g/mol?

La masa molecular (o atómica) relativa de una sustancia M r es la relación entre la masa de una molécula (o átomo) m 0 de una sustancia dada y 1/12 de la masa de un átomo de carbono m 0C M r (H 2 O) = 2 1 + 16 = 18 (a.u. .m.) Calculemos M r de agua H 2 O (para esto usaremos la tabla periódica) Mendeleev Unidad de masa atómica (a.m.u.) 1.66 kg

Un mol es la cantidad de una sustancia que contiene la misma cantidad de moléculas o átomos que átomos hay en el carbono que pesa 12 g. 1 mol de cualquier sustancia contiene la misma cantidad de átomos o moléculas. Este número de átomos se denota N A y se llama constante de Avogadro en honor al científico italiano (siglo XIX). NA = 6·10 23 mol -1






4. Por tanto, la presión del gas en la pared: P = = _______ Esta ecuación, derivada por primera vez por el físico alemán R. Clausius, se denomina ecuación básica de la teoría cinética molecular de un gas ideal. Establece una conexión entre parámetros microscópicos y cantidades macroscópicas (medibles).







Los parámetros macroscópicos incluyen: ___ (________), ___ (_________) El equilibrio térmico es... La temperatura caracteriza el grado de... La temperatura se mide usando... Página La escala Celsius (C) está determinada por dos puntos:...

Experiencia de la página: Conclusiones: A 0C: A 100C:



Tarea. Dado: Solución: Respuesta: uds.



Página Confirmación experimental de la fórmula: experimento de Stern (1920)



Encuesta después de la lección: 1. ¿Cómo cambiará la velocidad cuadrática media de las moléculas cuando la temperatura aumente 4 veces? 2. ¿Qué moléculas de la atmósfera se mueven más rápido: las de nitrógeno o las de oxígeno? ¿Por qué? 3. ¿Qué es el cero absoluto en la escala Celsius? 4. ¿Cómo se relacionan el volumen, la presión y el número de moléculas de varios gases en el equilibrio térmico?


Corolario: - Ecuación de Clapeyron R – constante universal de los gases Problema, 928











Dictado físico Opción 1 Opción 2



El equilibrio dinámico es un estado en el que _______ Vapor saturado - vapor, _______ La concentración de ________ _____ saturado a una ________ constante no depende de su ____ Dado que p=nkT, la presión de ________ vapor _____________ del volumen que ocupa. La presión de vapor saturado (p vp) es la presión de vapor a la que ______ está en equilibrio con su _________.

La temperatura crítica es la _____ máxima a la que _____ se convertirá en __ P n.a. a 100°C equivale a Pa (760 mmHg) Presión de la mezcla: Componentes




Evaporación. Condensación. Hirviendo. La vaporización es el fenómeno de convertir un líquido en vapor. I.- vaporización de la superficie de un líquido, acompañada de absorción de energía. Depende de: Temperatura (tC - I.) Superficie del líquido Tipo de líquido K. - vaporización en todo el volumen del líquido a un determinado tC (punto de ebullición). ¡Durante la ebullición, la temperatura no cambia! (t=constante)

Durante la evaporación, solo salen moléculas rápidas que pueden superar la atracción de otras moléculas y la temperatura disminuye (tC). El punto de ebullición depende de la presión ambiental y de la presencia de impurezas. Dentro de la burbuja hay vapor saturado, es decir. presión Pvapor = Agua. t P vapor V burbuja Fa flota Ejemplos: “Soplar té”, “hace frío cuando está mojado”. Ejemplos: “Se añade sal después de hervir”, “en las montañas, el agua hierve a 80 C”.


§Humedad del aire ¿Por qué saberlo? Libros Tejidos Productos Aparatos eléctricos, etc. La humedad del aire es el contenido de vapor de agua en la atmósfera. ¡En 1 año, miles de millones de toneladas de agua se evaporan de la superficie de la Tierra! La presión parcial del agua P es la presión producida por el vapor de agua en la presión atmosférica total.

Humedad absoluta: la cantidad de vapor de agua por unidad de volumen (densidad del vapor de agua). Humedad relativa: la proporción de absoluta. humedad ρ a la densidad ρ 0 del vapor saturado a una temperatura determinada, expresada en%. P – presión parcial P 0 – presión de vapor saturado. P 0 y ρ 0 se encuentran en la tabla




"Mono" - uno. Un monocristal es un cuerpo sólido cuyas partículas forman una red monocristalina. Un ejemplo de monocristales son los muy extendidos cristales de cuarzo hexagonales. Los cristales de diamante, turmalina, etc. son menos comunes. Todos tienen la forma característica de poliedros h ttp:// /…

La anisotropía es la dependencia de las propiedades físicas de una sustancia de la dirección. Hay muchas partículas en el plano A, están ubicadas cerca unas de otras y hay una fuerte interacción. En el plano B hay menos partículas, la distancia entre ellas es mayor, las partículas del plano interactúan débilmente entre sí;

El grafito y el diamante están hechos de carbono...

El zafiro (corindón) contiene impurezas de titanio y hierro. Se forman microcircuitos en los zafiros.

Entre los minerales naturales, sólo superado por el diamante, el zafiro tiene una dureza excepcionalmente alta: 9 puntos en la escala de dureza sobre 10 posibles. Con polvos de zafiro se pueden taladrar, pulir y afilar piedras y metales.

El diamante es la creación más dura de la naturaleza. Aproximadamente el 80% de todos los diamantes extraídos se utilizan en la industria.

Debido a su dureza, los diamantes se utilizan para procesar materiales superduros, exploración y minería. Antes de 1430, los diamantes no se utilizaban como joyería. La que marcó tendencia para ellos fue la francesa Agnes Sorel. ...

Entre las piedras preciosas, el rubí ocupa el segundo lugar en fuerza después del diamante. Algunos ejemplos de rubí, que se distinguen por su particular pureza de color, se valoran incluso más que los diamantes del mismo peso...

Debido a su alta dureza, el rubí se utiliza mucho en la industria. Usando rubí, puedes producir un intenso haz de luz roja millones de veces más brillante que el sol. Los láseres de rubí se utilizan en la investigación científica para sondear la atmósfera...

Cristal esmeralda El color depende del contenido de óxido de cromo... ...

Los depósitos de esmeraldas son pocos. En el mundo antiguo, la minería se realizaba únicamente en Egipto. Se considera que una de las mejores de nuestro tiempo son las minas de las montañas de Copi en las montañas de Colombia, que los conquistadores españoles capturaron en el siglo XVI. ...

Un policristal es un cuerpo sólido que consta de monocristales orientados aleatoriamente... En la naturaleza, los monocristales fusionados aleatoriamente son más comunes. Ejemplos de policristales son: sal gema (Fig. 1), cuarzo (Fig. 2), azúcar, hielo, hierro, cobre.

Entre los cuerpos que generalmente se consideran sólidos porque conservan su forma y volumen y tienen resistencia, también están los que se diferencian significativamente de los cristales. Las partículas que contienen están dispuestas en el mismo desorden que en un líquido. Los cuerpos amorfos incluyen vidrio, resina, colofonia y plásticos. ...

CristalesCuerpos amorfos Las partículas están dispuestas de una manera ordenada y estrictamente definida. No existe ningún orden en la disposición de las partículas. Las partículas dan “saltos” Se funden a una determinada temperatura No tienen un punto de fusión específico AnisotrópicoIsotrópico Tienen una forma de poliedro característica No tienen el corte correcto


Los cristales líquidos son sustancias que tienen simultáneamente propiedades tanto de líquido (fluidez) como de cristales (anisotropía). En estructura, son líquidos similares a la gelatina, formados por moléculas alargadas, ordenadas de cierta forma en todo el volumen de este líquido. El estado externo de los cristales líquidos cuando se calientan puede cambiar de sólido a líquido cristalino y transformarse completamente en líquido. un aumento adicional de la temperatura.

Aplicación de cristales líquidos Al seleccionar la composición de una sustancia de cristal líquido, se crean indicadores para diferentes rangos de temperatura y para varios diseños. Por ejemplo, un indicador de cristal líquido colocado en la piel de un paciente diagnostica rápidamente una inflamación oculta e incluso un tumor. Los cristales líquidos se utilizan para detectar vapores de compuestos químicos nocivos y radiaciones gamma y ultravioleta peligrosas para la salud humana. Se han creado manómetros y detectores de ultrasonidos a base de cristales líquidos. Pero el área de aplicación más prometedora de sustancias cristalinas líquidas es la tecnología de la información. Actualmente, las pantallas LCD a color se utilizan en teléfonos móviles, monitores y televisores. Tienen pequeño espesor, bajo consumo de energía, alta resolución y brillo. ...

La primera reserva mineralógica del mundo fue creada por iniciativa de V. I. Vernadsky, N. M. Fedorovsky y A. E. Fersman en los Urales (en las montañas Ilmen, cerca de la ciudad de Miass) en los primeros años del poder soviético...

El área de la reserva es de 303,7 km². La longitud de la cresta Ilmen de norte a sur es de 41 km. El pico más alto es el monte Ilmentau (747,3 m) La red hidrológica de la Reserva constituye el 9% del territorio Hay 30 lagos en la reserva El lago más profundo Big Kisegach 34 m El río más largo B. Cheremshanka 9,8 km Minerales, rocas Minerales 264 Descubierto por primera vez en el mundo en Ilmeny 16 Rocas más de 70 Minas más de 400

Rusia, año 1842, 8 de octubre. En la mina Tsarevo-Aleksandrovsky cerca de la ciudad de Miass, en los Urales del Sur, se encontró una pepita de oro que pesa 36 kg 16 g. Hoy en día se puede ver en el Diamante el "Gran Triángulo", así se llama el ejemplar único. Fondo del Kremlin de Moscú. Se considera el más grande que se conserva en el mundo. ¿Cuántos grados se calentará si recibe J de calor? La capacidad calorífica específica del oro es 0,13 kJ/(kg K). Respuesta: 4°C. ...

En 1813, en uno de los afluentes del río Ural, Iset, donde se extraían pobres vetas de cuarzo auríferas, una joven, Katya Bogdanova, encontró una gran pepita de platino y se la llevó al empleado. ¿Cuál es la masa de una pepita de platino encontrada en los Urales en 1904 si se necesitarían J de energía para calentarla 20 °C? La capacidad calorífica específica del platino es 0,14 kJ/(kg * K). Respuesta: 8,395 kg.

1. ¿En qué tres tipos se dividen los sólidos según la naturaleza de la disposición de las partículas? ¿Qué determina si los sólidos pertenecen a uno de estos tipos? 2. ¿Cuál es la diferencia entre monocristales y policristales? 3.¿Qué cuerpos se clasifican como amorfos? 4.La madera es anisotrópica. ¿Es un cuerpo cristalino? 5.¿Surgiría la profesión de soplador de vidrio si el vidrio fuera un cuerpo cristalino y no amorfo?

1. Se colocan en agua caliente un cubo de vidrio y un cubo cortado de un monocristal de cuarzo. ¿Los cubos mantendrán su forma? 2. Un cubo cortado de un solo cristal puede convertirse en un paralelepípedo. ¿Por qué es esto posible? 3. Puedes dejar caer una palangana de hierro diez mil veces, pero no puedes dejar caer un jarrón de porcelana ni siquiera una vez. Después de todo, diez mil veces necesitas diez mil jarrones. ¿Por qué? ...





Motivo: los impactos de las moléculas de un líquido sobre una partícula no se compensan entre sí. La naturaleza del movimiento depende del tipo de líquido, del tamaño y la forma de las partículas y de la temperatura. El movimiento browniano es el movimiento continuo aleatorio de pequeñas partículas de un cuerpo sólido suspendido en un líquido o gas bajo el impacto de moléculas de líquido o gas. La naturaleza del movimiento depende del tipo de líquido, el tamaño y la forma de las partículas. temperatura. R. marrón 1827





La masa molecular (o atómica) relativa de una sustancia M r es la relación entre la masa de una molécula (o átomo) m 0 de una sustancia dada y 1/12 de la masa de un átomo de carbono m 0C M r (H 2 O) = 2 1 + 16 = 18 a.u. Calculemos M r de agua H 2 O (para esto usamos la tabla periódica) Mendeleev Unidad de masa atómica (uma) 1,66 kg

Un mol es la cantidad de una sustancia que contiene la misma cantidad de moléculas o átomos que átomos hay en el carbono que pesa 12 g. 1 mol de cualquier sustancia contiene la misma cantidad de átomos o moléculas. Este número de átomos se denota N A y se llama constante de Avogadro en honor al científico italiano (siglo XIX). NA = 6·10 23 mol -1

Disposiciones básicas de las TIC. Tamaños de moléculas y átomos. Estado agregado de una sustancia.
(introducción al tema “Termodinámica”)

Principios básicos de la teoría cinética molecular.
- Todas las sustancias, sin excepción, están formadas por partículas.
El objetivo de las TIC es explicación de las propiedades de los cuerpos macroscópicos y las leyes de los procesos térmicos basada en la idea de que todos los cuerpos consisten en partículas individuales que interactúan y se mueven caóticamente.





Tamaños de moléculas y átomos.
Una gota de aceite sobre la superficie de un líquido no se extenderá por toda el área libre; forma una capa de sólo una molécula de espesor: una “capa monomolecular”. Si tomamos el volumen de una gota de 1 mm 3, entonces se extenderá a una superficie máxima de no más de 0,6 m 2, luego calculamos:
d=0,001 cm3: 6000 cm2 ≈1,7×10⁻⁷cm.
El diámetro de una molécula de agua es aproximadamente 3 × 10⁻⁸ cm, entonces hay 3,7 × 10 22 moléculas en 1 cm 3. La masa de la molécula será 2,7 × 10⁻ 23 g.
- La masa de todas las moléculas y átomos se compara con 1/12 de la masa de un átomo de carbono.
- El peso molecular relativo está determinado por la fórmula:
Señor r = mm / m c/ 12
Donde m es la masa de una molécula de una sustancia,
m c es la masa de un átomo de carbono.
- Masa atómica relativa Ar es la relación entre la masa de un átomo y 1/12 de la masa de un átomo de carbono.

Fórmulas y definiciones sobre el tema.
1 uma = mc / 12 = 1,66 × 10-27 kilogramos
El número de moléculas en un mol de una sustancia se llama constante de Avogadro: N a = 6,02 × 10 23 mol -1
Ley de Avogadro: volúmenes iguales de diferentes gases en las mismas condiciones contienen siempre el mismo número de partículas.
La unidad de cantidad de sustancia ν es el mol.
Mol- es la cantidad de una sustancia que contiene la misma cantidad de moléculas (átomos) que hay en 12 g de carbono.
La masa de moléculas de una sustancia se puede determinar de la siguiente manera:
Masa molar METRO - Esta es la masa de 1 mol de una sustancia.
mm = M / N a; mm = m / N; metro metro = ρ / norte
Masa de sustancia m = M× ν
m es la masa de la sustancia, N es el número de moléculas,
unidad SI de masa molar
n es la concentración de moléculas.
kg/mol M = M r ×10 -3
El número de moléculas de una sustancia se puede determinar de la siguiente manera:
norte = norte a × ν; norte = m / m m; N=n×V
El volumen V M de un mol de una sustancia está determinado por la fórmula:
V = M / ρ ρ – densidad de la materia

Estado de la materia
- Sólido
- Líquido
- Gaseoso
La sustancia más abundante en la Tierra es el agua. Considerémoslo en todos los estados y recordemos,
que la molécula en sí no es
Cambios.

Estado sólido de la materia.
Las moléculas están ubicadas a ciertas distancias entre sí,
haciendo oscilatorio
movimiento en la posición
balance. Interacción
hay una conexión muy fuerte entre ellos,
Por tanto, en estado sólido, los cuerpos conservan su forma y volumen.
(en la imagen de una molécula de hielo
y foto de la ciudad de hielo).

Estado liquido de la materia
Las moléculas están situadas muy cerca unas de otras, lo que hace que los líquidos sean prácticamente
incompresible. Muévelos
desordenados y se mueven
en todo el volumen, esto provoca fluidez
sustancias en este estado de agregación.
La atracción entre partículas es débil,
por lo tanto los líquidos se derraman fácilmente
porciones. En consecuencia, los líquidos conservan su volumen pero adoptan fácilmente la forma del recipiente.

estado gaseoso de la materia
Las moléculas están ubicadas lo suficientemente separadas entre sí, lo que les permite dispersarse a largas distancias y
no interactúes entre
tú mismo. Por lo tanto los gases no son
tener un volumen constante
se esfuerzan por llenar todo el espacio que se les da. En consecuencia, los gases no tienen forma ni volumen propios.

Consolidación
1.Formular las principales disposiciones de las TIC.
2. Proporcionar hechos que confirmen la validez de estas disposiciones.
3. Resuelve el problema: determina la masa molar del azúcar.
4. ¿Cuántas moléculas hay en 210 g de nitrógeno?
Se puede pedir a los estudiantes que resuelvan problemas en casa.

1. Todas las sustancias, sin excepción, están formadas por partículas.
Todas las partículas se mueven aleatoriamente.
Todas las partículas de materia interactúan entre sí.
2. Trituración, evaporación, disolución, difusión, movimiento browniano, dispersión de líquido, aparición de elasticidad, deformación, conservación de la forma y volumen de los sólidos, fricción.
3. Señor r (C 12 H 22 O 11) = 12 A r (C) + 22 A r (H) + 11 A r (O)
Señor r = 12 12 + 22 + 11 16 = 342 (uma)
M = Mr 10 -3 = 0,342 (kg/mol).
4.m(N2) = 0,21 kg
N = m / m N 2 m N 2 = M / N a N = m N a /m