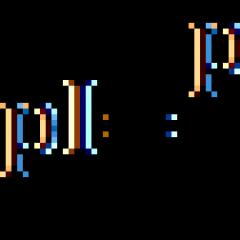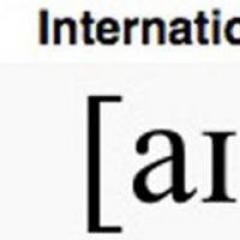Propiedades físicas de los aminoácidos. Reacciones de aminoácidos
En un ambiente ácido, los α-aminoácidos actúan como bases (en el grupo amino) y en un ambiente alcalino actúan como ácidos (en el grupo carboxilo). Para algunos aminoácidos, el radical (R) también puede estar ionizado y, por lo tanto, todos los aminoácidos se pueden dividir en cargados y no cargados (a un valor de pH fisiológico = 6,0 - 8,0) (ver Tabla 4). Ejemplos de los primeros incluyen ácido aspártico y lisina:
Si los radicales de aminoácidos son neutros, entonces no afectan la disociación del grupo α-carboxilo o α-amino, y los valores de pK (el logaritmo negativo que indica el valor de pH en el que estos grupos están medio disociados) permanecen relativamente constante.
Los valores de pK para el grupo α-carboxilo (pK 1) y el grupo α-amino (pK 2) son muy diferentes. A pH< pK 1 почти все молекулы аминокислоты протежированы и заряжены положительно. Напротив, при рН >pK 2 casi todas las moléculas de aminoácidos están cargadas negativamente, ya que el grupo α-carboxilo está en un estado disociado.
En consecuencia, dependiendo del pH del ambiente, los aminoácidos tienen una carga total positiva o negativa cero. El valor de pH en el que la carga total de la molécula es cero y no se mueve en el campo eléctrico ni hacia el cátodo ni hacia el ánodo se llama punto isoeléctrico y se denota pI.
Para los α-aminoácidos neutros, el valor de pI se calcula como la media aritmética entre dos valores de pK:
![]()
Cuando el pH de la solución es inferior a pI, los aminoácidos se protonan y, al cargarse positivamente, se mueven en el campo eléctrico hacia el cátodo. La imagen opuesta se observa a pH > pI.
Para los aminoácidos que contienen radicales cargados (ácidos o básicos), el punto isoeléctrico depende de la acidez o basicidad de estos radicales y su pK (pK 3). El valor de pI para ellos se encuentra mediante las siguientes fórmulas:
para aminoácidos ácidos:
![]()
para aminoácidos básicos:
![]()
En las células y el líquido intercelular del cuerpo humano y animal, el pH del medio ambiente es casi neutro, por lo que los aminoácidos básicos (lisina, arginina) tienen una carga positiva (cationes), los aminoácidos ácidos (aspártico, glutámico) tienen una carga negativa (aniones), y el resto existe en forma de zwitterión bipolar.
Estereoquímica de aminoácidos.
Una característica importante de los α-aminoácidos proteicos es su actividad óptica. A excepción de la glicina, todos están construidos de forma asimétrica y, por tanto, cuando se disuelven en agua o ácido clorhídrico, son capaces de rotar el plano de polarización de la luz. Los aminoácidos existen en forma de isómeros espaciales que pertenecen a la serie D o L. La configuración L o D está determinada por el tipo de estructura del compuesto en relación con el átomo de carbono asimétrico (un átomo de carbono unido a cuatro átomos o grupos de átomos diferentes). En las fórmulas, un átomo de carbono asimétrico se indica con un asterisco. La Figura 3 muestra los modelos de proyección de las configuraciones L y D de aminoácidos, que son, por así decirlo, imágenes especulares entre sí. Los 18 aminoácidos proteicos ópticamente activos pertenecen a la serie L. Sin embargo, los D-aminoácidos se encuentran en las células de muchos microorganismos y en los antibióticos producidos por algunos de ellos.

Arroz. 3. Configuración de L- y D-aminoácidos
Estructura proteica
Con base en los resultados del estudio de los productos de la hidrólisis de proteínas y los propuestos por A.Ya. A partir de las ideas de Danilevsky sobre el papel de los enlaces peptídicos -CO-NH- en la construcción de una molécula de proteína, el científico alemán E. Fischer propuso la teoría peptídica de la estructura de las proteínas a principios del siglo XX. Según esta teoría, las proteínas son polímeros lineales de α-aminoácidos unidos por enlaces peptídicos: polipéptidos:

En cada péptido, un residuo de aminoácido terminal tiene un grupo α-amino libre (terminal N) y el otro tiene un grupo α-carboxilo libre (terminal C). La estructura de los péptidos suele representarse a partir del aminoácido N-terminal. En este caso, los residuos de aminoácidos se designan mediante símbolos. Por ejemplo: Ala-Tyr-Leu-Ser-Tyr- - Cis. Esta entrada denota un péptido en el que el α-aminoácido N-terminal es está formado por alanina y el C-terminal - cisteína. Al leer un registro de este tipo, las terminaciones de los nombres de todos los ácidos, excepto los últimos, cambian a "limo": alanil-tirosil-leucil-seril-tirosil-cisteína. La longitud de la cadena peptídica de los péptidos y proteínas que se encuentran en el cuerpo varía de dos a cientos y miles de residuos de aminoácidos.
Para determinar la composición de aminoácidos, las proteínas (péptidos) se someten a hidrólisis:

En un ambiente neutro, esta reacción avanza muy lentamente, pero se acelera en presencia de ácidos o álcalis. Normalmente, la hidrólisis de proteínas se lleva a cabo en una ampolla sellada en una solución 6 M de ácido clorhídrico a 105 ° C; En tales condiciones, la desintegración completa se produce en aproximadamente un día. En algunos casos, la proteína se hidroliza en condiciones más suaves (a una temperatura de 37-40 ° C) bajo la acción de catalizadores enzimáticos biológicos durante varias horas.
Luego, los aminoácidos del hidrolizado se separan mediante cromatografía sobre resinas de intercambio iónico (intercambiador de cationes de sulfopoliestireno), aislando una fracción separada de cada aminoácido. Para eliminar los aminoácidos de la columna de intercambio iónico, se utilizan tampones con valores de pH crecientes. Primero se elimina el aspartato, que tiene una cadena lateral ácida; La arginina con la cadena lateral principal se elimina en último lugar. La secuencia de eliminación de aminoácidos de la columna está determinada por el perfil de lixiviación de aminoácidos estándar. Los aminoácidos fraccionados están determinados por el color que se forma cuando se calienta con ninhidrina:

En esta reacción se convierte la ninhidrina incolora; en un producto azul violeta, cuya intensidad de color (a 570 nm) es proporcional a la cantidad de aminoácido (sólo la prolina da un color amarillo). Midiendo la intensidad de la tinción es posible calcular la concentración de cada aminoácido en el hidrolizado y el número de residuos de cada uno de ellos en la proteína en estudio.
Actualmente, dicho análisis se lleva a cabo utilizando dispositivos automáticos: analizadores de aminoácidos (consulte la figura a continuación. Diagrama del dispositivo). El dispositivo muestra el resultado del análisis en forma de gráfico de las concentraciones de aminoácidos individuales. Este método ha encontrado una amplia aplicación en el estudio de la composición de nutrientes y en la práctica clínica; con su ayuda, en 2-3 horas se puede obtener una imagen completa de la composición cualitativa de los aminoácidos en productos y fluidos biológicos.
Aminoácidos.
Aminoácidos(ácidos aminocarboxílicos): compuestos orgánicos, cuya molécula contiene simultáneamente carboxilo (-COOH) Y grupos amina (-NH2).
La estructura de los aminoácidos se puede expresar mediante la siguiente fórmula general,
(Dónde R– radical hidrocarbonado, que puede contener varios grupos funcionales).
Aminoácidos pueden considerarse derivados ácidos carboxílicos, en el que uno o más átomos de hidrógeno son reemplazados por grupos amina (-NH2).
Un ejemplo son los protozoos: ácido aminoacético, o glicina y ácido aminopropiónico o alanina:

Propiedades químicas de los aminoácidos.
Los aminoácidos son compuestos anfóteros., es decir. Dependiendo de las condiciones, pueden presentar propiedades tanto básicas como ácidas.
Debido al grupo carboxilo ( -COOH) forman sales con bases.
Debido al grupo amino ( -NH2) forman sales con ácidos.
Un ion de hidrógeno que se elimina al disociarse de un carboxilo ( -ÉL) aminoácido, puede pasar a su grupo amino con la formación de un grupo amonio ( NH3+).

Así, los aminoácidos también existen y reaccionan en forma de iones bipolares (sales internas).
Esto explica que las soluciones de aminoácidos que contienen un grupo carboxilo y un grupo amino tienen una reacción neutra.
Alfa aminoácidos
De moléculas aminoácidos Las moléculas de sustancias proteicas se construyen o proteínas, que, tras una hidrólisis completa bajo la influencia de ácidos minerales, álcalis o enzimas, se descomponen formando mezclas de aminoácidos.
El número total de aminoácidos naturales llega a 300, pero algunos de ellos son bastante raros.
Entre los aminoácidos, existe un grupo de los 20 más importantes. Se encuentran en todas las proteínas y se llaman. aminoácidos alfa.
Alfa aminoácidos– sustancias cristalinas solubles en agua. Muchos de ellos tienen un sabor dulce. Esta propiedad se refleja en el nombre del primer homólogo de la serie de alfa aminoácidos: glicina, que también fue el primer alfa aminoácido encontrado en un material natural.
A continuación se muestra una tabla con una lista de alfa aminoácidos:
Nombre | Fórmula | Nombre restante |
|---|---|---|
| Aminoácidos con radicales alifáticos. | ||
| grupo OH | ||
| ser | ||
| tr | ||
| Aminoácidos con radicales que contienen un grupo COOH. | ||
| Áspid | ||
| glu | ||
| Aminoácidos con radicales que contienen NH2CO-grupo | ||
| asn | ||
| Gln | ||
| Aminoácidos con radicales que contienen NH2-grupo | ||
| lis | ||
| Arg | ||
| Aminoácidos con radicales que contienen azufre. | ||
| cis | ||
| Reunió | ||
| Aminoácidos con radicales aromáticos. | ||
| phe | ||
| tiro | ||
| Aminoácidos con radicales heterocíclicos. | ||
| Trp | ||
| Su | ||
| Pro | ||
Aminoácidos esenciales
Fuente principal aminoácidos alfa Las proteínas alimentarias sirven al cuerpo animal.
Muchos alfa aminoácidos se sintetizan en el cuerpo, pero algunos alfa aminoácidos necesarios para la síntesis de proteínas no se sintetizan en el cuerpo y debe venir de fuera, con comida. Estos aminoácidos se llaman insustituible. Aquí está su lista:
nombre del aminoácido | Nombre de los productos alimenticios. |
|---|---|
cereales, legumbres, carne, champiñones, productos lácteos, maní |
|
almendras, anacardos, pollo, garbanzos, huevos, pescado, lentejas, hígado, carne, centeno, la mayoría de las semillas, soja |
|
carne, pescado, lentejas, nueces, la mayoría de las semillas, pollo, huevos, avena, arroz integral |
|
pescado, carne, productos lácteos, trigo, nueces, amaranto |
|
leche, carne, pescado, huevos, judías, judías, lentejas y soja |
|
productos lácteos, huevos, nueces, frijoles |
|
legumbres, avena, plátanos, dátiles secos, cacahuetes, semillas de sésamo, piñones, leche, yogur, requesón, pescado, pollo, pavo, carne |
|
legumbres, nueces, carne de res, pollo, pescado, huevos, requesón, leche |
|
semillas de calabaza, cerdo, ternera, maní, semillas de sésamo, yogur, queso suizo |
|
atún, salmón, solomillo de cerdo, filete de ternera, pechugas de pollo, soja, maní, lentejas |
En algunas enfermedades, a menudo congénitas, la lista de ácidos esenciales se amplía. Por ejemplo, con la fenilcetonuria, el cuerpo humano no sintetiza otro aminoácido alfa: tirosina, que en el organismo de personas sanas se obtiene por hidroxilación de la fenilalanina.
Uso de aminoácidos en la práctica médica.
Alfa aminoácidos ocupar una posición clave en metabolismo del nitrógeno. Muchos de ellos se utilizan en la práctica médica como medicamentos, afectando el metabolismo de los tejidos.
Entonces, ácido glutamico utilizado para tratar enfermedades del sistema nervioso central, metionina Y histidina– tratamiento y prevención de enfermedades hepáticas, cisteína- enfermedades de los ojos.
Según la naturaleza de los sustituyentes de hidrocarburos, las aminas se dividen en
Características estructurales generales de las aminas.
Al igual que en la molécula de amoníaco, en la molécula de cualquier amina el átomo de nitrógeno tiene un par de electrones solitario dirigido a uno de los vértices del tetraedro distorsionado:
Por esta razón, las aminas, al igual que el amoníaco, tienen propiedades básicas significativamente expresadas.
Así, las aminas, similares al amoníaco, reaccionan reversiblemente con el agua formando bases débiles:
El enlace entre el catión de hidrógeno y el átomo de nitrógeno en la molécula de amina se realiza mediante un mecanismo donador-aceptor debido al par de electrones solitario del átomo de nitrógeno. Las aminas saturadas son bases más fuertes en comparación con el amoníaco, porque en tales aminas, los sustituyentes hidrocarbonados tienen un efecto inductivo positivo (+I). En este sentido, aumenta la densidad electrónica del átomo de nitrógeno, lo que facilita su interacción con el catión H +.
Las aminas aromáticas, si el grupo amino está directamente conectado al anillo aromático, presentan propiedades básicas más débiles en comparación con el amoníaco. Esto se debe al hecho de que el par de electrones solitarios del átomo de nitrógeno se desplaza hacia el sistema π aromático del anillo de benceno, como resultado de lo cual disminuye la densidad electrónica en el átomo de nitrógeno. A su vez, esto conduce a una disminución de las propiedades básicas, en particular la capacidad de interactuar con el agua. Por ejemplo, la anilina reacciona solo con ácidos fuertes, pero prácticamente no reacciona con el agua.
Propiedades químicas de las aminas saturadas.
Como ya se mencionó, las aminas reaccionan reversiblemente con el agua:
Las soluciones acuosas de aminas tienen una reacción alcalina debido a la disociación de las bases resultantes:
Las aminas saturadas reaccionan con el agua mejor que el amoníaco debido a sus propiedades básicas más fuertes.
Las propiedades básicas de las aminas saturadas aumentan en la serie.
Las aminas saturadas secundarias son bases más fuertes que las aminas saturadas primarias, que a su vez son bases más fuertes que el amoníaco. En cuanto a las propiedades básicas de las aminas terciarias, si hablamos de reacciones en soluciones acuosas, entonces las propiedades básicas de las aminas terciarias se expresan mucho peor que las de las aminas secundarias, e incluso un poco peor que las de las primarias. Esto se debe a impedimentos estéricos, que afectan significativamente la tasa de protonación de las aminas. En otras palabras, tres sustituyentes “bloquean” el átomo de nitrógeno e interfieren con su interacción con los cationes H+.
Interacción con ácidos
Tanto las aminas saturadas libres como sus soluciones acuosas reaccionan con los ácidos. En este caso se forman sales:
Dado que las propiedades básicas de las aminas saturadas son más pronunciadas que las del amoníaco, dichas aminas reaccionan incluso con ácidos débiles, como el ácido carbónico:
Las sales de amina son sólidos muy solubles en agua y poco solubles en disolventes orgánicos no polares. La interacción de las sales de amina con los álcalis conduce a la liberación de aminas libres, similar al desplazamiento del amoníaco cuando los álcalis actúan sobre las sales de amonio:
2. Las aminas primarias saturadas reaccionan con el ácido nitroso para formar los correspondientes alcoholes, nitrógeno N2 y agua. Por ejemplo:
Un rasgo característico de esta reacción es la formación de gas nitrógeno y, por tanto, es cualitativa para las aminas primarias y se utiliza para distinguirlas de las secundarias y terciarias. Cabe señalar que la mayoría de las veces esta reacción se lleva a cabo mezclando la amina no con una solución de ácido nitroso en sí, sino con una solución de una sal de ácido nitroso (nitrito) y luego agregando un ácido mineral fuerte a esta mezcla. Cuando los nitritos interactúan con ácidos minerales fuertes, se forma ácido nitroso, que luego reacciona con la amina:
En condiciones similares, las aminas secundarias dan líquidos aceitosos, las llamadas N-nitrosaminas, pero esta reacción no ocurre en pruebas de uso reales en química. Las aminas terciarias no reaccionan con el ácido nitroso.
La combustión completa de cualquier amina conduce a la formación de dióxido de carbono, agua y nitrógeno:
Interacción con haloalcanos
Es de destacar que se obtiene exactamente la misma sal mediante la acción del cloruro de hidrógeno sobre una amina más sustituida. En nuestro caso, cuando el cloruro de hidrógeno reacciona con la dimetilamina:
Preparación de aminas:
1) Alquilación de amoniaco con haloalcanos:
En caso de deficiencia de amoníaco, se obtiene su sal en lugar de amina:
2) Reducción por metales (a hidrógeno en la serie de actividad) en un ambiente ácido:
seguido del tratamiento de la solución con álcali para liberar la amina libre:
3) La reacción del amoníaco con los alcoholes al pasar su mezcla a través de óxido de aluminio calentado. Dependiendo de las proporciones alcohol/amina se forman aminas primarias, secundarias o terciarias:
Propiedades químicas de la anilina.
Anilina - el nombre trivial del aminobenceno, que tiene la fórmula:
Como puede verse en la ilustración, en la molécula de anilina el grupo amino está directamente conectado al anillo aromático. Estas aminas, como ya se mencionó, tienen propiedades básicas mucho menos pronunciadas que el amoníaco. Así, en particular, la anilina prácticamente no reacciona con agua y ácidos débiles como el ácido carbónico.
Reacción de anilina con ácidos.
La anilina reacciona con ácidos inorgánicos fuertes y medios. En este caso se forman sales de fenilamonio:
Reacción de anilina con halógenos.
Como ya se dijo al principio de este capítulo, el grupo amino en las aminas aromáticas es atraído hacia el anillo aromático, lo que a su vez reduce la densidad electrónica en el átomo de nitrógeno y, como resultado, la aumenta en el anillo aromático. Un aumento de la densidad electrónica en el anillo aromático conduce al hecho de que las reacciones de sustitución electrófila, en particular las reacciones con halógenos, se desarrollan mucho más fácilmente, especialmente en las posiciones orto y para con respecto al grupo amino. Así, la anilina reacciona fácilmente con el agua con bromo, formando un precipitado blanco de 2,4,6-tribromoanilina:
Esta reacción es cualitativa para la anilina y a menudo permite identificarla entre otros compuestos orgánicos.
Reacción de anilina con ácido nitroso.
La anilina reacciona con el ácido nitroso, pero debido a la especificidad y complejidad de esta reacción, no aparece en el Examen Estatal Unificado de Química real.
Reacciones de alquilación de anilina.
Utilizando la alquilación secuencial de anilina en el átomo de nitrógeno con hidrocarburos halogenados, se pueden obtener aminas secundarias y terciarias:
Obtención de anilina
1. Reducción del nitrobenceno por metales en presencia de ácidos fuertes no oxidantes:
C 6 H 5 -NO 2 + 3Fe + 7HCl = +Cl- + 3FeCl 2 + 2H 2 O
Cl - + NaOH = C 6 H 5 -NH 2 + NaCl + H 2 O
Como metales se pueden utilizar todos los metales situados antes del hidrógeno en la serie de actividad.
Reacción del clorobenceno con amoníaco:
C 6 H 5 −Cl + 2NH 3 → C 6 H 5 NH 2 + NH 4 Cl
Propiedades químicas de los aminoácidos.
Aminoácidos son compuestos cuyas moléculas contienen dos tipos de grupos funcionales: grupos amino (-NH 2) y carboxi- (-COOH).
En otras palabras, los aminoácidos pueden considerarse derivados de ácidos carboxílicos, en cuyas moléculas uno o más átomos de hidrógeno están reemplazados por grupos amino.
Por tanto, la fórmula general de los aminoácidos se puede escribir como (NH 2) x R(COOH) y, donde xey suelen ser iguales a uno o dos.
Dado que las moléculas de aminoácidos contienen tanto un grupo amino como un grupo carboxilo, exhiben propiedades químicas similares tanto a las aminas como a los ácidos carboxílicos.
Propiedades ácidas de los aminoácidos.
Formación de sales con álcalis y carbonatos de metales alcalinos.
Esterificación de aminoácidos.
Los aminoácidos pueden reaccionar durante la esterificación con alcoholes:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Propiedades básicas de los aminoácidos.
1. Formación de sales al interactuar con ácidos.
NH2CH2COOH + HCl → + Cl —
2. Interacción con el ácido nitroso
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Nota: la interacción con el ácido nitroso se produce de la misma manera que con las aminas primarias.
3. Alquilación
NH 2 CH 2 COOH + CH 3 I → + I —
4. Interacción de aminoácidos entre sí.
Los aminoácidos pueden reaccionar entre sí para formar péptidos, compuestos que contienen el enlace peptídico –C(O)-NH- en sus moléculas.
Al mismo tiempo, cabe señalar que en el caso de una reacción entre dos aminoácidos diferentes, sin observar unas condiciones de síntesis específicas, la formación de diferentes dipéptidos se produce simultáneamente. Entonces, por ejemplo, en lugar de la reacción anterior de glicina con alanina, que conduce a glicilanina, puede ocurrir la reacción que conduce a alanilglicina:
Además, la molécula de glicina no reacciona necesariamente con la molécula de alanina. También ocurren reacciones de peptización entre moléculas de glicina:
Y alanina:
Además, dado que las moléculas de los péptidos resultantes, al igual que las moléculas de aminoácidos originales, contienen grupos amino y grupos carboxilo, los propios péptidos pueden reaccionar con aminoácidos y otros péptidos debido a la formación de nuevos enlaces peptídicos.
Los aminoácidos individuales se utilizan para producir polipéptidos sintéticos o las llamadas fibras de poliamida. Así, en particular, mediante la policondensación del ácido 6-aminohexano (ε-aminocaproico), el nailon se sintetiza en la industria:
La resina de nailon resultante se utiliza para producir fibras textiles y plásticos.
Formación de sales internas de aminoácidos en solución acuosa.
En soluciones acuosas, los aminoácidos existen predominantemente en forma de sales internas: iones bipolares (zwitteriones):
Obtención de aminoácidos
1) Reacción de ácidos carboxílicos clorados con amoníaco:
Cl-CH 2 -COOH + 2NH 3 = NH 2 -CH 2 -COOH + NH 4 Cl
2) Descomposición (hidrólisis) de proteínas bajo la acción de soluciones de ácidos y álcalis minerales fuertes.
Los aminoácidos son el principal material de construcción de cualquier organismo vivo. Por su naturaleza, son las sustancias nitrogenadas primarias de las plantas, que se sintetizan a partir del suelo. La estructura de los aminoácidos depende de su composición.
Estructura de aminoácidos
Cada una de sus moléculas tiene grupos carboxilo y amina que están conectados a un radical. Si un aminoácido contiene 1 grupo carboxilo y 1 amino, su estructura puede indicarse mediante la fórmula que se presenta a continuación.

Los aminoácidos que tienen 1 ácido y 1 grupo alcalino se llaman ácidos monoaminomonocarboxílicos. En los organismos también se sintetizan 2 grupos carboxilo o 2 grupos amina y cuyas funciones están determinadas. Los aminoácidos que contienen 2 grupos carboxilo y 1 amina se denominan monoaminodicarboxílicos, y los que contienen 2 aminas y 1 carboxilo se denominan diaminomonocarboxílicos.
También se diferencian en la estructura del radical orgánico R. Cada uno de ellos tiene su propio nombre y estructura. De ahí las diferentes funciones de los aminoácidos. Es la presencia de grupos ácidos y alcalinos lo que asegura su alta reactividad. Estos grupos conectan aminoácidos y forman un polímero: una proteína. Las proteínas también se llaman polipéptidos debido a su estructura.
Aminoácidos como materiales de construcción.
Una molécula de proteína es una cadena de decenas o cientos de aminoácidos. Las proteínas difieren en composición, cantidad y orden de aminoácidos, porque el número de combinaciones de 20 componentes es casi infinito. Algunos de ellos tienen toda la composición de aminoácidos esenciales, otros prescinden de uno o más. Los aminoácidos individuales, una estructura cuyas funciones son similares a las proteínas del cuerpo humano, no se utilizan como productos alimenticios, ya que son poco solubles y no se descomponen en el tracto gastrointestinal. Entre ellas se incluyen las proteínas de las uñas, el cabello, el pelaje o las plumas.
Las funciones de los aminoácidos son difíciles de sobreestimar. Estas sustancias son el alimento principal de la dieta humana. ¿Qué función realizan los aminoácidos? Aumentan el crecimiento de la masa muscular, ayudan a fortalecer las articulaciones y ligamentos, restauran los tejidos corporales dañados y participan en todos los procesos que ocurren en el cuerpo humano.

Aminoácidos esenciales
Sólo a partir de suplementos o productos alimenticios se pueden obtener funciones muy importantes en el proceso de formación de articulaciones sanas, músculos fuertes y un cabello hermoso. Estos aminoácidos incluyen:
- fenilalanina;
- lisina;
- treonina;
- metionina;
- valina;
- leucina;
- triptófano;
- histidina;
- isoleucina.
Funciones de los aminoácidos esenciales.
Estos ladrillos desempeñan funciones esenciales en el funcionamiento de cada célula del cuerpo humano. Son invisibles siempre que entren en el organismo en cantidades suficientes, pero su deficiencia perjudica significativamente el funcionamiento de todo el organismo.
- La valina renueva los músculos y sirve como una excelente fuente de energía.
- La histidina mejora la composición de la sangre, promueve la recuperación y el crecimiento muscular y mejora la función de las articulaciones.
- La isoleucina ayuda a la producción de hemoglobina. Controla la cantidad de azúcar en la sangre, aumenta la energía y la resistencia de una persona.
- La leucina fortalece el sistema inmunológico, controla el nivel de azúcar y leucocitos en la sangre. Si el nivel de leucocitos es demasiado alto: los baja y activa las reservas del organismo para eliminar la inflamación.
- La lisina ayuda a absorber el calcio, que forma y fortalece los huesos. Ayuda a la producción de colágeno, mejora la estructura del cabello. Para los hombres, este es un excelente esteroide anabólico, ya que desarrolla músculos y aumenta la fuerza masculina.
- La metionina normaliza el funcionamiento del sistema digestivo y del hígado. Participa en la descomposición de grasas, elimina la toxicosis en mujeres embarazadas y tiene un efecto beneficioso sobre el cabello.
- La treonina mejora el funcionamiento del tracto gastrointestinal. Aumenta la inmunidad, participa en la creación de elastina y colágeno. La treonina previene la deposición de grasa en el hígado.
- El triptófano es responsable de las emociones humanas. Produce serotonina, la hormona de la felicidad, normalizando así el sueño y mejorando el estado de ánimo. Controla el apetito, tiene un efecto beneficioso sobre el músculo cardíaco y las arterias.
- La fenilalanina sirve como transmisor de señales desde las células nerviosas al cerebro de la cabeza. Mejora el estado de ánimo, suprime el apetito poco saludable, mejora la memoria, aumenta la sensibilidad y reduce el dolor.
Una deficiencia de aminoácidos esenciales provoca retraso en el crecimiento, trastornos metabólicos y disminución de la masa muscular.

aminoácidos no esenciales
Estos son aminoácidos, cuya estructura y funciones se producen en el cuerpo:
- arginina;
- alanina;
- asparagina;
- glicina;
- prolina;
- taurina;
- tirosina;
- glutamato;
- serina;
- glutamina;
- ornitina;
- cisteína;
- carnitina
Funciones de los aminoácidos no esenciales.
- La cisteína elimina sustancias tóxicas, participa en la creación de tejido cutáneo y muscular y es un antioxidante natural.
- La tirosina reduce la fatiga física, acelera el metabolismo, elimina el estrés y la depresión.
- La alanina sirve para el crecimiento muscular y es fuente de energía.
- aumenta el metabolismo y reduce la formación de amoníaco durante el ejercicio intenso.
- La cistina elimina el dolor cuando se lesionan ligamentos y articulaciones.
- es responsable de la actividad cerebral; durante la actividad física prolongada, se convierte en glucosa y produce energía.
- La glutamina restaura los músculos, mejora la inmunidad, acelera el metabolismo, mejora la función cerebral y crea la hormona del crecimiento.
- La glicina es necesaria para la función muscular, la degradación de grasas, la estabilización de la presión arterial y el azúcar en sangre.
- La carnitina mueve los ácidos grasos hacia las células, donde se descomponen para liberar energía, lo que resulta en la quema del exceso de grasa y genera energía.
- La ornitina produce la hormona del crecimiento, participa en el proceso de formación de la orina, descompone los ácidos grasos y ayuda a producir insulina.
- Proline asegura la producción de colágeno, es necesario para ligamentos y articulaciones.
- La serina mejora la inmunidad y produce energía; es necesaria para el rápido metabolismo de los ácidos grasos y el crecimiento muscular.
- La taurina descompone las grasas, aumenta la resistencia del cuerpo y sintetiza sales biliares.
Proteína y sus propiedades.
Las proteínas, o proteínas, son compuestos de alto peso molecular que contienen nitrógeno. El concepto de "proteína", designado por primera vez por Berzelius en 1838, proviene de la palabra griega y significa "primaria", lo que refleja el papel protagónico de las proteínas en la naturaleza. La variedad de proteínas hace posible que exista una gran cantidad de seres vivos: desde las bacterias hasta el cuerpo humano. Hay muchas más que otras macromoléculas, porque las proteínas son la base de una célula viva. Constituyen aproximadamente el 20% de la masa del cuerpo humano, más del 50% de la masa seca de la célula. Esta cantidad de proteínas diversas se explica por las propiedades de veinte aminoácidos diferentes, que interactúan entre sí y crean moléculas poliméricas.

Una propiedad destacada de las proteínas es la capacidad de crear de forma independiente una determinada estructura espacial característica de una proteína en particular. Las proteínas son biopolímeros con enlaces peptídicos. La composición química de las proteínas se caracteriza por un contenido medio constante de nitrógeno de aproximadamente el 16%.
La vida, así como el crecimiento y desarrollo del cuerpo, son imposibles sin la función de los aminoácidos proteicos para construir nuevas células. Las proteínas no pueden ser reemplazadas por otros elementos; su papel en el cuerpo humano es extremadamente importante.
Funciones de las proteínas
La necesidad de proteínas radica en las siguientes funciones:
- es necesario para el crecimiento y el desarrollo, ya que es el principal material de construcción para la creación de nuevas células;
- controla el metabolismo, durante el cual se libera energía. Después de ingerir alimentos, la tasa metabólica aumenta, por ejemplo, si los alimentos se componen de carbohidratos, el metabolismo se acelera en un 4%, si se componen de proteínas, en un 30%;
- regular en el cuerpo debido a su hidrofilicidad: la capacidad de atraer agua;
- fortalecer el sistema inmunológico mediante la síntesis de anticuerpos que protegen contra infecciones y eliminan la amenaza de enfermedades.

Productos - fuentes de proteínas
Los músculos y el esqueleto humanos están formados por tejidos vivos que no sólo funcionan sino que también se renuevan a lo largo de la vida. Se recuperan de daños y conservan su resistencia y durabilidad. Para ello, requieren nutrientes muy específicos. Los alimentos proporcionan al cuerpo la energía que necesita para todos los procesos, incluida la función muscular, el crecimiento y la reparación de los tejidos. Y la proteína en el cuerpo se utiliza como fuente de energía y como material de construcción.

Por eso, es muy importante observar su uso diario en la alimentación. Alimentos ricos en proteínas: pollo, pavo, jamón magro, cerdo, ternera, pescado, camarones, frijoles, lentejas, tocino, huevos, nueces. Todos estos productos aportan al organismo proteínas y aportan la energía necesaria para la vida.
Propiedades de los aminoácidos Se pueden dividir en dos grupos: químicos y físicos.
Propiedades químicas de los aminoácidos.
Dependiendo de los compuestos, los aminoácidos pueden presentar diferentes propiedades.
Interacciones de aminoácidos:
Los aminoácidos, como compuestos anfóteros, forman sales tanto con ácidos como con álcalis.
Como ácidos carboxílicos, los aminoácidos forman derivados funcionales: sales, ésteres, amidas.
Interacción y propiedades de los aminoácidos con razones:
Se forman sales:
NH 2 -CH 2 -COOH + NaOH NH 2 -CH 2 -COONa + H2O
Sal sódica + ácido 2-aminoacético Sal sódica del ácido aminoacético (glicina) + agua
Interacción con alcoholes:
Los aminoácidos pueden reaccionar con alcoholes en presencia de gas cloruro de hidrógeno, convirtiéndose en ester. Los ésteres de aminoácidos no tienen una estructura bipolar y son compuestos volátiles.
NH2-CH2-COOH + CH3OH NH2-CH2-COOCH3 + H2O.
Éster metílico / ácido 2-aminoacético /
Interacción amoníaco:
Se forman amidas:
NH 2 -CH(R)-COOH + H-NH 2 = NH 2 -CH(R)-CONH 2 + H 2 O
Interacción de aminoácidos con ácidos fuertes:
Obtenemos sales:
HOOC-CH 2 -NH 2 + HCl → Cl (o HOOC-CH 2 -NH 2 *HCl)
Estas son las propiedades químicas básicas de los aminoácidos.
Propiedades físicas de los aminoácidos.
Enumeremos las propiedades físicas de los aminoácidos.:
- Incoloro
- Tener forma cristalina
- La mayoría de los aminoácidos tienen un sabor dulce, pero dependiendo del radical (R), pueden ser amargos o insípidos.
- Fácilmente soluble en agua, pero poco soluble en muchos disolventes orgánicos.
- Los aminoácidos tienen la propiedad de actividad óptica.
- Se funde con descomposición a temperaturas superiores a 200°C.
- No volátil
- Las soluciones acuosas de aminoácidos en ambientes ácidos y alcalinos conducen corriente eléctrica.