Označite tvari za koje je voda otapalo. Otapanje u vodi: što, kako i pod kojim uvjetima
MOU Maninskaya srednja škola
Otvoreni sat geografije
V razred
Učitelj, nastavnik, profesor:
2008 godina.
Tema lekcije: “Voda je otapalo. Rad vode u prirodi”.
Ciljevi lekcije:
Upoznati učenike sa značenjem vode na Zemlji.
Dajte pojam otopina i suspenzija, topljivih i u vodi netopivih tvari
Prikaži rad vode u prirodi (kreativno i destruktivno)
Poticati poštovanje prema vodi, ljubav prema ljepoti.
Oprema: karta hemisfere, globus, izjava o vodi, tablice "Surfanje", "Špilja", "Ocean", "Stanovnici mora i oceana", "Vremensko stanje", epruvete s vodom, soli, pijeskom, filterom, magnetofonom, TV, multimedijski projektor...
Tijekom nastave.
jaOrganiziranje vremena.
II.Učenje novog gradiva.
Nastava počinje gledanjem ulomka filma o vodi.
Na pozadini tihe glazbe, koja odražava zvukove vode.
Učitelj, nastavnik, profesor:
Prostranost oceana
I tiha rukavac jezerca,
I sve je to samo voda
Tema naše lekcije je „Voda je otapalo. Rad vode u prirodi”.
Akademik je vedro i točno govorio o ulozi vode u prirodi. “Je li voda samo tekućina koja je ulivena u čašu?
Okean koji pokriva gotovo cijeli planet, cijelu našu divnu Zemlju, u kojoj se život rodio prije milijuna godina, je voda."
Oblaci, oblaci, magla, koji nose vlagu svim živim bićima na površini zemlje - to je također voda.
Čini se da su odjevene u čipku
Drveće, grmlje, žice,
I čini se kao bajka
I, u biti, samo voda.
Raznolikost života je neograničena. Ona je posvuda na našoj planeti. Ali život je samo tamo gdje ima vode. Nema živog bića ako nema vode. Da, danas ćemo u našoj lekciji govoriti o vodi, o kraljici - Voditsa. Idemo se malo zagrijati.
Pogodi zagonetke.
1. Hoda pod zemljom,
Gleda u nebo. ( Proljeće)
2. Što je vidljivo kad se ništa ne vidi. ( magla)
3. Navečer leti na zemlju,
Noć ostaje na zemlji
Ujutro opet odleti. ( rosa)
4. lete bez krila,
Trče bez nogu
Plove bez jedra. ( oblaci)
5. Nije konj, nego trči,
Ne šuma, nego buka. ( rijeka, potok).
6. Došao - pokucao na krov,
Otišao je – nitko nije čuo. ( kiša)
Pogledajmo globus. Naš planet je dobio ime Zemlja zbog očitog nesporazuma: ¼ njegovog teritorija pada na kopno, a sve ostalo je voda. Bilo bi ispravno nazvati ga planetom Vodom! Na zemlji ima puno vode, ali u prirodi nema apsolutno čiste vode, ona je uvijek prisutna, neke nečistoće, neke od njih su poželjne, budući da je ljudskom tijelu potrebna. Drugi mogu biti opasni po zdravlje i učiniti vodu neupotrebljivom.
1. Voda je otapalo.
Nema tvari koje se, barem u maloj mjeri, ne otapaju u vodi. Čak se zlato, srebro, željezo, staklo otapaju u vodi u neznatnom stupnju. Znanstvenici su izračunali da, primjerice, kada popijemo čašu vrućeg čaja, s njom apsorbiramo oko 0,0001 g otopljenog stakla. Zbog sposobnosti vode da otapa druge tvari, nikada se ne može nazvati apsolutno čistom.
Demonstracija iskustva: voda kao otapalo.
Ulijte sol u čašu vode i promiješajte žlicom. Što se događa s kristalima soli? Postaju sve manji i uskoro potpuno nestaju. Ali je li sol nestala?
Ne. Otopljena je u vodi. Dobili smo otopinu soli.
Propustimo otopinu soli kroz filter. Ništa se nije slijeglo na filter. Otopina soli slobodno je prolazila kroz filter. Što se zove rješenje?
Riješenje - tekućina koja sadrži strane tvari koje su u njoj ravnomjerno raspoređene .
Demonstracija iskustva: iskustvo s glinom.
Napravimo isti pokus s glinom. Čestice gline plutaju u vodi. Propustimo vodu kroz filter. Voda je prošla kroz njega, a čestice gline su ostale na filteru.
Iz tog iskustva može se zaključiti da se glina ne otapa u vodi.
Koja je razlika između rezultata dvaju pokusa? ( voda s otopljenom soli je bistra, ali voda s glinom nije)
Doista, prirodna voda može sadržavati razne čestice koje se u njoj ne otapaju. Ove čestice ga čine mutnim. U ovom slučaju govore o suspenzije... Nakon što stoji neko vrijeme, zamućena tekućina postaje prozirna. Netopljive čestice tvari tonu na dno. A u otopinama, koliko god da stoje, tvari se ne talože na dno.
Ljudi su odavno primijetili da se voda izlivena u srebrne posude ne kvari dugo vremena. Činjenica je da sadrži otopljeno srebro, koje štetno djeluje na bakterije u vodi. "Srebrnu" vodu koriste astronauti tijekom svojih letova.
Kako možete napraviti srebrnu vodu kod kuće?
U vodi se ne otapaju samo krute i tekuće tvari, već i plinovi: kisik, dušik, ugljični dioksid.
Ribe, biljke i životinje udišu kisik otopljen u vodi.
Dobivanje gazirane vode temelji se na otapanju ugljičnog dioksida u vodi.
Tjelesni odgoj "Voda nije voda"
Igra svjesnosti. imenujem riječi. Ako navedena riječ znači ono što sadrži vodu (oblak), onda bi djeca trebala ustati. Ako je predmet ili pojava neizravno povezana s vodom (brodom), djeca podižu ruku. Ako se zove predmet ili pojava koja nema veze s vodom (vjetrom), djeca plješću rukama.
Lokva, čamac, kiša, pijesak, vodopad, kamen, ronilac, snijeg, drvo, plaža, tuljan, auto, oblak.
2. Rad vode u prirodi.
Mnoge pojave na Zemljinoj površini uključuju vodu.
Dakle, potoci otopljene vode, sjedinjujući se, postaju strašni potoci i mogu donijeti veliko uništenje. Tako nastaju jaruge ( demonstracija "bas-reljefa", "formiranja jaruge").
Voda ispire gornji sloj plodnog tla.
Pod utjecajem vode stijene se polako uništavaju ( priča prema tablici "Weathering".). U narodu postoji poslovica „Voda nosi kamen“.
Dok prodire u zemlju, voda erodira i otapa razne stijene. Tako nastaju praznine ispod zemlje - špilje ( stol "Špilje").
Poznate su strašne prirodne katastrofe poput poplava i tsunamija.
Tijekom poplava i tsunamija voda uništava mostove, razara obale i zgrade, uništava usjeve kultiviranih biljaka i oduzima ljudske živote.
Studentska poruka "Poplave".
Poplava je poplava područja, naselja, industrijskih i poljoprivrednih objekata, uz nanošenje štete. Poplave dovode do uništavanja gospodarskih objekata, odumiranja usjeva, šuma i prisilne evakuacije stanovništva iz poplavnog područja. Poplave, koje dovode ne samo do razaranja, već i do ljudskih žrtava, nazivaju se katastrofalan.
Mogu ih uzrokovati jaki pljuskovi, prijateljsko otapanje snijega nakon snježne zime.
Studentska poruka "Tsunami"
Tsunami je rijedak, ali vrlo strašan prirodni fenomen. Riječ "tsunami" na japanskom znači "veliki val koji preplavljuje zaljev". Ti valovi mogu biti beznačajni, pa čak i neprimjetni, ali mogu biti i katastrofalni. Razorne tsunamije uzrokuju uglavnom snažni podvodni potresi na velikim dubinama mora i oceana, kao i podvodne vulkanske erupcije. Istodobno, milijarde tona vode se pokreću u kratkim vremenskim razdobljima. Pojavljuju se niski valovi koji putuju duž površine oceana brzinom mlaznog aviona - 700-800 kilometara na sat.
Na otvorenom oceanu čak i najstrašniji tsunamiji uopće nisu opasni. Tragedije se odigravaju kada se valovi tsunamija približavaju obalnom području plitkih voda. Na obali valovi dosežu 10-15 metara i više.
Posljedice tsunamija mogu biti katastrofalne: uzrokuju ogromna razaranja, oduzimajući stotine tisuća ljudskih života.
Najveći broj tsunamija nastaje na obali Pacifika (otprilike jednom godišnje).
Učitelj, nastavnik, profesor: kakav rad obavlja voda u svim ovim primjerima?
(destruktivno)
Ali voda čini više od samo destruktivnog rada. Tijekom proljetnih poplava riječna voda donosi plodni mulj u neka područja kopna. Na njima se vrlo dobro razvija vegetacija.
Niti jedan proces u živim organizmima ne odvija se bez sudjelovanja vode. Biljke ga trebaju da apsorbiraju tvari iz tla, pomiču ih duž stabljike, lišća, u obliku otopina, za klijanje sjemena.
Sve živo i neživo: bilo koje tlo, stijene, svi predmeti, tijela, organizmi - sastoje se od vode.
Na primjer, u ljudskom tijelu voda čini 60 - 80% ukupne mase.
Voda igra važnu ulogu u životu ljudskog društva. Čovjek je akumulacije pretvorio u transportne rute, riječne tokove - izvor jeftine električne energije.
Voda je stanište mnogih živih organizama koji se ne mogu naći na kopnu (f Fragment videa filma "Stanovnici mora i oceana")
Vodni resursi su nacionalno bogatstvo naše zemlje, koje zahtijeva pažljivo postupanje: strogo računovodstvo, zaštitu od onečišćenja, ekonomično korištenje.
Učiteljica: A koristimo li uvijek vodu štedljivo?
Zapamtite osobu zauvijek:
Simbol života na zemlji je voda!
Sačuvaj i čuvaj se -
Nismo sami na planeti!
III... Sidrenje
1. Pitanja:
a) Kako se zovu sva mora i oceani zajedno ( svjetski ocean)
b) Ne more, ne kopno - brodovi ne plutaju i ne možeš hodati ( Močvara)
b) Svuda okolo voda i piće - nevolje ( more)
d) Pogodite o kojoj je tvari riječ: Ova tvar je vrlo česta u prirodi, ali se praktički ne pojavljuje u svom čistom obliku. Život je nemoguć bez ove supstance. Kod starih naroda smatran je simbolom besmrtnosti i plodnosti. Općenito, to je najneobičnija tekućina na svijetu. Što je? ( voda).
2. Igra "Prekriži nepotrebno" (kartice sa zadatkom na stolovima učenika)
Zadatak: izbrisati suvišnu riječ i objasniti zašto?
a) Snijeg, led, para, tuča.
b) Kiša, pahulja, more, rijeka.
c) Tuča, vodena para, snijeg, kiša.
3. A sada sljedeći zadatak. Popunite praznine u tekstu:
Voda ... otapalo. U njemu se otapaju krute tvari.
Na primjer ...: tekuće tvari, na primjer ... plinovite tvari,
na primjer…
S tim u vezi, nemoguće je pronaći u prirodi ... vodu.
4. Igra "Suvišna imovina"
Zadatak: Prekriži svojstvo koje se ne odnosi na vodu.
Nekretnina:
a) Ima boju, nema boju.
b) Okus, bez okusa.
c) Ima miris, nema miris.
d) Neproziran, proziran.
e) Posjeduje fluidnost, ne posjeduje tečnost.
f) Brzo se zagrijava i brzo se hladi, polako zagrijava i polako se hladi.
g) Otapa pijesak i kredu, otapa sol i šećer.
h) Ima oblik, nema oblik.
Na pozadini glazbe
Učitelj, nastavnik, profesor:
Voda je divan prirodni dar,
Živ, fluidan i slobodan
On slika slike našeg života.
U svoja tri važna obličja.
Sad vijuga kao potok, pa kao rijeka,
To se izlijeva iz stakla na tlo.
Smrzne se u tanak komad leda,
Snježna pahulja lijepog imena.
Poprimi lakoću pare:
Bila - i odjednom je nestala.
Veliki radnik vodica,
Pa kako joj se ne bi divila.
Ona plovi prema nama u oblacima
Hrani se snijegom i kišom
I uništava i nanosi
I zato traži našu brigu.
IV... Domaća zadaća§ 23, zadatak 77 radna bilježnica. str. 45
Energija stvaranja molekula vode je visoka, iznosi 242 kJ / mol. To objašnjava stabilnost vode u prirodnim uvjetima. Stabilnost, u kombinaciji s električnim karakteristikama i molekularnom strukturom, čini vodu gotovo univerzalnim otapalom za mnoge tvari. Visoka dielektrična konstanta određuje najveću moć otapanja vode u odnosu na tvari čije su molekule polarne. Od anorganskih tvari vrlo je mnogo soli, kiselina i baza topljivo u vodi. Od organskih tvari topive su samo one u čijim molekulama polarne skupine čine značajan dio - mnogi alkoholi, amini, organske kiseline, šećeri itd.
Otapanje tvari u vodi popraćeno je stvaranjem slabih veza između njihovih molekula ili iona i molekula vode. Taj se fenomen naziva hidratacija. Za tvari s ionskom strukturom karakteristično je stvaranje hidratacijskih ljuski oko kationa zbog veze donor-akceptor s usamljenim parom elektrona atoma kisika. Što je njihov polumjer manji i što je veći naboj, to su kationi hidratiziraniji. Anioni, obično manje hidratizirani od kationa, vežu molekule vodika na molekule vode.
U procesu otapanja tvari mijenja se veličina električnog momenta dipola molekula vode, mijenja se njihova prostorna orijentacija, neke vodikove veze se kidaju i stvaraju druge vodikove veze. Zajedno, ove pojave dovode do restrukturiranja unutarnje strukture.
Topljivost krutih tvari u vodi ovisi o prirodi tih tvari i temperaturi i uvelike varira. Povećanje temperature u većini slučajeva povećava topljivost soli. Međutim, topljivost takvih spojeva kao što su CaSO 4 2H 2 O, Ca (OH) 2 opada s povećanjem temperature.
Uz međusobno otapanje tekućina, od kojih je jedna voda, mogući su različiti slučajevi. Na primjer, alkohol i voda se međusobno miješaju u bilo kojem omjeru, budući da su oba polarna. Benzin (nepolarna tekućina) je praktički netopiv u vodi. Najčešći je slučaj ograničene međusobne topljivosti. Primjer je sustav voda – eter i voda – fenol. Zagrijavanjem se međusobna topljivost za neke tekućine povećava, za druge opada. Na primjer, za sustav voda – fenol, povećanje temperature iznad 68 ° C dovodi do neograničene međusobne topljivosti.
Plinovi (na primjer, NH 3, CO 2, SO 2) su lako topljivi u vodi, u pravilu kada stupe u kemijsku interakciju s vodom; obično je topljivost plinova niska. Kako temperatura raste, topljivost plinova u vodi se smanjuje.
Treba napomenuti da je topljivost kisika u vodi gotovo 2 puta veća od topljivosti dušika. Kao rezultat toga, sastav zraka otopljenog u vodi rezervoara ili postrojenja za pročišćavanje razlikuje se od atmosferskog. Otopljeni zrak obogaćen je kisikom, što je vrlo važno za organizme koji žive u vodenom okolišu.
Za vodene otopine, kao i za bilo koje druge, karakteristično je smanjenje točke smrzavanja i povećanje točke vrelišta. Jedno od općih svojstava otopina očituje se u fenomenu osmoze. Ako su dvije otopine različitih koncentracija razdvojene polupropusnom pregradom, kroz nju prodiru molekule otapala iz razrijeđene otopine u koncentriranu. Mehanizam osmoze može se razumjeti ako se uzme u obzir da, prema općem prirodnom principu, svi molekularni sustavi teže stanju najjednolinije raspodjele (u slučaju dva rješenja - želja za izjednačavanjem koncentracija s obje strane particije).
Najčešći otapalo na našem planetu je voda. Tijelo prosječne osobe težine 70 kg sadrži oko 40 kg vode. U tom slučaju na tekućinu unutar stanica otpada oko 25 kg vode, a 15 kg je izvanstanična tekućina koja uključuje krvnu plazmu, međustaničnu tekućinu, likvor, intraokularnu tekućinu i tekući sadržaj gastrointestinalnog trakta. U životinjama i biljkama voda je obično više od 50%, au nekim slučajevima sadržaj vode doseže 90-95%.
Zbog svojih anomalnih svojstava, voda je jedinstveno otapalo, savršeno prilagođeno životu.
Prije svega, voda dobro otapa ionske i mnoge polarne spojeve. Ovo svojstvo vode u velikoj je mjeri povezano s njenom visokom dielektričnom konstantom (78,5).
Druga brojna klasa tvari koje su dobro topljive u vodi uključuje polarne organske spojeve kao što su šećeri, aldehidi, ketoni, alkoholi. Njihova topljivost u vodi objašnjava se težnjom molekula vode da stvaraju polarne veze s polarnim funkcionalnim skupinama tih tvari, na primjer, s hidroksilnim skupinama alkohola i šećera ili s atomom kisika karbonilne skupine aldehida i ketona. Ispod su primjeri vodikovih veza koje su važne za topljivost tvari u biološkim sustavima. Zbog visokog polariteta vode izaziva hidrolizu tvari.
Budući da je voda glavni dio unutarnjeg okoliša tijela, ona osigurava procese apsorpcije, kretanja hranjivih tvari i metaboličkih proizvoda u tijelu.
Treba napomenuti da je voda krajnji proizvod biološke oksidacije tvari, posebice glukoze. Formiranje vode kao rezultat ovih procesa popraćeno je oslobađanjem velike količine energije - otprilike 29 kJ / mol.
Važna su i druga anomalna svojstva vode: visoka površinska napetost, niska viskoznost, visoke točke taljenja i vrelišta te veća gustoća u tekućem stanju nego u čvrstom stanju.
Vodu karakterizira prisutnost asociata – skupina molekula povezanih vodikovim vezama.
Ovisno o afinitetu prema vodi, funkcionalne skupine otopljenih čestica dijele se na hidrofilne (privlače vodu), koje se lako otapaju vodom, hidrofobne (odbijaju vodu) i difilne.
Hidrofilne skupine uključuju polarne funkcionalne skupine: hidroksil -OH, amino -NH 2, tiol -SH, karboksil -COOH. Za hidrofobne - nepolarne skupine, kao što su ugljikovodični radikali: CH3-(CH 2) p -, C 6 H 5 -. Tvari (aminokiseline, proteini) čije molekule sadrže i hidrofilne skupine (-OH, -NH2, -SH, -COOH) i hidrofobne skupine: (CH 3 - (CH 2) p, - C6H5-).
Kada se amfifilne tvari otapaju, struktura vode se mijenja kao rezultat interakcije s hidrofobnim skupinama. Povećava se stupanj uređenosti molekula vode blizu hidrofobnih skupina, a kontakt molekula vode s hidrofobnim skupinama svodi se na minimum. Kada se hidrofobne skupine udruže, one potiskuju molekule vode iz svog područja.
Metode pročišćavanja vode- načini odvajanja vode od neželjenih nečistoća i elemenata. Postoji nekoliko metoda čišćenja i svi se svrstavaju u tri skupine metoda:
Mehanički
Fizikalno-kemijski
Biološki
Najjeftinije - mehaničko čišćenje - koristi se za oslobađanje suspendiranih tvari. Glavne metode su cijeđenje, taloženje i filtriranje. Primjenjuju se kao preliminarni koraci.
Kemijska obrada koristi se za odvajanje topljivih anorganskih nečistoća iz otpadne vode. Kada se otpadna voda tretira reagensima, ona se neutralizira, oslobađaju se otopljeni spojevi, a efluent se mijenja boja i dezinficira.
Fizikalno-kemijska obrada koristi se za pročišćavanje otpadnih voda od grubih i fino dispergiranih čestica, koloidnih nečistoća i otopljenih spojeva. Visokoučinkovita, ali u isto vrijeme i skupa metoda čišćenja.
Za uklanjanje otopljenih organskih spojeva koriste se biološke metode. Metoda se temelji na sposobnosti mikroorganizama da razgrađuju otopljene organske spojeve.
Trenutno je od ukupne količine otpadnih voda 68% svih otpadnih voda podvrgnuto mehaničkom tretmanu, fizičko-kemijskom - 3%, biološkom - 29%. U budućnosti se planira povećanje udjela biološke obrade na 80%, čime će se poboljšati kvaliteta pročišćene vode.
Glavna metoda poboljšanja kvalitete obrade štetnih emisija od strane poduzeća u tržišnom gospodarstvu je sustav kazni, kao i sustav naknada za korištenje uređaja za pročišćavanje.
Halogeni(od grčkog ἁλός - sol i γένος - rođenje, porijeklo; ponekad se koristi zastarjeli naziv halogenidi) - kemijski elementi 17. skupine periodnog sustava kemijskih elemenata D.I.Mendelejeva (prema zastarjeloj klasifikaciji - elementi glavne podskupine VII skupine).
Reagira s gotovo svim jednostavnim tvarima, osim s nekim nemetalima. Svi halogeni su energetski oksidanti, stoga se u prirodi nalaze samo u obliku spojeva. S povećanjem serijskog broja, kemijska aktivnost halogena opada, kemijska aktivnost halogenih iona F -, Cl -, Br -, I -, At - opada.
Halogeni uključuju fluor F, klor Cl, brom Br, jod I, astatin At, a također (formalno) umjetni element ununseptium Uus.
Svi halogeni su nemetali. Na vanjskoj energetskoj razini, 7 elektrona su jaki oksidansi. Kod interakcije s metalima nastaje ionska veza i nastaju soli. Halogeni (osim F), kada su u interakciji s više elektronegativnih elemenata, također mogu pokazati redukcijska svojstva do najvišeg oksidacijskog stanja od +7.
Značajke kemije fluora
najelektronegativniji element u periodnom sustavu, sve gori u atmosferi fluora, čak i kisik!
S Slobodni fluor je zelenkasto-žuti plin karakterističnog oštrog i neugodnog mirisa. Gustoća u zraku je 1,13, vrelište -187 °C, a talište -219 °C. Relativna atomska masa fluora je 19. U svim svojim spojevima fluor je jednovalentan. Atomi fluora spajaju se u dvoatomske molekule.
Fluor tvori spojeve, izravno ili neizravno, sa svim ostalim elementima, uključujući neke inertne plinove.
Fluor se spaja s vodikom čak i na –252 ° C. Na toj temperaturi vodik se pretvara u tekućinu, a fluor se skrutne, a reakcija se ipak odvija s tako jakim oslobađanjem topline da dolazi do eksplozije. Dugo vremena nije bio poznat spoj fluora s kisikom, ali su 1927. francuski kemičari uspjeli dobiti kisikov difluorid, koji nastaje djelovanjem fluora na slabu alkalnu otopinu:
2F 2 + 2NaON = 2NaF + OF 2 + H 2 O.
Fluor se ne spaja izravno s dušikom, ali je poznati stručnjak za fluor Otto Ruff uspio 1928. neizravno dobiti dušikov trifluorid NF 3. Poznati su i drugi spojevi fluora koji sadrže dušik. Sumpor se pod svojim djelovanjem zapali kada je izložen zraku. Ugljen se pali u atmosferi fluora na sobnoj temperaturi.
Najjednostavnije sredstvo za gašenje požara - voda - gori u mlazu fluora s laganim ljubičastim plamenom.
Svi metali, pod određenim uvjetima, stupaju u interakciju s fluorom. Alkalijski metali se pale u njegovoj atmosferi već na sobnoj temperaturi. Srebro i zlato na hladnom vrlo sporo stupaju u interakciju s fluorom, a kada se zagrije, u njemu izgaraju. Platina ne reagira s fluorom u normalnim uvjetima, ali izgara kada se zagrije na 500-600 ° C.
Iz spojeva drugih halogena s metalima, fluor istiskuje slobodne halogene, zauzimajući njihovo mjesto. Kisik se također lako istiskuje fluorom iz većine kisikovih spojeva. Tako, na primjer, fluor razgrađuje vodu oslobađanjem kisika (s primjesom ozona):
H2O + F2 = 2HF + O.
Kombinirajući se s vodikom, fluor tvori plinoviti spoj - fluorovodik HF. Vodene otopine fluorovodika nazivaju se fluorovodičnom kiselinom. Plinoviti HF je bezbojni plin oštrog mirisa, koji je vrlo štetan za dišne organe i sluznice. Uobičajena metoda za njegovu proizvodnju je djelovanje sumporne kiseline na fluorit CaF 2:
CaF 2 + H 2 SO 4 = CaSO 4 + 2HF.
Molekule vodikovog fluorida karakterizira sposobnost njihovog povezivanja (vezivanja). Na temperaturi od oko 90 °C dobiva se jednostavna HF molekula s relativnom molekulskom težinom od 20, ali kada se temperatura spusti na 32 °C, mjerenja dovode do dvostruke formule H 2 F 2. Pri vrelištu fluorovodika jednakoj 19,4 ° C, pojavljuju se suradnici H 3 F 3 i H 4 F 4. Na nižim temperaturama sastav suradnika fluorovodika je još složeniji.
Fluorovodonična kiselina djeluje na sve metale osim zlata i platine. Fluorovodonična kiselina djeluje vrlo sporo na bakar i srebro. Njegova slaba rješenja nemaju apsolutno nikakav učinak na kositar, bakar i broncu.
Otporan na fluorovodičnu kiselinu i olovo, koje je prekriveno slojem olovnog fluorida, koji štiti metal od daljnjeg uništavanja. Stoga olovo služi i kao materijal za opremu u proizvodnji fluorovodične kiseline.
Sklonost molekula HF povezivanju dovodi do toga da su, osim prosječnih soli fluorovodične kiseline, poznate i kisele, na primjer, KHF 2 (fluor se dobiva iz njega elektrolizom). To je njegova razlika od ostalih halogenovodičnih kiselina, koje daju samo prosječne soli.
Karakteristična karakteristika fluorovodične kiseline, koja je razlikuje od svih ostalih kiselina, je njen izuzetno lagani učinak na silicij SiO 2 i soli silicijeve kiseline:
SiO 2 + 4HF = SiF 4 + 2H 2 O.
Silicij tetrafluorid SiF 4 je plin koji izlazi tijekom reakcije.
Djelujući na silicij koji je dio stakla, fluorovodična kiselina korodira staklo, stoga se ne može skladištiti u staklenim posudama.
Od organskih tvari, fluorovodična kiselina djeluje na papir, drvo, pluto i pougljuje ih. Slabo djeluje na plastiku, uopće ne djeluje na parafin, koji se koristi pri skladištenju fluorovodične kiseline u posudama napravljenim od ovog materijala.
F torus je dosta čest u prirodi. Njegov postotak u zemljinoj kori je blizak sadržaju elemenata kao što su dušik, sumpor, krom, mangan i fosfor. Međutim, samo su dva minerala fluora od industrijske važnosti – fluorit i kriolit. Osim toga, fluor je u relativno maloj količini uključen u sastav apatita. Kada se prirodni fosfati prerađuju u umjetna gnojiva, kao nusproizvodi dobivaju se spojevi fluora.
Fluorspar, inače zvan fluorit, ili fluorit, u svom je sastavu kalcijev fluorid CaF 2. U prirodi se fluorit može pojaviti kako u obliku pojedinačnih kristala, tako iu kontinuiranim masama. Geolozi objašnjavaju nastanak naslaga fluorita na sljedeći način. Kada se nekada tekuća masa zemljine kore ohladila, unutar nje su nastale pukotine i praznine. Kada su otopine ili vulkanski plinovi koji sadrže fluor prodrli u takve šupljine koje su nastale unutar stijena koje sadrže kalcij, došlo je do interakcije između kalcija u stijeni i fluora otopine ili plina. Kao rezultat ove interakcije, praznine su ispunjene masom kalcijevog fluorida. Ovo je porijeklo fluorita.
Raznolikost boja fluorita je izvanredna: može biti potpuno bezbojna (prozirna), bijela, ružičasta, plava, zelena, crvena, ljubičasta. Najčešće boje su zelena i ljubičasta.
Moćne naslage fluorita nalaze se u američkim državama Illinois, Kentucky, Colorado.
Elementarni fluor do sada je našao svoju jedinu široku primjenu: u dezinfekciji pitke vode. Ali za razliku od njegovog analoga klora, koji služi istoj svrsi izravno, fluor se ovdje koristi neizravno. Djelovanjem fluora na vodu nastaje ozon koji se koristi za sterilizaciju pitke vode.
Inače, fluor u naše tijelo ulazi s pitkom vodom. S nedostatkom fluora smanjuje se otpor zubne cakline na kiseline sadržane u hrani.
Mnoge fluorirane tvari vrlo su važne za suvremenu znanost i tehnologiju. Od velike važnosti su spojevi fluora s ugljikom, koji se nazivaju fluorougljikovodici. Ne javljaju se u prirodi i dobivaju se isključivo umjetno. Fluorugljikovodici imaju niz vrijednih svojstava: ne izgaraju, ne korodiraju, ne trunu itd. Mogućnosti njihove praktične primjene stalno se šire. Primjerice, fluoroklor derivati najjednostavnijih ugljikovodika (CH 4 i dr.) - tzv. freoni -Široko se koriste kao rashladna sredstva u rashladnim jedinicama na brodovima, željezničkim vagonima, kućnim hladnjacima itd.
Molekularni klor i njegovi glavni spojevi
Voda je najzastupljenija tvar na Zemlji, pokriva oko četiri petine zemljine površine. To je jedini kemijski spoj koji prirodno postoji u obliku tekućine, krutine (led) i plina (vodena para). Voda igra vitalnu ulogu u industriji, svakodnevnom životu i u laboratorijskoj praksi; apsolutno je bitno održati život. Oko dvije trećine ljudskog tijela je voda, a mnoge namirnice su pretežno voda.
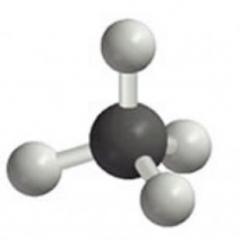
Struktura i fizikalna svojstva vode. V Talijanski kemičar Stanislav Cannizzaro iz 1860-ih, istražujući organske spojeve koji sadrže -OH grupe, koje je on nazvao hidroksil, konačno je utvrđeno da voda ima formulu H 2 0.
Voda je kovalentni molekularni spoj. Komunikacija O-N kovalentno polarni; kut - 104,5 °. Kisik, kao elektronegativniji atom (elektronegativnost je sposobnost da privuče ukupnu gustoću elektrona na sebe tijekom stvaranja veze) povlači za sebe elektronsku gustoću zajedničku s atomom vodika i stoga nosi djelomični negativni naboj; atomi vodika s kojih je pomaknuta elektronska gustoća nose djelomično pozitivan naboj. Dakle, molekula vode je dipol, oni. ima pozitivno i negativno nabijena područja. Voda je bistra, bezbojna tekućina s brojnim anomalnim fizičkim svojstvima. Na primjer, ima nenormalno visoke točke smrzavanja i vrelišta te površinsku napetost. Rijetka karakteristika vode je da je njezina gustoća u tekućem stanju na 4 °C veća od gustoće leda. Stoga led pluta na površini vode. Ova anomalna svojstva vode objašnjavaju se postojanjem vodikovih veza u njoj, koje međusobno vežu molekule u tekućem i čvrstom stanju. Voda ne provodi dobro električnu struju, ali postaje dobar vodič ako se u njoj otopi i male količine ionskih tvari.
Kemijska svojstva vode
1... Kiselo-bazne reakcije. Voda posjeduje amfoterna Svojstva. To znači da može djelovati i kao kiselina i kao baza. Njegova amfoterna svojstva su posljedica sposobnosti vode da se samoionizira:
To omogućuje vodi da s jedne strane bude akceptor protona, a s druge strane donor protona:
2. Redox reakcije. Voda ima sposobnost da djeluje kao oksidacijsko sredstvo, i u ulozi reduktor. Oksidira metale koji se nalaze u elektrokemijskom nizu napona iznad kositra. Na primjer, u reakciji između natrija i vode
dolazi do sljedećeg oksidativnog procesa:
U ovoj reakciji voda igra ulogu redukcijskog sredstva:
Drugi primjer slične reakcije je interakcija između magnezija i vodene pare:
Voda djeluje kao oksidant u procesima korozije. Na primjer, jedan od procesa koji se javljaju tijekom hrđanja željeza je sljedeći: 
Voda je važan redukcijski agens u biokemijskim procesima. Na primjer, neki od koraka u ciklusu limunske kiseline uključuju obnavljanje vode:
Ovaj proces prijenosa elektrona također je od velike važnosti u redukciji organskih fosfatnih spojeva tijekom fotosinteze. Ciklus limunske kiseline i fotosinteza složeni su procesi koji uključuju niz uzastopnih kemijskih reakcija. U oba slučaja procesi prijenosa elektrona koji se odvijaju u njima još nisu u potpunosti shvaćeni.
- 3.Hidratacija. Molekule vode sposobne su otopiti i katione i anione. Ovaj proces se zove hidratacija. Hidratizirana voda u kristalima soli naziva se voda kristalizacije. Molekule vode obično su povezane s kationom koji solvatiraju koordinacijskim vezama. Navedite sadržaj hidratizirane vode u formuli tvari: CuS0 4 4H 2 0.
- 4. Hidroliza. Hidroliza je reakcija iona ili molekule s vodom. Primjer ove vrste reakcije je reakcija između klorovodika i vode da nastane klorovodična kiselina. Drugi primjer je hidroliza željezovog (III) klorida:
5. Interakcija s aktivnim metalnim oksidima: CaO + H 2 0 =
6. Interakcija s nemetalnim oksidima: R 2 0 5 + N 2 0 = 2NR0 3.
Voda se široko koristi kao otapalo u kemiji
tehnologiji, kao i u laboratorijskoj praksi. To je univerzalno otapalo potrebno za biokemijske reakcije. Činjenica je da voda savršeno otapa ionske spojeve, kao i mnoge kovalentne spojeve. Sposobnost vode da dobro otapa mnoge tvari posljedica je polariteta njezinih molekula, koje su, kad se ionske tvari otapaju u vodi, orijentirane oko iona, t.j. solvati ih. Vodene otopine ionskih tvari su elektroliti. Topljivost kovalentnih spojeva u vodi ovisi o njihovoj sposobnosti stvaranja vodikovih veza s molekulama vode. Jednostavni kovalentni spojevi kao što su sumporov dioksid, amonijak i klorovodik otapaju se u vodi. Kisik, dušik i ugljični dioksid slabo su topljivi u vodi. Mnogi organski spojevi koji sadrže atome elektronegativnih elemenata, kao što su kisik ili dušik, topljivi su u vodi. Kao primjer navedimo etanol C 2 H 5 OH, octenu kiselinu CH3COOH, šećer Ci 2 H 22 0 6. Prisutnost nehlapljivih otopljenih tvari u vodi, poput natrijevog klorida ili šećera, snižava tlak pare i točku smrzavanja vode, ali povećava njezino vrelište. Prisutnost topivih kalcijevih i magnezijevih soli u vodi (tvrdoća vode) otežava je korištenje u tehnološkim procesima.
Krutost voda se dijeli na privremeni (karbonat, zbog prisutnosti kalcijevih bikarbonata Ca (HC0 3) 2
i magnezij Mg (HCO3) 2) i trajno (nekarbonatno) krutost. Prema GOST R 52029-2003, tvrdoća se izražava u stupnjevima tvrdoće (°F), što odgovara koncentraciji zemnoalkalijskog elementa, brojčano jednakoj "/ 2 njegovog mola, izraženo u mg / dm 3 (g / m 3). Ukupna tvrdoća se razlikuje po vodi mekana(do 2 mg-eq/l), srednje tvrdoće(2-10 mEq/l) i tvrd(više od 10 mEq / l).
Tvrdoća vode površinskih izvora značajno varira tijekom cijele godine; maksimalna je na kraju zime, minimalna - tijekom poplava (na primjer, tvrdoća vode Volge u ožujku je 4,3 meq / l, u svibnju - 0,5 meq / l). U podzemnim vodama tvrdoća je obično veća (do 80-100 meq/l) i manje se mijenja tijekom godine.
Topljivost plinova u vodi ovisi o temperaturi i parcijalnom tlaku plina iznad vode: što je temperatura niža i što je veći parcijalni tlak plina iznad vode, to je veća koncentracija plina u tekućini.
Topljivost većine čvrstih tvari raste s porastom temperature. Kada se krutina otopi, javljaju se dva procesa:
- 1) proces razaranja kristalne rešetke. Ovaj proces zahtijeva potrošnju energije, stoga jest endotermički "
- 2) proces stvaranja hidrata (solvata) teče oslobađanjem energije.
Ukupna toplina otapanja je zbroj toplina ova dva procesa, pa se otapanje može odvijati i s porastom i s padom temperature.
Riješenje naziva se homogenim (homogenim) sustavom koji se sastoji od dvije ili više komponenti. Potrebne komponente otopine su otapalo i otopljena tvar kao što je šećer otopljen u vodi. Jedno otapalo može sadržavati nekoliko otopljenih tvari. Na primjer, kada se priprema marinada, šećer, sol i octena kiselina se otapaju u vodi. Otopljene tvari s istim agregatnim stanjem komponenti obično se razmatraju komponente koje su u manjku, dok se komponenta u višku smatra otapalo. U različitim agregacijskim stanjima komponenti otopine, komponenta se obično smatra otapalom, čije se agregacijsko stanje podudara sa stanjem agregacije otopine. Na primjer, u slučaju tekućih otopina čvrstih i plinovitih tvari, otapalo se uvijek smatra tekućom komponentom, bez obzira na koncentraciju otopljenih tvari. Ako se za pripremu otopine koriste dvije tekućine, otapalo je ono u višku. Ako se za pripremu otopine koristi voda, otapalo je voda.
| 1. Struktura molekule vode. | ||
| Voda ima polarnu molekulu. Kisik, kao elektronegativniji atom, povlači na sebe elektronsku gustoću, koja je zajednička s atomom vodika, te stoga nosi djelomični negativni naboj; atomi vodika s kojih je pomaknuta elektronska gustoća nose djelomično pozitivan naboj. Dakle, molekula vode jedipol, tj. ima pozitivno i negativno nabijena područja. (Model s desne strane je trodimenzionalan, može se rotirati pritiskom lijeve tipke miša.) |
|
2. Vodikove veze.
3. Voda kao otapalo. |
alt = "(! LANG: Vaš preglednik razumije |
U odnosu na vodu, praktički se sve tvari mogu podijeliti u dvije skupine:
1. Hidrofilna(od grčkog "phileo" - voljeti, imaju pozitivan afinitet prema vodi
). Ove tvari imaju polarnu molekulu koja sadrži elektronegativne atome (kisik, dušik, fosfor itd.). Kao rezultat toga, pojedinačni atomi takvih molekula također dobivaju djelomične naboje i stvaraju vodikove veze s molekulama vode. primjeri: šećeri, aminokiseline, organske kiseline.
2. Hidrofobna(od grčkog "phobos" - strah, imaju negativan afinitet prema vodi
). Molekule takvih tvari su nepolarne i ne miješaju se s polarnim otapalom kao što je voda, ali su lako topljive u organskim otapalima, na primjer, u eteru i u mastima. Primjer je linearni i ciklički ugljikovodici... uklj. benzen.
|
2. pitanje. Pažljivo pogledajte dvije molekule s desne strane. Što mislite, koja je od ovih molekula hidrofilna, a koja hidrofobna? Zašto to misliš? Jeste li znali koje su to tvari? Među organskim tvarima postoje i spojevi čiji je jedan dio molekule nepolaran i pokazuje hidrofobna svojstva, a drugi je polaran i stoga hidrofilan. |
alt = "(! LANG: Vaš preglednik razumije |
alt = "(! LANG: Vaš preglednik razumije |
||
| Takve tvari se nazivaju amfipatski
. Molekula fosfotidilserin(jedan od fosfolipida plazma membrane stanica, desno) primjer je amfipatskih spojeva. 3. pitanje.
Pažljivo pogledajte ovu molekulu. Što mislite koji je dio hidrofilan, a koji hidrofoban? Rasporedite molekulu tako da bude što jasnija, napravite grafičku datoteku i označite hidrofilna i hidrofobna područja molekule u njoj. 4. Voda kao otapalo u živim organizmima.
|
alt = "(! LANG: Vaš preglednik razumije |
Osim toga, transportna funkcija unutarnjih tekućina kako kod višestaničnih životinja (krv, limfa, hemolimfa, celimska tekućina) tako i kod višestaničnih biljaka izravno je povezana sa svojstvom vode kao otapala.
5. Voda kao reagens.
Važnost vode povezana je i s njezinim kemijskim svojstvima – kao obične tvari koja ulazi u kemijske reakcije s drugim tvarima. Najvažnije su cijepanje vode pod djelovanjem svjetlosti ( fotoliza) u svjetlosnoj fazi fotosinteza, sudjelovanje vode kao potrebnog reagensa u reakcijama razgradnje složenih biopolimera (takve reakcije nisu slučajno nazvane reakcije hidrolize
). I, obrnuto, tijekom reakcija stvaranja biopolimera, polimerizacije, oslobađa se voda.
4. pitanje.
Koju bi netočnost u posljednjoj frazi kemičar ispravio?