Načelo metode tekućinske kromatografije. Tekuća kromatografija visokih performansi zagađivača prirodnih i otpadnih voda
Uvod
Poglavlje 1. Osnovni pojmovi i klasifikacija metoda tekućinske kromatografije
1.1 Aparat za tekućinsku kromatografiju
Poglavlje 2. Bit HPLC
2.1 Primjena
Poglavlje 3. Primjeri uporabe HPLC-a u analizi objekata okoliša
Poglavlje 4. Oprema za HPLC
Književnost
Primjena
Uvod
Kromatografske metodečesto su neophodni za identifikaciju i kvantificiranje organskih tvari slične strukture. Istodobno, za rutinsku analizu zagađivača okoliša najčešće se koriste plinska i tekućinska kromatografija visoke učinkovitosti. Plinska kromatografska analiza organskih onečišćujućih tvari u pitkim i otpadnim vodama prvo se temeljila na korištenju nabijenih kolona, kasnije su se raširile i kvarcne kapilarne kolone. Unutarnji promjer kapilarnih stupova je obično 0,20-0,75 mm, duljina 30-105 m. Optimalni rezultati u analizi kontaminanata u vodi postižu se najčešće kada se koriste kapilarne kolone različite debljine filma od metilfenilsilikona koji sadrže fenilne skupine 5 i 50%... Sustav za uvođenje uzorka često postaje ranjivost u kromatografskim tehnikama koje koriste kapilarne kolone. Sustavi za uvođenje uzoraka mogu se podijeliti u dvije skupine: univerzalni i selektivni. Svestrane primjene uključuju split i splitless sustave injektiranja, "hladno" injektiranje u koloni i temperaturno programirano isparavanje. Kod selektivnog ubrizgavanja koristi se puhanje s međuzahvatom, analiza prostora glave itd. Kod korištenja univerzalnih sustava za injektiranje cijeli uzorak se dovodi u kolonu, a kod selektivnog ubrizgavanja ubrizgava se samo određena frakcija. Rezultati dobiveni selektivnim ubrizgavanjem mnogo su točniji, budući da frakcija koja ulazi u kolonu sadrži samo hlapljive tvari, a tehnika se može potpuno automatizirati.
Plinski kromatografski detektori koji se koriste u praćenju onečišćujućih tvari često se dijele na univerzalne detektore koji reagiraju na svaku komponentu u mobilnoj fazi i selektivne detektore koji reagiraju na prisutnost određene skupine tvari sličnih kemijskih karakteristika u mobilnoj fazi. Među univerzalne spadaju plamena ionizacija, atomska emisija, spektrometrijski detektori mase i infracrvena spektrometrija. Selektivni detektori koji se koriste u analizi vode su hvatanje elektrona (selektivni prema tvarima koje sadrže atome halogena), termoionski (selektivni na spojeve koji sadrže dušik i fosfor), fotoionizacijski (selektivni na aromatične ugljikovodike), detektor elektrolitičke vodljivosti (selektivan na spojeve koji sadrže atome halogena , sumpor i dušik). Minimalne količine tvari koje se mogu detektirati su od nanograma do pikograma u sekundi.
Tekuća kromatografija visokog učinka(HPLC) je idealna metoda za određivanje velikog broja termički labilnih spojeva koji se ne mogu analizirati plinskom kromatografijom. Suvremene agrokemikalije, uključujući metil karbonate i organofosfatne insekticide, te druge nehlapljive tvari, često su predmet analize tekućinskom kromatografijom. Tekućinska kromatografija visoke učinkovitosti dobiva na popularnosti među ostalim metodama koje se koriste u praćenju okoliša, također i zbog toga što ima sjajne izglede u smislu automatizacije pripreme uzoraka.
POGLAVLJE 1. OSNOVNI POJMOVI I KLASIFIKACIJA METODA TEKUĆINE KROMATOGRAFIJE
Tekuća kromatografija dijeli se u nekoliko klasa ovisno o vrsti nosača stacionarne faze. Jednostavan hardverski dizajn papira i tankoslojne kromatografije doveo je do široke uporabe ovih metoda u analitičkoj praksi. Međutim, velike mogućnosti tekućinske kolonske kromatografije potaknule su poboljšanje opreme za ovu klasičnu metodu i dovele do brzog uvođenja HPLC. Propuštanje eluensa kroz kolonu pod visokim tlakom omogućilo je dramatično povećanje brzine analize i značajno povećanje učinkovitosti odvajanja zbog upotrebe fino dispergiranog sorbenta. HPLC metoda trenutno omogućuje izolaciju, kvantitativno i kvalitativno analiziranje složenih smjesa organskih spojeva.
Prema mehanizmu interakcije tvari koja se odvaja (eluira) sa stacionarnom fazom razlikuje se adsorpcijska, distribucijska, ionska izmjena, veličina isključenja, ionska parna, ligandna izmjenjivačka i afinitetna kromatografija.
Adsorpcijska kromatografija... Odvajanje adsorpcijskom kromatografijom provodi se kao rezultat interakcije tvari koja se odvaja s adsorbensom, kao što je aluminij ili silikagel, koji na površini imaju aktivna polarna središta. Otapalo (eluens) je nepolarna tekućina. Mehanizam sorpcije sastoji se u specifičnoj interakciji između polarne površine sorbenta i polarnih (ili sposobnih za polarizaciju) područja molekula analizirane komponente (slika 1.).
Riža. 1. Adsorpcijska tekućinska kromatografija.
Razdjelna kromatografija... U distribucijskoj varijanti tekućinske kromatografije, odvajanje smjese tvari provodi se zbog razlike u njihovim koeficijentima raspodjele između dviju faza koje se ne miješaju - eluensa (mobilna faza) i faze na sorbentu (stacionarna faza).
Na normalna faza U varijanti distribucijske tekućinske kromatografije koristi se nepolarni eluent i polarne skupine, cijepljene na površinu sorbenta (najčešće silika gel). Supstituirani alkilklorosilani koji sadrže polarne skupine, kao što su nitril, amino skupine, itd., koriste se kao modifikatori površine silika gela (cijepljene faze) (slika 2). Primjena cijepljenih faza omogućuje finu kontrolu sorpcijskih svojstava površine stacionarne faze i postizanje visoke učinkovitosti odvajanja.

Riža. 2. Razdjelna kromatografija s cijepljenom fazom (varijanta normalne faze).
Obrnuta faza tekućinska kromatografija temelji se na raspodjeli komponenti smjese između polarnog eluensa i nepolarnih skupina (dugi alkilni lanci) cijepljenih na površinu sorbenta (slika 3.).

Riža. 3. Cijepljena fazna particijska kromatografija (verzija s obrnutom fazom).
Manje korištena verzija tekućinske kromatografije s podržanim fazama je kada se tekuća stacionarna faza taloži na stacionarni nosač.
Ekskluzivno (probijajući gel) kromatografija je varijanta tekućinske kromatografije, u kojoj se razdvajanje tvari događa zbog raspodjele molekula između otapala u porama sorbenta i otapala koje teče između njegovih čestica.
Srodan kromatografija se temelji na specifičnim interakcijama odvojenih proteina (antitijela) s tvarima (antigenima) cijepljenim na površinu sorbenta (sintetička smola), selektivno tvoreći komplekse (konjugate) s proteinima.
Ionska izmjena, ionski par, kromatografija izmjene liganda koriste se uglavnom u anorganskoj analizi.
Osnovni parametri kromatografskog odvajanja.
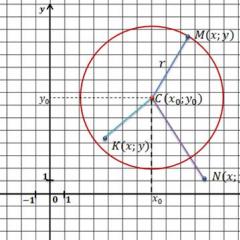
Glavni parametri kromatografskog odvajanja su retencijski volumen i vrijeme zadržavanja komponente smjese (slika 4.).
Vrijeme zadržavanja tR je vrijeme proteklo od trenutka ubrizgavanja uzorka u kolonu do pojave maksimuma odgovarajućeg vrha. Množenjem vremena zadržavanja s volumnom brzinom eluensa F, dobivamo retencijski volumen VR:
Ispravljeno vrijeme zadržavanja - vrijeme proteklo od trenutka pojave maksimalnog vrha nesorbirane komponente do vrha odgovarajućeg spoja:
tR "= tR - t0;
Smanjeni ili ispravljeni retencijski volumen je retencijski volumen ispravljen za mrtvi volumen kolone V0, tj. retencijski volumen nesorbirane komponente:
VR "= VR - V0;
Karakteristika zadržavanja je i koeficijent kapaciteta k", definiran kao omjer mase tvari u stacionarnoj fazi prema masi tvari u pokretnoj fazi: k" = mn / mp;
Vrijednost k" je lako odrediti iz kromatograma:

Najvažniji parametri kromatografskog odvajanja su njegova učinkovitost i selektivnost.
Učinkovitost kolone, mjerena visinom teoretskih ploča (HETT) i obrnuto proporcionalna njihovom broju (N), to je veća to je uži vrh tvari koja izlazi pri istom vremenu zadržavanja. Vrijednost učinkovitosti može se izračunati iz kromatograma pomoću sljedeće formule:
N = 5,54 . (tR / 1/2) 2 ,
gdje tR- vrijeme zadržavanja,
w 1/2 - širina vrha na pola visine
Poznavajući broj teoretskih ploča po stupcu, duljinu stupca L i prosječni promjer zrna sorbenta dc, lako je dobiti vrijednosti visine ekvivalentne teorijskoj ploči (HETT) i smanjene visine (PVETT):
VETT = L / N PVETT = VETT / d c
Ove karakteristike omogućuju usporedbu učinkovitosti različitih vrsta kolona, procjenu kvalitete sorbenta i kvalitete punjenja kolona.
Selektivnost razdvajanja dviju tvari određena je jednadžbom:
Kada se razmatra odvajanje mješavine dviju komponenti, važan parametar je i stupanj razdvajanja RS:
 ;
;
Vrhovi se smatraju dopuštenim ako je RS vrijednost veća ili jednaka 1,5.
Glavni kromatografski parametri povezani su sljedećom jednadžbom za razlučivanje:
 ;
;
Čimbenici koji određuju selektivnost odvajanja su:
1) kemijska priroda sorbenta;
2) sastav otapala i njegovih modifikatora;
3) kemijsku strukturu i svojstva sastojaka smjese koja se odvaja;
4) temperatura stupca
1.1 Aparat za tekućinsku kromatografiju
U suvremenoj tekućinskoj kromatografiji koriste se uređaji različitog stupnja složenosti - od najjednostavnijih sustava do kromatografa visoke klase opremljenih raznim dodatnim uređajima.
Na sl. 4. prikazan je blok dijagram tekućeg kromatografa koji sadrži minimalni potrebni skup komponenti, u ovom ili onom obliku, prisutnih u bilo kojem kromatografskom sustavu.

Riža. 4. Blok dijagram tekućeg kromatografa.
Crpka (2) je dizajnirana za stvaranje konstantnog protoka otapala. Njegov dizajn prvenstveno je određen radnim tlakom u sustavu. Za rad u rasponu od 10-500 MPa koriste se klip (štrcaljka) ili klipne pumpe. Nedostatak prvoga je potreba za periodičnim zaustavljanjem radi punjenja eluentom, a potonjeg velika složenost dizajna i kao posljedica toga visoka cijena. Za jednostavne sustave s niskim radnim tlakovima od 1-5 MPa uspješno se koriste jeftine peristaltičke pumpe, ali budući da je teško postići konstantan tlak i brzinu protoka, njihova je uporaba ograničena na pripremne zadatke.
Injektor (3) osigurava da se uzorak mješavine komponenti koje se odvajaju ubrizgavaju u kolonu s dovoljno visokom ponovljivošću. Jednostavni sustavi uzorkovanja zaustavljenim protokom zahtijevaju zaustavljanje pumpe i stoga su manje prikladni od dozatora s petljom Reodyne.
HPLC kolone (4) su cijevi od nehrđajućeg čelika debelih stijenki koje mogu izdržati visoki tlak. Važnu ulogu igra gustoća i ujednačenost pakiranja kolone sa sorbentom. Za niskotlačnu tekućinsku kromatografiju uspješno su korištene staklene kolone debelih stijenki. Postojanost temperature osigurava termostat (5).
Detektori (6) za tekućinsku kromatografiju imaju protočnu ćeliju u kojoj se kontinuirano mjeri neka svojstva tekućeg eluensa. Najpopularnije vrste detektora opće namjene su refraktometri, koji mjere indeks loma, i spektrofotometrijski detektori, koji mjere apsorbanciju otapala na fiksnoj valnoj duljini (obično u ultraljubičastom području). Prednosti refraktometara (i nedostaci spektrofotometara) uključuju nisku osjetljivost na vrstu spoja koji se utvrđuje, a koji možda ne sadrži kromoforne skupine. S druge strane, uporaba refraktometara ograničena je na izokratske sustave (s konstantnim sastavom eluensa), tako da u ovom slučaju nije moguća uporaba gradijenta otapala.
HPLC kolone, koje se najčešće koriste u analizi onečišćujućih tvari iz okoliša, duge su 25 cm i unutarnjeg promjera 4,6 mm, ispunjene su sfernim česticama silikagela veličine 5-10 µm s cijepljenim oktadecil skupinama. Posljednjih godina pojavljuju se stupovi s manjim unutarnjim promjerima, ispunjeni manjim česticama. Korištenje takvih stupaca dovodi do smanjenja potrošnje otapala i trajanja analize, povećanja osjetljivosti i učinkovitosti odvajanja, a također se olakšava problem povezivanja kolona sa spektralnim detektorima. Kolone s unutarnjim promjerom od 3,1 mm opremljene su sigurnosnom patronom (prekolumnom) kako bi se produžio vijek trajanja i poboljšala ponovljivost analiza.
Kao detektori u modernim HPLC instrumentima obično se koriste UV detektor na diodnoj matrici, fluorescencija i elektrokemijski.
Treba imati na umu da se u praktičnom radu razdvajanje često odvija ne jedan po jedan, već kroz nekoliko mehanizama istovremeno. Dakle, odvajanje isključenja je komplicirano adsorpcijskim učincima, adsorptivno - distribucijom i obrnuto. Štoviše, što je veća razlika između tvari u uzorku u smislu stupnja ionizacije, bazičnosti ili kiselosti, molekularne mase, polarizabilnosti i drugih parametara, veća je vjerojatnost različitog mehanizma razdvajanja za takve tvari.
U praksi je najraširenija kromatografija "obrnute faze" (distribucijska) u kojoj stacionarna faza nije polarna, već je mobilna faza polarna (odnosno obrnuta kromatografiji "direktne faze").
U većini laboratorija u svijetu HPLC ili CMS analizira skupinu od 16 prioritetnih PAH-a.
POGLAVLJE 2. BIT HPLC
U tekućinskoj kromatografiji visoke učinkovitosti (HPLC), priroda procesa koji se odvijaju u kromatografskoj koloni općenito je identična procesima u plinskoj kromatografiji. Jedina razlika je korištenje tekućine kao stacionarne faze. Zbog velike gustoće tekućih mobilnih faza i velike otpornosti na stupac, plinska i tekućinska kromatografija uvelike se razlikuju po svom hardverskom dizajnu.
U HPLC, čista otapala ili njihove smjese se obično koriste kao mobilne faze.
Za stvaranje struje čistog otapala (ili mješavine otapala), koji se u tekućinskoj kromatografiji naziva eluent, pumpe se koriste u hidrauličkom sustavu kromatografa.
Adsorpcijska kromatografija provodi se kao rezultat interakcije tvari s adsorbensima, kao što su silikagel ili aluminij, koji imaju aktivna središta na površini. Razlika u sposobnosti interakcije s adsorpcijskim centrima različitih molekula uzorka dovodi do njihove podjele na zone tijekom kretanja s mobilnom fazom duž stupca. Odvajanje zona komponenti koje se postiže u ovom slučaju ovisi o interakciji i s otapalom i s adsorbensom.
Silika gel adsorbensi različitih volumena, površina i promjera pora najčešće se koriste u HPLC. Aluminij i drugi adsorbenti koriste se mnogo rjeđe. Glavni razlog za to:
nedovoljna mehanička čvrstoća, koja ne dopušta pakiranje i korištenje pri povišenim tlakovima tipičnim za HPLC;
silika gel, u usporedbi s aluminijevim oksidom, ima širi raspon poroznosti, površine i promjera pora; značajno veća katalitička aktivnost aluminijevog oksida dovodi do izobličenja rezultata analize zbog razgradnje komponenti uzorka ili njihove ireverzibilne kemisorpcije.
HPLC detektori
Tekućinska kromatografija visoke učinkovitosti (HPLC) koristi se za otkrivanje polarnih nehlapljivih tvari koje se iz bilo kojeg razloga ne mogu pretvoriti u oblik pogodan za plinsku kromatografiju, čak ni u obliku derivata. Te tvari uključuju, posebice, sulfonske kiseline, boje topive u vodi i neke pesticide, kao što su derivati fenil-uree.
detektori:
UV - diodni niz detektora. "Matrica" fotodioda (ima ih više od dvjesto) neprestano registrira signale u UV i vidljivom spektralnom području, čime se osigurava snimanje UV-B spektra u načinu skeniranja. To omogućuje kontinuirano snimanje neiskrivljenih spektra komponenti visoke osjetljivosti koje brzo prolaze kroz posebnu ćeliju.
U usporedbi s detekcijom na jednoj valnoj duljini, koja ne daje informaciju o "čistoći" vrha, mogućnost usporedbe punog spektra niza dioda daje rezultat identifikacije s mnogo većim stupnjem pouzdanosti.
Fluorescentni detektor. Velika popularnost fluorescentnih detektora posljedica je vrlo visoke selektivnosti i osjetljivosti te činjenice da mnogi zagađivači okoliša fluoresciraju (na primjer, poliaromatski ugljikovodici).
Elektrokemijski detektor služi za otkrivanje tvari koje se lako oksidiraju ili reduciraju: fenoli, merkaptani, amini, aromatični nitro i halogeni derivati, ketonski aldehidi, benzidini.
Kromatografsko odvajanje smjese na koloni zbog sporog napredovanja PP traje dugo. Kako bi se ubrzao proces, kromatografija se provodi pod pritiskom. Ova metoda se naziva tekućinska kromatografija visoke učinkovitosti (HPLC).
Modernizacija opreme koja se koristi u klasičnoj tekućinskoj kolonskoj kromatografiji učinila ju je jednom od najperspektivnijih i najsuvremenijih metoda analize. Tekućinska kromatografija visoke učinkovitosti prikladna je metoda za odvajanje, preparativnu izolaciju te kvalitativnu i kvantitativnu analizu nehlapljivih termolabilnih spojeva niske i visoke molekularne mase.
Ovisno o vrsti sorbenta koji se koristi u ovoj metodi, koriste se 2 mogućnosti kromatografije: na polarnom sorbentu koji koristi nepolarni eluent (opcija izravne faze) i na nepolarnom sorbentu koji koristi polarni eluent - tzv. fazna tekućinska kromatografija visoke učinkovitosti (HPLC).
Kada eluens prijeđe u eluent, ravnoteža se u uvjetima HPLC-a uspostavlja višestruko brže nego u uvjetima polarnih sorbenata i nevodenih PP. Kao rezultat toga, kao i praktičnosti rada s vodenim i vodeno-alkoholnim eluensima, Off-HPLC je stekao veliku popularnost u današnje vrijeme. Većina HPLC analiza izvodi se ovom metodom.
Detektori. Registracija izlaza iz stupca zasebne komponente vrši se pomoću detektora. Za registraciju možete koristiti promjenu bilo kojeg analitičkog signala koji dolazi iz mobilne faze i povezan s prirodom i količinom komponente smjese. U tekućinskoj kromatografiji koriste se analitički signali kao što su apsorpcija svjetlosti ili emisija svjetlosti izlazne otopine (fotometrijski i fluorometrijski detektori), indeks loma (refraktometrijski detektori), potencijal i električna vodljivost (elektrokemijski detektori) itd.
Kontinuirano detektirani signal snima snimač. Kromatogram je slijed detektorskih signala snimljenih na vrpci snimača, generiranih kada pojedine komponente smjese napuste kolonu. U slučaju odvajanja smjese, na vanjskom kromatogramu vidljivi su pojedinačni vrhovi. Položaj vrha na kromatogramu koristi se u svrhu identifikacije, visina ili površina vrha se koristi za potrebe kvantifikacije.
2.1 Primjena
HPLC se najviše koristi u sljedećim područjima kemijske analize (naglašeni su objekti analize, gdje HPLC praktički nema konkurencije):
Kontrola kvalitete hrane - tonik i aditivi za okus, aldehidi, ketoni, vitamini, šećeri, bojila, konzervansi, hormoni, antibiotici, triazini, karbamat i drugi pesticidi, mikotoksini, nitrozamini, policiklički aromatični ugljikovodici itd.
Zaštita okoliša - fenoli, organski nitro spojevi, mono- i policiklički aromatski ugljikovodici, niz pesticida, glavni anioni i kationi.
Forenzička znanost - droge, organski eksplozivi i boje, jaki lijekovi.
Farmaceutska industrija - steroidni hormoni, gotovo svi proizvodi organske sinteze, antibiotici, polimerni pripravci, vitamini, proteinski pripravci.
Medicina - navedene biokemijske i ljekovite tvari i njihovi metaboliti u biološkim tekućinama (aminokiseline, purini i pirimidini, steroidni hormoni, lipidi) u dijagnostici bolesti, određivanju brzine eliminacije lijekova iz organizma u svrhu njihove individualne doziranje.
Poljoprivreda - određivanje nitrata i fosfata u tlu radi određivanja potrebne količine unesenih gnojiva, određivanje nutritivne vrijednosti hrane za životinje (aminokiseline i vitamini), analiza pesticida u tlu, vodi i poljoprivrednim proizvodima.
Biokemija, bioorganska kemija, genetski inženjering, biotehnologija - šećeri, lipidi, steroidi, proteini, aminokiseline, nukleozidi i njihovi derivati, vitamini, peptidi, oligonukleotidi, porfirini itd.
Organska kemija - svi stabilni proizvodi organske sinteze, bojila, termolabilni spojevi, nehlapljivi spojevi; anorganska kemija (gotovo svi topljivi spojevi u obliku iona i kompleksnih spojeva).
kontrola kvalitete i sigurnosti prehrambenih proizvoda, alkoholnih i bezalkoholnih pića, pitke vode, kućanskih kemikalija, parfema u svim fazama njihove proizvodnje;
utvrđivanje prirode onečišćenja na mjestu katastrofe ili izvanredne situacije koju je uzrokovao čovjek;
otkrivanje i analiza narkotičkih, jakih, otrovnih i eksplozivnih tvari;
utvrđivanje prisutnosti štetnih tvari (policikličkih i drugih aromatskih ugljikovodika, fenola, pesticida, organskih bojila, iona teških, alkalnih i zemnoalkalijskih metala) u tekućim otpadnim vodama, emisijama u zrak i krutom otpadu iz poduzeća i u živim organizmima;
praćenje procesa organske sinteze, prerade nafte i ugljena, biokemijske i mikrobiološke industrije;
analizu kakvoće tla za gnojidbu, prisutnosti pesticida i herbicida u tlu, vodi i proizvodima, kao i nutritivne vrijednosti hrane za životinje; složeni istraživački analitički zadaci; dobivanje količine ultračiste tvari u tragovima.
POGLAVLJE 3. PRIMJERI UPOTREBE HPLC-a U ANALIZI OBJEKATA OKOLIŠA
HPLC - metoda za praćenje PAH-a u objektima okoliša
Za policikličke aromatske ugljikovodike (PAH), ekotoksikante 1. razreda opasnosti, utvrđene su iznimno niske razine maksimalno dopuštenih koncentracija (MPC) u prirodnim objektima. Određivanje PAH-ova na razini MPC i niže je jedan od vrlo složenih analitičkih zadataka i za njihovo rješavanje koriste se visokotehnološke metode analize (GC-MS, GC, HPLC). Prilikom odabira metode za praćenje, glavnim razmatranim karakteristikama - osjetljivost i selektivnost, dodaju se brzina i ekonomičnost, jer praćenje uključuje serijsku analizu. HPLC opcija na kratkim stupovima s malim provrtom u velikoj mjeri zadovoljava ove zahtjeve. Koristeći ovu metodu, autori su razvili i certificirali metode za praćenje benzo[a]pirena u tri prirodna okruženja: aerosol, snježni pokrivač i površinske vode. Tehnike karakterizira: jednostavna objedinjena priprema uzorka, uključujući ekstrakciju PAH-a organskim otapalima i koncentraciju ekstrakta, izravno uvođenje koncentriranog ekstrakta u kromatografsku kolonu, korištenje fotometrijske detekcije s više valnih duljina u UV području spektra, identifikacija PAH vrhova u kromatogramima pomoću dva parametra, vremena zadržavanja i spektralnog omjera... Ukupna pogreška ne prelazi 10% pri određivanju benzo[a]pirena u aerosolu u rasponu koncentracija od 0,3 do 450 ng/m 3, u površinskim vodama u rasponu koncentracija od 10 do 1000 ng/L, u snježnom pokrivaču u raspon površinske gustoće od 0,5 do 50 μg / m 2. Za slučaj istovremenog određivanja prioritetnih PAH-ova (do 12 spojeva) i registracije nehomogenih pikova analita, predlaže se ponovno odvajanje ekstrakta s promjenom selektivnosti mobilne faze, detekcijske valne duljine i temperature kolone, uzimajući u obzir pojedinačna svojstva utvrđenog PAH-a.
1 ... Kvaliteta ambijentalnog zraka. Masena koncentracija benzo[a]pirena. HPLC tehnika mjerenja. Potvrda o ovjeri MVI br.01-2000.
2 ... Kvaliteta površinskih i pročišćenih otpadnih voda. Masena koncentracija benzo[a]pirena. HPLC tehnika mjerenja. Potvrda o ovjeri MVI br.01-2001.
3 ... Kvaliteta snijega. Masena koncentracija benzo[a]pirena. HPLC tehnika mjerenja. Potvrda o ovjeri MVI br.02-2001.
Uklanjanje anilina iz vodenih otopina korištenjem otpadne alumotermalne redukcije valjanog bakrenog kamenca
Problem uklanjanja ugljikovodika iz otpadnih voda hitan je zadatak. U mnogim kemijskim, petrokemijskim i drugim industrijama nastaje anilin i njegovi derivati koji su otrovne tvari. Anilin je vrlo otrovna tvar, maksimalna granica koncentracije je 0,1 mg / m 3. Anilin i njegovi derivati topljivi su u vodi i stoga se ne mogu ukloniti gravitacijskim taloženjem.
Jedna od najboljih metoda za pročišćavanje otpadnih voda od organskih zagađivača je uporaba anorganskih i organskih adsorbensa sposobnih za regeneraciju (aluminosilikati, modificirane gline, drvo, vlakna itd.) i nesposobnih za regeneraciju (aktivni ugljen, makroporozni polimerni materijali itd.) . ).
Regenerirani adsorbenti mogu ukloniti organske tvari različitog polariteta iz vode. Potraga za učinkovitim adsorbensima hitan je zadatak.
U ovom izvješću prikazani su rezultati istraživanja u području primjene valjane bakrene ljuske Erevanske tvornice kabela (OPMOERKZ) kao anilinskih sorbenata.
Kromatografska ispitivanja provedena su na HPLC kromatografu / tekućinska kromatografija visoke učinkovitosti / sustavima (Waters 486 - detektor, Waters 600S - kontroler, Waters 626 - pumpa), na koloni 250 x 4 mm ispunjenoj sorbentima koji se proučavaju, mobilni brzina faze 1 ml/m/mobilna faza su otapala koja istražujemo/, detektor je UV-254. UV spektroskopska analiza provedena je na spektrofotometru Specord-50, spektri su dobiveni računalnim programom ASPECT PLUS.
Određenim količinama anilina u vodi dodani su točno odmjereni obroci sorbenata čije su početne koncentracije varirale. Smjesa je temeljito mućkana 6 sati, a zatim je uzorak ostavljen da se slegne. Adsorpcija je završena praktički unutar 48 sati Količina istaloženog anilina određena je UV spektrofotometrijskom i refraktometrijskom analizom.
Najprije su ispitana adsorpcijska svojstva OPMOErKZ kada je anilin uklonjen iz otopine u tetrakloridu ugljika. Pokazalo se da anilin najbolje apsorbira sorbent 3 (tablica).
Mjerenja su također provedena za vodene otopine anilina u koncentracijama od 0,01-0,0001 mol/l. Tablica prikazuje podatke za otopinu od 0,01 M.
Apsorpcija anilina raznim sorbentima iz 0,01 M vodene otopine anilina na 20 °C
Prethodno je utvrđeno da se adsorpcija povećava unutar specificiranog raspona koncentracije i linearno ovisi o indeksu loma. Količina anilina određena je grafičkim odnosom "indeks loma - molarna koncentracija" i korigirana podacima tekućinske kromatografije i UV spektralne analize.
Za vodene otopine najaktivniji je sorbent 3. Količina adsorbiranog onečišćujućeg tvari izračunata je kao razlika između ukupne količine onečišćujućeg tvari dodanog u početnu otopinu i njegovog ostatka u konačnoj otopini.
Metode za određivanje PAH-ova u objektima okoliša
Obično se za određivanje PAH-a koriste metode plinske kromatografije (GC) i tekućinske kromatografije visoke učinkovitosti (HPLC). odvajanje glavnih 16 PAH-a, dovoljnih za kvantitativnu analizu, postiže se korištenjem kapilarnih kolona u plinskoj kromatografiji ili visokoučinkovitih kolona koje se koriste u HPLC. Treba imati na umu da kolona koja dobro odvaja kalibracijske smjese šesnaest PAH-a ne jamči da će se i oni dobro odvojiti na pozadini pratećih organskih spojeva u ispitnim uzorcima.
Radi pojednostavljenja analize, kao i postizanja visoke kvalitete dobivenih rezultata, većina analitičkih postupaka sadrži fazu preliminarne izolacije (odvajanja) PAH-a od ostalih skupina srodnih spojeva u uzorcima. Tehnike niskotlačne tekućine-krutine ili tekućine-tekućine tekućinske kromatografije najčešće se koriste u tu svrhu koristeći mehanizme adsorpcije kao što su silikagel ili aluminij, ponekad se koriste mješoviti mehanizmi, poput adsorpcije i eliminacije pomoću Sephadexa.
Primjena prethodnog pročišćavanja uzoraka omogućuje izbjegavanje utjecaja:
Potpuno nepolarni spojevi kao što su alifatski ugljikovodici;
Umjereno do visoko polarni spojevi kao što su ftalani, fenoli, polihidrični alkoholi, kiseline;
Spojevi visoke molekularne težine kao što su smole.
Tekućinska kromatografija visoke učinkovitosti (HPLC) koristi uglavnom dvije vrste detektora: fluorometrijski detektor ili spektrofotometrijski detektor s nizom fotodioda. Granica detekcije PAH-a u fluorometrijskoj detekciji je vrlo niska, što ovu metodu čini posebno prikladnom za određivanje tragova poliaromatskih spojeva. Međutim, klasični fluorometrijski detektori praktički ne daju informacije o strukturi spoja koji se proučava. Suvremeni dizajni omogućuju snimanje spektra fluorescencije koji su karakteristični za pojedine spojeve, ali se još nisu raširili u praksi rutinskih mjerenja. Spektrofotometrijski detektor s fotodiodnim ravnalom (PDL) omogućuje registraciju apsorpcijskih spektra u UV i vidljivom spektralnom području, ti se spektri mogu koristiti za identifikaciju. Slične informacije mogu se dobiti pomoću detektora brzog skeniranja.
Prilikom odabira analitičke tehnike za odvajanje, identifikaciju i kvantitativnu analizu navedenih PAH-ova, potrebno je uzeti u obzir sljedeće uvjete:
Razina utvrđenog sadržaja u ispitnim uzorcima;
Broj srodnih tvari;
Korišteni analitički postupak (tehnika mjerenja);
Mogućnosti serijske opreme.
Razvoj metode za određivanje zemnoalkalijskih elemenata i magnezija ionskom tekućinskom kromatografijom visoke učinkovitosti
Razvoj i unapređenje metoda koje omogućuju rješavanje problema analize vode važan je problem u analitičkoj kemiji. Razvoj tekućinske kromatografije visoke učinkovitosti visokog tlaka potaknuo je razvoj novog smjera u ionsko-izmjenjivačkoj kromatografiji, tzv. ionske kromatografije. Sinteza sorbenata za ionsku kromatografiju je teška, jer za njih postoji mnogo zahtjeva. Zbog nedostatka komercijalno dostupnih visoko učinkovitih kationskih izmjenjivača, korištena je dinamički modificirana obrnuta faza, za koju je sintetiziran modifikator: N-heksadecil-N-dekanoil-paraminobenoilsulfonska kiselina etil-diizopropilamonij (DHDASK), gdje je hidrofobni amin koji sadrži SO 3 - skupina, sposobna za kationsku izmjenu. Nakon prolaska otopine modifikatora, apsorpcija na l = 260 nm dosegnula je 6,4 jedinice optičke gustoće (° E) s platoom. Izračunati kapacitet ionske izmjene je 15,65 μmol. Budući da kationi zemnoalkalijskih elemenata i magnezija ne apsorbiraju u UV području spektra, korištena je neizravna UV detekcija korištenjem sintetiziranog UV apsorbirajućeg eluensa 1,4-dipiridinium butan bromida (DPB bromid). Budući da halogeni ioni uništavaju čelične dijelove kolone, bromidni ion 1,4-dipiridiniumbutana zamijenjen je acetatnim ionom. Kada se kolona ispere s eluentom, modifikatorski protuion, etildiizopropilamonij, zamijenjen je ionom 1,4-dipiridiniumbutana koji apsorbira UV zrake. Odvajanje kationa provedeno je na optimalnoj valnoj duljini l = 260 nm na skali od 0,4 A u načinu “sklapanja skale”; polaritet snimača je bio obrnut. Odvajanje svih proučavanih kationa postignuto je uvođenjem kompleksnog aditiva, oksalne kiseline. Granice detekcije za Mg 2+, Ca 2+, Sr 2+, Ba 2+ su 8 μg / L; 16 μg / L; 34 μg / L; 72 μg / L, respektivno. U odabranim uvjetima analizirana je voda iz slavine, sadržaj Ca 2+ u kojoj je 10,6 +1,9 mg-ion/l, Mg 2+ -2,5 + mg-ion/l. Pogreška obnovljivosti ne prelazi -2,2% za Ca 2+ i 1,4% za Mg 2+.
Analiza kompleksa kadmija u okolišu
Za proučavanje mehanizama migracije teških metala u biosferi potrebni su podaci o kemijskim oblicima postojanja metala u prirodi. Poteškoće u analizi spojeva jednog od najotrovnijih metala - kadmija - povezane su s činjenicom da tvori krhke komplekse, a kada se pokušavaju izolirati, prirodne ravnoteže su iskrivljene. U ovom radu istraženi su spojevi kadmija u tlu i biljkama tehnikom koja se temelji na kromatografskom odvajanju ekstrakata s naknadnom identifikacijom komponenti kemijskom analizom. Ovaj pristup omogućio je ne samo identificiranje kemijskih oblika kadmija, već i praćenje njihovih transformacija u objektima okoliša.
OH-skupine ugljikohidrata i polifenola (uključujući flavonoide), C = O, fosfati, NH 2, NO 2, SH-skupine su usklađene s kadmijem u objektima biosfere. Za potrebe ovog istraživanja sastavljen je skup modelnih liganada koji predstavljaju ove klase spojeva. Interakcija modelnih liganada s kadmijevim solima topivim u vodi ispitana je UV spektroskopijom i HPLC.
Za izolaciju spojeva kadmija koristili smo ekstrakciju posebno odabranim (ne stvarajući komplekse s Cd) otapalima. Tako je kadmij moguće odvojiti od svih teških metala, osim njegovog bliskog kemijskog analoga – cinka. Pikovi koji sadrže kadmij i cink u kromatogramima dobivenih ekstrakata detektirani su vezanjem metala u obliku njihovih ditizonata. Za odvajanje od cinka korištena je razlika u stabilnosti kompleksa Cd i Zn pri pH 6-8. Izolirani spojevi Cd identificirani su HPLC-om s promjenom pH tijekom eluiranja. Provedena je analiza spojeva kadmija s komponentama tla i biljnih tkiva te su identificirane tvari koje biljke proizvode kao odgovor na povećanje unosa kadmija iz tla. Pokazalo se da su flavonoidi, posebice tricin, zaštitni agensi u žitaricama, alkoksi derivati cisteina u mahunarkama, te polifenoli i tioli u biljkama križarica.
POGLAVLJE 4. HPLC OPREMA
SERIJA ACCELA
Novi tekućinski kromatograf ultra visokih performansi ACCELA sposoban je raditi u najširem rasponu brzina protoka i tlakova, pružajući tipično HPLC odvajanje na konvencionalnim kolonama i ultra brzo i učinkovito odvajanje na kolonama s veličinom čestica sorbenta manjom od 2 μm pri ultravisokim pritiscima (preko 1000 atm.).
Sustav uključuje ulaznu pumpu s tromjesečnim gradijentom sposobnu za tlakove veće od 1000 bara i s volumenom zadržavanja od samo 65 µl za visokobrzinsko kromatografsko odvajanje. Autosampler ACCELA sposoban je raditi u ciklusu ubrizgavanja uzorka od 30 sekundi i pruža najveću ponovljivost ubrizgavanja. Diodni niz detektor Accela PDA s minimalnim volumenom protočne ćelije (2 μL) optimiziran je za način rada brze kromatografije, koristi patentiranu tehnologiju LightPipe i održava simetričan oblik vrha koji je osiguran upotrebom besprijekornog kromatografskog sustava i kolona.
Sustav se savršeno integrira s masenim spektrometrima za stvaranje najmoćnijih i najboljih HPLC/MS sustava dostupnih na svijetu.
UHP stupovi s veličinom zrna 1,9 μm dostupni od Thermo Electrona za bilo koju primjenu
SERIJA TSP
Modularni princip dizajna HPLC uređaja omogućuje kupcu fleksibilno kompletiranje opreme za rješavanje bilo kakvih analitičkih zadataka, a ako se oni mijenjaju, može se brzo i ekonomično modificirati. Širok raspon modula uključuje crpke u rasponu od izokratskog do četverokomponentnog gradijenta, od mikrokolona do polupreparativnih, sve dostupne detektore, sustave za ubrizgavanje uzoraka od ručnih injektora do automatskih uzorkovača s bilo kojom mogućnošću manipulacije uzorkom, moćan softver za obradu rezultata mjerenja i kontrolu svih moduli sustava. Svi moduli su certificirani prema CSA, TUF/GS, FCC (EMI), VDE (EMI), ISO-9000, kompaktni su, modernog su dizajna, jednostavni su za rukovanje, opremljeni su ugrađenim zaslonom i samostalnim -dijagnostički sustav, omogućuju stvaranje i spremanje parametara metoda zadatka. Zadovoljavaju kriterije "Dobre laboratorijske prakse" (GLP) i uvršteni su u Registar mjernih instrumenata Ruske Federacije. Izvješća o mjerenju izdaju se u skladu s farmakopejama Engleske, SAD-a, Njemačke i Francuske.
TSP modularni sustavi odlikuju se najvišom pouzdanošću i radnom stabilnošću.
Kombinacija modula pruža analitičaru sve prednosti integralnog sustava s jedne strane i fleksibilnost modularnog sustava s druge strane. U bilo kojem području primjene visokoučinkovite tekuće kromatografije (HPLC) - farmakologija, biotehnologija, analiza okoliša, klinička analiza,
Zrak u zatvorenom prostoru: metode kontrole i čišćenja. Kontrola izvora štetnih tvari i okoliša. Analizatori plina: primjena i njihove suvremene vrste za praćenje sastava mješavine plinova - univerzalna fotometrijska tekućina i traka.
Monitoring kao sustav za praćenje i kontrolu okoliša. Metode praćenja onečišćujućih tvari u objektima okoliša.
Odvajanje aniona ionskom kromatografijom na jednoj koloni. Slika strukture čestice smole za ionsku izmjenu. Primjeri primjene kromatografije ionske izmjene u analizi objekata okoliša. Značajke analize piva ionskom kromatografijom.
Opće karakteristike organoklornih spojeva, njihova glavna fizikalna i kemijska svojstva i primjena, negativan utjecaj na okoliš, organizam životinja, riba i čovjeka. Organoklorni pesticidi u hrani i metode za njihovo određivanje.
Osnove planarne (tankoslojne) kromatografije: stanje i izgledi korištenja suvremenih instrumentalnih metoda za analizu pesticida, organoklornih pesticida u vodi, hrani, hrani i duhanskim proizvodima kromatografijom u tankom sloju.
Dostupne metode za uzimanje uzoraka zraka u zatvorenom prostoru za analizu. Princip rada kolorimetrijskih cijevi. Promjena boje određenog reagensa u kontaktu s određenim kontaminantom. Detekcija hlapljivih organskih spojeva.
Teorijske osnove fluometrije (luminiscencije), područja njezine primjene u analizi objekata okoliša i suvremene istraživačke opreme. Izvanredna osjetljivost i brzina analize luminiscencije. Problemi s opskrbom uzbudne energije.
Razvoj kemijske analitičke opreme ne samo da ne otklanja problem kvalitete provedenih mjerenja, već, naprotiv, postavlja sve veće zahtjeve u svim aspektima mjerenja.
Opći podaci o industrijskom objektu. Klimatski uvjeti područja. Tehnološki lanac. Izvori onečišćenja i narušavanja prirodnog okoliša. Zagađenje prirodnih voda. Točke za promatranje kvalitete površinske vode. Metode uzorkovanja i analize vode.
Širok raspon organskih spojeva unesenih u okoliš tijekom ljudske gospodarske djelatnosti dovodi do činjenice da su te tvari postale glavni zagađivači koji određuju prirodu tehnogenog onečišćenja hidrosfere.
Karakteristike spektroskopskih metoda analize. Bit ekstrakcijsko-fotometrijskih metoda. Primjeri primjene metode za određivanje teških metala u prirodnim vodama. Metoda za detekciju bromidnih iona, nitratnih iona. Moderna oprema.
Pojam i svrha plinske kromatografije, parametri njezina zadržavanja. Vrijeme zadržavanja i volumen zadržavanja. Jednadžbe u plinskoj kromatografiji. Dodatni uređaji za plinsku kromatografiju. Kontrola onečišćenja zraka u hitnim situacijama.
Pojam i karakteristike metode masene spektrometrije. Maseni spektrometri s dvostrukim fokusom u masenoj spektrometriji induktivno spregnute plazme. Korištenje kromatografije-masene spektrometrije u identifikaciji zagađivača okoliša, opreme.
Metode procjene onečišćenja plinskih tokova. Osnovni zahtjevi za uzorkovanje plina i metode analize i mjerenja. Metode za procjenu parametarskog onečišćenja. Metode procjene onečišćenja vodenog okoliša, tla, tla i vegetacije. Identifikacija promjena.
Određivanje tisućinki postotka sadržaja tvari u čistim metalima optičkim metodama analize primjenom adsorpcijskih metoda spektrofotometrijom, fotokolorimetrijom i kolorimetrijom. Prodaja kemijske analitičke opreme putem web stranica.
Svrha i osnovna načela primjene metoda konduktometrijske analize. Vrste korištenih metoda i značajke njihove primjene. Primjeri uporabe konduktometrije u analizi objekata okoliša i opreme potrebne za to.
S obzirom na prirodne vode, razmatraju se problemi kvantitativnog određivanja i razdvajanja na antropogene i prirodne komponente ugljikovodika (CH).
Danas se sve više koriste sorpcijske metode pročišćavanja vode, a jedan od najčešće korištenih sorbensa je aktivni ugljen.
Glavne vrste kromatografije. Primjena kromatografskih metoda u praćenju okoliša. Primjena kromatografije u analizi objekata okoliša. Moderan dizajn hardvera. Metode izrade kromatograma i rad kromatografa.
Praćenje prirodnih voda fizikalno-kemijskim metodama: planarna (tanslojna kromatografija) i njezina primjena za lizu vode. Odvajanje smjese tvari u ravnom sloju sorbenta i otapala. Intenzitet luminescencije naftnih derivata na fluorometru.
(OFS 42-0096-09)
Tekuća kromatografija visoke učinkovitosti (HPLC) je tehnika kolonske kromatografije u kojoj je mobilna faza (PF) tekućina
kost koja se kreće kroz kromatografsku kolonu ispunjenu ne-
mobilna faza (sorbent). HPLC kolone imaju visoki hidraulički tlak na ulazu u kolonu, pa se HPLC ponekad naziva
vyvayut "tekućinska kromatografija visokog pritiska".
Ovisno o mehanizmu odvajanja tvari, razlikuju se sljedeće:
HPLC opcije: adsorpcija, distribucija, ionska izmjena,
ekskluzivni, kiralni itd.
U adsorpcijskoj kromatografiji do razdvajanja tvari dolazi zbog njihove različite sposobnosti adsorbiranja i desorbiranja s
površina adsorbensa s razvijenom površinom, na primjer, silika gel.
U distribucijskoj HPLC do odvajanja dolazi zbog razlike u koeficijentima raspodjele tvari koje se odvajaju između stacionarnih
(obično kemijski cijepljeni na površinu nepokretnog nosača) i
mobilne faze.
Prema polaritetu PP i NF, HPLC se dijeli na normalnu fazu i vol-
proširena faza.
Kromatografija normalne faze naziva se varijanta u kojoj
koristite polarni sorbent (na primjer, silika gel ili silika gel s
uvrnute NH2 - ili CN-grupe) i nepolarni PF (na primjer, heksan s razvijenim
osobni dodaci). U kromatografiji obrnute faze,
koristiti nepolarne kemijski modificirane sorbente (npr.
nepolarni alkil radikal C18) i polarne mobilne faze (npr.
metanol, acetonitril).
U ionsko-izmjenjivačkoj kromatografiji, molekule tvari u smjesi, disocijacija
formirani u otopini u katione i anione, odvajaju se pri kretanju
sorbenta (kationa ili aniona) zbog njihovog različitog tečaja s ionskim
mi skupine sorbenta.
Isključeno (sito, prodiranje u gel, gel-filtracija)
kromatografijom, molekule tvari su odvojene po veličini zbog njihove različite sposobnosti prodiranja u pore stacionarne faze. U ovom slučaju, prvi od su-
pojavljuju se najveće molekule (s najvećom molekularnom težinom), sposobne prodrijeti u minimalni broj pora stacionarne faze,
a potonje su tvari s malim veličinama molekula.
Razdvajanje se često odvija ne jedan po jedan, već nekoliko mehanizama istovremeno.
HPLC metoda može se koristiti za kontrolu kvalitete bilo kojeg negativa
zigomatskih analita. Za analizu koristite odgovarajuće instrumente – tekućinske kromatografe.
Sastav tekućeg kromatografa obično uključuje sljedeće osnove:
ny čvorovi:
– Jedinica za pripremu PF, uključujući spremnik s mobilnom fazom (ili kapacitivnim
s pojedinačnim otapalima koji su dio mobilne faze
zy) i PF sustav za otplinjavanje;
– crpni sustav;
– mješalica mobilne faze (ako je potrebno);
– sustav za ubrizgavanje uzorka (injektor);
– kromatografska kolona (može se ugraditi u termostat);
- detektor;
– sustav prikupljanja i obrade podataka.
Sustav za pumpanje
Crpke osiguravaju PF dovod u kolonu pri zadanoj konstantnoj brzini. Sastav mobilne faze može biti konstantan ili promjenjiv.
tijekom analize. U prvom slučaju, proces se naziva izokratskim,
a u drugom - gradijent. Ispred crpnog sustava ponekad se ugrađuje
filteri s promjerom pora od 0,45 µm za filtraciju mobilne faze. Moderna
Sustav pumpanja tekućinske kromatografa sastoji se od jedne ili više crpki kojima upravlja računalo. To vam omogućuje promjenu su-
postajući PF prema određenom programu tijekom gradijentnog eluiranja. Sme-
PF komponente u mješalici mogu se pojaviti i pri niskom tlaku
lening (prije pumpi) i pri visokom tlaku (nakon pumpi). Mješalica se može koristiti za pripremu PP i za izokratsko eluiranje,
međutim točniji omjer komponenti postiže se preliminarnim
miješanje PP komponenti za izokratski proces. Pumpe za analitičku HPLC omogućuju održavanje konstantne brzine protoka PP u kolonu u rasponu od 0,1 do 10 ml/min pri tlaku na ulazu u kolonu do 50 MPa. Preporučljivo je, međutim, da ta vrijednost ne prelazi
Shalo 20 MPa. Pulsacije tlaka se minimiziraju posebnim prigušivanjem
željezni sustavi uključeni u dizajn crpki. Radni dijelovi na
pumpe su izrađene od materijala otpornih na koroziju, što omogućuje korištenje agresivnih komponenti u sastavu PF-a.
Mješalice
Po svom dizajnu mješalice mogu biti statične ili dinamičke
mentalno.
U mješalici se iz
odvojena otapala koja se isporučuju pumpama, ako potrebna smjesa nije unaprijed pripremljena. Miješanje otapala obično se događa spontano, ali ponekad se koriste sustavi prisilnog miješanja.
šivanje.
Injektori
Injektori mogu biti svestrani za ubrizgavanje uzorka iz
1 μl do 2 ml ili diskretno za ubrizgavanje uzorka samo određenog volumena
ema. Obje vrste injektora mogu biti automatske ("auto injektori" ili "autosampleri"). Injektor za ubrizgavanje uzorka (otopine) nije smješten
neposredno ispred kromatografske kolone. Dizajn injektora omogućuje promjenu smjera protoka PF i izvođenje preliminarnog ubrizgavanja uzorka u petlju određenog volumena (obično od 10 do 100 μL).
Ovaj volumen je naznačen na naljepnici šarke. Dizajn injektora omogućuje zamjenu petlje. Za uvođenje analizirane otopine u nepoznato
injektor rajčice je ručna mikro šprica s volumenom koji je
znatno premašujući volumen petlje. Višak ubrizgane otopine, ne
u petlji se odbacuje, a u kolonu se ubrizgava točan i uvijek jednak volumen uzorka. Ručno nepotpuno popunjavanje petlje smanjuje točnost
točnost doziranja i ponovljivost te stoga narušava točnost
nost i reproducibilnost kromatografske analize.
Kromatografska kolona
Kromatografske kolone su obično cijevi od nehrđajućeg čelika, stakla ili plastike napunjene sorbentom i zatvorene
s obje strane s filterima s promjerom pora od 2-5 µm. Analitička duljina
kolona, ovisno o mehanizmu kromatografskog odvajanja, može biti u rasponu od 5 do 60 cm ili više (obično je
10-25 cm), unutarnji promjer - od 2 do 10 mm (obično 4,6 mm). Stupovi s unutarnjim promjerom manjim od 2 mm koriste se u kromu mikro stupova
tografija. Također se koriste kapilarni stupovi s unutarnjim promjerima.
rum oko 0,3-0,7 mm. Kolone za preparativnu kromatografiju imaju unutarnji promjer do 50 mm ili više.
Ispred analitičke kolone mogu se postaviti kratki kabeli.
stupovi (stražarski stupovi) koji obavljaju razne pomoćne funkcije
(češće - zaštita analitičkog stupca). Obično se analiza provodi s kom-
temperatura, međutim, za povećanje učinkovitosti odvajanja i
smanjujući trajanje analize, može se koristiti termostat
tirovanie kolone na temperaturama ne većim od 60 C. Na višim temperaturama moguće je uništavanje sorbenta i promjena sastava PF-a.
Stacionarna faza (sorbent)
Obično se koriste kao sorbenti:
1. Silika gel, aluminijev oksid, porozni grafit se koriste normalno
malofazna kromatografija. Mehanizam držanja u ovom slučaju
čaj - obično adsorpcija;
2. Smole ili polimeri s kiselim ili bazičnim skupinama. Područje primjene - kromatografija ionske izmjene;
3. Porozni silika gel ili polimeri (kromatografija isključivanja veličine);
4. Kemijski modificirani sorbenti (sorbenti s cijepljenim
zami), pripremana najčešće na bazi silikagela. Mehanizam zadržavanja u većini slučajeva je raspodjela između
noa i stacionarne faze;
5. Kemijski modificirani kiralni sorbenti, npr.
vodene celuloze i amiloze, proteini i peptidi, ciklodekstrini,
koristi se za odvajanje enantiomera (kiralna kromatografija
Sorbenti s cijepljenim fazama mogu imati različite stupnjeve kemije
tehnička modifikacija. Čestice sorbenta mogu biti sferne ili ne-
pravilnog oblika i raznolike poroznosti.
Najčešće korištene cijepljene faze su:
– oktilne skupine(sorbent oktilsilan ili C8);
– oktadecil grupe(sorbent oktadecilsilan
(ODS) ili C18);
– fenilne skupine(fenilsilan sorbent);
– cijanopropilne skupine(CN sorbent);
– aminopropilne skupine(NH2 sorbent);
- diolne skupine (sorbent diol).
Najčešće se analiza provodi na nepolarnim cijepljenim fazama u
način obrnute faze pomoću C18 sorbenta.
U nekim je slučajevima preporučljivije primijeniti normalnu
fazna kromatografija. U ovom slučaju se koriste silika gel ili polarne cijepljene faze ("CN", "NH2", "diol") u kombinaciji s nepolarnim otapalima.
Sorbenti s cijepljenim fazama kemijski su stabilni pri pH vrijednostima od 2,0 do 8,0, osim ako nije drugačije određeno od strane proizvođača.
Čestice sorbenta mogu imati sferne ili nepravilne oblike i različite poroznosti. Veličina čestica sorbenta u analitičkoj HPLC obično je 3-10 µm, u preparativnoj HPLC - do 50 µm ili više.
Također se koriste monolitni sorbenti.
Visoku učinkovitost odvajanja osigurava velika površina čestica sorbenta (što je posljedica njihove mikroskopske
veličina i prisutnost pora), kao i ujednačenost sastava sorbenta i njegovo gusto i jednolično pakiranje.
Detektori
Koriste se različite metode detekcije. U općem slučaju, PP s komponentama otopljenim u njemu nakon kromatografske kolone
Ki ulazi u detektorsku stanicu, gdje je jedno ili drugo od njegovih svojstava (apsorpcija u UV ili vidljivom području spektra, fluorescencija,
indeks loma, električna vodljivost itd.). Rezultirajući kromatogram je graf ovisnosti neke fizičke
ili fizikalno-kemijski parametar PF u odnosu na vrijeme.
Najčešći su spektrofotometrijski de-
tektora (uključujući diodnu matricu), registrirajući promjenu u optičkom
gustoća u ultraljubičastom, vidljivom i često blizu infracrvenog
spektralna područja od 190 do 800 ili 900 nm. Kromatogram u ovom slučaju
tea predstavlja ovisnost optičke gustoće PF-a o vremenu.
Tradicionalno korišteni spektrofotometrijski detektor omogućuje
Može provesti detekciju na bilo kojoj valnoj duljini u svom radnom rasponu.
zona. Također se koriste detektori s više valnih duljina, što omogućuje
osigurati detekciju na nekoliko valnih duljina istovremeno.
Uz pomoć detektora s diodnim nizom moguće je ne samo provoditi detekciju na nekoliko valnih duljina odjednom, već i praktički trenutačno
za dobivanje optičkog spektra FS-a u bilo kojem trenutku (bez skeniranja), što uvelike pojednostavljuje kvalitativnu analizu odvojenih komponenti.
pristalice.
Osjetljivost fluorescentnih detektora je oko 1000 puta veća od osjetljivosti spektrofotometrijskih. U tom se slučaju koristi ili intrinzična fluorescencija ili fluorescencija odgovarajućih derivata, ako tvar koju treba odrediti sama ne fluorescira. Moderna
fluorescentni detektori omogućuju ne samo dobivanje kromatografskih
grama, ali i za snimanje spektra ekscitacije i fluorescencije analize-
veze.
Refraktometrijski detektori koriste se za analizu uzoraka koji ne apsorbiraju u UV i vidljivom spektralnom području (npr. ugljikohidrati).
(refraktometri). Nedostaci ovih detektora su njihova niska (u usporedbi sa spektrofotometrijskim detektorima) osjetljivost i značajna temperaturna ovisnost intenziteta signala (detektor mora biti termostatiran).
Također se koriste elektrokemijski detektori (konduktometrijski
nebo, amperometrija, itd.), masena spektrometrija i Fourier-IR
detektori, detektori raspršenja svjetlosti, radioaktivnosti i neki drugi
Mobilna faza
V Kao PP, mogu se koristiti razna otapala - pojedinačna i njihove mješavine.
V normalna faza kromatografija obično koristi tekući ugljik
levodorodi (heksan, cikloheksan, heptan) i drugi relativno nepolarni
otapala s malim dodatkom polarnih organskih spojeva,
koji reguliraju eluirajuću moć PF-a.
U kromatografiji reverzne faze, PF sadrži polarne
ganska otapala (obično acetonitril i metanol) i voda. Za opt-
separacije često koriste vodene otopine s određenim
pH, posebno puferske otopine. Aditivi se koriste anorganski
kemijske i organske kiseline, baze i soli i drugi spojevi (za
na primjer, kiralni modifikatori za odvajanje enantiomera u akiralne
sorbent).
Kontrola pH vrijednosti mora se provoditi odvojeno za vodenu komponentu, a ne za njezinu smjesu s organskim otapalom.
PF se može sastojati od jednog otapala, često od dva, ako je potrebno
doseg - od tri ili više. Sastav PP je naznačen kao volumni omjer otapala uključenih u njega. U nekim slučajevima, masa
omjer, koji treba posebno odrediti.
Kada se koristi UV spektrofotometrijski detektor, PF ne bi trebao imati izraženu apsorpciju na valnoj duljini odabranoj za detekciju. Granica prozirnosti ili optičke gustoće pri određivanju
često je naznačena specifična valna duljina otapala određenog proizvođača
nalazi na pakiranju.
Na kromatografsku analizu uvelike utječe stupanj čistoće PF, stoga je poželjno koristiti otapala proizvedena
posebno za tekućinsku kromatografiju (uključujući vodu).
PP i analizirane otopine ne smiju sadržavati netopive
čestice i mjehurići plina. Voda dobivena u laboratorijskim uvjetima
vodene otopine, prethodno pomiješane s vodom, organske otopine
Instrumenti, kao i analizirane otopine, moraju biti podvrgnuti finoj filtraciji i otplinjavanju. U te se svrhe obično koristi filtracija.
pod vakuumom kroz membranski filter s veličinom pora od 0,45 μm inertnim u odnosu na dano otapalo ili otopinu.
Sustav prikupljanja i obrade podataka
Suvremeni sustav za obradu podataka je sučelje
osobno računalo povezano s kromatografom s instaliranim
softver koji vam omogućuje registraciju i obradu kro-
matograma, kao i kontrolirati rad kromatografa i pratiti glavnu
parametri kromatografskog sustava.
Popis kromatografskih uvjeta koje treba navesti
U privatnoj monografiji veličine ko-
kolone, vrsta sorbenta s naznakom veličine čestica, temperatura kolone (ako je potrebno, termostatiranje), volumen ubrizganog uzorka (volumen petlje),
postaje PF i način njegove pripreme, brzina dodavanja PF, uvjeti detektora i detekcije, opis načina gradijenta (ako se koristi), vrijeme kromatografije.
IONSKA IZMJENA I IONSKA HPLC
Ionska izmjenjivačka kromatografija koristi se za analizu oba organska
(heterocikličke baze, aminokiseline, proteini, itd.) i inor-
ganski (razni kationi i anioni) spojevi. Razdvajanje komponenti
njeti analizirane smjese u ionsko-izmjenjivačkoj kromatografiji temelji se na reverzibilnoj interakciji iona analiziranih tvari s ionskim skupinama
pami sorbent. Anioniti ili kationi-
vas. Ovi sorbenti su uglavnom ili polimerni ionski
izmjenjivačke smole (obično kopolimeri stirena i divinilbenzena s cijepljenim
ionske skupine) ili silika gelovi s cijepljenim skupinama za ionsku izmjenu. Za odvajanje aniona koriste se sorbenti sa skupinama - (SN2) 3 N + X–, a za odvajanje kationa sorbenti sa skupinama - (SN2) SO3 - N +.
Obično se polimerne smole koriste za odvajanje aniona, i
ispiranje kationa – modificirani silika gelovi.
Kao PF u kromatografiji ionske izmjene koriste se vodene otopine kiselina, baza i soli. Obično se koriste tampon utrke.
kreme koje vam omogućuju održavanje određenih pH vrijednosti. Također je moguće koristiti male dodatke, organske koji se miješaju s vodom
kemijska otapala - acetonitril, metanol, etanol, tetrahidrofuran.
Ionska kromatografija- varijanta kromatografije ionske izmjene, u
koji za određivanje koncentracije iona analita je
koristi konduktometrijski detektor. Za vrlo osjetljive op-
Određivanje promjena u vodljivosti koja prolazi kroz PF detektor, pozadinska vodljivost PF-a treba biti niska.
Postoje dvije glavne opcije za ionsku kromatografiju.
Prvi od njih temelji se na suzbijanju električne vodljivosti elektrolize
PF pomoću druge kolone za ionsku izmjenu koja se nalazi između ana-
litički stupac i detektor. U ovoj koloni dolazi do neutralizacije
PF i analizirani spojevi ulaze u detektorsku stanicu u deionskoj
voda. Otkriveni ioni su jedini ioni
osiguravajući PF vodljivost. Nedostatak stupa supresora je potreba da se regenerira u prilično kratkim intervalima.
mi. Stup supresora može se zamijeniti kontinuiranim djelovanjem
membranski supresor, u kojem je sastav membrane kontinuiran
obnavlja se protokom otopine za regeneraciju koja se kreće u smjeru,
suprotno od smjera PF toka.
Druga varijanta ionske kromatografije je ionska kromatografija na jednoj koloni.
matografija. U ovoj verziji koristi se PF s vrlo niskom električnom vodljivošću.
sadržaj vode. Slabi organski spojevi naširoko se koriste kao elektroliti.
skične kiseline - benzojeva, salicilna ili izoftalna.
EKSKLUZIVNA HPLC
Size exclusion kromatografija (size exclusion chromatography) je posebna vrsta HPLC-a koja se temelji na razdvajanju molekula prema njihovoj veličini. Distribucija
molekula između stacionarne i mobilne faze temelji se na veličini molekula
lekule i dijelom na njihov oblik i polaritet. Za odvajanje koristite a
porozni sorbenti - polimeri, silikagel, porozna stakla i polisaharidi.
Veličina čestica sorbenata je 5-10 µm.
Prednosti poroznih stakla i silika gela su brza difuzija PP i molekula analita u pore, stabilnost u različitim uvjetima (čak i pri visokim temperaturama). polimerni sorben-
vi ste kopolimeri stirena i divinilbenzena (to su hidro-
fobni sorbenti koji se koriste s nepolarnim mobilnim fazama) i
hidrofilni gelovi izrađeni od sulfoniranih divinilbenzenskih ili poliakrilamidnih smola.
Moguća su dva ograničavajuća tipa interakcije molekula s poroznom stacionarnom fazom. Molekule, čija je veličina veća od prosječnog promjera pora a, uopće ne prodiru u sorbent i eluiraju se zajedno s mobilnom fazom.
idi prvi. Molekule s promjerom mnogo manjim od veličine pora sorte.
benta slobodno prodiru u nju, najdulje ostaju u stacionarnoj fazi i posljednji se eluiraju. Molekule srednje veličine prodiru u pore sorbenta ovisno o veličini, a dijelom i o obliku. Oni eluiraju s različitim vremenima zadržavanja između ca-
naše najveće i najmanje molekule. Razdvajanje komponenti kromatografiranog uzorka događa se kao rezultat ponovljenih ak-
difuzija komponenti uzorka u pore sorbenta i obrnuto.
U kromatografiji isključenja veličine za karakterizaciju zadržavanja
koristi retencijski volumen jednak umnošku PF protoka i vremena zadržavanja.
Mobilna faza. Izbor PP ovisi o vrsti sorbenta. Ekskluzivan-
ny kromatografija općenito se dijeli na gel filtraciju i gel
penetracijska kromatografija.
Za odvajanje se koristi metoda gel filtracijske kromatografije
spojeva topivih u vodi na hidrofilnim sorbentima. Mobilne faze su vodene puferske otopine zadane pH vrijednosti.
U gel permeacijskoj kromatografiji, hidrofobna sor-
benti i nepolarna organska otapala (toluen, diklormetan, tet-
rahidrofuran). Ova metoda se koristi za analizu spojeva niske topljivosti.
rub u vodi.
Detektori. Diferencijalni refraktometrijski detektori, kao i spektrofotometrijski detektori (uključujući i one u infracrvenom području spektra) koriste se kao detektori u kromatografiji isključenja veličine.
Također se koriste viskometrijski i protočni laserski detektori.
Ovi detektori, u kombinaciji s refraktometrom ili drugom koncentracijom
detektor omogućuje kontinuirano određivanje molekularne težine
limer u PF.
ULTRA EFIKASNA TEKUĆINA KROMATOGRAFIJA
Tekuća kromatografija ultra učinkovite varijante je tekućinske kromatografije koja je učinkovitija
u usporedbi s klasičnom HPLC.
Značajka tekućinske kromatografije ultra učinkovite je
Koriste se sorbenti s veličinom čestica od 1,5 do 2 mikrona. Dimenzije kro-
matografski stupovi su obično duljine od 50 do 150 mm i od 1
promjera do 4 mm. Volumen ubrizganog uzorka može biti od 1 do 50 μl.
Kromatografska oprema koja se koristi u klasic
riante HPLC, obično posebno prilagođen za ovu vrstu kromatografije
Oprema dizajnirana za tekućinsku kromatografiju ultra-performanse također se može koristiti u klasičnoj verziji HPLC-a.
Tekuća kromatografija
Tekuća kromatografija je vrsta kromatografije u kojoj mobilna faza, nazvan eluent, je tekućina. Stacionarna faza može biti čvrsti sorbent, čvrsti nosač s tekućinom nanesenom na njegovu površinu ili gel.
Razlikovati stupasti i tanki sloj tekućinska kromatografija. U stupnoj verziji, dio mješavine tvari koje se odvajaju prolazi kroz kolonu ispunjenu stacionarnom fazom u struji eluensa koji se kreće pod pritiskom ili pod djelovanjem gravitacije. U tankoslojnoj kromatografiji eluens se kreće pod djelovanjem kapilarnih sila duž ravnog sloja sorbenta nanesenog na staklenu ploču ili metalnu foliju, duž poroznog polimernog filma ili duž trake posebnog kromatografskog papira. Također je razvijena metoda tankoslojne tekućinske kromatografije pod tlakom, kada se eluens pumpa kroz sloj sorbenta koji je u sendviču između ploča.
Postoje takve vrste tekućinske kromatografije kao što su analitički(za analizu smjesa tvari) i preparativni(za izolaciju čistih komponenti).
Razlikovati tekućinska kromatografija (LC) u svojoj klasičnoj verziji, provedenoj na atmosferski pritisak, i velika brzina) provedeno na visoki krvni tlak... Tekućinska kromatografija visoke učinkovitosti (HPLC) koristi stupce promjera do 5 mm, čvrsto napunjene sorbentom s malim česticama (3-10 mikrona). Za pumpanje eluensa kroz kolonu primijeniti pritisak do 3,107 Pa. Ova vrsta kromatografije tzv visokotlačna kromatografija... Propuštanje eluensa kroz kolonu pod visokim tlakom omogućuje dramatično povećanje brzine analize i značajno povećanje učinkovitosti odvajanja zbog upotrebe fino dispergiranog sorbenta.
HPLC opcije su mikrokolumna kromatografija na stupovima malog promjera ispunjenim sorbentom i kapilarna kromatografija na šupljim i sorbentom ispunjenim kapilarnim stupcima. HPLC metoda trenutno omogućuje izolaciju, kvantitativno i kvalitativno analiziranje složenih smjesa organskih spojeva.
Tekuća kromatografija je najvažnija fizikalno-kemijska metoda istraživanja u kemiji, biologiji, biokemiji, medicini i biotehnologiji. Koristi se za:
· Proučavanje metaboličkih procesa u živim organizmima lijekova;
· Dijagnostika u medicini;
· Analiza proizvoda kemijske i petrokemijske sinteze, međuproizvoda, bojila, goriva, maziva, ulja, otpadnih voda;
· Proučavanje izotermi sorpcije iz otopine, kinetike i selektivnosti kemijskih procesa;
Pražnjenje
· Analiza i odvajanje smjesa, njihovo pročišćavanje i izolacija iz njih mnogih bioloških tvari, kao što su aminokiseline, proteini, enzimi, virusi, nukleinske kiseline, ugljikohidrati, lipidi, hormoni.
U kemiji makromolekularnih spojeva i u proizvodnji polimera tekućinskom kromatografijom analizira se kakvoća monomera, proučava se raspodjela molekulske mase i raspodjela po vrstama funkcionalnosti oligomera i polimera, što je neophodno za kontrolu proizvoda.
Tekuća kromatografija također se koristi u parfumeriji, prehrambenoj industriji, za analizu onečišćenja okoliša, u forenzici.
Metoda tekućinske kromatografije visoke učinkovitosti (HPLC) razvijena je i uvedena sredinom 70-ih godina XX. stoljeća. Tada su se pojavili prvi tekući kromatografi.
Tekuća kromatografija je optimalna metoda za analizu kemijski i toplinski nestabilnih molekula, visokomolekularnih tvari smanjene hlapljivosti. To se može objasniti posebnom ulogom mobilne faze u LC, za razliku od plinske kromatografije: eluent ima ne samo transportnu funkciju.
2. Osnovni pojmovi i klasifikacija metoda tekućinske kromatografije.
Po mehanizam zadržavanja odvojenih tvari stacionarnom fazom LC razlikovati između:
- sedimentna kromatografija na temelju različite topljivosti precipitata koji nastaju pri interakciji komponenti analizirane smjese s talogom. Prednost metode je u tome što dobivene zone uz sorbent imaju oštre granice, sadrže precipitate samo jedne tvari i često su odvojene zonama čistog sorbenta. Međutim, ova metoda još nije našla široku primjenu.
· adsorpcijska kromatografija , u kojem se razdvajanje provodi kao rezultat interakcije tvari s kojom se odvaja adsorbent kao što je aluminijev oksid ili silikagel, imajući na površini aktivni polarni centri. Otapalo(eluens) - nepolarna tekućina.

Riža. Shema razdvajanja smjese tvari adsorpcijskom kromatografijom
http: // www. xumuk. ru / biologhim / bio / img014.jpg
Mehanizam sorpcije sastoji se u specifičnoj interakciji između polarne površine sorbenta i polarnih (ili sposobnih za polarizaciju) područja molekula analizirane komponente (Sl.). Interakcija nastaje zbog interakcije donor-akceptor ili stvaranja vodikovih veza.

Riža. Dijagram adsorpcijske tekućinske kromatografije
https://pandia.ru/text/80/271/images/image006_11.jpg "width =" 219 "height =" 200 ">
Riža. ... Cijepljena fazna particijska kromatografija (normalna fazna varijanta).
http: // www. chemnet. ru / rus / podučavanje / ulje / spezprakt-chr. html
Na normalna faza U varijanti razdjelne tekućinske kromatografije kao modifikatori površine silikagela (cijepljene faze) koriste se supstituirani alkilklorosilani koji sadrže polarne skupine, kao što su nitril, amino skupine itd. (Sl.). Primjena cijepljenih faza omogućuje finu kontrolu sorpcijskih svojstava površine stacionarne faze i postizanje visoke učinkovitosti odvajanja.
Obrnuta faza tekućinska kromatografija temelji se na raspodjeli komponenti smjese između polarnog eluensa i nepolarnih skupina (dugi alkilni lanci) cijepljenih na površinu sorbenta (Sl.). Rjeđe se koristi varijanta tekućinske kromatografije s podržanim fazama, kada se tekuća stacionarna faza nanosi na stacionarni nosač.

Riža. ... Cijepljena fazna particijska kromatografija (verzija s obrnutom fazom). http: // www. chemnet. ru / rus / podučavanje / ulje / spezprakt-chr. html
Razdjelna tekućinska kromatografija uključuje tekućina za ekstrakciju kromatografija, u kojem je stacionarna faza organski ekstraktant taložen na čvrsti nosač, a mobilna faza je vodena otopina spojeva koji se odvajaju. Kao ekstraktanti koriste se, na primjer, fenoli, trialkil fosfati, amini, kvaternarne amonijeve baze, kao i organofosforni spojevi koji sadrže sumpor. Ekstrakciona tekućinska kromatografija koristi se za odvajanje i koncentriranje anorganskih spojeva, na primjer, iona alkalnih metala, aktinida i drugih elemenata sličnih svojstava, u obradi istrošenog nuklearnog goriva.
- ionska izmjenjivačka kromatografija, koji se temelji na reverzibilnoj stehiometrijskoj izmjeni iona sadržanih u analiziranoj otopini za mobilne ione uključene u ionski izmjenjivači. Ovisno o predznaku naboja ionizirajućih skupina, ionski izmjenjivači se dijele na kationski izmjenjivači i anioniti. Postoje također amfoterni ionski izmjenjivači –amfoliti, koji može istovremeno izmjenjivati i katione i anione. Ionska izmjenjivačka kromatografija koristi se samo za odvajanje nabijenih čestica. Odvajanje se temelji na sposobnosti smole za ionsku izmjenu da zadrži različite ione različite jačine. jonit sastoji se od polimerne matrice i povezanih aktivnih skupina koje su sposobne za ionsku izmjenu. Kationski izmjenjivač posjeduje kisela ili slabo kisela svojstva, jer sadrži sljedeće skupine: - SO3H, –CH2SO3H, - COOH, - PO3H2 i druge, u kojima su ioni vodika pokretni. Anioniti posjeduju osnovna ili slabo bazična svojstva i sadrže skupine: = NH2, - NH2, –NR3 +, - OH i druge. Odvajanje iona kontrolira se odabirom optimalnih pH vrijednosti eluensa i njegove ionske snage. Ionska izmjena može se shematski prikazati reakcijama:
R-H + Na + + Cl - → R-Na + H + + Cl - (kationska izmjena)
R-OH + Na + + Sl - → R-Sl + Na + + OH - (anionska izmjena)
Ionski izmjenjivači moraju ispunjavati sljedeće zahtjeve: biti kemijski postojani u raznim okruženjima, mehanički jaki u suhom i posebno u nabubrenom stanju, imati visoku sposobnost upijanja i sposobnost dobre regeneracije.
U ionskoj (ionskoj) kromatografiji odvojeni anioni (kationi) se detektiraju kao kiseline (odgovarajuće baze) s visokoosjetljivim konduktometrijskim detektorom, gdje se kolone visokih performansi pune površinski aktivnim ionskim izmjenjivačem malog kapaciteta.
- ionska parna kromatografija, što se može smatrati kombinacijom kromatografije adsorpcije i ionske izmjene. Metoda se temelji na ekstrakciji ionskih tvari – njihovom prijenosu iz vodene faze u organsku fazu u obliku ionskih parova. Za to se mobilnoj fazi dodaje protuion, koji je sposoban selektivno reagirati s analiziranim komponentama, pretvarajući ih u kompleksne spojeve uz stvaranje ionskog para. Glavne prednosti ove opcije su da se kisele, bazične i neutralne tvari mogu analizirati istovremeno.
- kromatografija izmjene liganda na temelju različita sposobnost odvojenih spojeva da tvore komplekse s kationima prijelaznih metala- Cu + 2, Ni + 2, Zn + 2, Cd + 2, Co + 2 itd. - i fiksirajuće skupine (ligandi) stacionarne faze. Dio koordinacijske sfere metalnih iona zauzimaju molekule vode ili drugi slabi ligandi, koji mogu biti istisnuti molekulama spojeva koji se odvajaju. Ova vrsta kromatografije koristi se za odvajanje optičkih izomera.
- kromatografija isključivanja veličine(sito, gel-prodiranje, gel-filtracija), u kojem se odvajanje temelji na razlike u veličini molekula.
https://pandia.ru/text/80/271/images/image009_7.jpg "align =" desno "width =" 429 "height =" 319 ">
Riža. Shema gel permeacijske kromatografije
- afinitetna kromatografija(biospecifičan), na temelju činjenice da se mnoge biološki aktivne makromolekule, na primjer, enzimi, mogu specifično vezati na određeni reagens. Reagens se fiksira na nosač (često agarozu), zatim ispere analiziranom smjesom. Na polimeru se zadržava samo potrebna makromolekula (sl.).

Riža. Shema afinitetne kromatografije
http: // www. chemnet. ru / rus / podučavanje / ulje / spezprakt-chr. html
Zatim se uklanja iz polimera propuštanjem otopine spoja s još većim afinitetom za makromolekulu. Takva je kromatografija posebno učinkovita u biotehnologiji i biomedicini za izolaciju enzima, proteina, hormona.
Ovisno o na putu transporta tvari razlikuju se sljedeće opcije tekućinske kromatografije: izražajan, frontalni i pomak.
Najčešće se koristi izražajan varijanta u kojoj se dio smjese za odvajanje uvodi u kolonu u toku eluensa. Prinos komponenti smjese iz kolone bilježi se na kromatogramu kao pikovi. (riža.)
https://pandia.ru/text/80/271/images/image012_4.jpg "width =" 291 "height =" 165 ">
Riža. Shema razvojne varijante kromatografije
Visina ili vršna površina karakterizira koncentracija komponenti, a održanog svezaka – kvalitativni sastav smjese... Komponente se obično identificiraju po podudarnosti vremena zadržavanja sa standardnim tvarima; također se koriste kemijske ili fizikalno-kemijske metode.
Na frontalni U varijanti (sl.), smjesa tvari koje se odvajaju kontinuirano se propušta kroz kolonu koja ima ulogu mobilne faze. Kao rezultat, u čistom obliku može se dobiti samo tvar koja je najmanje sorbirana u koloni.
https://pandia.ru/text/80/271/images/image014_2.jpg "width =" 279 "height =" 145 ">
Riža. Shema frontalne kromatografije
Kromatogram u ovom slučaju predstavlja korake čije su visine proporcionalne koncentracijama komponenti; retencijski volumeni određeni su vremenom zadržavanja komponenti. Kod razlikovanja takvog kromatograma dobiva se slika slična onoj dobivenoj u inačici koja se razvija.
V pomak U jednoj varijanti, komponente smjese uvedene u kolonu istiskuju se eluensom, koji se adsorbira jače od bilo koje komponente. Kao rezultat dobivaju se susjedne frakcije tvari koje se odvajaju.Red otpuštanja komponenti određen je silom njihove interakcije s površinom sorbenta (Sl.).
https://pandia.ru/text/80/271/images/image016_3.jpg "width =" 320 "height =" 175 ">
Riža. Shema displacement kromatografije
3. Osnovne kromatografske veličine i njihovo određivanje.
Prilikom odvajanja tvari tekućinskom kromatografijom mogu se koristiti varijante razvoja, frontalne i pomačne varijante, kako je gore navedeno. Najčešće se koristi verzija za razvijanje, u kojoj se dio smjese za odvajanje uvodi u kolonu u toku eluensa. Prinos komponenti smjese iz kolone bilježi se na kromatogramu kao pikovi. Iz kromatograma (sl.) Odredite:
- vremena zadržavanja neupijajućih (t0), odvojenih komponenti (tR1, tR2, tR3, itd.); širina baze vrhova (tw1, tw2, itd.).
https://pandia.ru/text/80/271/images/image018_12.gif "width =" 61 "height =" 24 src = ">;
b) korigirani volumen držanja komponente ,
gdje t "R - korigirano vrijeme zadržavanja komponenti;
c) omjer kapaciteta stupca prema danoj komponenti ![]() ;
;
d) učinkovitost stupca karakteriziran broj ekvivalentnih teorijskih ploča
https://pandia.ru/text/80/271/images/image022_8.gif "width =" 129 "height =" 51 src = ">;
f) dopuštenje https://pandia.ru/text/80/271/images/image024_9.gif "width =" 203 visina = 51 "height =" 51 ">
Faktor kapacitivnosti k" ima značajan utjecaj na vrijednost R S: na promjenu k"od 0 do 10 (optimalne granice) R S jako raste. Značenje k" određena je udvostručenom površinom sorbenta i njegovom količinom u koloni, kao i konstantom adsorpcijske ravnoteže (Henryjeva konstanta).
Koeficijent selektivnosti α određena je razlikom konstanti adsorpcijske ravnoteže dviju odvojenih komponenti. S povećanjem α (od 1 do ~ 5) R S naglo raste, s daljnjim povećanjem α - malo se mijenja. Selektivnost kolone ovisi o čimbenicima kao što su kemijska struktura površine sorbenta, sastav eluensa, temperatura kolone i struktura spojeva koji se odvajaju. Budući da je sorpcija kromatografiranih tvari u tekućinskoj kromatografiji određena međudjelovanjem u paru triju glavnih komponenti sustava - sorbenta, tvari koje se odvajaju i eluensa, promjena sastava eluensa je prikladan način za optimizaciju proces odvajanja.
Učinkovitost stupca ovisi o veličini čestica i strukturi pora adsorbensa, o ujednačenosti pakiranja kolone, viskoznosti eluensa i brzini prijenosa mase. Produljenje kolone ne dovodi uvijek do poboljšanja odvajanja, jer raste otpor kolone, povećava se tlak eluensa na ulazu i vrijeme eksperimenta, a osjetljivost i točnost analize opada zbog širenja vrha analizirane komponente. . Ako, tada su vrhovi dviju tvari na kromatogramu gotovo potpuno odvojeni. S rastom R S vrijeme razdvajanja se povećava. Na R S < 1 - razdvajanje je nezadovoljavajuće. U preparativnoj kromatografiji, u vezi s uvođenjem relativno velikih količina odvojenih tvari, kolona radi s preopterećenjem. Time se smanjuje omjer kapacitivnosti, povećava visina ekvivalentna teorijskoj ploči, što dovodi do smanjenja rezolucije.
4. Adsorbenti
Kromatografsko odvajanje smjese bit će učinkovito ako su adsorbens i otapalo (eluens) pravilno odabrani.
Adsorbens ne bi trebao kemijski stupiti u interakciju s odvojenim komponentama, pokazati katalitički učinak na otapalo. Također je potrebno da adsorbens bude selektivan u odnosu na komponente smjese. Pravilno odabrano sredstvo za sušenje mora imati maksimalnu sposobnost upijanja.
Razlikovati polarni (hidrofilni) i nepolarni (hidrofobni) adsorbenti... Treba imati na umu da je adsorpcijski afinitet polarnih tvari za polarne sorbente mnogo veći nego kod nepolarnih.
Kao adsorbenti koriste se aluminijev oksid, aktivni ugljen, silika gel, zeoliti, celuloza i neki minerali.
Aluminij oksidAl2O3 – amfoterni adsorbens(sl.) Na njemu smjese se mogu odvojiti tvari u polarnim i u nepolarnim otapalima... Neutralni aluminij se obično koristi za kromatografiju iz nevodenih otopina zasićenih ugljikovodika, aldehida, alkohola, fenola, ketona i etera.

Riža. Aluminijev oksid za kromatografiju
http: // slike. /542857_w200_h200_product5.jpg
Aktivnost Al2O3 ovisi o njegovom sadržaju vlage. Najveću aktivnost ima bezvodni aluminijev oksid. Konvencionalno se uzima kao jedinica. Po potrebi možete pripremiti aluminij s različitim sadržajem vlage miješanjem svježe pripremljene glinice s vodom (Brockmannova ljestvica).
Ovisnost aktivnosti aluminijevog oksida o sadržaju vlage
Na primjer, Al2O3 s aktivnošću od 1,5-2 koristi se za odvajanje ugljikovodika; za odvajanje alkohola i ketona - 2-3,5.
Specifična površina aluminij oksida 230-380 m2/g.
Silikonski gel(hidroksiliran ili kemijski modificiran) je sušeni želatinozni silicijev dioksid, koji se dobiva iz prezasićenih otopina silicijeve kiseline ( n SiO2 m H2O) pri pH> 5-6. (Sl.) Čvrsti hidrofilni sorbent.

Riža. Silikonski gel
http: // www. silikonski gel. /
http: // silikagel. ru / slike / askg. gif
Veličina čestica silikagela u analitičkim kolonama je 3-10 mikrona, u preparativnim kolonama - 20-70 mikrona. Mala veličina čestica povećava brzinu prijenosa mase i poboljšava učinkovitost kolone. Moderne analitičke kolone duge su 10-25 cm. Ispunjeni su silika gelom veličine čestica od 5 mikrona i omogućuju odvajanje složenih smjesa od 20-30 komponenti. Kako se veličina čestica smanjuje na 3-5 mikrona, povećava se učinkovitost stupca, ali se povećava i njegov otpor. Dakle, za postizanje brzine protoka eluensa od 0,5-2,0 ml/min, potreban je tlak od (1-3) · 107Pa. Silika gel može izdržati takav pad tlaka, dok su granule polimernog sorbenta elastičnije i deformabilnije. Nedavno su razvijeni mehanički jaki polimerni sorbenti s makroporoznom strukturom s gustom mrežom, koji su po svojoj učinkovitosti bliski silika gelovima. Oblik čestica sorbenta veličine 10 μm i više nema velik utjecaj na učinkovitost kolone, međutim preferiraju se sferni sorbenti koji osiguravaju propusnije pakiranje (Sl.)


Riža. Sferični silika gel
http: // slike. / 6450630_w200_h200_silicagelksmg. gif
http: ///N6_2011/U7/silikagel-2.jpeg
Unutarnja struktura čestice silikagela je sustav komunikacijskih kanala. Za tekućinsku kromatografiju koriste se sorbenti s promjerom pora od 6-25 nm. Odvajanje tekućinske kromatografije provodi se uglavnom na silika gelovima modificiranim reakcijom alkil i arilklorosilana ili alkil etoksisilana sa silanolnim površinskim skupinama. Pomoću takvih reakcija cijepe se skupine C8H17-, C18H37- ili C6H5- (za dobivanje sorbenata s hidrofobiziranom površinom), nitrilne, hidroksilne skupine itd. (Sl.)
 https://pandia.ru/text/80/271/images/image033_0.jpg "width =" 166 "height =" 116 src = ">
https://pandia.ru/text/80/271/images/image033_0.jpg "width =" 166 "height =" 116 src = ">
Riža. Modificirana struktura silikagela
Silika gelovi koristi se u kromatografiji za odvajanje smjesa naftnih derivata, viša masne kiseline, njihovi esteri, aromatični amini, nitro derivati organski spojevi. Silikonski gel – hidrofilni sorbent, lako se navlaži vodom. Stoga se ne može koristiti za sorpciju iz vodenih otopina. Aktivnost silika gela ovisi o sadržaju vode: što manje vode sadrži, to je veća aktivnost (Brockmannova ljestvica).
Ovisnost aktivnosti silikagela o sadržaju vlage
Specifična površina silika gela je 500-600 m2/g.
Aktivni ugljeni su oblik ugljika koji tijekom obrade postaje izuzetno porozan i dobiva vrlo veliku površinu za adsorpciju ili kemijske reakcije (Sl.) Imaju specifičnu površinu od 1300-1700 m2/g.

Riža. Aktivni ugljik
http: // e-katalog. rusbiz. ru / user_images / ru / prod_picture / 58035161249b9016f64372.jpg
Glavni učinak na strukturu pora aktivnog ugljena imaju polazni materijali za njihovu proizvodnju. Aktivni ugljen na bazi kokosovih ljuski karakterizira veći udio mikropora (do 2 nm), na bazi ugljena – veći udio mezopora (2-50 nm). Veliki udio makropora karakterističan je za aktivni ugljen na bazi drva (više od 50 nm). Mikropore su posebno pogodne za adsorpciju malih molekula, a mezopore su posebno pogodne za adsorpciju većih organskih molekula.
Zeoliti (molekularna sita)- porozni kristalni aluminosilikati zemnoalkalijskih i zemnoalkalijskih metala prirodnog i sintetskog porijekla. (riža.)
https://pandia.ru/text/80/271/images/image036_2.jpg "width =" 211 visina = 211 "height =" 211 ">
Riža. Zeoliti
http: // www. zeolit. spb. ru / _img / _36 mm. jpg
http: // kntgroup. ru / palac. php? datoteka = / uploads / proizvodi / 6.jpg & x_width = 250
Postoje četiri vrste zeolita (A, X, Y, M) s različitim kristalnim strukturama. Ovisno o kationu, zeoliti se označavaju na sljedeći način: KA, NaA, CaM, NaX, KY, CaY. Značajka zeolita je li to pore kristala imaju veličine reda 0,4-1 nm, srazmjerne veličini molekula mnoge tekuće ili plinovite tvari. Ako molekule tvari mogu prodrijeti u te pore, tada dolazi do adsorpcije u porama kristala zeolita. Veće molekule tvari se ne adsorbiraju. Odabirom zeolita s različitim veličinama pora moguće je jasno odvojiti mješavine različitih tvari.
Specifična površina zeolita je 750-800 m2/g.
Prilikom odabira adsorbensa potrebno je uzeti u obzir strukturu tvari i njihovu topljivost. Na primjer, zasićeni ugljikovodici se slabo adsorbiraju, dok se nezasićeni (imaju dvostruke veze) bolje adsorbiraju. Funkcionalne skupine povećavaju sposobnost adsorpcije tvari.
5. Eluenti
Prilikom odabira otapala (eluensa) potrebno je uzeti u obzir prirodu adsorbensa i svojstva tvari u smjesi koja se odvaja. Eluenti trebaju dobro otopiti sve komponente kromatografirane smjese, imati nisku viskoznost, osigurati potrebnu razinu selektivnosti, biti jeftini, netoksični, inertni i kompatibilni s metodama detekcije (na primjer, benzen se ne može koristiti kao eluens s UV detektor).
Kromatografija normalne faze obično koristi ugljikovodike (heksan, heptan, izooktan, cikloheksan) uz dodatak malih količina kloroforma CHCl3, izopropanola izo-C3H7OH, diizopropil etera; u kromatografiji reverzne faze - smjesa vode s acetonitrilom CH3CN, metanolom CH3OH, etanolom C2H5OH, dioksanom, tetrahidrofuranom, dimetilformamidom. Kako bi se izdvojile pojedinačne komponente smjese, odvojene tijekom kromatografije, često se uzastopno ispiru (eluiraju). U tu svrhu koriste se otapala s različitim kapacitetima desorpcije. Otapala su u polarnim adsorbentima raspoređena u opadajućem redu desorpcionog kapaciteta - eluotropna serija Trappe... Ako komponente smjese koje se odvajaju imaju bliske vrijednosti k"( omjer kapaciteta kolone s obzirom na danu komponentu), zatim kromatografirati s jednim eluentom. Ako se pojedine komponente smjese snažno zadržavaju sorbentom, koristi se niz eluensa sve jačine.
Eluotropni raspon otapala
6. Oprema za tekućinsku kromatografiju
U suvremenoj tekućinskoj kromatografiji koriste se uređaji različitog stupnja složenosti - od najjednostavnijih sustava do kromatografa visoke klase.
Suvremeni tekući kromatograf uključuje: spremnike za eluens, visokotlačne pumpe, dozator, kromatografsku kolonu, detektor, uređaj za snimanje, upravljački sustav i matematičku obradu rezultata.
Na sl. predstavlja blok dijagram tekućeg kromatografa koji sadrži minimalni potrebni skup komponenti, u ovom ili onom obliku, prisutnih u bilo kojem kromatografskom sustavu.
https://pandia.ru/text/80/271/images/image038_2.jpg "width =" 361 "height =" 254 src = ">
Riža. Dijagram tekućinskog kromatografa: 1- rezervoar za mobilnu fazu, 2- pumpa, 3- injektor, 4- kolona, 5- termostat, 6- detektori, 7- sustav za snimanje, 8- računalo.
Spremnik za mobilnu fazu, mora imati dovoljan kapacitet za analizu i uređaj za otplinjavanje otapala kako bi se isključilo stvaranje mjehurića plinova otopljenih u eluensu u koloni i detektoru.
Pumpa namjeravao za stvaranje stalnog protoka otapala... Njegov dizajn prvenstveno je određen radnim tlakom u sustavu. Za rad u rasponu od 10-500 MPa koriste se pumpe tipa klipa (štrcaljke). Njihov nedostatak je potreba za periodičnim zaustavljanjem radi punjenja eluentom. Za jednostavne sustave s niskim radnim tlakovima od 1-5 MPa koriste se jeftine peristaltičke pumpe. Eluenti ulaze u pumpu kroz filter koji zadržava čestice prašine (više od 0,2 mikrona). Ponekad se mala struja helija propušta kroz eluens kako bi se uklonio otopljeni zrak i spriječilo stvaranje mjehurića u detektoru (osobito u slučaju vodenih i polarnih eluensa). U analitičkim kromatografima za dovod eluensa u kolonu koriste se klipne pumpe sa sustavom povratne sprege, koje omogućuju izravnavanje pulsiranja protoka unutar 1-2% i osiguravaju volumetrijske brzine od 0,1 do 25 ml / min pri tlakovima do ~ 3,107 Pa. U kromatografiji mikrokolona, volumetrijske brzine protoka eluensa su mnogo niže - 10-1000 μl / min. U slučaju gradijentnog eluiranja koristi se nekoliko pumpi koje kontrolira programator i dovode 2-3 komponente eluensa u komoru za miješanje, ostavljajući ukupni protok konstantnim. Za ubrizgavanje uzorka u kolonu pod visokim tlakom, bez zaustavljanja protoka, upotrijebite posebne slavine za mikrodoziranje spojene na petlju poznatog volumena za uzorak otopine koji se istražuje. Razvijeni su sustavi za doziranje s automatskim uzorkovanjem i ubrizgavanjem uzorka pomoću mikrodozirajućih ventila ili šprica.
Injektor pruža ubrizgavanje uzorka smjese komponente koje treba razdvojiti u kolonu s dovoljno visokom ponovljivošću. Jednostavni sustavi uzorkovanja zaustavljenim protokom zahtijevaju zaustavljanje pumpe i stoga su manje prikladni od dozatora s petljom Reodyne.
Zvučnici za HPLC se najčešće izrađuju od polirane cijevi od nehrđajućeg čelika duljine 10-25 cm i unutarnjeg promjera 3-5 mm.


Riža. Kromatografske kolone za tekućinsku kromatografiju
Također koristite stakleni stupovi stavljen u metalno kućište; u mikrokolumnoj kromatografiji - tiskani metalni stupovi s unutarnjim promjerom od 1,0-1,5 mm, tiskane staklene mikrokolone promjera 70-150 mikrona i šuplji kapilarni stupovi promjera 10-100 mikrona; u preparativnoj kromatografiji - kolone promjera od 2 do 10 cm i više. Za jednolično i gusto punjenje stupaca sorbentom koristi se metoda pakiranja suspenzije. Suspenzija se priprema od sorbenta i prikladne organske tekućine, koja se dovodi u kolonu pod tlakom do 5 × 107 Pa. Odrediti odvojene komponente koje izlaze iz stupca koristiti detektori. Konstantnost temperature pod uvjetom termostat.
Detektori za tekućinsku kromatografiju imaju protočnu ćeliju u kojoj postoji kontinuirano mjerenje bilo kojeg svojstva tekućeg eluensa. Moraju biti vrlo osjetljivi. Kako bi se povećala osjetljivost detektora, ponekad se koristi derivatizacija komponenti smjese nakon kolone. Da bi se to postiglo, uz protok eluensa uvode se takvi reagensi koji u interakciji s odvojenim tvarima tvore derivate s izraženijim svojstvima, na primjer, jače apsorbiraju u UV ili vidljivom području spektra ili imaju veću fluorescentna sposobnost. Ponekad se derivatizacija provodi prije kromatografske analize i odvajaju se derivati, a ne polazni materijali. Najpopularnije vrste detektori opće namjene su refraktometri mjerenje indeks loma, i spektrofotometrijski detektori definiranje optička gustoća otapala na fiksnoj valnoj duljini (obično u ultraljubičastom području). DO prednosti refraktometara(i nedostaci spektrofotometara) treba pripisati niska osjetljivost na vrstu veze, koji mogu, ali i ne moraju sadržavati kromoforne skupine. S druge strane, uporaba refraktometara ograničena je na izokratske sustave (s konstantnim sastavom eluensa), tako da u ovom slučaju nije moguća uporaba gradijenta otapala.
Diferencijalno "href =" / text / category / differentcial / "rel =" bookmark "> diferencijalno pojačalo i snimač. integrator, što vam omogućuje izračunavanje relativnih površina rezultirajućih vrhova. Upotreba složenih kromatografskih sustava jedinica sučelja povezujući kromatograf sa osobno računalo, koji provodi ne samo prikupljanje i obradu informacija, već i kontrolira uređaj, izračunava kvantitativne karakteristike i, u nekim slučajevima, kvalitativni sastav smjesa. Mikroprocesor pruža automatsko ubrizgavanje uzorka, promijeniti po zadanog programa sastava eluensa s gradijentom eluiranja, održavanje temperatura stupca.
Bruker". Riža. Tekući kromatograf Jasco
Pitanja za samotestiranje
Što je tekuća kromatografija? Navedite njegove vrste, područja primjene. Popis o Glavne kromatografske veličine i njihovo određivanje Koje vrste tekućinske kromatografije postoje ovisno o mehanizmu zadržavanja izdvojenih tvari stacionarnom fazom LC? Koje vrste kromatografije postoje ovisno o načinu transporta tvari? Koje se tvari koriste kao adsorbenti? Koja je razlika? Što služi kao tekuća mobilna faza - eluent? Zahtjevi za otapala. Koja je razlika između razdjelne kromatografije i adsorpcijske kromatografije? Navedite glavne dijelove kruga tekućinske kromatografa, njihovu namjenu.Popis korištene literature
1 "Tekuća kromatografija u medicini"
Http: // časopis. issep. rssi. ru / članci / pdf / 0011_035.pdf
2 "Uvod u metode tekućinske kromatografije visokih performansi"
Http: // www. chemnet. ru / rus / podučavanje / ulje / spezprakt-chr. html
3 "Tekunska kromatografija"
Http: // e-znanost. ru / index /? id = 1540
4 "Kromatografija"
Http: // belchem. narod. ru / kromatografija1.html
U tekućinskoj kromatografiji visoke učinkovitosti (HPLC), priroda procesa koji se odvijaju u kromatografskoj koloni općenito je identična procesima u plinskoj kromatografiji. Jedina razlika je korištenje tekućine kao stacionarne faze. Zbog velike gustoće tekućih mobilnih faza i velike otpornosti na stupac, plinska i tekućinska kromatografija uvelike se razlikuju po svom hardverskom dizajnu.
U HPLC, čista otapala ili njihove smjese se obično koriste kao mobilne faze.
Za stvaranje struje čistog otapala (ili mješavine otapala), koji se u tekućinskoj kromatografiji naziva eluent, pumpe se koriste u hidrauličkom sustavu kromatografa.
Adsorpcijska kromatografija provodi se kao rezultat interakcije tvari s adsorbensima, kao što su silikagel ili aluminij, koji imaju aktivna središta na površini. Razlika u sposobnosti interakcije s adsorpcijskim centrima različitih molekula uzorka dovodi do njihove podjele na zone tijekom kretanja s mobilnom fazom duž stupca. Odvajanje zona komponenti koje se postiže u ovom slučaju ovisi o interakciji i s otapalom i s adsorbensom.
Silika gel adsorbensi različitih volumena, površina i promjera pora najčešće se koriste u HPLC. Aluminij i drugi adsorbenti koriste se mnogo rjeđe. Glavni razlog za to:
nedovoljna mehanička čvrstoća, koja ne dopušta pakiranje i korištenje pri povišenim tlakovima tipičnim za HPLC;
silika gel, u usporedbi s aluminijevim oksidom, ima širi raspon poroznosti, površine i promjera pora; značajno veća katalitička aktivnost aluminijevog oksida dovodi do izobličenja rezultata analize zbog razgradnje komponenti uzorka ili njihove ireverzibilne kemisorpcije.
HPLC detektori
Tekućinska kromatografija visoke učinkovitosti (HPLC) koristi se za otkrivanje polarnih nehlapljivih tvari koje se iz bilo kojeg razloga ne mogu pretvoriti u oblik pogodan za plinsku kromatografiju, čak ni u obliku derivata. Te tvari uključuju, posebice, sulfonske kiseline, boje topive u vodi i neke pesticide, kao što su derivati fenil-uree.
detektori:
UV - diodni niz detektora. "Matrica" fotodioda (ima ih više od dvjesto) neprestano registrira signale u UV i vidljivom spektralnom području, čime se osigurava snimanje UV-B spektra u načinu skeniranja. To omogućuje kontinuirano snimanje neiskrivljenih spektra komponenti visoke osjetljivosti koje brzo prolaze kroz posebnu ćeliju.
U usporedbi s detekcijom na jednoj valnoj duljini, koja ne daje informaciju o "čistoći" vrha, mogućnost usporedbe punog spektra niza dioda daje rezultat identifikacije s mnogo većim stupnjem pouzdanosti.
Fluorescentni detektor. Velika popularnost fluorescentnih detektora posljedica je vrlo visoke selektivnosti i osjetljivosti te činjenice da mnogi zagađivači okoliša fluoresciraju (na primjer, poliaromatski ugljikovodici).
Elektrokemijski detektor koriste se za otkrivanje tvari koje se lako oksidiraju ili reduciraju: fenoli, merkaptani, amini, aromatični nitro i halogeni derivati, ketonski aldehidi, benzidini.
Kromatografsko odvajanje smjese na koloni zbog sporog napredovanja PP traje dugo. Kako bi se ubrzao proces, kromatografija se provodi pod pritiskom. Ova metoda se naziva tekućinska kromatografija visoke učinkovitosti (HPLC).
Modernizacija opreme koja se koristi u klasičnoj tekućinskoj kolonskoj kromatografiji učinila ju je jednom od najperspektivnijih i najsuvremenijih metoda analize. Tekućinska kromatografija visoke učinkovitosti prikladna je metoda za odvajanje, preparativnu izolaciju te kvalitativnu i kvantitativnu analizu nehlapljivih termolabilnih spojeva niske i visoke molekularne mase.
Ovisno o vrsti sorbenta koji se koristi u ovoj metodi, koriste se 2 mogućnosti kromatografije: na polarnom sorbentu koji koristi nepolarni eluent (opcija izravne faze) i na nepolarnom sorbentu koji koristi polarni eluent - tzv. fazna tekućinska kromatografija visoke učinkovitosti (HPLC).
Kada eluens prijeđe u eluent, ravnoteža se u uvjetima HPLC-a uspostavlja višestruko brže nego u uvjetima polarnih sorbenata i nevodenih PP. Kao rezultat toga, kao i praktičnosti rada s vodenim i vodeno-alkoholnim eluensima, Off-HPLC je stekao veliku popularnost u današnje vrijeme. Većina HPLC analiza izvodi se ovom metodom.
Detektori. Registracija izlaza iz stupca zasebne komponente vrši se pomoću detektora. Za registraciju možete koristiti promjenu bilo kojeg analitičkog signala koji dolazi iz mobilne faze i povezan s prirodom i količinom komponente smjese. U tekućinskoj kromatografiji koriste se analitički signali kao što su apsorpcija svjetlosti ili emisija svjetlosti izlazne otopine (fotometrijski i fluorometrijski detektori), indeks loma (refraktometrijski detektori), potencijal i električna vodljivost (elektrokemijski detektori) itd.
Kontinuirano detektirani signal snima snimač. Kromatogram je slijed detektorskih signala snimljenih na vrpci snimača, generiranih kada pojedine komponente smjese napuste kolonu. U slučaju odvajanja smjese, na vanjskom kromatogramu vidljivi su pojedinačni vrhovi. Položaj vrha na kromatogramu koristi se u svrhu identifikacije, visina ili površina vrha se koristi za potrebe kvantifikacije.
Uvod.
Brzi razvoj tekućinske kromatografije u posljednjih 10 godina uglavnom je posljedica intenzivnog razvoja teoretskih temelja i praktične uporabe njezine visoko učinkovite inačice, kao i stvaranja i industrijske proizvodnje potrebnih sorbenata i opreme.
Posebnost tekućinske kromatografije visoke učinkovitosti (HPLC) je uporaba sorbenata s veličinom zrna od 3-10 mikrona, što omogućuje brz prijenos mase uz vrlo visoku učinkovitost odvajanja.
Trenutno je HPLC izbio na prvo mjesto u pogledu stopa razvoja među instrumentalnim metodama, nadmašujući čak i plinsku kromatografiju. Najvažnija prednost HPLC-a u odnosu na plinsku kromatografiju je mogućnost proučavanja gotovo bilo kojeg objekta bez ikakvih ograničenja na njihova fizikalno-kemijska svojstva, na primjer, na vrelište ili molekularnu težinu.
Danas je HPLC dobro definirana instrumentalna metoda koja se široko koristi u različitim područjima znanosti i tehnologije. Posebno je važan u kritičnim područjima kao što su biokemija, molekularna biologija, kontrola onečišćenja okoliša, kao i u kemijskoj, petrokemijskoj, prehrambenoj i farmaceutskoj industriji.
budući da je potrebno uzeti u obzir niz vrlo specifičnih zahtjeva zbog sljedećih značajki tehnike.
a. HPLC kolone su pakirane s medijima vrlo malog promjera čestica. Kao rezultat, na stupcu se stvara visoki tlak pri volumetrijskim brzinama otapala koje su neophodne za brzo odvajanje uzorka.
b. HPLC detektori su osjetljivi na fluktuacije protoka i tlaka eluensa (šum). Štoviše, pri korištenju detektora koncentracije potrebna je još veća stabilnost volumetrijske brzine eluensa.
v. Proces kromatografskog odvajanja popraćen je nizom antagonističkih učinaka, na primjer, disperzija uzorka u mobilnoj fazi dovodi do miješanja odvojenih komponenti i smanjuje maksimalnu koncentraciju tvari u eluiranom vrhu (u detektoru). Disperzija se opaža u svim dijelovima sustava od točke ubrizgavanja do detektora.
d. Otapala koja djeluju kao mobilna faza često su korozivna za opremu. To se prvenstveno odnosi na otapala koja se koriste u kromatografiji reverzne faze, što se preferira u biokemijskim HPLC aplikacijama.
Specifičnost HPLC-a kao instrumentalne tehnike mora se uzeti u obzir pri razvoju, stvaranju i radu ovih sustava. Za izradu komercijalnih uzoraka kromatografskih sustava i njihovih komponenti, koji su dovoljno pouzdani, jednostavni i sigurni za rad uz prihvatljiv omjer cijene i tehničkih karakteristika, bilo je potrebno više od deset godina traženja i istraživanja. Nedavni trendovi prema smanjenju stupova (i duljine i promjera) postavljaju nove zahtjeve za instrumente.
1.1. UČINKOVITOSTISELEKTIVNOST
Kromatografija je metoda odvajanja komponenti smjese na temelju razlike u njihovoj ravnotežnoj distribuciji između dviju "faza koje se ne miješaju, od kojih je jedna stacionarna, a druga pokretna. Komponente uzorka kreću se duž kolone kada su u mobilnoj fazi i ostaju na mjestu kada su Što je veći afinitet komponente za stacionarnu fazu, a što je manji za mobilnu fazu, to se sporije kreće duž stupa i duže ostaje u njemu. Zbog razlike u afinitetu komponenti smjese do stacionarnog i prihvatljivog vremenskog razdoblja smjese u zasebne trake (vrhove) komponenti dok se kreću kroz kolonu s mobilnom fazom.
Iz ovih općih koncepata jasno je da je kromatografsko odvajanje moguće samo ako će komponente uzorka koje ulaze u kolonu tijekom ubrizgavanja uzorka, prvo, biti otopljene u mobilnoj fazi i, kao drugo, stupit će u interakciju (zadržati) s stacionarnom fazom... . Ako tijekom ubrizgavanja uzorka neke komponente nisu u obliku otopine, bit će filtrirane i neće sudjelovati u kromatografskom procesu. Isto tako, komponente koje ne stupaju u interakciju sa stacionarnom fazom proći će kroz kolonu s mobilnom fazom bez razdvajanja na komponente.
Prihvatimo uvjet da su neke dvije komponente topive u mobilnoj fazi i da djeluju u stacionarnoj fazi, odnosno da se kroiatografski proces može odvijati bez smetnji. U tom slučaju, nakon prolaska smjese kroz kolonu, mogu se dobiti kromatogrami oblika a, b ili v(slika 1.1). Ovi kromatogrami ilustriraju kromatografska odvajanja koja se razlikuju po učinkovitosti. (a i b) s jednakom selektivnošću i selektivnošću (b i v) s jednakom učinkovitošću.
Što je stupac učinkovitiji, to se postiže uži vrh uz isto vrijeme zadržavanja. Učinkovitost kolone mjeri se brojem teoretskih ploča (PTT) N:
što je veći ef-

 Riža. 1.2. Parametri kromatografskog pika i izračun broja teoretskih ploča:
Riža. 1.2. Parametri kromatografskog pika i izračun broja teoretskih ploča:
t R - vrijeme zadržavanja vrha; h - visina vrha; Wj / j - širina vrha na pola visine
Riža. 1.1. Vrsta kromatograma ovisno o učinkovitosti i selektivnosti kolone:
a- konvencionalna selektivnost, smanjena učinkovitost (manje teoretskih ploča); b - konvencionalna selektivnost i učinkovitost; v - konvencionalna učinkovitost, povećana selektivnost (veći omjer vremena zadržavanja komponenti)
učinkovitost, što je veći FTT, što je manja ekspanzija vrha početno uskog pojasa dok prolazi kroz stupac, to je uži vrh na izlazu iz stupca. PTT karakterizira broj stupnjeva za uspostavljanje ravnoteže između mobilne i stacionarne faze.
Poznavanje broja teoretskih ploča po stupcu i duljine stupca L (μm), kao i prosječni promjer zrna sorbenta d c (μm), lako je dobiti vrijednosti visine ekvivalentne teorijskoj ploči (VETT), kao i smanjene visine ekvivalentne teorijskoj ploči (PVETT):
HETT = L/ N
PVETT = B3TT / d c.
Imajući vrijednosti PTT, HETT i PVETT, lako se može usporediti učinkovitost stupova različitih tipova, različitih duljina, ispunjenih sorbentima različite prirode i veličine zrna. Uspoređujući CTT dva stupca iste duljine, uspoređuje se izvedba. Pri usporedbi HETT-a uspoređuju se kolone sa sorbentima iste veličine zrna i različitih duljina. Konačno, PVETT vrijednost omogućuje da bilo koje dvije kolone procijene kvalitetu sorbenta, prvo i kvalitetu punjenja kolona, i drugo, bez obzira na duljinu kolona, granulaciju sorbenta po svojoj prirodi.
Selektivnost kolone igra važnu ulogu u postizanju kromatografskog odvajanja.
Selektivnost kolone ovisi o mnogim čimbenicima, a vještina eksperimentatora uvelike je određena sposobnošću utjecaja na selektivnost razdvajanja. Za to kromatograf ima tri vrlo važna čimbenika: izbor kemijske prirode sorbenta, izbor sastava otapala i njegovih modifikatora te razmatranje kemijske strukture i svojstava odvojenih komponenti. Ponekad promjena temperature kolone ima primjetan učinak na selektivnost, što mijenja koeficijente raspodjele tvari između pokretne i stacionarne faze.
Kada se razmatra razdvajanje dviju komponenti u kromatogramu i ocjenjuje ga, rezolucija je važan parametar. R s, koji povezuje izlazna vremena i vršne širine obje odvojene komponente
Rezolucija, kao parametar koji karakterizira razdvajanje vrhova, raste s povećanjem selektivnosti, što se odražava povećanjem brojnika, i povećanjem učinkovitosti, što se odražava smanjenjem nazivnika zbog smanjenja širine vrhova. Stoga je brzi napredak tekućinske kromatografije doveo do promjene koncepta "tekućinske kromatografije visokog tlaka" - zamijenjena je "tekućinskom kromatografijom visoke rezolucije" (dok je skraćeni oblik izraza u engleskom jeziku ostao HPLC kao najispravniji koji karakterizira smjer razvoja suvremene tekućinske kromatografije).
Tako se smanjuje razmazivanje u koloni i povećava učinkovitost pri korištenju finijeg sorbenta, ujednačenijeg sastava (uska frakcija), gušće i ravnomjernije nabijenog u koloni, korištenjem tanjih slojeva cijepljene faze, manje viskoznih otapala i optimalnog protoka stope.
Međutim, uz zamućenje trake kromatografske zone tijekom procesa odvajanja u koloni, ona se može zamutiti i u uređaju za uvođenje uzorka, u spojnim kapilarama injektor - kolona i kolona - detektor, u detektorskoj ćeliji i u neki pomoćni uređaji (mikrofiltri za hvatanje mehaničkih čestica iz uzoraka postavljenih nakon injektora, zaštitni stupovi, reaktori zavojnica, itd.) - Što je volumen ekstra-kolone u usporedbi s retencijskim vršnim volumenom, to je veće razmazivanje. Također je važno gdje se nalazi mrtvi volumen: što je uži kromatografski poziv, to će veće zamućenje dati mrtvi volumen. Stoga posebnu pozornost treba obratiti na dizajn onog dijela kromatografa gdje je kromatografska zona najuža (injektor i uređaji od injektora do kolone) – ovdje je ekstrakolumna erozija najopasnija i ima najjače djelovanje. Iako se smatra da u dobro dizajniranim kromatografima izvore dodatnog ekstrakolumnog razrjeđivanja treba minimizirati, ipak svaki novi uređaj, svaka izmjena kromatografa nužno mora završiti ispitivanjem na koloni i usporedbom dobivenog kromatograma s kromatogramom iz putovnice. Ako se primijeti vršno izobličenje, oštro smanjenje učinkovitosti, potrebno je pažljivo pregledati novouvedene kapilare i druge uređaje.
Ispiranje izvan kolone i pogrešan izračun mogu dovesti do značajnog (više od 50%) gubitka učinkovitosti, posebno u slučajevima kada se relativno dugotrajni kromatografi pokušavaju koristiti za brzi HPLC, mikrokolona HPLC i druge moderne HPLC opcije koje zahtijevaju mikroinjektore , međusobno povezivanje kapilara unutarnjeg promjera 0,05-0,15 mm minimalne duljine, kolone kapaciteta 10-1000 μl, detektori s mikro kivetama kapaciteta 0,03-1 μl i s velikom brzinom, brzi snimači i integratori.
1.2. ZADRŽAVANJE I ČVRSTOĆA OTAPALA
Da bi se analiti razdvojili na koloni, kao što je gore spomenuto, faktor kapaciteta k" mora biti veći od 0, tj. tvari moraju držati stacionarna faza, sorbent. Međutim, faktor kapacitivnosti ne bi trebao biti previsok kako bi se dobilo prihvatljivo vrijeme eluiranja. Ako se za danu smjesu tvari odabere stacionarna faza koja ih zadržava, tada se daljnji rad na razvoju analitičke metode sastoji u odabiru otapala koje bi u idealnom slučaju omogućilo različito za sve komponente, ali prihvatljivo ne jako. velika k". To se postiže promjenom jačine eluiranja otapala.
U slučaju adsorpcijske kromatografije na silika gelu ili aluminijevom oksidu, u pravilu se jačina dvokomponentnog otapala (npr. heksana s dodatkom izopropanola) povećava povećanjem sadržaja polarne komponente (izopropanola), ili smanjuje smanjenjem sadržaja izopropanola. Ako polarna komponenta koja sadrži postane premala (manje od 0,1%), treba je zamijeniti slabijom eluacijskom snagom. Isto se radi, zamjenjujući ili polarnu ili nepolarnu komponentu s drugima, iu slučaju da dati sustav ne pruža željenu selektivnost u odnosu na komponente smjese od interesa. Prilikom odabira sustava otapala uzimaju se u obzir i topljivost komponenti smjese i eluotropni niz otapala koje su sastavili različiti autori.
Približno na isti način odabire se jačina otapala u slučaju korištenja cijepljenih polarnih faza (nitril, amino, diol, nitro itd.), uzimajući u obzir moguće kemijske reakcije i isključujući otapala opasna za fazu (npr. , ketoni za amino fazu).
U slučaju kromatografije reverzne faze, jačina otapala se povećava povećanjem sadržaja organskog sastojka (metanol, acetonitril ili THF) u eluensu i smanjuje dodavanjem više vode. Ako nije moguće postići željenu selektivnost, upotrijebite drugu organsku komponentu ili je pokušajte promijeniti različitim aditivima (kiseline, reagensi ionskog para itd.).
Kod odvajanja ionskom izmjenjivačkom kromatografijom jačina otapala se mijenja povećanjem ili smanjenjem koncentracije puferske otopine ili promjenom pH, u nekim slučajevima se koristi modifikacija organskim tvarima.
Međutim, osobito u slučaju složenih prirodnih i bioloških smjesa, često nije moguće odabrati jačinu otapala na način da se sve komponente uzorka eluiraju u razumnom vremenu. Tada je potrebno pribjeći gradijentnom eluiranju, odnosno upotrijebiti otapalo čija se snaga eluiranja tijekom analize mijenja tako da se stalno povećava prema unaprijed zadanom programu. Ova tehnika omogućuje eluiranje svih komponenti složenih smjesa u relativno kratkom vremenskom razdoblju i njihovo razdvajanje na komponente u obliku uskih vrhova.
1.3. VELIČINA SORBENTNIH ČESTICA, PERMEABILNOST I UČINKOVITOST
Kada se razmatra razmazivanje kolone, naznačili smo da učinkovitost kolone (HETP) ovisi o veličini čestica sorbenta. U velikoj mjeri, brzi razvoj HPLC-a u posljednjih 10-12 godina uzrokovan je, prvo, razvojem metoda za dobivanje sorbenata veličine čestica od 3 do 10 μm i uskog frakcijskog sastava, koji osiguravaju visoku učinkovitost s dobre propusnosti, i, kao drugo, razvojem metoda punjenja kolona ovim sorbentima, i, treće, razvojem i serijskom proizvodnjom tekućinskih kromatografa s visokotlačnim pumpama, injektorima i detektorima s kivetama malog volumena koji mogu registrirati male količine. vrhovi volumena.
Za dobro nabijene stupce suspenzije, teoretska visina ekvivalenta ploče (PVETT) može biti 2 bez obzira na to koriste li se za pakiranje čestice od 3, 5, 10 ili 20 µm. U ovom slučaju dobit ćemo stupove (standardne duljine od 250 mm) s učinkovitošću od 41670, 25000, 12500 i 6250 tt. Čini se prirodnim odabrati najučinkovitiji stupac napunjen česticama od 3 µm. Međutim, ova će učinkovitost doći na račun vrlo visokih tlakova i relativno niske stope odvajanja, budući da će postojeća crpka vjerojatno moći pumpati otapalo kroz takav stup velikom prostornom brzinom. Ovdje smo samo suočeni s pitanjem odnosa između veličine čestica sorbenta, učinkovitosti i propusnosti stupaca.
Ako iz ovoga izrazimo faktor otpora stupa - bezdimenzijska veličina, dobivamo sljedeću jednadžbu:
Faktor otpora za stupove napunjene mikročesticama istog tipa istom metodom mijenja se neznatno i iznosi sljedeće vrijednosti:
Vrsta čestice ".... Nepravilna sferna
oblik oblika
Suho pakiranje. ... ... ... ... 1000-2000 800-1200
Pakiranje suspenzije. ... ... 700-1500 500-700
Ulazni tlak u kolonu proporcionalan je linearnoj brzini protoka, faktoru otpora kolone, viskoznosti otapala i duljini kolone i obrnuto je proporcionalan kvadratu promjera čestica.
Primjenjujući ovu ovisnost za gore navedene stupce s česticama promjera 3, 5, 10 i 20 μm i uz pretpostavku konstantnog linearnog protoka, faktora otpora kolone i viskoznosti otapala, dobivamo za kolone jednake duljine omjer ulaznog tlaka 44:16: 4: 1. Dakle, ako je za sorbent obrnute faze s veličinom čestica od 10 mikrona kada se koriste sustavi otapala metanol -. voda (70:30), obično na standardnoj koloni pri brzini protoka otapala od 1 ml/min, tlak na ulazu u kolonu je 5 MPa, zatim za čestice od 5 μm - 20 MPa i za 3 μm - 55 MPa . Pri korištenju silika gela i manje viskoznog sustava otapala heksan - izopropanol (100: 2), vrijednosti će biti znatno niže: 1, 4, odnosno 11 MPa. Ako je u slučaju sorbenta obrnute faze vrlo problematično korištenje čestica veličine 3 μm, a moguće je i 5 μm, ali ne na svim uređajima, tada za sorbent normalne faze nema problema s pritisak. Treba napomenuti da je moderni HPLC velike brzine karakteriziran upotrebom veće potrošnje otapala nego u gornjem primjeru, stoga se zahtjevi za tlakom još više povećavaju.
Međutim, u slučajevima kada je za odvajanje potreban određeni broj teoretskih ploča i poželjno je provesti analizu velikom brzinom, slika se donekle mijenja. Budući da će duljine stupaca sa sorbentima veličine zrna od 3, 5, 10 mikrona s jednakom učinkovitošću biti 7,5; 12,5 i 25 cm, tada će se omjer tlaka na ulazu u stupove promijeniti na 3: 2: 1. Sukladno tome, trajanje analize na takvim stupcima jednake učinkovitosti bit će korelirano kao 0,3: 0,5: 1, tj. pri prelasku s 10 na 5 i 3 μm, trajanje analize će se smanjiti za 2 i 3,3 puta. Ovo ubrzanje analize dolazi po cijenu proporcionalno većeg ulaznog tlaka u koloni.
Prikazani podaci vrijede za one slučajeve kada sorbenti različite veličine zrna imaju iste krivulje raspodjele veličine čestica, kolone su pakirane na isti način i imaju isti faktor otpora stupca. Treba imati na umu da se poteškoća dobivanja uskih frakcija sorbenta povećava sa smanjenjem veličine čestica i to. frakcije različitih proizvođača imaju različit frakcijski sastav. Stoga će faktor otpornosti stupca varirati ovisno o veličini zrna, vrsti sorbenta, načinu pakiranja kolone itd.
KLASIFIKACIJA HPLC METODA MEHANIZMOM SEPARACIJE
Većina odvajanja provedenih HPLC metodom temelji se na mješovitom mehanizmu interakcije tvari sa sorbentom, koji osigurava manje ili više zadržavanje komponenti u koloni. Mehanizmi razdvajanja u više ili manje čistom obliku su u praksi prilično rijetki, na primjer, adsorpcijski mehanizmi kada se za odvajanje aromatskih ugljikovodika koriste apsolutno bezvodni silikagel i bezvodni heksan.
S mješovitim mehanizmom zadržavanja za tvari različite strukture i molekularne mase moguće je procijeniti doprinos zadržavanju adsorpcije, distribucije, isključivanja i drugih mehanizama. Međutim, za bolje razumijevanje i razumijevanje mehanizama razdvajanja u HPLC-u, preporučljivo je smatrati separacije s prevladavanjem jednog ili onog mehanizma pripadajućim određenoj vrsti kromatografije, na primjer kromatografiji ionske izmjene.
2.1.1 ADSORPCIJSKA KROMATOGRAFIJA
Odvajanje adsorpcijskom kromatografijom provodi se kao rezultat interakcije tvari s adsorbensima, kao što su silika gel ili aluminij, koji imaju aktivna središta na površini. Razlika u sposobnosti interakcije s adsorpcijskim centrima različitih molekula uzorka dovodi do njihove podjele na zone tijekom kretanja s mobilnom fazom duž stupca. Odvajanje zona komponenti koje se postiže u ovom slučaju ovisi o interakciji i s otapalom i s adsorbensom.
Sorpcija na površini adsorbenta s hidroksilnim skupinama temelji se na specifičnoj interakciji između polarne površine adsorbenta i polarnih (ili polarizabilnih) skupina ili područja molekula. Te interakcije uključuju dipol-dipol interakciju između trajnih ili induciranih dipola, stvaranje vodikove veze do stvaranja n-kompleksa ili kompleksa za prijenos naboja. Moguća i prilično česta u praktičnom radu je manifestacija kemosorpcije, što može dovesti do značajnog povećanja vremena zadržavanja, oštrog smanjenja učinkovitosti, pojave produkata raspadanja ili nepovratne sorpcije tvari.
Izoterme adsorpcije tvari imaju linearan, konveksan ili konkavni oblik. Uz linearnu izotermu adsorpcije, vrh tvari je simetričan i vrijeme zadržavanja ne ovisi o veličini uzorka. Najčešće su izoterme adsorpcije tvari nelinearne i imaju konveksni "oblik, što dovodi do neke asimetrije vrha s formiranjem repa.
Silika gel adsorbenti s različitim volumenima pora, površinama i promjerima pora najčešće se koriste u HPLC-u. Aluminij se koristi mnogo rjeđe, a iznimno rijetko drugi adsorbenti koji se široko koriste u klasičnoj kolonskoj i tankoslojnoj kromatografiji. Glavni razlog tome je nedovoljna mehanička čvrstoća većine drugih adsorbenata, što ne dopušta njihovo pakiranje i korištenje na povišenim tlakovima tipičnim za visokotlačne sušare.
Polarne skupine odgovorne za adsorpciju i smještene na površini silikagela i aluminijevog oksida slične su po svojstvima. Stoga su redoslijed eluiranja smjesa tvari i eluotropni raspon otapala za njih obično isti. Međutim, razlika u kemijskoj strukturi silika gela i glinice ponekad dovodi do razlika u selektivnosti; u ovom slučaju prednost se daje jednom ili drugom adsorbentu, koji je prikladniji za određeni zadatak. Na primjer, aluminij osigurava veću selektivnost u odvajanju određenih polinuklearnih aromatskih ugljikovodika.
Prednost silika gela u odnosu na aluminij objašnjava se širim izborom silika gela u smislu poroznosti, površine i promjera pora, kao i znatno većom katalitičkom aktivnošću glinice, što često dovodi do izobličenja rezultata analize zbog razgradnja komponenti uzorka ili njihova nepovratna kemisorpcija...
2.1.2 Nedostaci adsorpcijske kromatografije koji ograničavaju njezinu upotrebu
Popularnost adsorpcijske kromatografije postupno je opadala razvojem HPLC metode, sve je više zamjenjivana i nastavlja se zamjenjivati drugim opcijama, kao što su HPLC s reverznom fazom i HPLC normalne faze na sorbentima s cijepljenom fazom. Koji su nedostaci adsorpcijske kromatografije koji su doveli do toga?
Prije svega, to je dugo trajanje procesa ekvilibracije adsorbenata s otapalima koja sadrže vodu u tragovima, teškoća pripreme takvih otapala s određenim i ponovljivim sadržajem vlage. To rezultira slabom ponovljivošću retencijskih parametara, rezolucije, selektivnosti. Iz istog razloga nemoguće je koristiti gradijentno eluiranje – povratak u početno stanje je toliko dug da značajno nadmašuje dobitak u vremenu zbog korištenja gradijenta.
Značajni nedostaci adsorbenata, posebno aluminijevog oksida, povezani s čestim preraspodjelama spojeva osjetljivih na katalizu, njihovom razgradnjom, ireverzibilnom sorpcijom, također su dobro poznati i više puta su zabilježeni u literaturi. Nepovratno sorbirane tvari, koje se nakupljaju na početnom dijelu kolone, mijenjaju prirodu sorbenta, mogu dovesti do povećanja otpora stupca ili čak do njegovog potpunog začepljenja. Posljednji nedostatak može se otkloniti korištenjem zaštitnog stupa, koji na- Kako se otpor povećava i dolazi do začepljenja, zamjenjuje se novim * ili se ponovno puni novim sorbentom. Međutim, ireverzibilna sorpcija, koja se također događa u ovom slučaju, rezultira kromatogramom u kojem komponente uzorka osjetljive na sorpciju ili katalitičku razgradnju potpuno ili djelomično odsutne.
2.2. DISTRIBUCIJSKA KROMATOGRAFIJA
Razdjelna kromatografija je varijanta HPLC-a, u kojoj se razdvajanje smjese na komponente provodi zbog razlike u njihovim koeficijentima raspodjele između dviju faza koje se ne miješaju: otapala (mobilna faza) i faze na sorbentu (stacionarna faza). Povijesno gledano, prvi su bili sorbenti ovog tipa, koji su dobiveni taloženjem tekućih faza (oksidipropionitril, parafinsko ulje i dr.) na porozne nosače, slično kao što su se pripremali i pripremali sorbenti za plinsko-tekućinsku kromatografiju (GLC). Međutim, odmah su otkriveni nedostaci takvih sorbenata, od kojih je glavni bio relativno brzo ispiranje faze s nosača. Zbog toga se količina faze u koloni postupno smanjivala, vrijeme retencije također se smanjivalo, a adsorpcijski centri koji nisu pokriveni fazom pojavili su se na početnom dijelu kolone, uzrokujući stvaranje vršnih repova. Ovaj nedostatak je otklonjen zasićenjem otapala nataloženom fazom čak i prije nego što je ušlo u kolonu. Prijenos se također smanjio kada su korištene viskoznije i manje topive polimerne faze, međutim, u ovom slučaju, zbog difuzije iz debelih polimernih filmova, učinkovitost kolona je značajno smanjena.
Pokazalo se logičnim cijepiti tekuću fazu na nosač kemijskim vezama na način da njezino uvlačenje postane fizički nemoguće, odnosno transformirati nosač i fazu u jednu cjelinu - u tzv. sorbent.
U budućnosti su napori istraživača bili usmjereni na potragu za reagensima čije bi cijepljenje išlo prilično brzo i potpuno, a nastale veze bile što stabilnije. Alkilklorosilani i njihovi derivati postali su takvi reagensi, koji su omogućili dobivanje sorbenata u fazi cijepljenja različitih tipova i s različitim polarnim i nepolarnim skupinama na površini pomoću slične tehnologije.
Uspješna uporaba potonjeg tipa sorbenata za HPLC potaknula je rast njihove proizvodnje od strane raznih proizvođača. Svaka tvrtka proizvodi takve sorbente, u pravilu, na temelju vlastite vrste silika gela i prema vlastitoj tehnologiji, što obično predstavlja "know-how" proizvodnje. Kao rezultat toga, veliki broj sorbenata koji su kemijski nazvani potpuno istim (na primjer, silika gel s cijepljenim oktadecilsilanom) imaju vrlo različite kromatografske karakteristike. To je zbog činjenice da silikagel može imati šire ili uže pore, različitu površinu, poroznost, njegova površina prije cijepljenja može biti hidroksilirana ili ne, mono-, di- ili triklorosilani se mogu cijepiti, uvjeti cijepljenja mogu dati monomerne, polimerne ili sloj mješovite faze, koriste se različite metode uklanjanja zaostalih reagensa, dodatna deaktivacija silanola i drugih aktivnih skupina može se koristiti, ali i ne mora.
Složenost tehnologije cijepljenja reagensa i pripreme sirovina i materijala, njezina višestupanjska priroda dovode do činjenice da čak i serije sorbenata dobivene istom tehnologijom iz iste proizvodne tvrtke mogu imati neznatno različite kromatografske karakteristike. To je osobito istinito kada se takvi sorbenti koriste za analizu višekomponentnih smjesa koje sadrže tvari koje se značajno razlikuju po broju i položaju funkcionalnih skupina, u smislu funkcionalnosti.
Uzimajući u obzir gore navedeno, uvijek biste trebali nastojati * da pri korištenju metode analize opisane u literaturi koristite potpuno isti sorbent i iste radne uvjete. U ovom slučaju, vjerojatnost da se djelo ne može reproducirati je minimalna. Ako to nije moguće, ali se uzima sorbent druge tvrtke sa sličnom cijepljenom fazom, morate biti spremni na činjenicu da će trebati dugo vremena za izmjenu tehnike. Istodobno, postoji mogućnost (i to treba uzeti u obzir) da se potrebno odvajanje na ovom sorbentu ne može postići ni nakon dugotrajnog razvoja. Prisutnost u literaturi mnogih opisanih tehnika separacije na starim sorbentima koji se proizvode dugo vremena potiče njihovu daljnju proizvodnju i korištenje iz tog razloga. Međutim, u onim slučajevima kada je potrebno prijeći na razvoj originalnih metoda, posebno u odnosu na tvari sklone razgradnji, kemisorpciji, preraspodjelu, preporučljivo je započeti rad na sorbentima koji su nedavno razvijeni i proizvedeni korištenjem novih, poboljšane tehnološke mogućnosti. Novi sorbenti imaju ujednačeniji frakcijski sastav, ujednačeniju i potpuniju pokrivenost površine cijepljenom fazom te savršenije završne faze obrade sorbenta.
2.3. IONSKA IZMJENJSKA KROMATOGRAFIJA
U kromatografiji s ionskom izmjenom, razdvajanje komponenti smjese postiže se reverzibilnom interakcijom tvari koje se ioniziraju s ionskim skupinama sorbenta. Zadržavanje elektroneutralnosti sorbenta osigurava prisutnost protuiona sposobnih za ionsku izmjenu, koji se nalaze u neposrednoj blizini površine. Ion unesenog uzorka, u interakciji s fiksnim nabojem sorbenta, izmjenjuje se s protuionom. Tvari s različitim afinitetom "prema fiksnim nabojima odvajaju se na anionite ili na kationite. Anioniti imaju pozitivno nabijene skupine na površini i sorbiraju anione iz mobilne faze. Kationiti, odnosno, sadrže skupine s negativnim nabojem u interakciji s kationima.
Kao mobilna faza koriste se vodene otopine soli kiselina, baza i otapala kao što je tekući amonijak, odnosno sustavi otapala visoke dielektrične konstante e i velike sklonosti ionizaciji spojeva. Obično rade s puferskim otopinama koje omogućuju podešavanje pH vrijednosti.
Kod kromatografskog odvajanja, ioni analita se natječu s ionima sadržanim u eluensu, nastojeći komunicirati sa suprotno nabijenim skupinama sorbenta. Iz toga slijedi da se kromatografija ionske izmjene može koristiti za odvajanje svih spojeva koji se mogu ionizirati na bilo koji način. Moguće je analizirati čak i neutralne molekule šećera u obliku njihovih kompleksa s boratnim ionom:
Šećer + VO 3 2 - = Šećer -VO 3 2 -.
Ionska izmjenjivačka kromatografija nezamjenjiva je za odvajanje visoko polarnih tvari koje se ne mogu analizirati GLC-om bez pretvorbe u derivate. Takvi spojevi uključuju aminokiseline, peptide, šećere.
Kromatografija ionske izmjene ima široku primjenu u medicini, biologiji, biokemiji, za kontrolu okoliša, u analizi sadržaja lijekova i njihovih metabolita u krvi i urinu, pesticida u prehrambenim sirovinama, kao i za odvajanje anorganskih spojeva, uključujući radioizotopi, lantanidi, aktinidi itd. Analiza biopolimera (proteina, nukleinskih kiselina i dr.), koja je obično trajala satima ili danima, pomoću ionsko-izmjenjivačke kromatografije provodi se za 20-40 minuta uz bolje odvajanje. Korištenje ionsko-izmjenjivačke kromatografije u biologiji omogućilo je promatranje uzoraka izravno u biološkim medijima, smanjujući mogućnost preuređivanja ili izomerizacije, što može dovesti do pogrešne interpretacije konačnog rezultata. Zanimljivo je koristiti ovu metodu za kontrolu promjena u biološkim tekućinama. Korištenje poroznih slabih anionskih izmjenjivača na bazi silika gela omogućilo je odvajanje peptida. V
Mehanizam ionske izmjene može se predstaviti u obliku sljedećih jednadžbi:
za anionsku izmjenu
X- + R + Y- h ->■ Y- + R + X-.
za kationsku izmjenu |
X + + R-Y + h = * Y ++ R-X +.
U prvom slučaju, ion uzorka X ~ natječe se s ionom mobilne faze Y ~ za ionske centre R + ionskog izmjenjivača, a u drugom kationi uzorka X + ulaze u konkurenciju s ioni mobilne faze Y + za ionske centre R ~.
Naravno, ioni uzorka, koji slabo djeluju s ionskim izmjenjivačem, s ovom konkurencijom će se slabo zadržati na koloni i prvi će se isprati iz nje, i obrnuto, jače zadržani ioni će posljednji eluirati iz kolone. Obično BTqpH4Hbie interakcije neionske prirode nastaju zbog adsorpcije ili vodikovih veza uzorka s neionskim dijelom matrice ili zbog ograničene topljivosti uzorka u mobilnoj fazi. Teško je izolirati "klasičnu" kromatografiju s ionskom izmjenom u "čistom" obliku, te stoga neki kromatografi polaze od empirijskih, a ne teorijskih principa kromatografije s ionskom izmjenom.
Odvajanje specifičnih tvari prvenstveno ovisi o izboru najprikladnijeg sorbenta i mobilne faze. Kao stacionarne faze u ionizmjenjivačkoj kromatografiji koriste se ionsko-izmjenjivačke smole i silika gelovi s cijepljenim ionogenim skupinama.
2.4. EKSKLUZIVNA KROMATOGRAFIJA
Ekskluzivna kromatografija je opcija! tekućinska kromatografija, u kojoj se razdvajanje događa zbog raspodjele molekula između otapala unutar pora sorbenta i otapala koje teče " između njegovih čestica.
Za razliku od drugih HPLC opcija, gdje je odvajanje ide Zbog različitih interakcija komponenti s površinom sorbenta, uloga krutog punila u kromatografiji isključenja veličine je samo u stvaranju pora određene veličine, a stacionarna faza je otapalo koje ispunjava te pore. Stoga je primjena pojma "sorbent" na ova punila u određenoj mjeri proizvoljna.
Temeljna značajka metode je sposobnost odvajanja molekula po njihovoj veličini u otopini u rasponu praktički bilo koje molekularne težine - od 10 2 do 10 8, što je čini nezamjenjivom za proučavanje sintetičkih i biopolimera.
Tradicionalno se postupak koji se provodi u organskim otapalima još uvijek često naziva gel permeacijska kromatografija, a u vodenim sustavima - gel filtracijska kromatografija. U ovoj knjizi usvojen je jedan izraz za obje opcije, koji dolazi od engleskog "Size Exclusion" - iznimka po veličini - i u najvećoj mjeri odražava mehanizam procesa.
U monografijama je provedena detaljna analiza postojećih ideja o vrlo složenoj teoriji procesa ekskluzijske kromatografije.
Ukupni volumen otapala u koloni Vt (ovo se često naziva ukupnim volumenom stupca jer Vd ne sudjeluje u kromatografskom procesu) je zbroj volumena pokretne i stacionarne faze.
Zadržavanje molekula u koloni isključenja određeno je vjerojatnošću njihove difuzije u pore i ovisi o omjeru veličina molekula i pora, što je shematski prikazano na Sl. 2.15. Koeficijent raspodjele ka, kao i u drugim varijantama kromatografije, je omjer koncentracija tvari u stacionarnoj i pokretnoj fazi.
Budući da mobilna i stacionarna faza imaju isti sastav, onda Kd tvar kojoj su obje faze jednako dostupne jednaka je jedinici. Ova situacija se ostvaruje za najmanje molekule C (uključujući molekule otapala), koje prodiru u sve pore (vidi sliku 2.15) i stoga se najsporije kreću kroz stupac. Njihov retencijski volumen jednak je ukupnom volumenu otapala Vt-
 Riža. 2.15. Model za odvajanje molekula mjerenjem u ekskluzijskoj kromatografiji
Riža. 2.15. Model za odvajanje molekula mjerenjem u ekskluzijskoj kromatografiji
Sve molekule, čija je veličina veća od veličine pora sorbenta, ne mogu ući u njih (potpuno isključenje) i proći kroz kanale između čestica. Oni eluiraju iz kolone s istim retencijskim volumenom jednakim volumenu mobilne faze V 0 - Koeficijent raspodjele za ove molekule je nula.
Molekule srednje veličine, sposobne prodrijeti samo u dio pora, zadržavaju se u stupcu u skladu sa svojom veličinom. Koeficijent raspodjele ovih molekula varira od nule do jedan i karakterizira udio volumena pora koji je dostupan za molekule određene veličine.Njihov retencijski volumen određen je zbrojem Y oko i raspoloživog dijela volumena pora.
KVALITATIVNA ANALIZA
Kromatograf koji počinje s tekućinskom kromatografijom visoke učinkovitosti trebao bi biti upoznat s osnovama kvalitativne analize. Kvalitativna analiza se koristi za identifikaciju poznatog proizvoda, dobivenog na nov način ili u mješavini s drugim proizvodima. „Potrebna je za izolaciju različitih komponenti iz složenih bioloških, kemijskih smjesa, što je posebno važno u medicini, forenzici, ekologije, kontrolirati mjesto nekih medicinskih kemijskih proizvoda i njihovih metabolita u biomaterijalima.. „." Upoznavanje s osnovama kvalitativne "analize pomoći će da se izbjegnu tipične pogreške, na primjer / da se razlikuju nečistoće u uzorku od nečistoća u otapalu ili za provjeru čistoće tvari na više od jednog spektrofotometra valne duljine i na različitim itd.
Prije nastavka analize potrebno je utvrditi je li cijeli uzorak eluiran iz kolone ovim sustavom otapala ili ne. Da biste bili sigurni u potpuno eluiranje, potrebno je prikupiti svu tekućinu koja istječe iz kolone, ispariti otapalo, izvagati ostatak i pronaći stupanj izvlačenja uzorka.
Identifikacija komponente u HPLC-u može se izvršiti na tri načina: 1) korištenje informacija o zadržavanju; 2) ispitati zone dobivene tijekom odvajanja u koloni tekućinske kromatografa pomoću metoda spektralne ili kemijske analize; 3) izravno spojiti analizator spektra na kolonu.
Retencijski volumen se koristi za snimanje pikova u kromatografiji. V R odnosno vrijeme zadržavanja t R. Obje su veličine karakteristične za tvar u danom kromatografskom sustavu. Budući da se vrijeme zadržavanja tvari koju treba odvojiti sastoji od vremena interakcije u stupcu i vremena prolaska praznih dijelova cijevi, ono se razlikuje od uređaja do uređaja. Prikladno je imati tvar koju ne zadržava dana kolona, uzimajući je kao standard, čije vrijeme zadržavanja i volumen t 0 , V o. Kromatografija tvari i standarda mora se provesti pod istim uvjetima (tlak i brzina protoka). Kada se identificiraju retencijskim podacima, poznate pojedinačne tvari koje mogu biti prisutne u uzorcima odvajaju se u istom kromatografskom sustavu i za njih se dobivaju vrijednosti. t R. Uspoređujući ove vrijednosti t R s vremenom zadržavanja nepoznatog vrha, može se utvrditi da se oni ili podudaraju, i tada je vjerojatno da pikovi odgovaraju istoj tvari, ili t R poznata tvar ne odgovara t R nepoznata zona. Tada je još uvijek moguća gruba procjena vrijednosti t R tvari koje nisu dostupne za izravno mjerenje stupnja njihova zadržavanja. Razmotrimo obje opcije.
U prvom slučaju očito je potrebno prethodno proučavanje uzorka kako bi se pretpostavilo prisutnost specifičnih tvari u njemu. Pri radu s jednostavnim smjesama lako je odrediti podudara li se stupanj zadržavanja zona uzorka i poznatih tvari ili ne, tj. vrijednosti t B su isti ili različiti. U slučaju složenih smjesa, nekoliko tvari odjednom može eluirati sa sličnim vrijednostima. t R, a zone stvarno dobivene kromatografskim odvajanjem se preklapaju. Kao rezultat, dobivanje točnih vrijednosti t R za različite zone postaje nemoguće. Pouzdanost identifikacije povećava se povećanjem razlučivosti, pažljivijom kontrolom uvjeta odvajanja i višestrukim mjerenjem vrijednosti t R i usrednjavanje pronađenih vrijednosti. U tom slučaju treba se izmjenjivati kromatografsko razdvajanje poznatih i nepoznatih tvari. Prilikom odvajanja složenih smjesa, vrijednost t R tvari se mogu mijenjati pod utjecajem matrice samog uzorka. Taj je učinak moguć na početku kromatograma i s preklapajućim vrhovima; moguće je i zategnuti zone, što je već spomenuto.
U takvim slučajevima uzorku dodajte standard u omjeru 1: 1. Ako su tvari identične, vrijednost t R početni materijal se ne mijenja, a na kromatogramu se dobiva samo jedan pik. Ako postoji instrument sa sustavom cikličke kromatografije, tada je za pouzdanost identifikacije poželjno smjesu proći kroz kolonu nekoliko puta.
Informacije o zadržavanju također se mogu pronaći u literaturi, ali je vrijednost tih informacija ograničena. Budući da stupci čak i jedne serije daju lošu ponovljivost, literarne vrijednosti ne odgovaraju uvijek pravoj vrijednosti. t R na ovoj kolumni. Za adsorpcijsku kromatografiju, međutim, moguće je predvidjeti t R na temelju literaturnih podataka. Još jedna poteškoća povezana s upotrebom književnih značenja t R, - složenost njihova pretraživanja u specijaliziranoj literaturi, iako bibliografski pregledi objavljeni u časopisu Kromatography imaju ažurirani indeks vrsta tvari.
U drugom slučaju, kada se vremena zadržavanja poznatih spojeva i zona uzorka ne podudaraju, moguće je predvidjeti vrijeme zadržavanja nepoznate komponente. Predviđanja relativne retencije prilično su pouzdana na temelju podataka o strukturi u kromatografiji s isključenjem prostora. Manje su točni u adsorpcijskoj, distribucijskoj kromatografiji, a posebno pri radu na kemijski vezanoj fazi. Za ionsku i ion-parnu kromatografiju tvari s poznatim str Ka moguće su samo približne vrijednosti tR. Uvijek je lakše predvidjeti relativno zadržavanje ili * x vrijednost nego apsolutne vrijednosti k". Relativne vrijednosti t R lakše procijeniti za srodne spojeve ili derivate kao što su supstituirane alkil karboksilne kiseline ili derivati benzena.
Kod izokratskog odvajanja homologa ili oligomera, ponekad se opaža sljedeći obrazac:
\ gk" = A + Bn,
gdje A i V- konstante za veći broj odabranih uzoraka i za zadani kromatografski sustav (na istoj koloni, s istim pokretnim i stacionarnim fazama); NS- broj identičnih strukturnih jedinica u molekuli uzorka.
Uvođenje funkcionalne skupine / u molekulu uzorka dovest će do promjene k" u prvoj jednadžbi nekim konstantnim koeficijentom a / u danom kromatografskom sustavu. Moguće je dobiti grupne konstante a / za različite supstituentske skupine /, čije će se vrijednosti povećavati s povećanjem polariteta funkcionalnih skupina u svim vrstama kromatografije, osim kromatografije obrnute faze, gdje su vrijednosti konstanti smanjivat će se s povećanjem polariteta.
Neke grupne konstante a / za različite supstituentske skupine / date su u tablici. 9.1.
U adsorpcijskoj kromatografiji prva jednadžba nije uvijek primjenjiva, jer vrijedi pod uvjetom da svi izomeri imaju isto značenje k", što se ne promatra uvijek. Moguće je, međutim, nacrtati ovisnost lgfe "istih spojeva na jednoj koloni naspram lgfe" istih spojeva, ali na drugom stupcu ili naspram odgovarajućih karakteristika u tankoslojnoj kromatografiji, na primjer, lg [(l - Rf) IRf].
Kada se uspoređuju podaci o zadržavanju tvari, mogu se koristiti vrijednosti faktora kapaciteta k", budući da na njemu, za razliku od t R brzina pokretne faze i geometrijska obilježja stupa ne utječu.
Odvajanje na kemijski vezanoj fazi slično je razdvajanju particijskom kromatografijom sa sličnim fazama, pa se stoga podaci o ravnotežnoj ekstrakciji mogu koristiti za predviđanje vremena zadržavanja.
U kromatografiji ionske izmjene na retenciju utječu tri čimbenika: stupanj ionizacije kiselina i baza, naboj ionizirane molekule i sposobnost tvari iz vodene mobilne faze koja se koristi u kromatografiji ionske izmjene da migrira u organsku fazu. . Potonje ovisi o molekulskoj težini spoja i njegovoj hidrofobnosti. Stoga se jače kiseline ili baze jače zadržavaju u separaciji anionskom ili kationskom izmjenom. Prilikom smanjivanja pK a pojedine kiseline uključene u uzorak, zadržavanje raste s odvajanjem niza kiselina zbog anionske izmjene, a povećanjem p / C o povećava se zadržavanje baza tijekom njihova odvajanja zbog kationske izmjene.
Dakle, podudarnost vremena zadržavanja poznate tvari s promatranom omogućuje pretpostaviti njihov identitet. Pouzdanost identifikacije se povećava ako se uspoređuju kromatogrami poznate tvari i nepoznate komponente u različitim uvjetima. Ako se tvari u adsorpcijskoj i reverznoj fazi ili ionskoj izmjeni i kromatografiji isključivanja veličine ponašaju isto, povećava se pouzdanost identifikacije. Ako je pouzdanost identifikacije s jednakim relativnim zadržavanjem 90%, onda kada se proučava ponašanje istih tvari u značajno različitim uvjetima, pouzdanost identifikacije je već 99%.
Vrijedna karakteristika tvari koja se koristi u identifikaciji je omjer signala dobivenih za danu tvar na dva različita detektora. Analit nakon napuštanja kolone prvo prolazi kroz prvi detektor, zatim kroz drugi, a signali koji dolaze iz detektora bilježe se istovremeno pomoću snimača s više pera ili dva snimača. Obično se koristi serijski spoj ultraljubičastog detektora (osjetljivijeg, ali selektivnog) s refraktometrom, ili ultraljubičastog detektora s detektorom fluorescencije, ili dva ultraljubičasta detektora koja rade na različitim valnim duljinama. Relativni odziv, odnosno omjer signala refraktometra i signala fotometra, karakteristika je tvari, pod uvjetom da oba detektora rade u svom linearnom rasponu; to se provjerava uvođenjem različitih količina iste tvari. Kvalitativne informacije mogu se dobiti radom fotometrijskih detektora opremljenih uređajem za zaustavljanje protoka koji bilježe spektar vrha koji izlazi "iz stupca dok je u protočnoj ćeliji, uspoređujući ga sa spektrom poznatog spoja".
Moderni, još uvijek skupi spektrofotometri s diodnim nizom od velikog su interesa za identifikaciju.
Potpuno nepoznata tvar ne može se identificirati samo tekućinskom kromatografijom visoke učinkovitosti, a potrebne su druge metode.
KVANTITATIVNA ANALIZA
Kvantitativna tekućinska kromatografija je dobro razvijena analitička metoda koja po točnosti ne zaostaje za kvantitativnom plinskom kromatografijom i značajno premašuje točnost TLC-a ili elektroforeze, stoga je za dobivanje kvantitativnih rezultata instrument potrebno kalibrirati.
Kvantitativna analiza sastoji se od sljedećih faza: 1) kromatografsko odvajanje; 2) mjerenje površina ili visina vrha; 3) proračun kvantitativnog sastava smjese na temelju kromatografskih podataka; 4) interpretacija dobivenih rezultata, odnosno statistička obrada. Razmotrimo sve ove faze.
4.1. HMATOGRAFSKO RAZVOJ
Uzorkovanje može biti sklono greškama. Posebno je važno izbjeći pogrešku i dobiti adekvatan reprezentativan uzorak nehomogenih čvrstih uzoraka, hlapljivih ili nestabilnih tvari, kao i poljoprivrednih proizvoda i biomaterijala. Nehomogeni uzorci, kao što su prehrambeni proizvodi, temeljito se miješaju i razrežu na četvrtine. Višestrukim provođenjem ove operacije postiže se homogenost uzorka.
Pogreške i gubici tvari mogu se dopustiti u fazi ekstrakcije, izolacije, pročišćavanja itd.
Uzorke treba potpuno otopiti i pripremiti njihove otopine s točnošću od ± 0,1%. Uzorak je poželjno otopiti u mobilnoj fazi, što isključuje mogućnost taloženja nakon njegovog unošenja u kromatograf. Ako je otapanje u mobilnoj fazi nemoguće, onda treba upotrijebiti otapalo koje se s njim miješa i u kromatograf unijeti volumene uzorka (manje od 25 μl).
Tijekom ubrizgavanja uzorka mogu se pojaviti značajne netočnosti zbog njegovog frakcioniranja, curenja i vršnog razmazivanja. Zamućenje vrhova uzrokuje stvaranje repova, što dovodi do djelomičnog preklapanja vrhova, a kao posljedica toga, do pogrešaka u detekciji. Za kvantitativno ubrizgavanje, uređaji s ventilom s petljom su poželjniji u odnosu na štrcaljke zbog veće točnosti i manje ovisnosti o operateru.
Kod kromatografskog odvajanja tvari mogu nastati i komplikacije koje dovode do izobličenja podataka: kvantitativna analiza. Moguća je razgradnja ili transformacija uzorka tijekom kromatografskog procesa ili ireverzibilna adsorpcija tvari na ovoj koloni. Važno je osigurati da te nepoželjne pojave ne postoje i, ako je potrebno, regenerirati ili zamijeniti stupac. Preklapanje vrhova i zaostatak se također mogu smanjiti promjenom kromatografskih uvjeta.
Ne možete koristiti lažne ili nejasne vrhove u kvantitativnoj analizi, kao ni vrhove čije je vrijeme oslobađanja blizu do, budući da može biti nedovoljnog odvajanja. Obično se koriste pikovi vrijednosti ^ 0,5. Najveća učinkovitost kolone postiže se uvođenjem 10 ~ 5 -10 ~ 6 g otopljene tvari po gramu sorbenta. Uz uvođenje velikih količina uzorka, ovisnost o visina vrha na opterećenju može biti nelinearna i potrebna je kvantifikacija po vršnim površinama.
Pogreške povezane s detekcijom ili pojačavanjem dovode do značajnog izobličenja rezultata kromatografskog odvajanja. Svaki detektor karakterizira specifičnost, linearnost i osjetljivost. Ispitivanje selektivnosti posebno je važno kada se analiziraju nečistoće u tragovima. Reakcija UV detektora može se promijeniti na tvari sa sličnim funkcionalnim skupinama za faktor 10 4. Potrebno je kalibrirati odziv detektora za svaki analit. Naravno, tvari koje ne apsorbiraju u UV području neće dati signal snimaču kada se koristi fotometar kao detektor. Pri korištenju refraktometra mogu se pojaviti negativni vrhovi. Osim toga, ovaj detektor treba biti termostatiran, što nije potrebno za UV detektor.
Linearnost detektora određuje veličinu ubrizganog uzorka. Treba imati na umu da će brzina protoka kolone, temperatura kolone i detektora te dizajn utjecati na točnost kvantitacije. Pogreške u prijenosu električnog signala na izlazni uređaj (snimač), integrator ili na računalo mogu nastati zbog podizanja šuma, nedostatka uzemljenja, fluktuacija napona u mreži itd.
 4.2. MJERENJE POVRŠINE ILI VISINE VRHA
4.2. MJERENJE POVRŠINE ILI VISINE VRHA
Visina vrha h (Sl. 10.1) naziva se udaljenost od vrha vrha do osnovne crte, mjeri se linearno ili se broj podjela na snimaču. Neki elektronički integratori i računala daju informacije o visinama vrhova. Položaj osnovne linije pomaknutih vrhova nalazi se interpolacijom ordinatnih vrijednosti koje odgovaraju početku i kraju vrha (vrh 1 i 3 vidi sl. 10.1). Da biste poboljšali točnost, morate imati nježnu, stabilnu osnovnu liniju. U slučaju nerazdvojenih vrhova, osnovna crta se povlači između početka i kraja vrha, umjesto da se zamjenjuje nultom linijom. Budući da je visina vrha manje ovisna o utjecaju susjednih vrhova koji se preklapaju, procjena visine vrha je točnija i gotovo se uvijek koristi za analizu tragova.
Područje vrha može se odrediti na različite načine. Pogledajmo neke od njih.
1. Planimetrijska metoda se sastoji u činjenici da je vrh okružen ručnim planimetrom, koji je uređaj koji mehanički određuje površinu vrha. Metoda je točna, ali naporna i slabo ponovljiva. Ova metoda je nepoželjna.
2. Metoda papirnatih silueta - vrh se izrezuje i važe. Metoda je dobro reproducibilna, ali naporna, a kromatogram je uništen. Njegova primjenjivost ovisi o ujednačenosti trake grafikona. Metoda se također ne može široko preporučiti.
4. Metoda triangulacije sastoji se u konstruiranju trokuta povlačenjem tangentnih linija na stranice vrha. Vrh trokuta je viši od vrha vrha. Povećanje površine koju formira ovaj prošireni vrh bit će dosljedno u cijelom kromatogramu i neće previše utjecati na točnost. Osim toga, neka površina izgubljena prilikom crtanja tangenti bit će nadoknađena. Osnovica trokuta određena je presjekom tangenti s baznom linijom, a površina je određena umnoškom 7g osnovice i visine. Ova metoda je najbolja za određivanje područja asimetričnih vrhova. Međutim, ponovljivost u konstrukciji tangenta od strane različitih operatora je različita i stoga; nisko.
5. Metoda integratora diska temelji se na elektromehaničkom uređaju spojenom na snimač. Olovka pričvršćena na integrator pomiče se duž trake na dnu vrpce brzinom proporcionalnom kretanju olovke snimača.
Kao i kod ručnog mjerenja, vrh bi trebao ostati na ljestvici rekordera, međutim prilagodbe za kompenzaciju pomaka osnovne linije i nepotpuno odvajanje susjednih vrhova smanjuju pouzdanost i povećavaju vrijeme analize.
Metoda je točnija od ručnih metoda mjerenja, osobito s asimetričnim vrhovima, i nudi prednost u brzini. Osim toga, pruža kontinuirani kvantitativni zapis analize.
6. Metode koje koriste elektroničke integratore za određivanje područja vrhova i ispis informacija o tom području i vremenima zadržavanja mogu uključivati korekciju za osnovnu pristranost i određivanje površine samo djelomično odvojenih vrhova. Glavne prednosti su točnost, brzina, neovisnost radnje od rada snimača. Integratori imaju memoriju i mogu se programirati za određenu analizu pomoću unaprijed programiranog programa. Prednosti integratora uključuju njegovu sposobnost korištenja korekcijskih faktora za odziv detektora pri ponovnom izračunavanju početnih podataka o površinama vrhova, kompenzirajući razliku u osjetljivosti detektora na različite tvari. Takvi sustavi štede vrijeme, poboljšavaju analitičku točnost i korisni su za rutinsku analitičku analizu.
7. U tekućinskoj kromatografiji računala se široko koriste za mjerenje površina vrhova. Oni ispisuju potpunu poruku koja uključuje naziv tvari, područja vrhova, vremena zadržavanja, faktore korekcije za odgovor detektora i sadržaj (u težinskim %) za različite komponente uzorka.