Загальні і специфічні метаболічні шляхи. Основні біохімічні шляхи мікробіологічної трансформації забруднюючих речовин
Введення в метаболізм (біохімія)
Обмін речовин або метаболізм - це сукупність хімічних реакцій в організмі, які забезпечують його речовинами і енергією, необхідними для життєдіяльності. Процес метаболізму, що супроводжується утворенням більш простих з'єднань зі складних, позначають терміном - катаболізм. Процес, що йде в зворотному напрямку і приводить, в кінцевому рахунку, до утворення складного продукту з відносно більш простих - анаболізм. Анаболічні процеси супроводжуються споживанням енергії, катаболіческіе - вивільненням.
Анаболизм і катаболізм не є простим зверненням реакцій. Анаболічні шляхи повинні відрізнятися від шляхів катаболізму хоча б однієї з ферментативних реакцій, щоб регулюватися незалежно, і за рахунок контролю активності цих ферментів регулюється сумарна швидкість розпаду і синтезу речовин. Ферменти, які визначають швидкість всього процесу в цілому, називаються ключовими.
Більш того, шлях по якому йде катаболізм тієї чи іншої молекули, може бути непридатним для її синтезу з енергетичних міркувань. Наприклад, що протікають в печінці розщеплення глюкози до пірувату є процес, що складається з 11 послідовних стадій, що каталізують специфічними ферментами. Здавалося б, синтез глюкози з пірувату повинен бути простим зверненням всіх цих ферментативних стадій її розпаду. Такий шлях представляється на перший погляд і найприроднішим, і найбільш економічним. Однак насправді біосинтез глюкози (глюконеогенез) в печінці протікає інакше. Він включає лише 8 з 11 ферментативних стадій, що беруть участь в її розпаді, а 3 відсутні стадії замінені в ньому зовсім іншим набором ферментативних реакцій, властивим тільки цьому биосинтетической шляху. Крім того, реакції катаболізму і анаболізму часто розділені мембранами і протікають в різних компартментах клітин.
Таблиця 8.1. Компартменталізація деяких метаболічних шляхів в гепатоците
|
компартмент |
метаболічні шляхи |
|---|---|
|
цитозоль |
Гліколіз, багато реакції глюконеогенезу, активація амінокислот, синтез жирних кислот |
|
плазматична мембрана |
Енергозалежні транспортні системи |
|
Реплікація ДНК, синтез різних видів РНК |
|
|
рибосоми |
синтез білка |
|
лізосоми |
Ізоляція гидролитических ферментів |
|
комплекс Гольджі |
Освіта плазматичноїмембрани і секреторних пухирців |
|
мікросоми |
Локалізація каталази і оксидаз амінокислот |
|
ендоплазматична мережа |
синтез ліпідів |
|
мітохондрії |
Цикл трикарбонових кислот, ланцюг тканинного дихання, окислення жирних кислот, окисне фосфорилювання |
Метаболізм виконує 4 функції:
1. постачання організму хімічної енергією, отриманої при розщепленні багатих енергією харчових речовин;
2. перетворення харчових речовин в будівельні блоки, які використовуються в клітці для біосинтезу макромолекул;
3. збірка макромолекулярних (біополімери) і надмолекулярних структур живого організму, пластичне та енергетичне підтримку його структури;
4. синтез і руйнування тих біомолекул, які необхідні для виконання специфічних функцій клітини і організму.
Метаболічний шлях - це послідовність хімічних перетворень конкретного речовини в організмі. Проміжні продукти, що утворюються в процесі перетворення, називають метаболітами, а останнім з'єднання метаболічного шляху - кінцевим продукт. Прикладом метаболічного шляху є гліколіз, синтез холестерину.
Метаболічний цикл - це такий метаболічний шлях, один з кінцевих продуктів якого ідентичний одному із з'єднань залучених в цей процес. Найбільш важливими в організмі людини метаболічними циклами є цикл трикарбонових кислот (цикл Кребса) і орнітіновий цикл мочевінообразованія.
Майже всі метаболічні реакції в кінцевому підсумку пов'язані між собою, оскільки продукт однієї ферментативної реакції служить субстратом для іншої, яка в даному процесі відіграє роль наступної стадії. Таким чином, метаболізм можна представити у вигляді надзвичайно складної мережі ферментативних реакцій. Якщо потік поживних речовин в який-небудь однієї частини цієї мережі зменшиться або порушиться, то у відповідь можуть відбутися зміни в іншій частині мережі, для того щоб це перша зміна було якось врівноважено або скомпенсировано. Більш того, і катаболические і анаболічні реакції відрегульовані таким чином, щоб вони протікали найбільш економічно, тобто з найменшою витратою енергії і речовин. Наприклад, окислення поживних речовин в клітині відбувається зі швидкістю, як раз достатньою для того, щоб задовольнити її енергетичні потреби в даний момент.
Специфічні і загальні шляхи катаболізму
У катаболизме розрізняють три стадії:
1. Полімери перетворюються в мономери (білки - в амінокислоти, вуглеводи в моносахариди, ліпіди - в гліцерин і жирні кислоти). Хімічна енергія при цьому розсіюється у вигляді тепла.
2. Мономери перетворюються в загальні продукти, в переважній більшості в ацетил-КоА. Хімічна енергія частково розсіюється у вигляді тепла, частково накопичується у вигляді відновлених коферментних форм (НАДН, ФАДН2), частково запасається в макроергічних зв'язках АТФ (субстратне фосфорилювання).
1-ша і 2-га стадії катаболізму відносяться до специфічних шляхах, які є унікальними для метаболізму білків, ліпідів і вуглеводів.
3. Заключний етап катаболізму, зводиться до окислення ацетил-КоА до СО 2 і Н 2 О в реакціях циклу трикарбонових кислот (циклу Кребса) - спільний шлях катаболізму. окислювальні реакції загального шляху катаболізму пов'язані з ланцюгом тканинного дихання. При цьому енергія (40-45%) запасається у вигляді АТФ (окисне фосфорилювання).
В результаті специфічних і загальних шляхів катаболізму біополімери (білки, вуглеводи, ліпіди) розпадаються до СО 2, Н 2 О і NH 3, які є основними кінцевими продуктами катаболізму.
Метаболіти в нормі і при патології
У живій клітині щомиті утворюються сотні метаболітів. Однак їх концентрації підтримуються на певному рівні, який є специфічною біохімічної константою або референтної величиною. При хворобах відбувається зміна концентрації метаболітів, що є основою біохімічної лабораторної діагностики. До нормальним метаболитам відносять глюкозу, сечовину, холестерол, загальний білок сироватки крові і ряд інших. Вихід концентрації цих речовин за межі фізіологічних норм (підвищення або зниження) говорить про порушення їх обміну в організмі. Більш того, ряд речовин в організмі здорової людини виявляється тільки в певних біологічних рідинах, що обумовлюється специфікою їх метаболізму. Наприклад, білки сироватки крові в нормі не проходять через нирковий фільтр і, відповідно, не виявляються в сечі. Але при запаленні нирок (гломерулонефриті) білки (в першу чергу альбуміни) проникають через капсулу клубочка, з'являються в сечі - протеїнурія і трактуються як патологічні компоненти сечі.
Патологічними метаболітами є мієломні білки (білки Бенс-Джонса), парапротеїни при макроглобулінемії Вальденштрема, накопичення аномального глікогену при глікогенозах, різноманітних фракцій складних ліпідів при сфінголіпідози і т.д. Вони виявляються тільки при хворобах і для здорового організму не характерні.
Рівні вивчення обміну речовин
Рівні вивчення обміну речовин:
1. Цілий організм.
2. Ізольовані органи (перфузіруемих).
3. Зрізи тканин.
4. Культури клітин.
5. гомогенатом тканин.
6. Ізольовані клітинні органели.
7. Молекулярний рівень (очищені ферменти, рецептори і т.д.).
Досить часто для вивчення метаболізму використовують радіоактивні ізотопи (3 H, 32 P, 14 C, 35 S, 18 O), якими позначають речовини, що вводяться в організм. Потім можна простежити клітинну локалізацію цих речовин, визначити період напіврозпаду і їх метаболічні шляхи.
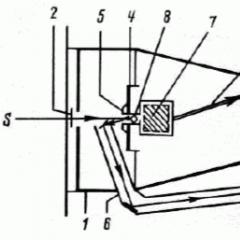
Мал. 8.1. Схема специфічних і загальних шляхів катаболізму
Глава 9. Біологічні мембрани
Клітка представляє біологічну систему, основу якої складають мембранні структури, що відокремлюють клітину від зовнішнього середовища, що формують її відсіки (компартменти), а також забезпечують надходження і видалення метаболітів, сприйняття і передачу сигналів і є структурними організаторами метаболічних шляхів.
Узгоджене функціонування мембранних систем - рецепторів, ферментів, транспортних механізмів допомагає підтримувати гомеостаз клітини і в той же час швидко реагувати на зміни зовнішнього середовища.
Мембрани - Нековалентні надмолекулярних структури. Білки і ліпіди в них утримуються разом безліччю нековалентних взаємодій (кооперативних за характером).
До основних функцій мембран можна віднести:
1. відділення клітини від навколишнього середовища і формування внутрішньоклітинних компартментов (відсіків);
2. контроль і регулювання транспорту величезного розмаїття речовин через мембрани (виборча проникність);
3. участь в забезпеченні міжклітинних взаємодій;
4. сприйняття і передача сигналу всередину клітини (рецепція);
5. локалізація ферментів;
6. енерготрансформірующая функція.
Мембрани асиметричні в структурному і функціональному відношеннях (вуглеводи локалізуються завжди зовні і їх немає на внутрішній стороні мембрани). Це динамічні структури: що входять до їх складу білки і ліпіди можуть рухатися в площині мембрани (латеральна дифузія). Однак існує і перехід білків і ліпідів з одного боку мембрани на іншу (поперечна дифузія, шльопанці), яка відбувається вкрай повільно. Рухливість і плинність мембран залежать від її складу: співвідношенням насичених і ненасичених жирних кислот, а також холестеролу. Плинність мембрани тим нижче, чим вище насиченість жирних кислот в фосфолипидах і чим більше зміст холестеролу. Крім того, для мембран характерна самосборка.
Загальні властивості клітинних мембран:
1. легко проникні для води і нейтральних ліпофільних сполук;
2. в меншій мірі проникні для полярних речовин (цукру, аміди);
3. погано проникні для невеликих іонів (Na +, Cl - і ін.);
4. характерно високий електричний опір;
5. асиметричність;
6. можуть мимовільно відновлювати цілісність;
7. рідинні.
Хімічний склад мембран.
Мембрани складаються з ліпідних і білкових молекул, відносна кількість яких у різних мембран широко коливається. Вуглеводи містяться в формі гликопротеинов, гликолипидов і складають 0,5% -10% речовин мембрани. Згідно рідинно-мозаїчної моделі будови мембрани (Сенджер і Ніколсон, 1972р.) Основу мембрани становить подвійний ліпідний шар, в формуванні якого беруть участь фосфоліпіди і гліколіпіди. Ліпідний бішар утворений двома рядами ліпідів, гідрофобні радикали яких заховані всередину, а гідрофільні групи звернені назовні і контактують з водним середовищем. Білкові молекули як би розчинені в ліпідному Біслі і відносно вільно «плавають в ліпідному море у вигляді айсбергів на яких ростуть дерева гликокаликса».
Ліпіди мембран.
Мембранні ліпіди - амфіфільних молекули, тобто в молекулі є як гідрофільні групи (полярні головки), так і аліфатичні радикали (гідрофобні хвости), мимовільно формують бислой, в якому хвости ліпідів звернені один до одного. Товщина одного ліпідного шару 2,5 нм, з яких 1 нм припадає на головку і 1,5 нм на хвіст. У мембранах присутні три основних типи ліпідів: фосфоліпіди, гліколіпіди і холестерол. Середнє молярне відношення холестерол / фосфоліпіди одно 0,3-0,4, але в плазматичній мембрані це співвідношення набагато вище (0,8-0,9). Наявність холестеролу в мембранах зменшує рухливість жирних кислот, знижує латеральну дифузію ліпідів і білків.
Фосфоліпіди можна розділити на гліцерофосфоліпіди і сфінгофосфоліпіди. Найбільш поширені гліцерофосфоліпіди мембран - фосфатидилхоліну і фосфатидилетаноламін. Кожен гліцерофосфоліпіди, наприклад фосфатидилхолин, представлений декількома десятками фосфатидилхолін, що відрізняються один від одного будовою жирнокислотного залишків.
На частку гліцерофосфоліпідів доводиться 2-8% всіх фосфоліпідів мембран. Найбільш поширеними є фосфатидилинозитол.
Специфічні фосфоліпіди внутрішньої мембрани мітохондрій - кардіоліпін (діфосфатідгліцероли), побудовані на основі гліцерину і двох залишків фосфатидного кислоти, становлять близько 22% від всіх фосфоліпідів мітохондріальних мембран.
У мієлінової оболонці нервових клітин в значних кількостях містяться сфінгомієліни.
Гліколіпіди мембран представлені цереброзидів і ганглиозидов, в яких гідрофобна частина представлена \u200b\u200bцераміди. Гідрофільна група - вуглеводний залишок - гликозидной зв'язком приєднаний до гідроксильної групі першого вуглецевого атома цераміду. У значних кількостях гліколіпіди знаходяться в мебрану клітин мозку, епітелію і еритроцитів. Гангліозид еритроцитів різних індивідуумів розрізняються будовою олігосахаридних ланцюгів і виявляють антигенні властивості.
Холестерол присутній у всіх мембранах клітин тварин. Його молекула складається з жорсткого гидрофобного ядра і гнучкою вуглеводневого ланцюга, єдина гідроксильна група є полярною головкою.
Функції мембранних ліпідів.
Фосфо і гліколіпіди мембран, крім участі в формуванні ліпідного бішару, виконують ряд інших функцій. Ліпіди мембран формують середовище для функціонування мембранних білків, які беруть у ній нативную конформацию.
Деякі мембранні ліпіди - попередники вторинних посередників при передачі гормональних сигналів. Так фосфатіділінозітолдіфосфат під дією фосфоліпази С гидролизируется до діацілгліцерола і інозітолтріфосфат, є вторинними посередниками гормонів.
Ряд ліпідів бере участь в фіксації заякоренних білків. Прикладом заякоренних білка є ацетилхолінестеразою, яка фіксується на постсинаптичні мембрані до фосфатітілінозітолу.
Білки мембран.
Мембранні білки відповідають за функціональну активність мембран і на їх частку припадає від 30 до 70%. Білки мембран відрізняються за своїм становищем в мембрані. Вони можуть глибоко проникати в ліпідний бішар або навіть пронизувати його - інтегральні білки, різними способами прикріплятися до мембрани - поверхневі білки, або, ковалентно контактувати з нею - заякоренних білки. Поверхневі білки майже завжди глікозовані. Олігосахаридні залишки захищають білок від протеолізу, беруть участь в впізнаванні лігандів і адгезії.
Білки, локалізовані в мембрані, виконують структурну і специфічні функції:
1. транспортну;
2. ферментативну;
3. рецепторну;
4. антигенну.
Механізми мембранного транспорту речовин
Розрізняють декілька способів перенесення речовин через мембрану:
1. Проста дифузія - це перенесення невеликих нейтральних молекул за градієнтом концентрації без витрат енергії і переносників. Найлегше проходять простий дифузією через ліпідну мембрану малі неполярні молекули, такі як О2, стероїди, тиреоїдні гормони. Малі полярні незаряджені молекули - СО 2, NH 3, H 2 O, етанол і сечовина - також дифундують з достатньою швидкістю. Дифузія глицерола йде значно повільніше, а глюкоза практично не здатна самостійно пройти через мембрану. Для всіх заряджених молекул, незалежно від розміру, ліпідна мембрана НЕ проникна.
2. Спрощена дифузія - перенесення речовини за градієнтом концентрації без витрат енергії, але з переносником. Характерна для водорозчинних речовин. Полегшена дифузія відрізняється від простої більшою швидкістю перенесення і здатністю до насичення. Розрізняють два різновиди полегшеної дифузії:
Транспорт по спеціальних каналах, утвореним в трансмебранних білках (наприклад, катіонселектівние канали);
За допомогою білків-транслоказ, які взаємодіють зі специфічним лігандом, забезпечують його дифузію по градієнту концентрації (пінг-понг) (перенесення глюкози в еритроцити з допомогою білка-переносника ГЛЮТ-1).
Кінетично перенесення речовин полегшеної дифузії нагадує ферментативну реакцію. Для транслоказ існує насичує концентрація ліганда, при якій всі центри зв'язування білка з лігандом зайняті, і білки працюють з максимальною швидкістю. Тому швидкість транспорту речовин полегшеної дифузії залежить не тільки від градієнтаконцентрацій переноситься речовини, а й від кількості беків-переносників в мембрані.
Проста і полегшена дифузія відноситься до пасивного транспорту, так як відбувається без витрати енергії.
3. Активний транспорт - транспорт речовини проти градієнта концентрації (незаряджені частки) або електрохімічного градієнта (для заряджених частинок), що вимагає витрат енергії, найчастіше АТФ. Виділяють два види його: первинно активний транспорт використовує енергію АТФ або окислювально-відновного потенціалу і здійснюється за допомогою транспортних АТФ-аз. Найбільш поширені в плазматичній мембрані клітин людини Na \u200b\u200b+, K + - АТФ-аза, Са 2+ -АТФ-аза, Н + -АТФ-аза.
При вдруге активному транспорті використовується градієнт іонів, створений на мембрані за рахунок роботи системи первинно активного транспорту (Всмоктування глюкози клітинами кишечника і реабсорбція з первинної сечі глюкози і амінокислот клітинами нирок, здійснювані при русі іонів Na + за градієнтом концентрації).
Перенесення через мембрану макромолекул. Транспортні білки забезпечують перенесення через клітинну мембрану полярних молекул невеликого розміру, але вони не можуть транспортувати макромолекули, наприклад білки, нуклеїнові кислоти, полісахариди або окремі частинки.
Механізми, за допомогою яких клітини можуть засвоювати такі речовини або видаляти їх з клітки, відрізняються від механізмів транспорту іонів і полярних сполук.
1. Ендоцитоз. Це перенесення речовини з середовища в клітину разом з частиною плазматичноїмембрани. Шляхом ендоцитозу (фагоцитозу) клітини можуть поглинати великі частки, такі як віруси, бактерії або фрагменти клітин. Поглинання рідини і розчинених в ній речовин за допомогою невеликих пухирців називають піноцитозом.
2. Екзоцитоз. Макромолекули, наприклад білки плазми крові, пептидні гормони, травні ферменти синтезуються в клітинах і потім секретуються в міжклітинний простір або кров. Але мембрани не проникна для таких макромолекул або комплексів, їх секреція відбувається шляхом екзоцитозу. В організмі є як регульований так і не регульований шляху екзоцитозу. Нерегульована секреція характеризується безперервним синтезом секретується білків. Прикладом може служити синтез і секреція колагену фібробластами для формування міжклітинної матриксу.
Для регульованою секреції характерні зберігання приготованих на експорт молекул в транспортних бульбашках. За допомогою регульованої секреції відбуваються виділення травних ферментів, а також секреція гормонів і нейромедіаторів.
Глава 10. Енергетичний обмін. біологічне окислення
Живі організми з точки зору термодинаміки - відкриті системи. Між системою і навколишнім середовищем можливий обмін енергії, який відбувається відповідно до законів термодинаміки. Кожне органічна сполука, що надходить в організм, має певний запас енергії (Е). Частина цієї енергії може бути використана для здійснення корисної роботи. Таку енергію називають вільною енергією (G). Напрямок хімічної реакції визначається значенням DG. Якщо ця величина негативна, то реакція протікає мимовільно. Такі реакції називаються екзергонічеськие. Якщо DG позитивно, то реакція буде протікати тільки при надходженні вільної енергії ззовні - це ендергонічеськие реакції. В біологічних системах термодинамічно невигідні ендергонічеськие реакції можуть протікати лише за рахунок енергії екзергонічеськие реакцій. Такі реакції називають енергетично сполученими.
Найважливішою функцією багатьох біологічних мембран служить перетворення однієї форми енергії в іншу. Мембрани, що володіють такими функціями, називаються енергопреобразующімі. Будь-яка мембрана, що виконує енергетичну функцію, здатна до перетворення хімічної енергії окислюваних субстратів або АТФ в електричну енергію, а саме в трансмембранну різниця електричних потенціалів (DY) або в енергію різниці концентрацій речовин, що містяться в розділених мембраною розчинах, і навпаки. Серед енергопреобразующіх мембран, що мають найбільше значення, Можна назвати внутрішню мембрану мітохондрій, зовнішню цитоплазматическую мембрану, мембрани лізосом і комплексу Гольджі, саркоплазматический ретикулум. Зовнішня мембрана мітохондрій і ядерна мембрана не може перетворювати одну форму енергії в іншу.
Перетворення енергії в живій клітині описується наступною загальною схемою:
Енергетичні ресурси → ΔμI → робота
де ΔμI - трансмембранная різниця електрохімічних потенціалів іона I. Отже, процеси утилізації енергії та здійснення за рахунок неї роботи виявляються пов'язані через освіту і використання ΔμI. Тому даний іон може бути названий сполучаються іоном. Основним сполучаються іоном в клітці еукаріот є Н +, і відповідно ΔμН + є основною конвертованій формою запасання енергії. Другим за значимістю сполучаються іоном є Na + (ΔμNa +). У той час як Сa 2+, K + і Cl - не використовуються для здійснення будь-якої роботи.
Біологічне окислення - це процес дегідрування субстрату за допомогою проміжних переносників водню і його кінцевого акцептора. Якщо в ролі кінцевого акцептора виступає кисень, процес називається аеробним окисленням або тканинним диханням, якщо кінцевий акцептор представлений не киснем - анаеробним окисленням. Анаеробне окислення має обмежене значення в організмі людини. Основна функція біологічного окислення - забезпечення клітини енергією в доступній формі.
Тканинне дихання - процес окислення водню киснем до води ферментами ланцюга тканинного дихання. Воно протікає за наступною схемою:

Речовина окислюється, якщо віддає електрони або одночасно електрони і протони (атоми водню), або приєднує кисень. Здатність молекули віддавати електрони іншої молекули визначається окислювально-відновним потенціалом (редокс-потенціалом). Будь-яке з'єднання може віддавати електрони тільки речовини з більш високим окислювально-відновним потенціалом. Окислювач і відновник завжди утворюють сполучену пару.
Виділяють 2 типу окислюваних субстратів:
1. Пірідінзавісімие - спиртові або альдегідні - ізоцитрат, α-кетоглутарат, піруват, малат, глутамат, β-гідроксіаціл-КоА, β-гидроксибутират, - в їх дегидрировании беруть участь НАД-залежні дегідрогенази.
2. флавінзавісімие - є похідними вуглеводнів - сукцинат, ацил-КоА, гліцерин-3-фосфат, холін - при дегидрировании передають водень на ФАД-залежні дегідрогенази.
Ланцюг тканинного дихання - послідовність переносників протонів водню (Н +) і електронів від окисляемого субстрату на кисень, локалізованих на внутрішній мембрані мітохондрій.

Мал. 10.1. схема ЦТД
Компоненти ЦТД:
1. НАД-залежні дегідрогенази дегидрирующей пірідінзавісімие субстрати і акцептують 2ē і один Н +.
2. ФАД (ФМН) - залежні дегідрогенази акцептують 2 атома водню (2Н + і 2ē). ФМН - залежна дегидрогеназа дегидрирующей тільки НАДН, в той час як ФАД-дегідрогенази окислюють флавінзавісімие субстрати.
3. Жиророзчинний переносник убихинон (кофермент Q, КоQ) - вільно переміщається по мембрані мітохондрій і акцептує два атома водню і перетворюється в КоQH 2 (відновлена \u200b\u200bформа - убіхінол).
4. Система цитохромов - переносить тільки електрони. Цитохроми залізовмісні білки, простетичної група яких за структурою нагадує гем. На відміну від гема атом заліза в цитохроме може зупинити переходити з двох - в тривалентне стан (Fe 3+ + ē → Fe 2+). Це і забезпечує участь цитохрому в транспорті електронів. Цитохроми діють в порядку зростання їх редокс-потенціалу і в дихальної ланцюга розташовуються в такий спосіб: b-с 1-з-а-а 3. Два останніх працюють в асоціації як один фермент цитохромоксидаза аа 3. Цитохромоксидази складається з 6 субодиниць (2 - цитохрому а й 4 - цитохрому а 3). У цитохроме а 3 крім заліза є атоми міді і він передає електрони безпосередньо на кисень. Атом кисню при цьому заряджається негативно і набуває здатності взаємодіяти з протонами з утворенням метаболічної води.
Железосерние білки (FeS) - містять негемове залізо і беруть участь в окисно-відновних процесах, що протікають по одноелектронні механізму і асоційовані з флавопротеїнами і цитохромом b.
Структурна організація ланцюга тканинного дихання
Компоненти дихального ланцюга у внутрішній мембрані міхохондрій формують комплекси:
1. I комплекс (НАДН-КоQН 2 -редуктазою) - приймає електорони від мітохондріального НАДН і транспортує їх на КоQ. Протони транспортуються в межмембранное простір. Проміжним акцептором і переносником протонів і електронів є ФМН і железосерние білки. I комплекс розділяє потік електронів і протонів.
2. II комплекс - сукцинат - КоQ - редуктаза - включає ФАД- залежні дегідрогенази і железосерние білки. Він транспортує електрони і протони від флавінзавісімих субстратів на убіхінон, з утворенням проміжного ФАДН 2.
Убіхінон легко переміщується по мембрані і передає електрони на III комплекс.
3. III комплекс - КоQН 2 - цитохром с - редуктаза - має в своєму складі цитохроми b і з 1, а також железосерние білки. Функціонування КоQ з III комплексом призводить до поділу потоку протонів і електронів: протони з матриксу перекачуються в межмембранное простір мітохондрій, а електрони транспортуються далі по ЦТД.
4. IV комплекс - цитохром а - цитохромоксидаза - містить цитохромоксидазу і транспортує електрони на кисень з проміжного переносника цитохрому с, який є рухомим компонентом ланцюга.
Існує 2 різновиди ЦТД:
1. Повна ланцюг - в неї вступають пірідінзавісімие субстрати і зраджують атоми водню на НАД-залежні дегідрогенази
2. Неповна (укорочена або скорочена) ЦТД в якій атоми водню передаються від ФАД-залежних субстратів, в обхід першого комплексу.
Окислювальне фосфорилювання АТФ
Окислювальне фосфорилювання - процес утворення АТФ, пов'язаний з транспортом електронів по ланцюгу тканинного дихання від окисляемого субстрату на кисень. Електрони завжди прагнуть переходити від електронегативний систем до електропозитивні, тому їх транспорт по ЦТД супроводжується зниженням вільної енергії. У дихального ланцюга на кожному етапі зниження вільної енергії відбувається поступово. При цьому можна виділити три ділянки, в яких перенесення електронів супроводжується відносно великим зниженням вільної енергії. Ці етапи здатні забезпечити енергією синтез АТФ, Так як кількість виділяється вільної енергії приблизно дорівнює енергії, необхідної для синтезу АТФ з АДФ і фосфату.
Для пояснення механізмів сполучення дихання і фосфорилювання висунутий ряд гіпотез.
Механохімічна або конформационная (Грін-Бойера).
В процесі перенесення протонів і електронів змінюється конформація білків-ферментів. Вони переходять в нове, багате енергією конформационное стан, а потім при поверненні в вихідну конформацію віддають енергію для синтезу АТФ.
Гіпотеза хімічного сполучення (Ліпмана).
У сполученні дихання і фосфорилювання беруть участь «сполучають» речовини. Вони акцептують протони й електрони і взаємодіють з Н 3 РО 4. У момент віддачі протонів і електронів зв'язок з фосфатом стає макроергічним і фосфатна група передається на АДФ з утворенням АТФ шляхом субстратного фосфорилювання. Гіпотеза логічна, проте до цих пір не виділені «сполучають» речовини.
Хеміоосмотіческая гіпотеза Пітера Мітчелла (1961р.)
Основні постулати цієї теорії:
1. внутрішня мембрана мітохондрій непроникна для іонів Н + і ОН -;
2. за рахунок енергії транспорту електронів через I, III і IV комплекси дихального ланцюга з матриксу викачуються протони;
3. виникає на мембрані електрохімічний потенціал є проміжною формою запасання енергії;
4. повернення протонів в матрикс мітохондрії через протонний канал АТФ синтази є постачальником енергії для синтезу АТФ за схемою
АДФ + Н 3 РО 4 → АТФ + Н 2 О
Докази хеміоосмотіческой теорії:
1. на внутрішній мембрані є градієнт Н + і його можна виміряти;
2. створення градієнта Н + в мітохондрії супроводжується синтезом АТФ;
3. іонофори (разобщители), що руйнують протонний градієнт, гальмують синтез АТФ;
4. інгібітори, блокуючі транспорт протонів по протонним каналах АТФ-синтази, пригнічують синтез АТФ.
Будова АТФ-синтази
АТФ-синтаза - інтегральний білок внутрішньої мембрани мітохондрій. Він розташований в безпосередній близькості до дихального ланцюга і позначається як V комплекс. АТФ-синтаза складається з 2 субодиниць, що позначаються як F 0 і F 1. Гідрофобний комплекс F 0 занурений у внутрішню мембрану мітохондрій і складається з декількох протомеров, що утворюють канал по якому протони переносяться в матрикс. Субодиниця F 1 виступає в мітохондріальний матрикс і складається з 9 протомеров. Причому три з них пов'язують субодиниці F 0 і F 1, утворюючи своєрідну ніжку і є чутливими до олігоміціну.
Суть хеміоосмотіческой теорії: за рахунок енергії перенесення електронів по ЦТД відбувається рух протонів через внутрішню мітохондріальну мембрану в межмембранное простір, де створюється електрохімічний потенціал (ΔμН +), який призводить до конформаційної престройке активного центру АТФ-синтази, в результаті чого стає можливим зворотний транспорт протонів через протонні канали АТФ-синтази. При поверненні протонів назад електрохімічний потенціал трансформується в енергію макроергічних зв'язку АТФ. Новоутворена АТФ за допомогою білка-переносника транслокази переміщається в цитозоль клітини, а натомість в матрикс надходять АДФ і Ф н.
Коефіцієнт фосфорилювання (Р / О) - число атомів неорганічного фосфату, включених в молекули АТФ, в перерахунку на один атом використаного поглиненого кисню.
Пункти фосфорилювання - ділянки в дихальної ланцюга, де енергія транспорту електоронов використовується на генерацію протонного градієнта, а потім в ході фосфорилювання запасається у формі АТФ:
1. 1 пункт - між пірідінзавісімой і флавінзавісімой дегідрогеназ; 2 пункт - між цитохромами b і з 1; 3 пункт - між цитохромами а й а 3.
2. Отже, при окисленні НАД-залежних субстратів коефіцієнт Р / О дорівнює 3, тому що електрони від НАДН транспортуються за участю всіх комплексів ЦТД. Окислення ФАД-залежних субстратів йде в обхід I комплексу дихального ланцюга і Р / О дорівнює 2.
Порушення енергетичного обміну
Всі живі клітини постійно потребують АТФ для здійснення різних видів діяльності. Порушення будь-якого етапу метаболізму, що призводять до припинення синтезу АТФ, згубні для клітини. Тканини з високими енергетичними потребами (ЦНС, міокард, нирки, скелетні м'язи і печінку) є найбільш уразливими. Стану, при яких синтез АТФ знижений об'єднують терміном «гіпоенергетіческое». Причини даних станів можна розбити на дві групи:
Аліментарні - голодування і гіповітаміноз В2 і РР - виникає порушення поставки окислюваних субстратів в ЦТД або синтез коферментів.
Гипоксические - виникають при порушенні доставки або утилізації кисню в клітині.
Регуляція ЦТД.
Здійснюється за допомогою дихального контролю.
Дихальний контроль - це регуляція швидкості перенесення електронів по дихальному ланцюгу ставленням АТФ / АДФ. Чим менше це відношення, тим інтенсивніше йде дихання і активніше синтезується АТФ. Якщо АТФ не використовується, і його концентрація в клітині зростає, то припиняється потік електронів до кисню. Накопичення АДФ збільшує окислення субстратів і поглинання кисню. Механізм дихального контролю характеризується високою точністю і має важливе значення, так як в результаті його дії швидкість синтезу АТФ відповідає потребам клітини в енергії. Запасів АТФ в клітці не існує. Відносні концентрації АТФ / АДФ у тканинах змінюються у вузьких межах, в той час як споживання енергії клітиною може змінюватися в десятки разів.
Американський біохімік Д. Чанс запропонував розглядати 5 станів мітохондрій, при яких швидкість їх дихання обмежується певними факторами:
1. Недолік SH 2 і АДФ - швидкість дихання дуже низька.
2. Недолік SH 2 при наявності АДФ - швидкість обмежена.
3. Є SH 2 і АДФ - дихання дуже активно (лімітується тільки швидкістю транспорту іонів через мембрану).
4. Недолік АДФ при наявності SH 2 - дихання гальмується (стан дихального контролю).
5. Нестача кисню, при наявності SH 2 і АДФ - стан анаеробіозу.
Мітохондрії в спочиває клітці знаходяться в стані 4, при якому швидкість дихання визначається кількістю АДФ. Під час посиленої роботи можуть перебувати в стані 3 (вичерпуються можливості дихального ланцюга) або 5 (недолік кисню) - гіпоксії.
Інгібітори ЦТД - це лікарські препарати, які блокують перенесення електронів по ЦТД. До них відносять: барбітурати (амитал), які блокують транспорт електронів через I комплекс дихального ланцюга, антибіотик антіміцін блокує окислення цитохрому b; монооксид вуглецю і ціаніди інгібують цітохромооксідазу і блокують транспорт електронів на кисень.
Інгібітори окисного фосфорилювання (олігоміцін) - це речовини, які блокують транспорт Н + з протонному каналу АТФ-синтази.
Разобщители окисного фосфорилювання (іонофори) - це речовини, які пригнічують окисне фосфорилювання, не впливаючи при цьому на процес перенесення електронів по ЦТД. Механізм дії разобщітелей зводиться до того, що вони є жиророзчинними (липофильними) речовинами і володіють здатністю зв'язувати протони і переносити їх через внутрішню мембрану мітохондрій в матрикс, минаючи протонний канал АТФ-синтази. Виділяється при цьому енергія розсіюється у вигляді тепла.
Штучні разобщители - динитрофенол, похідні вітаміну К (дикумарол), деякі антибіотики (валиномицин).
Природні разобщители - продукти перекисного окислення ліпідів, жирні кислоти з довгим ланцюгом, великі дози йодовмісних гормонів щитовидної залози, білки термогеніни.
На роз'єднанні дихання і фосфорилювання базується терморегуляторна функція тканинного дихання. Мітохондрії бурої жирової тканини продукують більше тепла, так як присутній в них білок термогенін роз'єднує окислювання й фосфоріліровніе. Це має важливе значення в підтримці температури тіла новонароджених.
На відміну від різноманіття макросвіту (світу великих і видимих \u200b\u200bнеозброєним оком істот) світ мікробів характеризується відносною одноманітністю. Існуючі в даний час більше 3000 різних видів бактерій, але своїм зовнішнім виглядом поділяються на 3 основні форми:
Кулясті або елліпсовідниє (коки) розмірами від 1 до 2 мікрон (рис. 1.3). Коки відносяться до найбільш простій формі бактерій; вони можуть з'єднуватися один з одним, утворюючи диплококки (по дві), тетра-коки (по чотири) і стрептококи (ланцюжки); - паличкоподібні або циліндричні розмірами від 1 до 5 мікро (рис. 1.4). Вони також здатні з'єднуватися один з одним попарно верб ланцюжок і дають велику різноманітність форм бактерій (діплобактеріі, діплобацілли, стрептобацили, стрептобактерій); - Звиті або спірили розмірами від 1 до 30 мікрон.
Мікроорганізми-деструктори. Провідна роль в трансформації і мінералізації органічних ксенобіотиків належить хемоорганотрофним (гетеротрофних) мікроорганізмам, особливо бактеріям, які синтезують різноманітні ферментні системи.
З бактерій, що розщеплюють органічні ксенобіотики, по частоті, кількістю видів (близько 30) і спектру руйнуються з'єднань перше місце займають псевдомонади.
Біодеградуючі активність співтовариства мікроорганізмів залежить від його складу, швидкості росту і обміну між видами поживними речовинами і генетичним матеріалом. Накопичуються метаболіти можуть бути токсичні для одного компонента спільноти і можуть засвоюватися іншими мікроорганізмами, що прискорює в сукупності процес розкладання (феномен детоксификации).
З огляду на способи отримання біологічних об'єктів - деструкторів ксенобіотиків, можливі два варіанти біоочищення і біоремедіації. Перший варіант - для ділянок із застарілими забрудненнями, де майже завжди живе дика, аборигенна мікрофлора, здатна їх трансформувати. Такі забруднення можна видаляти in situ(За місцем) без внесення біопрепаратів. При цьому биодеградация лімітується факторами навколишнього середовища і властивостями забруднення, такими як вміст кисню в середовищі, розчинність речовини-забруднювача і ін. Другий варіант - попередньо отримують біологічно активний штам, накопичують життєздатні клітини, які вносять у вигляді біопрепарату в забруднену середу. Цей варіант доцільно застосовувати в північних регіонах і при обробці місць з незастарелимі забрудненнями;
Здатність мікроорганізмів руйнувати ксенобіотик або інший поллютантами залежить від наявності в клітинах генів, що визначають синтез ферментів, які беруть участь в деградації з'єднання. Конструювання рекомбінантних штамів - деструкторів ксенобіотиків полягає в об'єднанні кількох генів або їх блоків, відповідальних за первинний метаболізм сполук. Перевага такого об'єднання - генетично модифіковані мікроорганізми (ГММО) можуть синтезувати різні ферменти системи, що дозволяє ефективно і швидко руйнувати широкий спектр хімічних забруднень.
Біологічне очищення стічних вод. Принципові схеми очисних спорудженні. Основні принципи роботи, методи і споруди аеробного і анаеробної біологічної очистки стічних вод і переробки промислових відходів.
Класифікація біологічних методів очищення. біологічні методи очищення застосовуються для очищення господарсько-побутових і промислових стічних вод (рис.2.1) від багатьох розчинених органічних і деяких неорганічних речовин (Сірководню, сульфідів, аміаку, нітратів та ін.). Процес очищення заснований на здатності мікроорганізмів використовувати ці речовини для харчування. Контактуючи з органічними речовинами мікроорганізми частково руйнують їх, перетворюючи в воду, діоксид вуглеводу, нітрит, сульфатіони і ін. Органічні речовини для мікроорганізмів є джерелом вуглецю. Руйнування органічних речовин за допомогою мікроорганізмів називають біохімічним окисленням.
Анаеробні мікробіологічні процеси здійснюються при мінералізації як розчинених органічних речовин, так і твердої фази стічних вод. Анаеробні процеси протікають в уповільненому темпі, йдуть без доступу кисню, використовуються, головним чином, для зброджування опадів. Аеробний метод очищення заснований на використанні аеробних груп мікроорганізмів, для життєдіяльності яких необхідний постійний приплив кисню і температура 20-40 ° С.
Доступність будь-якого речовини біологічного окислення може бути оцінена величиною біохімічного показника, під яким розуміють відношення величин повного БПК (БПК повн) і ГПК. Біохімічний показник є параметром, необхідним для розрахунку і експлуатації промислових біологічних споруд для очищення стічних вод. При величині біохімічного показника дорівнює або більше 0,5, речовини піддаються біохімічному окисленню. Величина біохімічного показника коливається в широких межах для різних груп стічних вод. Промислові стічні води мають низький показник (0,05 - 0,3), побутові стічні води - понад 0,5.
Споруди біологічної очистки стічних вод. Основними спорудами біохімічної очистки служать аеротенки і вторинні відстійники.
Аеротенк є апарат з постійно протікає стічною водою, у всій товщі якої розвиваються аеробні мікроорганізми, які споживають субстрат, тобто "Забруднення" цієї стічної води. Біологічне очищення стічних вод в аеротенках відбувається в результаті життєдіяльності мікроорганізмів активного мулу. Стічна вода безперервно перемішується і аерується до насичення киснем повітря. Активний мул являє собою суспензію мікроорганізмів, здатну до флокуляції.
Існує також класифікація аеротенків за величиною "навантаження" на активний мул: високонавантажувані (аеротенки на неповну очистку), звичайні і нізконагружаемие (аеротенки продовженої аерації). Велике значення в конструкції аеротенків має система аерації. Аераційні системи призначені для подачі і розподілу кисню або повітря в аеротенках, а також підтримки активного мулу в підвішеному стані.
Аеротенки-змішувачі (Аеротенки повного змішання, рис.2, роздатковий матеріал) характеризуються рівномірним подаванням по довжині споруди вихідної води і активного мулу і рівномірним відведенням мулової суміші. Повне змішення в них стічних вод з мулової сумішшю забезпечує вирівнювання концентрацій мулу і швидкостей процесу біохімічного окислення, тому аеротенки-змішувачі більш пристосовані для очищення концентрованих виробничих стічних вод (БПК повне до 1000 мг / л) при різких коливаннях їх витрати, складу і кількості забруднень .
Аеротенки-витискувачі. На відміну від аеротенків інших типів (аеротенків-змішувачів і аеротенків проміжного типу), аеротенки-витискувачі (рис.2., Роздатковий матеріал) представляють собою споруди, в яких очищається стічна вода поступово переміщається від місця впуску до місця її випуску. При цьому практично не відбувається активного перемішування надходить стічної води з раніше надійшла. Процеси, які відбуваються в цих спорудах, характеризуються змінною швидкістю реакції, оскільки концентрація органічних забруднень зменшується по ходу руху води. Аеротенки-витискувачі вельми чутливі до зміни концентрації органічних речовин в надходить воді, особливо до залповим надходженням зі стічними водами токсичних речовин, тому такі споруди рекомендується застосовувати для очищення міських і близьких за складом до побутових і промислових стічних вод.
Аеротенки з розосередженим впусканням (Рис.2, роздатковий матеріал) стічної води займають проміжне положення між змішувачами і витискувачами; їх застосовують для очищення сумішей промислових і міських стічних вод.
Аеротенки можна компонувати з окремими вторинними відстійниками або об'єднувати в блок при прямокутній формі обох споруд в плані. Найбільш компактні комбіновані споруди - аеротенки-відстійники. За кордоном цей тип споруди круглої в плані форми з механічними аераторами отримав назву аероакселатора. Поєднання аеротенках з відстійником дозволяє збільшити рециркуляцию мулової суміші без застосування спеціальних насосних станцій, поліпшити кисневий режим в відстійнику і підвищити дозу мулу до 3-5 г / л, відповідно збільшивши окислительную потужність споруди.
різновид аеротенках-відстійника - аероакселатор представляє собою круглу в плані споруду. Освітлені стічні води надходять в нижню частину зони аерації, куди пневматичним або пневмомеханічний способом подається повітря, що забезпечує процес біохімічного окислення, а також створює циркуляційний рух рідини в цій зоні і підсмоктування мулової суміші з циркуляційної зони відстійника. Із зони аерації иловая суміш через затоплені регульовані переливні вікна надходить в воздухоотделітель і далі в циркуляційну зону відстійника. Значна частина мулової суміші через щілину повертається в зону аерації, а відводяться очищені стічні води через шар зваженого осаду надходять в відстійну зону.
вторинні відстійники є складовою частиною споруд біологічного очищення, розміщуються у технологічній схемі безпосередньо після біоокіслітелей і служать для відділення активного мулу від біологічно очищеної води, що виходить з аеротенків, або для затримання біологічної плівки, що надходить з водою з біофільтрів. Ефективність роботи вторинних відстійників визначає кінцевий ефект очищення води від зважених речовин. Для технологічних схем біологічної очистки стічних вод в аеротенках вторинні відстійники в якійсь мірі визначають також обсяг аераційних споруд, що залежить від концентрації поворотного мулу і ступеня його рециркуляції, здатності відстійників ефективно розділяти висококонцентровані мулові суміші.
Иловая суміш, яка надходить з аеротенків у вторинні відстійники, являє собою гетерогенну (багатофазну) систему, в якій дисперсійним середовищем служить біологічно очищена стічна вода, а основним компонентом дисперсної фази є хлопки активного мулу, сформовані у вигляді складної трирівневої клітинної структури, оточеній екзоклеточним речовиною біополімерного складу.
Анаеробну очищення використовують для видалення забруднень із стічних вод, в якості першого ступеня очищення стічних вод з високою концентрацією органічних забруднень (БПК n\u003e 4-5 г / л), а також для переробки активного мулу, інших опадів і твердих відходів. Багато тверді відходи містять целюлозу, легше піддається анаеробного розкладання з утворенням біогазу, ніж аеробному окислюванню.
В ході метаногенераціі (метаногенеза) - анаеробного процесу з утворенням метану - органічні забруднення конвертуються в біогаз, що містить в основному СН 4 і С0 2. Його можна використовувати в якості палива. Кількість виділеного біогазу достатньо не тільки для компенсації енергетичних витрат на анаеробне розкладання, але і для використання сторонніми споживачами - в котельнях або нагревателях для отримання пари і гарячої води, в стаціонарних газогенераторах для отримання електроенергії з рекуперацією тепла, в технологічних процесах термосушкі і спалювання опадів і ін.
Біоценози і біо хімічні процеси при анаеробної очистки. формування ценозов. Анаеробні біоценози при очищенні стічних вод можуть являти собою флокули, біоплівки і гранули мулу. Вони розвиваються в екосистемах з домінуванням аноксигенний і анаеробних умов, в яких протікають процеси бродіння, аноксигенний окислення (анаеробного дихання) і метаноутворення.
Аноксигенний окислення органічних субстратів включає процеси де- нітрифікації і сульфатредукции, що протікають при наявності іонів N0 3, - N0 2 -, S0 4 2- і, як правило, при відсутності кисню. Ці процеси використовуються для видалення сполук азоту і сірки з стічних вод.
Основний процес, який відбувається в анаеробних умовах і використовується для розкладання і видалення органічних забруднень і відходів, - метаногенеза. В процесі метаногенераціі (часто званим «метановим бродінням») відбувається розкладання органічних субстратів і забруднень, знезараження і детоксикація стоків. У природі цей процес протікає в різних середовищах з анаеробними умовами, в рубці жуйних тварин, в термітниках.
Метаногенерація - складний, багатоступінчастий процес, в якому вихідні органічні речовини послідовно перетворюються в більш прості з переходом значної частини вуглецю в метан і вуглекислий газ і в мулову рідина. Метанове розкладання включає три стадії анаеробного бродіння (рис.5.1): гідролізу, кислотну (ацідогенним), ацетогенную і четверту, метаногенів стадію (стадію газоутворення).
У першій стадії бродіння беруть участь мікроорганізми-гідролітіков, що володіють целлюлолитической, протеолітичної, амилолитической, ліполітичною, аммоніфіцірующей активностями. Вміщені в середовищі нітрати і сульфати відновлюються бактеріями-денітріфікатори і сульфатредуктори. В результаті гідролізу целюлоза і геміцелюлози, білки, жири і інші компоненти гідролізуються з утворенням жирних кислот, гліцерину, пептидів, амінокислот, моно- і дісахаров і в невеликій кількості оцтової кислоти, Метанолу, аміаку, водню. У гідролізі беруть участь бактерії pp. Clostridium, Bacillus, а також Bacteroides, Butyrivibrio, Cellobacterium, Eubacterium, Bifidobacterium, Lactobacillus, Selenomonas. На ацідогенним стадії протікають різні пилки бродіння: спиртове, маслянокислое, ацетоно-бутилове, пропіонова і інші, в ході яких бактерії-ацідогени зброджують утворюються продукти гідролізу, наприклад глюкозу, до органічних кислот:
Споживаючи моно- і олігосахариди, амінокислоти та інші проміжні продукти гідролізу, ці бактерії тим самим запобігають інгібірованіс продуктами гідролізу гидролитических ферментів, які беруть участь в першій фазі бродіння.
В результаті розщеплення на перших двох стадіях 70-80% з утворюються органічних продуктів складають вищі жирні кислоти, до 20% - ацетат і 3-5% - водень. Серед інших продуктів - ізомасляной, фенилуксусная, бензойна, індолілбензойная кислоти, NH 4 +, H, S, бутанол, пропанол, С0 2 і ін.
На ацетогенной стадії бродіння гетероацетогенние бактерії (ацетогени) pp. Clostridium, Syntrophus і інших переводять органічні кислоти, наприклад пропионовую і масляну, інші продукти ацидогенез в оцтову кислоту:

Основну роль в метановому розкладанні грає заключна стадія, яка виконується строгими анаеробами - метанообразуюшімі бактеріями. Вони більш чутливі до умов середовища. Час генерації клітин метаногенів становить кілька діб. Їх активність максимальна при рН середовища від 6,8 до 7,5. При більш низьких і високих значеннях рН розвиток метаногенів сповільнюється або припиняється зовсім.
Продукт реакцій метаногенной стадії - СН 4. Освіта його можливо двома шляхами. Метаногенів бактерії-літотрофи (pp. Methanococcus, Methanobacterium, Methanospirillum, Methanomicrobium, Methanogenium, Methanothermus, Methanobrevibacter) споживають в якості субстрату Н 2 і С0 2, а також СО і форміат:
С0 2 + 4Н 2 → СН 4 + 2Н 2 0
4НСООН → СН 4 + ЗС0 2 + 2Н, 0
4СО + 2Н 2 0 → СН 4 + ЗС0 2
Мікроорганізми-ацетотрофи (pp. Methanosarcina, Melhanosaeta, Methano- planus) використовують ацетат, метанол, метиламін:
CH 3 СООН → CH 4 + CО 2
4СН 3 ОН → ЗСН 4 + С0 2 + 2Н 2 0
4CH 3 NH 2 + 2Н 2 0 → ЗСН 4 + 4NH 3 + СО
Внаслідок руйнування органічних кислот рН середовища підвищується, реакція середовища стає шелочной, тому метаногенів стадію іноді називають «лужним бродінням».
При розкладанні оцтової кислоти утворюється 70-75% метану, а решта 25-30% - в результаті синтезу з вуглекислоти і водню і протікання інших реакцій. Співвідношення кінцевих продуктів в процесі метанового бродіння залежить від складу середовища, умов ферментації і присутньої мікрофлори.
Великим стимулом до розвитку багатьох із сучасних методів анаеробної очистки послужило виявлення в середині 1970-х рр. здатності мікроорганізмів, що входять до складу метаногенів спільноти, утворювати агрегати - гранули (пелети) при зростанні в анаеробному реакторі в умовах висхідного потоку (рис. 5,2 роздатковий матеріал).
Особливу роль у формуванні і функціонуванні гранул виконують метаногенів бактерії Methanosaeta concilii (Methanothrix soehngenii), а також Methanosarcina spp. Бактерії p. Methanosaeta утворюють хворосто- і клубкообразние структури (рис. 5.3), всередині яких групуються мікроколонії бактерій Methanosarcina (рис. 5.4). Завдяки цьому формуються агрегати у вигляді щільних легко осідають гранул розміром 1-5 мм.
До споруд традиційних конструкцій відносяться септітенкі, освітлювачі-перегнівателі, контактні реактори, анаеробні лагуни, метантенки, анаеробні біофільтри з висхідним потоком рідини (см.раздаточний матеріал, рис. 3.5).
Септітенк (септик) являє собою апарат, що складається з двох частин: отстойной і септичній (рис. 6.1). У першій частині відбувається освітлення води внаслідок руху її з малою швидкістю, а у другій частині, розташованій під першою, - перегнивання осаду при зберіганні його в протягом 6-12 міс. Відстійна і септична частини септика не розділені між собою. Тривалість перебування води в септику - 3-4 діб. Септики застосовуються, якщо кількість стічних вод не перевищує 25 м 3 / сут.
Септітенкі часто використовуються для зброджування активного мулу вторинних відстійників, опадів первинних відстійників і піни з метою накопичення осаду, зменшення його обсягу, поганого запаху і кількості патогенної мікрофлори. Септики є найбільш поширеними очисними спорудами для індивідуальних домогосподарств, оскільки можуть працювати автономно і не потребують електроживлення.
Освітлювачі-перегнівателі, які можна розглядати як різновид септітенка, застосовують на станціях очистки стічних вод з пропускною спроможністю до 30000 м 5 / сут. На рис. .2 приведена конструкція освітлювача - перегнівателя, виконаного у вигляді комбінованого споруди, що складається з освітлювача, концентрично наявного всередині перегнівателя.
Метод анаеробної очистки в контактному реакторі був одним з перших, широко застосовуваних у промисловості з початку 1930-х рр., Зокрема, для обробки стоків цукрових, спиртових і дріжджових виробництв. У порівнянні з септітенком контактний реактор набагато продуктивніше, оскільки в ньому передбачається перемішування середовища з анаеробним мулом і підтримується більш висока концентрація мулу за рахунок повернення його частини з вторинного відстійника (см.раздаточний матеріал до лекціі3, рис. 3.5), т. Е. Аналогічно тому, як це реалізується в аеротенках з вторинним відстійником. Для підвищення ефективності поділу иловая рідина перед вторинним відстійником може додатково піддаватися дегазації (в окремій ємності) або охолодження. При дегазації газ видаляють механічним (гідравлічним) способом або дією вакууму. Охолодження призводить до уповільнення процесів метаноутворення і, як наслідок, утворення нових бульбашок, що покращує седиментаційних властивості анаеробного мулу.
Традиційними і найбільш поширеними апаратами для проведення анаеробного розкладання є метантенки. Вони використовуються для зброджування стоків з високою концентрацією забруднень і розкладання органічних відходів, зокрема, активного мулу очисних споруд.
Метантенки працюють з обігрівом, як правило, в періодичному режимі завантаження відходів або стічних вод, з постійним відбором біогазу і вивантаженням твердого осаду у міру завершення процесу. Їх виготовляють зі сталі, бетону, пластмас, цегли; вони розрізняються формою резервуара, кількістю камер зброджування, способом завантаження, вивантаження субстрату, способами обігріву і перемішування.
Метантенки великого обсягу виготовляють у вигляді вертикальних резервуарів циліндричної або еліпсоїдної форми з примусовим перемішуванням сбраживаемой маси, вони розраховані на надлишковий тиск газу до 5 кПа. Невеликі біогазові установки можуть являти собою циліндричні горизонтальні або вертикальні біореактори з механічним перемішуванням, частково або повністю заглиблені в грунт для зниження тепло- втрат. Конструкція біореакторів повинна забезпечувати можливість повного спорожнення резервуара, тому дніше часто виконується скошеним, полусферическим або у формі конуса.
Метантенки з нерухомим незатопленним перекриттям мають недолік, властивий спорудам з жорсткими перекриттями - мінливість тиску всередині реактора. Під час вивантаження осаду всередині метантенка може утворитися вакуум, а при завантаженні підвищитися тиск. Це призводить до руйнування конструкцій, утворення тріщин.
Переваги метантенка з плаваючим перекриттям: 1) вибухобезпечність, так як незалежно від наповнення метантенка в ньому підтримується позитивний тиск газу, що виключає можливе попадання повітря всередину споруди; 2) за матеріальним становищем плаваючого перекриття можна здійснити дозування завантаження і вивантаження; 3) полегшується боротьба з утворенням кірки.
Роль перемішування і температурного режиму в метатенках.Метантенкі всіх типів можуть працювати в мезофільному (20-45 ° С, зазвичай 30-35 ° С) і термофильном (50-60 ° С) температурних режимах. Режим зброджування вибирають з урахуванням методів подальшої обробки та утилізації осадів, а також санітарних вимог. Мезофільні режим використовується чаші, оскільки він є менш енерговитратним і більш економічно вигідним, допускає існування більшого числа видів мікроорганізмів і тому більш стабільний, менш чутливий до змін умов навколишнього середовища; опади в цьому режимі після переробки обезвоживаются краще в порівнянні з термофільним процесом. Однак при термофільному швидкість розпаду органічних сполук вище (приблизно в 2 рази) і вище ступінь їх розпаду, досягається практично повна дегельмінтизація опадів, що важливо, якщо опади використовуються в якості рекультіванта або добрива для ґрунту. Тривалість зброджування при мезофільному режимі 20-30 діб., При термофильном - близько 10 діб. Теплотворна здатність газу при термофильном сбраживании на 5% нижче, ніж при мезофільному.
Для більш повного проведення процесу метаногенераціі необхідно ретельне перемішування вмісту метантенка, щоб забезпечити рівномірний розподіл вмісту реактора, необхідні умови масо-і теплообміну, звести до мінімуму злипання, утворення піни і кірки, формування придонного осаду, видалити гази. Для перемішування в метантенке використовують механічні мішалки, циркуляційні насоси, гідроелеватори або комбінацію цих систем.
Оптимальна концентрація зважених речовин в метантенке, при якій спостерігається висока інтенсивність метаноутворення, знаходиться в інтервалі 2-10%. При концентрації твердих частинок вище 10-12% перемішування середовища ускладнюється, і це призводить до зниження газовиділення. У таких випадках застосовуються спеці & чьние конструкції біореакторів, що забезпечують необхідний рівень перемішування.
Метаноутворення протікає з максимальною швидкістю при рН від 6 до 8. При зниженні рН нижче 5,5 (у разі «закисання» метантенка) активність метаногенних бактерій припиняється. Як правило, рН не регулюють внаслідок високої буферної ємності середовища. Але при закислення середовища найкращим нейтрализующим засобом є розчин NaHC0 3.
Процес метаногенеза сповільнюється в присутності різних детергентів (при їх концентрації близько 15 мг / л), антибіотиків та інших речовин. З аніоногенних ПАР порівняно повно розпадаються і слабо гальмують процес зброджування алкілсульфати, хлорний сульфанол; важко піддаються розпаду і сильно гальмують зброджування Сульфанол.
Анаеробні реактори стійкі до тривалих перерв в подачі стічної води, змінам хімічного складу вступників стоків, що дозволяє ефективно використовувати їх для очищення стоків сезонних виробництв, а також в режимах малих навантажень. У разі зниження метаногенной активності для її відновлення можна знижувати швидкість подачі субстрату, подщелачивать середу хімічними речовинами, розбавляти стоки водою, видаляти токсичні сполуки шляхом попередньої обробки стоків.
бактеріальне вилуговування хімічних елементів з руд, концентратів і гірських порід, Збагачення руд, біосорбції металів з розчинів. Видалення сірки з нафти і вугілля. Підвищення нафтовіддачі. Видалення метану з вугільних пластів. Придушення біокорозіі нафтопродуктів.
Дослідження по бактеріального окислення заліза і вилуговування металів розпочаті після виділення в 50-х роках ХХ століття з дренажних кислих вод вугільної шахти мікроорганізмів, здатних брати участь в окисленні двовалентного заліза до тривалентного - бактерій Acidithiobaccilus ferrooxidans (раніше називалися Thiobaccilus ferrooxidans). Бактерії, які беруть участь в вилуговуванні металів, за типом харчування відносяться до хемоавтотрофні, для отримання енергії каталізують хімічні окислювально-відновні реакції і асиміляційні вуглекислий газ для конструктивного обміну клітин, тобто харчуються автономно, без використання органіки.
Купчасте Біовилуження сульфідних руд.
В останні роки для підготовки наполегливої \u200b\u200bсировини до ціанування почали використовувати Чанов бактеріальне вилуговування концентратів або руд. У світі вже діє більше десятка промислових підприємств, які практикують цю технологію, але капітальні витрати для такої технології досить високі, тому для малих і середніх родовищ не виправдані.
Використання строго ацидофільних бактерій передбачає, що величина рН пульпи або розчину 2 і нижче. Якщо для вилуговування використовують бактерій A. ferrooxidans, то процес біологічного окислення мінералів може йти двома шляхами: ці бактерії не тільки окислюють сірчані з'єднання, а й здатні для отримання енергії окисляти закісние форми заліза до окисних. Час обробки залежить від складу сульфідної руди, форми і розподілу металу в руді і кількості доступної для мікроорганізмів сірки. Існує також ряд більш вузьких проблем, наприклад, токсичність високих концентрацій видобутих важких цінних металів для деяких видів або штамів витравлюють мікроорганізмів.
Таким чином, одним з підходів до вдосконалення і розвитку технології і методів біовилуження є підбір бактерій і архей, стійких до токсичності металів. Іншими критеріями підбору культур є: простота роботи з ними в промислових умовах, активність в окисленні мінеральних сполук, ставлення до рН, температури, режиму аерації і можливість стимулювати їх активність внесенням додаткових речовин.
В даний час відомий ряд пологів (груп, що поділяються за властивостями і систематичним положенням) бактерій і архей (два надцарства мікроорганізмів), представників яких здатні до вилуговування металів шляхом окислення сульфідів: Acidothiobacillus, Halothiobacillus, Thiobacillus, Leptospirillum, Acidiphilium, Sulfobacillus, Ferroplasma, Sulfolobus , Metallosphaera і Acidianus. Таким чином розвиток технологій біовилуження може спиратися як на внесення змін в організацію процесу (оптимізація аерації, температурного режиму, передпідготовки мінеральної сировини і т.п.), так і в підбір нових мікробних культур - з більш високою активністю або простіше нарощуваною біомасою, або з більш широким спектром рН, температури і т.п. Традиційне вилуговування кислими розчинами призвело до того, що пошук нових культур мікроорганізмів зосереджений саме на ацидофільних і суперацідофільних організмах.
^ 20.біохіміческіе основи якості сили та шляхи його розвитку
Під силою м'язів зазвичай розуміється здатність долати зовнішній опір, або протидіяти йому за допомогою м'язових напружень.
Швидкісно-силові якості головним чином залежать від енергозабезпечення працюючих м'язів і від їх структурно-морфологічних особливостей, значною мірою зумовлених генетично.
Прояв сили і швидкості характерно для фізичних навантажень, виконуваних у зоні максимальної і субмаксимальної потужності. Отже, в енергозабезпеченні швидкісно-силових якостей переважно беруть участь анаеробні шляху ресинтезу АТФ - креатин-фосфатний і гликолитический.
Швидше за все розгортається ресинтез АТФ за рахунок креатинфосфатного реакції. Вона досягає свого максимуму вже через 1-2 с після початку роботи. Максимальна потужність цього способу утворення АТФ перевищує швидкість гликолитического і аеробного шляхів синтезу АТФ в 1,5 і 3 рази відповідно. Саме за рахунок креатинфосфатного шляху ресинтезу АТФ м'язові навантаження виконуються з найбільшою силою і швидкістю. У свою чергу, величина максимальної швидкості креатинфосфатного реакції залежить від змісту в м'язових клітинах креатинфосфату і активності ферменту креатинкінази. Збільшити запаси креатинфосфату і активність креатинкінази можливо за рахунок використання фізичних вправ, що призводять до швидкого вичерпання в м'язах креатинфосфату.
Для цієї мети використовуються короткочасні вправи, що їх з граничною потужністю. Хороший ефект дає застосування інтервального методу тренування, що складається з серій таких вправ. Спортсмену пропонується серія з 4-5 вправ максимальної потужності тривалістю 8-10 с. Відпочинок між вправами в кожній серії дорівнює 20-30 с. Тривалість відпочинку між серіями становить 5-6 хв.
Виконання швидкісних і силових навантажень в зоні субмаксимальної потужності забезпечується енергією в основному за рахунок гликолитического ресинтезу АТФ. Можливості цього способу отримання АТФ обумовлені внутрім'язовими запасами глікогену, активністю ферментів, що беруть участь в цьому процесі, і резистентністю організму до молочної кислоти, що утворюється з глікогену. Тому для розвитку швидкісно-силових здібностей, які базуються на гликолитическом енергозабезпеченні, застосовуються тренування, які відповідають таким вимогам. По-перше, тренування повинна приводити до різкого зниження вмісту глікогену в м'язах з подальшою його суперкомпенсацією. По-друге, під час тренування в м'язах і в крові повинна накопичуватися молочна кислота для подальшого розвитку резистентності до неї організму.
Проміжки відпочинку як між окремими вправами, так і між серіями вправ явно недостатні для відновлення запасів глікогену, і внаслідок цього в ході тренування в м'язах відбувається поступове зменшення вмісту глікогену до дуже низьких величин, що є обов'язковою умовою виникнення вираженої суперкомпенсації.
Структурно-морфологічні особливості м'язів, що визначають можливості прояву сили і швидкості, стосуються будови як окремих м'язових волокон, так і м'язи в цілому. Швидкісно-силові якості окремого м'язового волокна залежать від кількості скорочувальних елементів - міофібрил - і від розвитку саркоплазматической мережі, що містить іони кальцію. Саркоплазматическим мережу також бере участь у проведенні нервового імпульсу всередині м'язової клітини. Зміст міофібрил і розвиток саркоплазматической мережі неоднаково в м'язових волокнах різних типів. Залежно від переважання тих чи інших способів освіти АТФ, хімічного складу і мікроскопічної будови виділяють три основних типи м'язових волокон: тонічні, фазіческіе і перехідні. Ці типи волокон також розрізняються по своїй збудливості, часу, швидкості і силі скорочення, тривалості функціонування.
Тонічні волокна містять відносно велику кількість мітохондрій, в них багато міоглобіну, але мало скорочувальних елементів - міофібрил. Основний механізм ресинтезу АТФ в таких м'язових волокнах - аеробний. Тому вони скорочуються повільно, розвивають невелику потужність, але зате можуть скорочуватися тривалий час.
Фазіческіе волокна мають багато міофібрил, добре розвинену саркоплазматическим мережу, до них підходить багато нервових закінчень. У них добре розвинені колагенові волокна, що сприяє їх швидкому розслабленню. В їх саркоплазме значні концентрації креатинфосфату і глікогену, висока активність креатинкінази і ферментів гліколізу. Відносна кількість мітохондрій в білих волокнах значно менше, вміст міоглобіну в них низька, тому вони мають бліде забарвлення. Забезпечення енергією білих м'язових волокон здійснюється за рахунок креатинфосфатного реакції і гліколізу. Поєднання анаеробних шляхів ресинтезу АТФ з великою кількістю міофібрил дозволяє волокнам даного типу розвивати високу швидкість і силу скорочення. Однак внаслідок швидкого вичерпання запасів креатинфосфату і глікогену час роботи цих волокон обмежена.
Перехідні м'язові волокна за своєю будовою і властивостями займають проміжне положення між тонічними і фазіческой.
Навіть з такого короткого перерахування відмінностей між типами м'язових волокон слід, що для прояву сили і швидкості більш кращі білі волокна і близькі до них за будовою перехідні волокна. Тому більш вираженими швидкісно-силовими якостями, при інших рівних умовах, мають ті м'язи, в яких співвідношення між м'язовими волокнами зміщено в бік білих.
Співвідношення між волокнами різних типів в скелетних м'язах неоднакове. Так, м'язи передпліччя, двоголовий м'яз плеча, м'язи голови і інші містять переважно фізичні волокна. М'язи тулуба, пряма м'яз живота, прямий м'яз стегна в основному містять тонічні волокна. Звідси легко зрозуміти, чому зазначені групи м'язів істотно розрізняються за такими властивостями, як збудливість, швидкість, сила, витривалість.
Співвідношення між різними типами м'язових клітин у кожної людини генетично зумовлено. Однак, використовуючи фізичні навантаження певного характеру, можна цілеспрямовано викликати зміна спектра м'язових волокон. За рахунок застосування силових вправ відбувається зміщення цього спектру в бік переважання білих волокон, що мають більший діаметр у порівнянні з червоними і перехідними, що в підсумку призводить до гіпертрофії тренованих м'язів. Основною причиною гіпертрофії в цьому випадку є збільшення вмісту в м'язових клітинах скорочувальних елементів - міофібрил. Тому м'язова гіпертрофія, що викликається силовими навантаженнями, відноситься до миофибриллярних типу.
Фізичні навантаження, що застосовуються для розвитку м'язової гіпертрофії миофибриллярного типу, на біохімічному рівні повинні призводити до пошкодження міофібрил з подальшою їх суперкомпенсацією. З цією метою використовуються різні вправи з обтяженням.
Для розвитку сили часто використовується метод повторних вправ з напругою 80-90% від максимальної сили. Найбільш ефективне обтяження - 85% від максимальної сили. У цьому випадку число повторень "до відмови" зазвичай 7-8. Кожна вправа виконується серіями, кількість яких коливається від 5 до 10, з інтервалом відпочинку між ними в кілька хвилин. Швидкість виконання вправ визначається метою тренування. Для переважного збільшення м'язової маси вправи виконуються в повільному або помірному темпі. Для одночасного розвитку сили і швидкості вправи проводяться у вибухово-плавному режимі: початкова фаза руху виконується з великою швидкістю, а завершується воно якомога більш плавно. Тому в швидкісно-силових видах спортсмени в період силової підготовки повинні відмовитися від повільного виконання силових вправ, так як в цьому випадку втрачається здатність м'язів до швидкого скорочення.
Час відновлення після швидкісно-силового тренування становить 2-3 дня. Однак, змінюючи м'язові групи, на які спрямовані навантаження, тренувальні заняття можна проводити через менші інтервали відпочинку.
Обов'язковою умовою ефективної силової підготовки є повноцінне, багате білками харчування, так як міофібрили складаються виключно з білків. Є дані про те, що розвитку м'язової гіпертрофії сприяє ультрафіолетове опромінення. Передбачається, що під впливом ультрафіолету збільшується утворення чоловічих статевих гормонів, що стимулюють в організмі синтез білків.
21 Біохімічні основи швидкості (швидкості) як якості рухової діяльності
Швидкість як рухове якість - це здатність людини здійснювати рухове дію в мінімальний для даних умов відрізок часу з певною частотою і імпульсивністю. У питанні про природу цієї якості серед фахівців немає єдності поглядів. Одні висловлюють думку, що фізіологічної основою швидкості є лабільність нервово-м'язового апарату. Інші вважають, що важливу роль у прояві швидкості грає рухливість нервових процесів. Численними дослідженнями доведено, що швидкість є комплексним руховим якістю людини.
Основні форми прояву швидкості людини - час рухової реакції, час максимально швидкого виконання одиночного руху, час виконання руху з максимальною частотою, час виконання цілісного рухового акту. Виділяють також ще одну форму прояву швидкості ( «швидкісних якостей») - швидкий початок руху (то, що в спортивній практиці називають «різкістю»). Практично найбільше значення має швидкість цілісних рухових актів (біг, плавання та ін.), А не елементарні форми прояву швидкості, хоча швидкість цілісного руху лише побічно характеризує швидкість людини.
Скелетний м'яз являє собою складну систему, преоб хімічну енергію в механічну роботу і тепло. Основними компонентами м'язового волокна є білки: актин і міозин.
При здійсненні швидких рухів для скорочення м'язів потрібна велика кількість енергії в одиницю часу при дефіциті кисню, тому основну роль при цьому відіграють анаеробні процеси гідролізу АТФ.
Гідроліз АТФ в АТФазной центрі головки міозину опору зміною конформації останньої і переведенням її в нове, високоенергетичне стан. Повторне приєднання міозіновой головки до нового центру на актиновом филаменте знову призводить до обертання головки, яке забезпечується за в ній енергією. У кожному циклі з'єднання і роз'єм головки міозину з актином розщеплюється одна молекула АТФ на кожен місток. Швидкість обертання визначається скоро розщеплення АТФ. Очевидно, що швидкі фазіческіе у споживають значно більше АТФ в одиницю часу і зберігають менше хімічної енергії під час тонічної навантаження, ніж повільні волокна. Таким чином, в процесі хемомеханіческого перетворення АТФ забезпечує роз'єднати головки міозину і актинового філамента і енергетику для подальшої взаємодії головки міозину з іншою ділянкою актинового філамента. Ці реакції можливі при концентрації кальцію вище 106 моль / л.
Рівень розвитку швидкості, в кінцевому підсумку, визначає успіх у переважній більшості видів спорту. Навіть марафонець повинен, можливо, швидше пробігти свою дистанцію, зберігаючи високу «крейсерську» швидкість (під «крейсерській» швидкістю мається на увазі середня швидкість проходження дистанції). І успіх важкоатлета залежить від того, з якою швидкістю він зуміє виконати необхідне рух.
Швидкість визначається:
а) шляхом вимірювання швидкості руху у відповідь на певний сигнал реакціометрамі різної конструкції;
б) за кількістю рухів за встановлений час незавантаженої кінцівкою або тулубом в межах певної амплітуди;
в) за часом подолання встановленого короткого відстані (наприклад, бігу на 20, 30 м);
г) за швидкістю виконання однократного руху в складному дії, наприклад відштовхування в стрибках, руху плечового пояса і руки в метаннях, удару в боксі, початкового руху бігуна на короткі дистанції, рухів гімнаста і ін.
Всі прояви швидкості ефективно розвиваються при грі в баскетбол. Можна також порекомендувати гандбол, настільний теніс, рухливі ігри з мінливої ігровий ситуацією і швидким пересуванням. Головне завдання при вихованні швидкості полягає в тому, щоб спортсмен передчасно не спеціалізувався в якомусь одному вправі швидкісного характеру, щоб не включати в великому обсязі однотипне повторення цієї вправи. Тому так важливо, щоб спортсмени застосовували швидкісні вправи якнайчастіше в формі змагання або гри. У програму занять повинні входити в значному обсязі такі швидкісні вправи, як спринтерський біг зі старту і з ходу, біг з прискоренням, стрибки в довжину і висоту з гранично швидким відштовхуванням, метання полегшених снарядів, рухливі і спортивні ігри, гранично швидко виконуються акробатичні вправи і різноманітні спеціальні підготовчі вправи.
Важливе значення для виховання швидкості і підвищення швидкості рухів має правильне визначення дозування швидкісних вправ. Ті з них, які виконуються з максимальною інтенсивністю, є сильно діючим засобом, що викликає швидке стомлення. Це саме можна сказати і до вправ, спрямованим на підвищення швидкості рухів. Тому вправи, що виконуються з максимальною швидкістю, повинні застосовуватися часто, але у відносно невеликому обсязі. Тривалість інтервалів відпочинку обумовлена \u200b\u200bступенем збудливості центральної нервової системи і відновленням показників вегетативних функцій, пов'язаних з ліквідацією кисневого дефіциту. Тренувальну роботу у розвиток швидкості слід закінчувати, як тільки суб'єктивні відчуття спортсмена або показники секундоміра скажуть про зменшення встановленої чи максимальної швидкості.
22.біохіміческіе основи якості витривалості до тривалих навантажень і шляхи його розвитку
Витривалість - найважливіша рухове якість, від рівня розвитку якого багато в чому залежать досягнення атлета. Витривалість можна визначити як час роботи із заданою потужністю до появи втоми.
Відповідно до характеру виконуваної роботи виділяють загальну і спеціальну витривалість. Загальна витривалість відображає здатність спортсмена виконувати неспецифічні навантаження. Такими навантаженнями, наприклад, для футболіста можуть бути крос, лижні гонки, плавання, рухливі ігри тощо, а також виконання фізичної роботи побутового характеру. Спеціальна витривалість характеризує виконання фізичних навантажень, специфічних для певного виду спорту і вимагають технічної, тактичної та психологічної підготовки спортсмена.
Першорядне значення для прояву витривалості має рівень розвитку молекулярних механізмів утворення АТФ - безпосереднього джерела енергії для забезпечення м'язового скорочення і розслаблення
Залежно від способу енергозабезпечення виконуваної роботи виділяють алактатну, лактатная і аеробне витривалість. Нерідко використовуються терміни. "Алактатіий, лактатний і аеробний компоненти витривалості.
Алактатного витривалість характеризується найбільшим часом роботи в зоні максимальної потужності. Залежно від виду навантаження можна виділити швидкісну, швидкості о-силову і силову алактатну витривалість. Головним джерелом енергії при м'язовій роботі максимальної потужності є креатинфосфатного реакція. Тому розвиток алактатной витривалості обумовлено внутрім'язовими запасами креатинфосфату. Як вже зазначалося, більш багаті креатинфосфат білі м'язові волокна. У зв'язку з цим більшої алактатной витривалістю мають м'язи з переважанням білих волокон. Зміст креатинфосфату в м'язах можна істотно підвищити, використовуючи спеціальні вправи. Принцип побудови такого тренування в інтервальному режимі був описаний вище, при розгляді енергозабезпечення швидкісно-силових якостей.
Біохімічна оцінка алактатной витривалості може бути дана шляхом визначення добового виділення з сечею креатиніну. Цей показник характеризує загальні запаси в організмі креатинфосфату. Зростання алактатной витривалості зазвичай супроводжується збільшенням добового виділення креатиніну. Іншим критерієм, що характеризує розвиток алактатной витривалості, є алактатний кисневий борг, який вимірюється після завершення роботи максимальної потужності.
Лактатная витривалість характеризує виконання фізичних навантажень в зоні субмаксимальної потужності. Основним джерелом енергії при роботі з такою потужністю служить анаеробний розпад м'язового глікогену до молочної кислоти, званий гликолизом. Можливості гликолитического способу отримання АТФ в значній мірі залежать від запасів м'язового глікогену. Чим вище дорабочей концентрація глікогену в м'язах, тим довше він буде використовуватися в гліколізі. Звідси випливає, що м'язи з переважанням білих, багатих креатинфосфат і гликогеном волокон володіють також і вираженою лактатної витривалістю. Іншим фактором, що визначає лактатная витривалість, є резистентність м'язових клітин і всього організму в цілому до зростання кислотності внаслідок накопичення лактату в м'язах і в крові.
Виходячи з такої залежності тренування, спрямовані на розвиток лактатної витривалості, будуються так, щоб забезпечити виконання двох завдань. По-перше, за рахунок виконуваних фізичних навантажень в м'язах має збільшуватися вміст глікогену. По-друге, тренувальні заняття повинні привести до виникнення резистентності до накопичення лактату і підвищення кислотності.
З цією метою застосовуються вправи, що викликають, з одного боку, значне вичерпання запасів м'язового глікогену, що є необхідною умовою для його подальшої суперкомпенсации, а з іншого - призводять до утворення великих кількостей молочної кислоти. Такими є фізичні навантаження субмаксимальної потужності, що виконуються в інтервальному або повторному режимі. Тренування такого типу описана вище, при розгляді енергозабезпечення швидкісно-силових якостей. Залежно від характеру застосовуваних навантажень можна переважно розвивати силовий або швидкісний компонент лактатної витривалості.
Провідним біохімічним показником прояви лактатної витривалості при роботі є накопичення лактату в крові. Визначення концентрації молочної кислоти в крові проводять після виконання фізичної роботи субмаксимальної потужності "до відмови". Високий рівень концентрації молочної кислоти в крові свідчить про використання для отримання енергії під час роботи великої кількості м'язового глікогену і розвитку резистентності до зростання кислотності.
Таку ж інформацію можна отримати, визначаючи в крові після субмаксимальних навантажень зміна кислотно-лужного балансу. В цьому випадку високої лактатної витривалості відповідає значний зсув водневого показника крові в кислу сторону. Ще одним показником розвитку лактатної витривалості може служити лактатний кисневий борг, який вимірюється після виконання роботи субмаксимальної потужності "до відмови". Чим вище значення цього показника, тим більший внесок анаеробного розпаду глікогену в енергозабезпечення виконаної роботи. У спортсменів з хорошою фізичною підготовкою величини лактатного кисневого боргу можуть досягати 18-20 л.
У спортивній практиці дуже часто алактатну і лактатного витривалість об'єднують в анаеробну.
Аеробна витривалість проявляється при виконанні тривалих вправ помірної потужності, які головним чином забезпечуються енергією за рахунок аеробного окислення. Внесок анаеробного енергоутворення обмежується лише початковим періодом врабативанія. У спортивній літературі часто під терміном "витривалість" мається на увазі саме аероба.
Аеробна витривалість визначається трьома найголовнішими факторами: запасами в організмі доступних джерел енергії, доставкою кисню в працюючі м'язи і розвитком в працюючих м'язах мітохондріального окислення.
Як джерела енергії зазвичай використовуються вуглеводи, жирні кислоти, кетонові тіла і амінокислоти. Внаслідок великої тривалості аеробного роботи ці енергетичні субстрати доставляються в м'язи кров'ю, так як власні енергетичні ресурси м'язових клітин витрачаються на початку роботи.
У забезпеченні м'язів джерелами енергії істотна роль належить печінці. Саме тут під час виконання тривалих навантажень відбувається розпад глікогену до глюкози, яка потім з потоком крові надходить в скелетні м'язи та інші органи, які беруть участь в забезпеченні м'язової діяльності. Інший процес, що протікає в печінці під час роботи, окислення жирних кислот, що супроводжується утворенням кетонових тіл, які також є важливими джерелами енергії. Крім того, в печінці під час роботи протікають і інші хімічні процеси, що сприяють виконанню м'язової роботи. У зв'язку з такою важливою роллю печінки в забезпеченні фізичної роботи в спортивній практиці застосовують гепатопротектори - фармакологічні засоби, що поліпшують функціонування печінки і прискорюють в ній процеси відновлення.
Доставка кисню в м'язи здійснюється кардиореспираторной системою. Тому для прояву аеробної витривалості виключно важливе значення має функціональний стан серцево-судинної і дихальної систем, киснева ємність крові, обумовлена \u200b\u200bкількістю еритроцитів і змістом в них гемоглобіну.
Розвиток аеробного витривалості в значній мірі визначається також станом нервово-гормональної регуляції. Провідну роль у цій регуляції виконують наднирники, які виділяють в кров катехолстіни і глюкокортикоїди - гормони, що викликають перебудову організму, спрямовану на створення оптимальних умов для м'язової діяльності. Для прояву аеробної витривалості важлива здатність наднирників протягом тривалого часу підтримувати в кров'яному руслі підвищену концентрацію цих гормонів.
Внутрім'язовими факторами, відповідальними за аеробне витривалість, є розмір і кількість мітохондрій - внутрішньоклітинних структур, в яких за участю кисню відбувається синтез АТФ, а також зміст міоглобіну - м'язового білка, що забезпечує всередині м'язових волокон перенесення кисню до мітохондрій. Як вже зазначалося, більш високим вмістом мітохондрій і міоглобіну характеризуються червоні м'язові волокна. Звідси випливає, що більш висока витривалість аероба спостерігається в м'язах з переважанням червоних волокон.
Аеробна витривалість на відміну від анаеробної менш специфічна. Це обумовлено тим, що її великою мірою лімітують різні внемишечние фактори: функціональний стан кардіореспіраторної системи, печінки і нервово-гормональної регуляції, киснева ємність крові, запаси в організмі легкодоступних джерел енергії. Тому спортсмен, який має хороший рівень аеробного витривалості, може проявити її не тільки в тому виді діяльності, де він пройшов спеціалізовану підготовку, але і в інших видах аеробного роботи. Наприклад, кваліфікований футболіст може показати гарний результат в бігу на довгі дистанції.
Многофакторность аеробного витривалості вимагає застосування комплексу різноманітних тренувальних засобів, оскільки кожне конкретне заняття, викликаючи досить різносторонній вплив на організм, все ж переважно удосконалює одну якусь сторону функціональних можливостей. У підсумку, тренування, спрямовані на розвиток аеробного витривалості, повинні забезпечити підвищення працездатності кардіореспіраторної системи, сприяти збільшенню кількості еритроцитів в крові і вмісту в них гемоглобіну, зростання концентрації міоглобіну в м'язових клітинах, кращому забезпеченню працюючих органів енергетичними субстратами.
З цією метою застосовуються різні варіанти повторної і інтервального тренування, а також безперервна тривала робота рівномірної або змінної потужності.
Як приклад побудови тренувальних занять, спрямованих на розвиток аеробного витривалості, можна привести так звану циркуляторную интервальную тренування. Цей метод полягає в чергуванні короткочасних вправ невеликої інтенсивності і тривалістю від 30 до 90 з з інтервалами відпочинку такої ж тривалості. Така робота стимулює аеробний енергозабезпечення м'язової діяльності і призводить до поліпшення показників кардіореспіраторної системи.
З метою підвищення вмісту в м'язах міоглобіну може бути використана міоглобіновая інтервальна тренування. Спортсменам пропонуються дуже короткі навантаження середньої інтенсивності, чередуемие з такими ж короткими проміжками відпочинку. Що Їх короткочасні навантаження в основному забезпечуються киснем, який зберігатиметься в м'язових клітинах у формі комплексу з миоглобином. Короткий відпочинок між вправами достатній для поповнення запасів кисню.
Для збільшення кисневої ємності крові, а також для підвищення концентрації міоглобіну хороший ефект дають тренування в умовах середньогір'я.
Особливістю розвитку аеробного витривалості є можливість використання неспецифічних вправ, і в першу чергу рухливих ігор, що дозволяє зробити тренувальний процес різноманітним і цікавим.
Важливу інформацію для оцінки аеробного витривалості можна Отримати шляхом визначення змісту і співвідношення в крові основних енергетичних субстратів в ході виконання тривалої роботи. У нетренованих людей між вмістом в крові глюкози і продуктів мобілізації жиру існують реципрокні відносини. Висока концентрація глюкози в крові перешкоджає мобілізації жиру з депо. Тому у нетренованих людей підвищення вмісту в крові жирних кислот, гліцерину і кетонових тіл спостерігається тільки на тлі зниження концентрації глюкози. У спортсменів, добре тренованих в аеробному режимі, потужна мобілізація жиру відзначається на тлі не тільки нормального, але і підвищений вміст глюкози в крові. Підвищена утилізація жиру і кетонових тіл дозволяє організму не тільки зберегти вуглеводи печінки і крові, але і уповільнити витрачання м'язовогоглікогену, зниження концентрації якого є одним з факторів розвитку втоми.
На закінчення необхідно відзначити, що всі компоненти витривалості поряд з розглянутими вище енергетичними та структурними чинниками значною мірою залежать від технічної, тактичної і психологічної підготовки. Хороша технічна підготовка, правильно обрана тактика дозволяє спортсменові економно і раціонально використовувати енергетичні резерви і тим самим довше зберігати працездатність. За рахунок високої мотивації, великої сили волі спортсмен може продовжувати виконання роботи навіть в умовах настання в організмі значних біохімічних і функціональних зрушень.
13.4.1. Реакції циклу Кребса відносяться до третьої стадії катаболізму поживних речовин і відбуваються в мітохондріях клітини. Ці реакції відносяться до загального шляху катаболізму і характерні для розпаду всіх класів поживних речовин (білків, ліпідів і вуглеводів).
Головною функцією циклу є окислення ацетильную залишку з утворенням чотирьох молекул відновлених коферментів (трьох молекул НАДН і однієї молекули ФАДН2), а також утворення молекули ГТФ шляхом субстратного фосфорилювання. Атоми вуглецю ацетильную залишку виділяються у вигляді двох молекул СО2.
13.4.2. Цикл Кребса включає 8 послідовних стадій, звертаючи особливу увагу на реакції дегідрування субстратів:
Малюнок 13.6. Реакції циклу Кребса, включаючи освіту α-кетоглутарата
а) конденсація ацетил-КоА з оксалоацетата, В результаті якої утворюється цитрат (ріс.13.6, реакція 1); тому цикл Кребса називають також цитратним циклом. У цій реакції метильний вуглець ацетильной групи взаємодіє з кетогруппу оксалоацетата; одночасно відбувається розщеплення тіоефірной зв'язку. В реакції звільняється КоА-SH, який може взяти участь в окислювальному декарбоксилюванні наступної молекули пірувату. реакцію каталізує цітратсінтаза, Це - регуляторний фермент, він відзначено зниження високими концентраціями НАДН, сукцинил-КоА, цитрату.
б) перетворення цитрату в ізоцитрат через проміжне утворення цис-аконітата. Утворений в першій реакції циклу цитрат містить третинну гідроксильну групу і не здатний окислюватися в умовах клітини. Під дією ферменту аконітаза йде відщеплення молекули води (дегідратація), а потім її приєднання (гідратація), але іншим способом (ріс.13.6, реакції 2-3). В результаті даних перетворень гідроксильна група переміщається в положення, що сприяє її подальшого окислення.
в) дегидрирование ізоцитрату з подальшим виділенням молекули СО2 (декарбоксилюванням) і утворенням α-кетоглутарата (рис. 13.6, реакція 4). Це - перша окислювально-відновна реакція в циклі Кребса, в результаті якої утворюється НАДН. ізоцитратдегідрогеназа, Що каталізує реакцію, - регуляторний фермент, активується АДФ. Надлишок НАДН пригнічує фермент.

Малюнок 13.7. Реакції циклу Кребса, починаючи з α-кетоглутарата.
г) окислювальне декарбоксилювання α-кетоглутарата, Каталізується Мультиферментний комплексом (рис. 13.7, реакція 5), супроводжується виділенням СО2 й утворенням другої молекули НАДН. Ця реакція аналогічна піруватдегідрогеназного реакції. Інгібітором служить продукт реакції - сукцинил-КоА.
д) субстратне фосфорилювання на рівні сукцинил-КоА, в ході якого енергія, що звільняється при гідролізі тіоефірной зв'язку, запасається у формі молекули ГТФ. На відміну від окисного фосфорилювання, цей процес протікає без утворення електрохімічного потенціалу мітохондріальної мембрани (рис. 13.7, реакція 6).
е) дегидрирование сукцината з утворенням фумарату і молекули ФАДН2 (рис. 13.7, реакція 7). Фермент сукцинатдегідрогеназа міцно пов'язаний з внутрішньою мембраною мітохондрії.
ж) гідратація фумарата, В результаті чого в молекулі продукту реакції з'являється легко окислюється гідроксильна група (рис. 13.7, реакція 8).
з) дегидрирование малата, Що приводить до утворення оксалоацетата і третьої молекули НАДН (ріс.13.7, реакція 9). Утворений в реакції оксалоацетат може знову використовуватися в реакції конденсації з черговою молекулою ацетил-КоА (рис. 13.6, реакція 1). Тому даний процес носить циклічний характер.
13.4.3. Таким чином, в результаті описаних реакцій піддається повного окислювання ацетильную залишок СН3 -СО-. Кількість молекул ацетил-КоА, що перетворюються в мітохондріях в одиницю часу, залежить від концентрації оксалоацетата. Основні шляхи збільшення концентрації оксалоацетата в мітохондріях (відповідні реакції будуть розглянуті пізніше):
а) карбоксилирование пірувату - приєднання до пирувату молекули СО2 з витратою енергії АТФ; б) дезамінування або трансамінування аспартату - відщеплення аміногрупи з утворенням на її місці кетогрупи.13.4.4. Деякі метаболіти циклу Кребса можуть використовуватися для синтезу структурних блоків для побудови складних молекул. Так, оксалоацетат може перетворюватися в амінокислоту аспартат, а α-кетоглутарат - в амінокислоту глутамат. Сукцініл-КоА бере участь у синтезі гема - простетичної групи гемоглобіну. Таким чином, реакції циклу Кребса можуть брати участь як в процесах катаболізму, так і анаболізму, тобто цикл Кребса виконує амфіболіческую функцію (Див. 13.1).
Вуглеводи, білки і жири в організмі гідролізуються, а утворюються при цьому продукти гідролізу - моносахариди, амінокислоти, жирні кислоти і гліцерин піддаються перетворенням, в ході яких частина з них окислюється до вуглекислого газу і води, які є продуктами окислення вуглецю і водню. Якби система, в якій кожен з продуктів гідролізу біополімерів, що представляє собою субстрат для подальшого окислення, мав би свій метаболічний шлях, то така система була б дуже громіздкою і ненадійною. Однак, Природа вирішила задачу уніфікації метаболічних шляхів, організувавши катаболические процеси таким чином, що на проміжних етапах цих процесів утворюється мінімальна кількість одних і тих же метаболітів, які виходять при окисленні різних речовин. І, дійсно, як видно зі схеми, більшість субстратів окислення перетворюються в пировиноградную кислоту - піруват (С 3), а потім в ацетил-КоА (С 2), причому останній може утворюватися і при окисленні пірувату. Ацетил-КоА повністю окислюється в циклі трикарбонових кислот (ЦТК - він же цикл Кребса або цитратний цикл). Цикл Кребса є загальним шляхом катаболізму для вуглеводів, білків і жирів. Енергія, що виділяється в ході катаболічних реакцій, частково розсіюється як теплоти, більша ж її частина витрачається в анаболічних реакціях. Передача енергії здійснюється за допомогою інтермедіаторов, основний з них - АТФ. Ендергонічеськие процеси - це синтез аденозинтрифосфату (АТФ) з аденозиндифосфату (АДФ) і неорганічного фосфату, а також синтез і інших речовин з макроергічними зв'язками. Цей процес протікає завдяки сполученню енергії з катаболическими реакціями. Екзергонічеськие процес - це гідроліз АТФ, а також інших трифосфатів. Гідроліз поставляє необхідну енергію для біосинтезу.
Нижче наведена схема сполучення анаболічних і катаболічних процесів:
S 1 окислений субстрат, ΔG< 0АДФ + фосфат АТФ + Н 2 О, ΔG< 0
сполучення
АТФ + Н 2 О → АДФ + фосфат, ΔG< 0S 2 продукт біосинтезу, ΔG\u003e 0
Велика частина АТФ в організмі утворюється в результаті окисного фосфорилювання, Яке відбувається в ланцюзі передачі електронів (ЦПЕ). Основними субстратами цього процесу є НАД * Н і ФАД * Н 2, що утворюються переважно в ЦТК, тому одним з основних завдань катаболізму є синтез АТФ - своєрідного акумулятора енергії, необхідної для подальших реакцій анаболізму. Більшість биосинтезов носять відновний характер, так як продукти біосинтезу є менш окисленими в порівнянні з вихідними речовинами. Роль відновника в таких процесах грає НАД * Н. Таким чином, ключова роль в метаболізмі належить обмеженому числу сполук. Це піруват і ацетил-КоА, речовини якими закінчуються специфічні шляхи катаболізму; АТФ, продукти гідролізу, до яких надходить енергія для анаболічних процесів; НАД * Н і ФАД * Н 2 - коферменти, при окисленні яких утворюється основна частина АТФ в організмі.
катаболізм вуглеводів
Процеси обміну вуглеводів у людини починаються в ротовій порожнині, так як до складу слини входить фермент амілаза, який здатний розщеплювати крохмаль і глікоген до дисахарида - мальтози, яка ферментом мальтаза розщеплює останню до глюкози. Надходження глюкози в клітини різних органів залежить від гормону інсуліну, який регулює швидкість перенесення глюкози через мембрани клітин. переносниками - білками.
Обмін глюкози в клітці починається з її фосфорилювання:
Глюкоза + АТФ глюкозо-6-фосфат + АДФ


АТФ → + АДФ
На відміну від вільної глюкози, глюклзо-6-фосфат не здатний проходити через клітинні мембрани, тому фосфорілірованний глюкоза як би «замикається» в клітці, і там запасається у формі глікогену - тваринного крохмалю, який синтезується з молекул глюкозо-6-фосфату.
Катаболізм глюкози в клітці може йти за трьома основними напрямками, які розрізняються за способом зміни вуглецевого скелета молекули:
1. Дихотомический шлях, при якому відбувається розщеплення зв'язку С-С між третім і четвертим атомами вуглецю, і з однієї молекули гексози виходять дві тріози (С 6 → 2С 3).
2. Апотоміческій шлях (пентозофосфатний), при якому гексоза перетворюється в пентозу (С 6 → З 5) в результаті окислення і відщеплення одного (першого) вуглецевого атома.
3.Глюкуроновий шлях, коли відбувається окислення і відщеплення шостого вуглецевого атома
Головним шляхом розпаду глюкози, що веде до вивільненню енергії є дихотомічний шлях, а в цьому шляху, в свою чергу, окислити глюкозу і отримати її енергію можна двома способами:
1.Незавісімость анаеробний розпад глюкози до молочної кислоти - гліколіз.
глюкоза → 2-лактат + 134 кДж
Частина цієї енергії витрачається на освіту двох молекул АТФ, А решта розсіюється у вигляді теплоти.
2.Аеробний (киснево) розпад глюкози до вуглекислого газу і води
Це процес зворотний фотосинтезу:
З 6 Н 12 О 6 + 6О 2 ↔ 6СО 2 + 6Н 2 О + 2850 кДж
60% цієї енергії запасається у вигляді макроергічних зв'язків АТФ, тобто в біологічно доступній формі. Як видно з наведених рівнянь, аеробний шлях, безсумнівно, більш вигідний в порівнянні з гликолизом, так як в ньому з однакової кількості глюкози утворюється в двадцять разів більше АТФ. Аеробний розпад здійснюється більшістю тканин організму за винятком еритроцитів. Для злоякісних клітин основний шлях отримання енергії - гліколіз. М'язи використовують гліколіз в разі великих навантажень, коли утруднений доступ кисню і тоді в натруджених м'язах утворюється молочна кислота.
Ланцюг реакції гліколізу глюкози включає в себе одинадцять реакцій, з яких перші десять - спільні з аеробних розпадом, а одинадцята - це синтез молочної кислоти з піровиноградної кислоти (ПВК) за допомогою НАД * Н. Розглянемо послідовно реакції при аеробному розпаді глюкози:
1 реакція - це фосфорилирование глюкози, її активація.
2 реакція - це ізомеризація, глюкозо-6-фосфат перетворюється в фруктозо-6-фосфат.
3 реакція - фруктозо-6-фосфат фосфорилируется до фруктозо-1,6-дифосфата.
Перші три реакції являють собою так звану підготовчу стадію, на цьому етапі ще йде витрата енергії АТФ на реакції фосфорилювання:
1Глюкозо-6-фосфат
2 ізомеризація
|
2-фосфогліцерат загальний шлях
9 Н 2 О АТФ
Наступний етап - це реакції гліколетіческой оксіредуктаціі, В яких йде розпад шестіуглеродних скелета на два трехуглеродних і окислення їх до пірувату.
4 реакція - фруктозо-1,6-дифосфат в своїй відкритій ациклической формі розпадається за допомогою ферменту альдолази на два трехуглеродних фрагмента: гліцеральдегідфосфат і діоксиацетонфосфат.
5 реакція - ізомеризація, перетворення діоксиацетонфосфат в гліцеральдегідфосфат.
Подальший катаболізм відбувається тільки через гліцеральдегідфосфат, дві молекули якого в 6-ій реакції окислюються НАД + в 1,3-дифосфоглицерата, а виділяється при цьому енергія запасається у вигляді АТФ. В даному випадку окислення альдегіду призводить до ангідриду органічної і фосфорної кислоти. Дві молекули 1,3-дифосфоглицерата перетворюються в процесі гідролізу в 3-фосфогліцерат, а далі, в 8-ій реакції відбувається перенесення фосфатної групи з положення 3 в положення 2.
9 реакція-відщеплення води з отриманням фосфоенолпіруват, а потім відбувається кето-енольними перетворення, поєднане з гідролізом, коли від діоксиацетонфосфат отщепляется одна молекула фосфорної кислоти і енольна форма перетворюється в кетоформу.
катаболізму ліпідів
У вищих тварин і людини ліпіди надходять в шлунок, і виходять з нього майже не порушені кислим середовищем. У лужному середовищі тонкого кишечника ліпіди гідролізуються під дією ліпаз. Гідролізовані ліпіди всмоктуються в кров і переносяться в різні органи для подальшого метаболізму.
У кров надходять крізь стінку кишечника гліцерин, ЖК, моно- і дигліцериди. У крові ЖК знову етерифікування гліцерином, який пов'язаний з білками крові і переноситься в жирову тканину або печінку, де відкладається. У печінки йде гідроліз з утворенням ЖК, які окислюються до СО 2 і Н 2 О. При окисленні вивільняється велика кількість енергії.
Процес окислення ЖК включає багато стадій. ЖК руйнується (синтезується) до фрагментів С-С (природні ЖК складаються з парного числа атомів вуглецю). При катаболизме, ЖК спочатку перетворюються в тіоефіри з коферментом А, з виділенням АТФ, потім окислюються в ненасичені кислоти, окислювачем служить ФАД.
З 15 Н 31 СООН - пальмітинова кислота
Про HSКоА Про ФАД
СН 3 (СН 2) 12 СН 2 СН 2 С ОН СН 3 (СН 2) 2 СН 2 СН 2 С SКоА
СН 2 (СН 2) 12 СН \u003d СНС SКоА
Починається шлях катаболізму білків з гідролізу (протеолізу) під дією ферментів протеази і пептідази.
Гідроліз білків починається в шлунку під дією ферменту пепсину, цьому сприяє кисле середовище шлункового соку рН \u003d 1-2 виникає завдяки виділенню шлункових клітин соляної кислоти.
У тонкому кишечнику при рН \u003d 7,8-8,4, розпад білків каталізується ферментами підшлункової залози трипсином і хімітріпсіном.
АК - продукт гідролізу білків, що надходять з шлунково-кишкового тракту, є важливим фондом поповнення амінокислотного запасу клітин і тканин. Обмежене надходження ззовні навіть однієї з незамінних АК викликає різкий розпад власних білків тканин, АК використовуються в синтезі власних білків, нуклеотидів, порфіринів і т. Д.
У добу дорослій людині необхідно 100 г білка. Білки можуть бути повноцінними - в наявності всі незамінні АК і неповноцінними - в наявності не всі незамінні АК. За добу розпадається і синтезується 400 г білка. За 35 днів оновлюються всі білки.
Про стан білкового обміну можна судити по азотистого балансу. Оскільки білки органів відрізняються суворої видовий і тканинної специфічністю, живий організм має здатність використовувати вводиться білок тільки в гідролізованому стані.
Всмоктування АК через мембрану тонкого кишечника відбувається під дією глутатіону. АК надходять в кров ворітної вени, потім у печінку, де піддаються ряду перетворень.