Сярна киселина. Серни оксиди
В тази статия ще намерите информация за това какво е серен оксид. Ще бъдат разгледани основните му свойства от химическо и физическо естество, съществуващите форми, методите за тяхното получаване и разликите помежду им. А също и областите на приложение и биологична ролятози оксид в различните му форми.
Какво е веществото
Серен оксид е съединение от прости вещества, сяра и кислород. Има три форми на серни оксиди, които се различават една от друга по степента на проявена валентност S, а именно: SO (моноксид, серен монооксид), SO 2 (серен диоксид или серен диоксид) и SO 3 (триоксид или серен анхидрид). Всички изброени вариации на серни оксиди имат сходни химични и физични характеристики.
Общи данни за серен моноксид
Двувалентният серен моноксид или по друг начин серен моноксид е неорганично вещество, състоящо се от два прости елемента - сяра и кислород. Формула - SO. При нормални условия това е безцветен газ, но с остра и специфична миризма. Реагира с воден разтвор... Доста рядко съединение в земната атмосфера. Той е нестабилен към въздействието на температурите, съществува в димерна форма - S 2 O 2. Понякога той е в състояние да реагира с кислород, за да образува серен диоксид в резултат на реакцията. Не образува сол.

Серен оксид (2) обикновено се получава чрез изгаряне на сяра или разлагане на нейния анхидрид:
- 2S2 + O2 = 2SO;
- 2SO2 = 2SO + O2.
Веществото се разтваря във вода. В резултат на това серен оксид образува тиосулфорна киселина:
- S 2 O 2 + H 2 O = H 2 S 2 O 3.
Общи данни за серен диоксид
Серен оксид е друга форма на серни оксиди с химична формула SO 2. Има неприятна специфична миризма и безцветен. При излагане на налягане може да се възпламени при стайна температура. Когато се разтвори във вода, той се образува нестабилен сярна киселина... Може да се разтваря в етанол и разтвори на сярна киселина. Той е компонент на вулканичния газ.

В промишлеността те се получават чрез изгаряне на сяра или изгаряне на нейните сулфиди:
- 2FeS 2 + 5O 2 = 2FeO + 4SO 2.
В лабораториите, като правило, SO 2 се получава с помощта на сулфити и хидросулфити, подлагайки ги на силни киселини, както и на метали с ниска степен на активност, концентриран H 2 SO 4.
Подобно на другите серни оксиди, SO 2 е киселинен оксид. Взаимодействайки с основи, образувайки различни сулфити, той реагира с вода, създавайки сярна киселина.
SO 2 е изключително активен и това ясно се отразява в неговите редуциращи свойства, където степента на окисляване на серен оксид се увеличава. Може да прояви окислителни свойства, когато е изложен на силен редуктор. Последният характерна чертаизползвани за производството на хипофосфорна киселина или за отделяне на S от газовете на металургичното поле на дейност.
Серен оксид (4) се използва широко от хората за получаване на сярна киселина или нейните соли - това е нейната основна област на приложение. Освен това участва в процесите на производство на вино и действа там като консервант (Е220), понякога зеленчуковите магазини и складовете се мариноват с него, тъй като унищожава микроорганизмите. Материалите, които не могат да бъдат избелени с хлор, се обработват със серен оксид.

SO 2 е доста токсично съединение. Характерни симптоми, които показват отравяне с него, са кашлица, проблеми с дишането, обикновено под формата на хрема, дрезгавост, необичаен вкус и възпалено гърло. Вдишването на такъв газ може да причини задушаване, нарушена речева способност на индивида, повръщане, затруднено преглъщане и остър белодробен оток. Максимално допустимата концентрация на това вещество в работната стая е 10 mg / m 3. както и да е различни хоратялото може да прояви различна чувствителност към серен диоксид.
Общи данни за серен анхидрид
Сярен газ или, както се нарича, серен анхидрид, е по -висок серен оксид с химична формула SO 3. Течност с задушаваща миризма, силно летлива при стандартни условия. Възможност за втвърдяване, образуване на смеси кристален типна неговите твърди модификации, при температури от 16.9 ° C и по -ниски.

Подробен анализ на по -висок оксид
Когато SO 2 се окислява от въздуха под въздействието на високи температури, необходимо условиее присъствието на катализатор, например V 2 O 5, Fe 2 O 3, NaVO 3 или Pt.
Термично разлагане на сулфати или взаимодействие на озон и SO 2:
- Fe 2 (SO 4) 3 = Fe 2 O 3 + 3SO 3;
- SO 2 + O 3 = SO 3 + O 2.
Окисляване на SO 2 с NO 2:
- SO 2 + NO 2 = SO 3 + NO.
Характеристиките на физическото качество включват: присъствие в газово състояние плоска структура, тригонален тип и D 3 h симетрия, по време на прехода от газ към кристал или течност образува тример с циклична природа и зигзагообразна верига, има ковалентна полярна връзка.
В твърда форма SO 3 се среща в алфа, бета, гама и сигма форми, с различни точки на топене, степен на полимеризация и различни кристални форми, съответно. Съществуването на такъв брой видове SO 3 се дължи на образуването на донорно-акцепторни връзки.
Свойствата на серния анхидрид включват много от неговите качества, основните от които са:
Възможност за взаимодействие с основи и оксиди:
- 2KHO + SO3 = K 2 SO 4 + H 2 O;
- CaO + SO 3 = CaSO 4.
По -високият серен оксид SO 3 има доста висока активност и създава сярна киселина, взаимодействайки с вода:
- SO 3 + H 2 O = H2SO 4.
Реагира с хлороводород и образува хлоросулфатна киселина:
- SO 3 + HCl = HSO 3 Cl.
Серен оксид се характеризира с проявление на силни окислителни свойства.
Сярен анхидрид се използва при създаването на сярна киселина. Малко количество от него се разпределя в заобикаляща средадокато използвате серни бомби. SO 3, образувайки сярна киселина след взаимодействие с влажна повърхност, унищожава различни опасни организми, като гъбички.
Обобщаване
Серен оксид може да бъде в различни агрегатни състоянияот течно до твърдо. Той рядко се среща в природата и има доста начини да се получи в промишлеността, както и в области, където може да се използва. Самият оксид има три форми, в които проявява различна степен на валентност. Може да бъде много токсичен и да причини сериозни здравословни проблеми.
Сярата се разпределя в земна кора, наред с други елементи, заема шестнадесетото място. Той се намира както в свободно състояние, така и в свързана форма. Неметалните свойства са характерни за този химичен елемент. Латинското му наименование "Сяра", обозначено със символа S. Елементът е част от различни йони на съединения, съдържащи кислород и / или водород, образува много вещества, принадлежащи към класовете киселини, соли и няколко оксида, всеки от които може да се нарече серен оксид със символите за добавяне, обозначаващи валентността. Окисляването заявява, че се проявява в различни съединения +6, +4, +2, 0, −1, −2. Известни са серни оксиди с различни степени на окисление. Най -често срещаните са серен диоксид и серен триоксид. По -малко известни са серен моноксид, както и по -високи (с изключение на SO3) и по -ниски оксиди на този елемент.
Серен моноксид
Неорганично съединение, наречено серен оксид II, SO, от външен видтова вещество е безцветен газ. При контакт с вода, той не се разтваря, но реагира с него. Това е много рядко съединение, което се среща само в среда на разредени газове. SO молекулата е термодинамично нестабилна, първоначално се трансформира в S2O2 (наречен дисулфурен газ или серен пероксид). Поради рядкото появяване на серен моноксид в нашата атмосфера и ниската стабилност на молекулата, е трудно да се определят напълно опасностите от това вещество. Но в кондензирана или по -концентрирана форма, оксидът се превръща в пероксид, който е относително токсичен и корозивен. Това съединение също е силно запалимо (прилича на метан по това свойство) и при изгаряне се получава серен диоксид, отровен газ. Серен оксид 2 е открит близо до Io (една от атмосферата на Венера и в междузвездната среда. Предполага се, че се произвежда на Io в резултат на вулканични и фотохимични процеси. Основните фотохимични реакции са следните: O + S2 → S + SO и SO2 → SO + O.
Серен диоксид
Серен оксид IV или серен диоксид (SO2) е безцветен газ с задушаваща остра миризма. При температура минус 10 С се превръща в течно състояние, и при температура минус 73 С се втвърдява. При 20 ° С около 40 обема SO2 се разтварят в 1 литър вода.
Този серен оксид, разтварящ се във вода, образува сярна киселина, тъй като това е неговият анхидрид: SO2 + H2O ↔ H2SO3.
Той взаимодейства с основи и 2NaOH + SO2 → Na2SO3 + H2O и SO2 + CaO → CaSO3.
Серен диоксид се характеризира със свойствата както на окислител, така и на редуктор. Той се окислява от атмосферния кислород до серен анхидрид в присъствието на катализатор: SO2 + O2 → 2SO3. Със силни редуктори, като сероводород, той играе ролята на окислител: H2S + SO2 → S + H2O.
Серен диоксид се използва в промишлеността главно за производството на сярна киселина. Серен диоксид се получава чрез изгаряне на сяра или железен пирит: 11O2 + 4FeS2 → 2Fe2O3 + 8SO2.
Сярен анхидрид
Серен оксид VI или серен триоксид (SO3) е междинен продукт и няма независимо значение. Това е безцветна течност на външен вид. Кипи при температура 45 С, а под 17 С се превръща в бяла кристална маса. Тази сяра (със степента на окисление на серен атом + 6) е изключително хигроскопична. С вода образува сярна киселина: SO3 + H2O ↔ H2SO4. Разтваряйки се във вода, той се отделя голям бройтоплина и ако добавите не постепенно, а веднага голямо количество оксид, тогава може да възникне експлозия. Серен триоксид се разтваря добре в концентрирана киселинасярна за образуване на олеум. Съдържанието на SO3 в олеума достига 60%. Това серно съединение има всички свойства
По -високи и по -ниски серни оксиди
Сярата е група химични съединенияс формула SO3 + x, където x може да бъде 0 или 1. Мономерният оксид SO4 съдържа пероксо група (О-О) и се характеризира, подобно на оксида SO3, със степента на окисление на сяра +6. Този серен оксид може да бъде получен при ниски температури (под 78 К) в резултат на реакцията на SO3 и или фотолиза на SO3 в смес с озон.
Долните серни оксиди са група химични съединения, които включват:
- SO (серен оксид и неговият димер S2O2);
- серни моноксиди SnO (са циклични съединения, състоящи се от пръстени, образувани от серни атоми, където n може да бъде от 5 до 10);
- S7O2;
- полимерни серни оксиди.
Интересът към оксидите с по -ниско съдържание на сяра се е увеличил. Това се дължи на необходимостта от изучаване на тяхното съдържание в земната и извънземната атмосфера.
1) За реакцията с хидроксида, образуван от някакъв елемент от групата 1 (А), с тегло 4,08 g, са необходими 1,46 g солна киселина. Този елемент: рубидий; Да сеaliy; литий; натрий;
2) Сумата от коефициентите в уравнението за реакцията на по -висок серен хидроксид с калиев хидроксид е: 4; 6; 5; 8;
неметални свойства на просто вещество:
1) хлор 2) сяра 3) силиций 4) калций
3. номерът на групата в периодичната таблица е:
1) най -високата валентност на атома 2) броят на електроните в атома 3) броят на протоните в ядрото 4) броят на електронните слоеве
4. по -високият азотен хидроксид реагира с:
1) калциев хидроксид 2) солна киселина 3) бариев сулфат 4) силициев оксид
5. най -изразените метални свойства на просто вещество: 1) натрий 2) магнезий 3) калций 4) калий
За всички реакции ще бъде необходимо да се напише пълно и сбито йонно уравнение. 1. Калий → калиев хидроксид → калиев сулфат →бариев сулфат
2. Фосфор → фосфорен (III) оксид → фосфорен (V) оксид → фосфорна киселина → калциев фосфат
3. Цинк → цинков хлорид → цинков хидроксид → цинков оксид
4. Сяра → серен диоксид → по -висок серен оксид → сярна киселина → алуминиев сулфат.
5. Литий → литиев хидроксид → литиев хлорид → сребърен хлорид
6. Азот → азотен оксид (II) → азотен оксид (IV) → азотна киселина → натриев нитрат
7. Сяра → калциев сулфид → калциев оксид → калциев карбонат → въглероден диоксид
8. Въглероден двуокис→ натриев карбонат → калциев карбонат → калциев оксид
9. Желязо → железен (II) оксид → железен (III) оксид → железен (III) сулфат
10. Барий → бариев оксид → бариев хлорид → бариев сулфат
1) Медта е просто вещество в израза: А) жицата е изработена от мед Б) медта е част от меден оксид В) медта е част от малахит Г) мединица е част от бронз 2) В периодите на периодичната система зарядът на ядрата не се променя: А) масата на атома В) броят на енергийните нива В) общият брой електрони Г) броят на електрони на външно енергийно ниво 3) Формули на по -високи оксиди на сяра, азот, хлор съответно: A) SO3, N2O5, Cl2O7 B) SO2, N2O5, Cl2O7 C) SO3, N2O3, ClO2 D) SO2, NO2, Cl2O5 4 ) Йонният тип връзка и кристалната решетка имат: А) натриев флуорид Б) вода В) сребро Г) бром 5) Формули на разтворима основа и съответно амфотерен хидроксид: А) BaO, Cu (OH) 2 В) Ba (OH ) 2, Al (OH) 3 C) Zn (OH) 2, Ca (OH) 2 D) Fe (OH) 3, KOH 6) Коефициент преди кислородната формула при термичното разлагане на калиев перманганат: A) 1 B) 2 В) 3 Г) 4 7) Взаимодействие на солна киселинаи меден оксид (II) се отнася до реакциите: А) разлагане Б) съединения В) заместване Г) обмен 8) Количеството топлина, отделено при изгарянето на 2 г въглища (уравнение на термохимичната реакция С + О2 = CO2 + 393 кДж ) е равно на: A) 24 kJ B) 32.75 kJ C) 65.5 kJ D) 393 kJ 9) При повишени температури кислородът реагира с всички вещества от групата: A) CuO, H2, Fe B) P, H2, Mg В) Cu, H2, Au D) S, CH4, H2O 10) Както с водород, така и с кислород при повишени температури реагира: А) меден оксид (II) В) злато В) сяра Г) азотна киселина 11) Разредена сярна киселина може да реагира с: A) Mg и Cu (OH) 2 B) CO2 и NaOH C) FeO и H2S D) P и CuCl2 12) Сярен (IV) оксид не реагира с: A) O2 B) HCl C) H2O D) NaOH 13) Формули на вещества "X" и "Y" в схемата на трансформации на CaO x Ca (OH) 2 y CaCl2 A) X - H2; Y е HCl B) X е Н20; Y е НС1 В) X е Н2; Y - Cl2 D) X - H2O; Y - Cl2 14) Масова частсярата в серен оксид (IV) е равна на: а) 20% б) 25% в) 33% г) 50% 15) Разтвор, съдържащ 19,6 г сярна киселина, се неутрализира с излишък от магнезиев оксид. Количеството на веществото на образуваната сол е: а) 0,2 мола б) 2 мола в) 0,1 мола г) 1 мола 16) Броят на напълно запълнените енергийни нива в натриевия атом: А) 2 В) 3 В) 4 Г) 5 17) Съотношението на химическата активност на елементите в двойка е правилно посочено: A) Li Na B) Na KC) Li KD) Na Li 18) Свойства на метала в серията Li Na K Cs A) увеличаване B) намаляване C) не се променя D) промяна периодично 19) Електронната формула на нивото на външната енергия на бромовия атом: A) 2s22p5 B) 3s13p6 C) 4s14p7 D) 4s24p5 20) Електронната формула 1s22s22p63s23p5 има атом: А) йод В) бром В) хлор Г) флуор 21) Метални свойства химични елементив ред I Br Cl FA) увеличаване B) намаляване C) промяна периодично D) не се променя 22) Формула на вещество с ковалентна неполярна връзка: A) SO3 B) Br2 C) H2O D) NaCl 23) Кристална решетка на твърд оксид въглерод (IV): А) йонна В) атомна В) молекулна Г) метална 24) Вещество с йонна връзка: А) серен оксид (VI) В) хлор В) сероводород Г) натриев хлорид 25 ) Номер 2, 8, 5 съответства на разпределението на електроните по енергийните нива на атома: А) алуминий В) азот В) фосфор Г) хлор 26) Електронната формула на външното енергийно ниво 2s22p4 съответства на атома: а ) сяра Б) въглерод В) силиций Г) кислород 27) Четири електрона на външното енергийно ниво има атом: А) хелий В) берилий В) въглерод Г) кислород
Характеристика на сярата: 1) Положението на елемента в Периодичната таблица D. И Характеристика на сярата: 1) Положението на елемента в Периодичната таблицаД. И. Менделеев и структурата на неговите атоми 2) Природата на просто вещество (метал, неметал) 3) Сравнение на свойствата на просто вещество със свойствата на прости вещества, образувани от съседни елементи в подгрупа 4) Сравнение на свойствата на просто вещество със свойства на прости вещества, образувани от съседни елементи елементи 5) Съставът на висшия оксид, неговата природа (основен, кисел, амфотерен) 6) Съставът на висшия хидроксид по своя характер (съдържащ кислород киселина, основа, амфотерен хидроксид) 7) съставът на летливото водородно съединение (за неметали)
При окислително -възстановителните процеси серен диоксид може да бъде както окислител, така и редуктор, тъй като атомът в това съединение има междинно окислително състояние +4.
Като окислител SO 2 реагира с по -силни редуктори, например:
SO 2 + 2H 2 S = 3S ↓ + 2H 2 O
Като редуктор, SO 2 реагира с по -силни окислители, например в присъствието на катализатор, с и т.н.:
2SO 2 + O 2 = 2SO 3
SO2 + Cl2 + 2H2O = H2SO3 + 2HCl
Получаване
1) Серен диоксид се образува при изгаряне на сяра:
2) В промишлеността се получава чрез изпичане на пирит:
3) В лабораторията може да се получи серен диоксид:
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
Приложение
Серен диоксид се използва широко в текстилната промишленост за избелване на различни продукти. Освен това се използва в селското стопанство за унищожаване на вредни микроорганизми в оранжерии и изби. Големи количества SO 2 се използват за производство на сярна киселина.
Серен оксид (VI) – ТАКА 3 (сярен анхидрид)
Сярен анхидрид SO 3 е безцветна течност, която при температури под 17 ° C се превръща в бяла кристална маса. Абсорбира много добре влагата (хигроскопична).
Химични свойства
Киселинно-алкални свойства
Как взаимодейства типичният киселинен оксид серен анхидрид:
SO 3 + CaO = CaSO 4
в) с вода:
SO 3 + H 2 O = H 2 SO 4
Специално свойство на SO 3 е способността му да се разтваря добре в сярна киселина. Разтвор на SO 3 в сярна киселина се нарича олеум.
Образуване на олеум: H 2 SO 4 + н SO 3 = H 2 SO 4 ∙ н SO 3
Редокс свойства
Серен оксид (VI) се характеризира със силни окислителни свойства (обикновено редуцирани до SO 2):
3SO 3 + H 2 S = 4SO 2 + H 2 O
Получаване и използване
Сярен анхидрид се образува по време на окисляването на серен диоксид:
2SO 2 + O 2 = 2SO 3
Чист серен анхидрид практиченне притежава. Получава се като междинен продукт при производството на сярна киселина.
H 2 SO 4
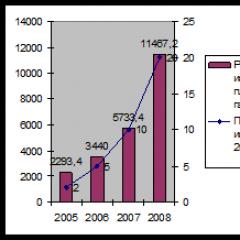
Сярната киселина се споменава за първи път от арабски и европейски алхимици. Получава се чрез калциниране на железен сулфат на въздух (FeSO 4 ∙ 7H 2 O): 2FeSO 4 = Fe 2 O 3 + SO 3 + SO 2 или смес с: 6KNO 3 + 5S = 3K 2 SO 4 + 2SO 3 + 3N 2, и отделените пари на серен анхидрид се кондензират. Поемайки влага, те се превръщат в олеум. В зависимост от начина на приготвяне, H 2 SO 4 се нарича витриолово масло или сярно масло. През 1595 г. алхимикът Андреас Либавий установява идентичността на двете вещества.
Дълго време витриоловото масло не се използва широко. Интересът към него силно нараства, след като през XVIII век. е открит процесът на получаване на индиго кармин, стабилно синьо багрило. Първата фабрика за сярна киселина е основана близо до Лондон през 1736 г. Процесът се извършва в оловни камери, в дъното на които се излива вода. В горната част на камерата се изгаря разтопена смес от селитра и сяра, след което се вкарва въздух в нея. Процедурата се повтаря, докато на дъното на контейнера се образува киселина с необходимата концентрация.
През XIX век. методът беше подобрен: вместо нитрат, те започнаха да използват азотна киселина (тя дава, когато се разлага в камерата). За да се върнат азотни газове в системата, са проектирани специални кули, които дават името на целия процес - процесът на кулата. Растения, работещи по метода на кулата, съществуват в наше време.

Сярната киселина е тежка мазна течност, безцветна и без мирис, хигроскопична; добре разтворим във вода. Когато концентрираната сярна киселина се разтвори във вода, се отделя голямо количество топлина, така че тя трябва внимателно да се излее във водата (а не обратното!) И разтворът трябва да се разбърка.
Разтвор на сярна киселина във вода, съдържаща по -малко от 70% H 2 SO 4, обикновено се нарича разредена сярна киселина, а разтвор над 70% се нарича концентрирана сярна киселина.
Химични свойства
Киселинно-алкални свойства
Разредената сярна киселина проявява всички характерни свойства силни киселини... Тя реагира:
H 2 SO 4 + NaOH = Na 2 SO 4 + 2H 2 O
H 2 SO 4 + BaCl 2 = BaSO 4 ↓ + 2HCl
Процесът на взаимодействие на Ba 2+ йони със сулфатни йони SO 4 2+ води до образуването на бяла неразтворима утайка BaSO 4. то качествен отговорна сулфатен йон.
Окисляващи - редуциращи свойства
В разреден H 2 SO 4, H + йони са окислители, а в концентрирани H 2 SO 4, сулфатните йони са SO 4 2+. Йони SO 4 2+ са по -силни окислители от йони Н + (виж диаграмата). 
V разредена сярна киселинаметалите, които са в електрохимичните серии на напрежения, се разтварят до водород... В този случай се образуват и отделят метални сулфати:
Zn + H 2 SO 4 = ZnSO 4 + H 2
Металите, които са в електрохимичните серии на напрежения след водород, не реагират с разредена сярна киселина:
Cu + H 2 SO 4 ≠
Концентрирана сярна киселинае силен окислител, особено при нагряване. Окислява много и някои органични вещества.
При взаимодействие на концентрирана сярна киселина с метали, които са в електрохимичните серии на напрежения след водород (Cu, Ag, Hg), се образуват метални сулфати, както и продуктът на редукция на сярна киселина - SO 2.
 Реакция на сярна киселина с цинк
Реакция на сярна киселина с цинк С по -активни метали (Zn, Al, Mg), концентрираната сярна киселина може да бъде редуцирана до свободна. Например, при взаимодействието на сярна киселина с, в зависимост от концентрацията на киселината, могат едновременно да се образуват различни продукти на редукция на сярна киселина - SO 2, S, H 2 S:
Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O
3Zn + 4H 2 SO 4 = 3ZnSO 4 + S ↓ + 4H 2 O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
В студена, концентрирана сярна киселина пасивира някои метали например и затова се транспортира в железни резервоари:
Fe + H 2 SO 4 ≠
Концентрираната сярна киселина окислява някои неметали (и т.н.), редуцирайки до серен оксид (IV) SO 2:
S + 2H2SO4 = 3SO2 + 2H2O
C + 2H 2 SO 4 = 2SO 2 + CO 2 + 2H 2 O
Получаване и използване

В промишлеността сярната киселина се получава чрез контактния метод. Производственият процес се осъществява на три етапа:
- Получаване на SO 2 чрез печене на пирит:
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
- Окисляване на SO 2 до SO 3 в присъствието на катализатор - ванадиев (V) оксид:
2SO 2 + O 2 = 2SO 3
- Разтваряне на SO 3 в сярна киселина:
H 2 SO 4 + н SO 3 = H 2 SO 4 ∙ н SO 3
Полученият олеум се транспортира в железни резервоари. Сярна киселина с желаната концентрация се получава от олеум чрез добавянето му към вода. Това може да се изрази с диаграмата:
H 2 SO 4 ∙ н SO 3 + H 2 O = H 2 SO 4
Сярната киселина намира най -различни приложения различни области Национална икономика... Използва се за изсушаване на газове, при производството на други киселини, за производство на торове, различни багрила и лекарства.
Соли на сярна киселина

Повечето сулфати са лесно разтворими във вода (слабо разтворим CaSO 4, още по -малко PbSO 4 и практически неразтворим BaSO 4). Някои сулфати, съдържащи кристализационна вода, се наричат витриол:
CuSO 4 ∙ 5H 2 O меден сулфат
FeSO 4 ∙ 7H 2 O железен сулфат
Всеки има соли на сярна киселина. Тяхното отношение към отоплението е специално.
Сулфатите на активни метали (,) не се разлагат дори при 1000 ° С, докато други (Cu, Al, Fe) - се разлагат при леко нагряване до метален оксид и SO 3:
CuSO 4 = CuO + SO 3
Изтегли:
Изтеглете безплатно резюме по темата: „Производство на сярна киселина чрез контактния метод“
Можете да изтеглите резюмета по други теми
* на записаното изображение има снимка на меден сулфат
Серен оксид (VI) (серен анхидрид, серен триоксид, сив газ) SO 3 - по -висок серен оксид. При нормални условия това е силно летлива безцветна течност с задушаваща миризма. При температури под 16.9 ° C се втвърдява с образуването на смес от различни кристални модификации на твърд SO 3.
Получаване
Може да се получи чрез термично разлагане на сулфати:
или взаимодействието на SO 2 с озон:
За окисляване на SO 2 се използва и NO 2:
Тази реакция е в основата на исторически първия азотен метод за производство на сярна киселина.
Физически свойства
Серен оксид (VI) - при нормални условия силно летлива безцветна течност с задушаваща миризма.
Молекулите SO 3 в газовата фаза имат плоска тригонална структура с D 3h симетрия (OSO ъгъл = 120 °, d (S-O) = 141 pm). По време на прехода към течно и кристално състояние се образуват циклични тримерни и зигзагообразни вериги. Тип химическа връзкав молекула: ковалентна полярна химическа връзка.
Твърдият SO 3 съществува в α-, β-, γ- и δ-форми, с точки на топене съответно 16,8, 32,5, 62,3 и 95 ° C и се различават по формата на кристалите и степента на полимеризация на SO 3. Α-формата на SO 3 се състои предимно от тримерни молекули. Други кристални форми на серен анхидрид се състоят от зигзагообразни вериги: изолирани в β-SO 3, свързани в плоски мрежи в γ-SO 3 или в пространствени структури в δ-SO 3. Когато се охлади, парата първо образува безцветна, подобна на лед, нестабилна α-форма, която постепенно се трансформира в присъствието на влага в стабилна β-форма-бели „копринени“ кристали, подобни на азбеста. Обратният преход на β-формата към α-формата е възможен само чрез газообразното състояние на SO 3. И двете модификации „пушат“ във въздуха (образуват се капчици H 2 SO 4) поради високата хигроскопичност на SO 3. Взаимният преход към други модификации е много бавен. Разнообразието от форми на серен триоксид е свързано със способността на молекулите на SO 3 да полимеризират поради образуването на донорно-акцепторни връзки. Полимерните структури на SO 3 лесно се трансформират една в друга, а твърдият SO 3 обикновено се състои от смес от различни форми, чието относително съдържание зависи от условията за получаване на серен анхидрид.
Химични свойства
и оксиди:
SO 3 се характеризира със силни окислителни свойства, обикновено редуцирани до серен диоксид:
При взаимодействие с хлороводород се образува хлоросулфонова киселина:
Той също така взаимодейства със серен дихлорид и хлор, за да образува тионилхлорид:
Приложение
Сярен анхидрид се използва главно при производството на сярна киселина.
Сярен анхидрид също се отделя във въздуха по време на изгарянето на серни бомби, използвани при обеззаразяване на помещенията. При контакт с влажни повърхности серният анхидрид се превръща в сярна киселина, която вече унищожава гъбичките и други вредни организми.
Напишете отзив за статията "Сярен (VI) оксид"
Литература
- Ахметов Н. С. "Общи и неорганична химия»М.: аспирантура, 2001
- Карапетянц М. Х., Дракин С. И. "Обща и неорганична химия" Москва: Химия 1994
Извадка, характеризираща сярен (VI) оксид
Наташа се изчерви. - Не искам да се омъжа за никого. Ще му кажа същото, когато го видя.- Ето как! - каза Ростов.
- Е, да, всичко това са глупости - продължи да бърбори Наташа. - А с какво е добър Денисов? Тя попита.
- Добре.
- Ами сбогом, облечи се. Страшен ли е, Денисов?
- Защо страшно? - попита Никола. - Не. Васка е славен.
- Наричате го Васка - странно е. Много ли е добър?
- Много добре.
- Е, елате и пийте чай възможно най -скоро. Заедно.
И Наташа застана на пръсти и излезе от стаята по начина, по който танцьорите правят, но се усмихва по начина, по който се усмихват щастливите 15 -годишни момичета. След като срещна Соня в хола, Ростов се изчерви. Не знаеше как да се държи с нея. Вчера те се целунаха в първата минута от радостта от срещата, но днес почувстваха, че е невъзможно да се направи това; чувстваше, че всички, както майка му, така и сестрите му, го гледаха въпросително и се очаква от него как ще се държи с нея. Той целуна ръката й и я нарече ти - Соня. Но очите им, като се срещнаха, си казаха „ти“ и се целунаха нежно. С погледа си тя поиска прошка от него за факта, че в посолството на Наташа се осмели да му напомни за обещанието му и му благодари за любовта. С погледа си той й благодари за предложението за свобода и каза, че така или иначе, той никога няма да спре да я обича, защото човек няма как да не я обича.
- Колко странно обаче - каза Вера, избирайки общ момент на мълчание, - че сега Соня и Николенка се срещнаха с теб и като непознати. - забележката на Вера беше вярна, както всичките й забележки; но както при повечето от нейните забележки, всички се чувстваха неловко и не само Соня, Николай и Наташа, но и старата графиня, която се страхуваше от любовта на този син към Соня, която можеше да го лиши от блестящата му част, също се изчерви като момиче. Денисов, за изненада на Ростов, в нова униформа, измазан и парфюмиран, се появи в гостната толкова елегантен, колкото и в битките, и толкова любезен към дамите и господата, че Ростов никога не е очаквал да го види.
Завръщайки се в Москва от армията, Николай Ростов е приет от семейството си като най -добрия син, герой и обичан Николушка; семейство - като сладък, приятен и уважителен млад мъж; познати - като красив хусарски лейтенант, сръчен танцьор и един от най -добрите ухажори в Москва.
Ростовите се срещнаха с цяла Москва; тази година старият граф имаше достатъчно пари, защото всички имения бяха ипотекирани отново и затова Николушка, след като започна собствения си тръс и най-модерните гамаши, специални, които никой друг в Москва нямаше, и ботушите, най-модерните, с най -острите чорапи и малки сребърни шпори, се забавляваха много. Ростов, завръщайки се у дома, изпита приятно чувство след определен период от време, опитвайки се да се придържа към старите условия на живот. Струваше му се, че е узрял и пораснал много. Отчаяние от изпита, който не беше скрит от Божия закон, заемане на пари от Гаврила за таксиметров автомобил, тайни целувки със Соня, той припомни всичко това като детство, от което сега беше неизмеримо далеч. Сега той е хусарски лейтенант в сребърна мантия, с войника Джордж, подготвящ своя тръс за бяг, заедно с известни ловци, възрастни, уважавани. Той има приятелка на булеварда, при която отива вечер. Той дирижира мазурка на бала на Архарови, говори за войната с фелдмаршал Каменски, посещава английски клуб и поддържа връзка с четиридесетгодишен полковник, с когото Денисов го запознава.
Страстта му към суверена малко отслабна в Москва, тъй като през това време той не го видя. Но той често говореше за суверена, за любовта си към него, правейки усещането, че още не казва всичко, че има нещо друго в чувствата му към суверена, което не може да бъде разбрано от всички; и той от все сърце споделяше чувството на обожание, което беше обичайно в Москва по онова време за императора Александър Павлович, който по това време в Москва получи името на ангел в плът.
По време на този кратък престой на Ростов в Москва, преди да замине за армията, той не се сближи, а напротив се раздели със Соня. Тя беше много красива, сладка и очевидно страстно влюбена в него; но той беше по това време на младостта си, когато изглежда толкова много, че няма време за това, а младият човек се страхува да се включи - той оценява свободата си, от която се нуждае за много други неща . Когато си помисли за Соня по време на този нов престой в Москва, си каза: Ех! има още много, много от тях ще бъдат и са там, някъде, непознати за мен. Все още имам време, когато искам, да правя любов, а сега нямам време. Освен това му се струваше, че нещо унизително за смелостта му в женското общество. Той ходи на балове и на сестринството, преструвайки се, че го прави против волята си. Бягане, английски клуб, общуване с Денисов, пътуване дотам - това беше друг въпрос: беше прилично за млад хусар.