Bir çözelti nasıl doğru şekilde titre edilir. titrasyon tekniği
TİTRASYON.(Fransız titresinden - kalite, karakteristik) - analit ile tamamen reaksiyona giren bir reaktif miktarının ölçülmesine dayanan nicel analiz yöntemlerinden biri. Örneğin, hidroklorik asit ile reaksiyonda tam olarak ne kadar potasyum hidroksit (gram veya mol olarak) tüketildiğini biliyorsanız, o zaman KOH + HCl = KCl + H 2 O reaksiyon denklemini kullanarak kaç gram (veya mol) olduğunu hesaplamak kolaydır. mol) hidrojen klorür analiz edilen çözeltideydi ...
Bu tür hesaplamalar sadece stokiyometrik reaksiyonlar için yapılabilir. Bu terim 1792'de Alman kimyager Jeremiah Richter tarafından icat edildi. Yunanca "görünmez" ve "boyut" anlamına gelen ve "görünmez"in oranı anlamına gelen "boyut" kelimelerinden türetmiştir. kimyasal elementler reaksiyonlarda. Kimya tarihinde ilk kez Richter, nicel reaksiyon denklemlerini kullanmaya başladı. Örneğin, onun verilerine göre, güçlü kalsinasyon üzerine 2400 tane CaC03'ten 1342 tane CaO elde edilir, yani CaC03 = CaO + CO2'nin ayrışma reaksiyonu, CaCO 3: CaO = 2400 oranı ile karakterize edilir. : 1342 = 1.788, ki bu şaşırtıcı bir şekilde tutarlı modern hesaplamadır ve 1.785 oranını verir.
Kantitatif analizde kullanılan tüm reaksiyonlar stokiyometrik olmalıdır. Bu reaksiyonlar için, reaktiflerin formüllerinin önündeki katsayılar, reaktiflerin ve ürünlerin hangi nicel oranlarda olduğunu gösterir. Örneğin, asidik bir ortamda oksalik asidin potasyum permanganat ile oksidasyon reaksiyonundaki reaktanların oranı tam olarak denkleme karşılık gelir.
5H 2 C 2 O 4 + 2KMnO 4 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 10CO 2 + 8H 2 O.
Bu nedenle, tüketilen oksalik asit miktarı biliniyorsa (ve tersi) bu reaksiyon, çözeltideki permanganat konsantrasyonunu doğru bir şekilde belirlemek için kullanılabilir. Ancak potasyum permanganat ile reaksiyona giren alkenin tam miktarını hesaplamak imkansızdır, çünkü bu reaksiyon stokiyometrik değildir: oksidasyon sırasında alkenden bir diol oluşur: R-CH = CH-R + 2 [O] ® R-CH (OH ) -CH (OH) - R, karbon-karbon bağını kırmak için daha fazla oksitlenebilir ve bir karbonil grubu (asit veya keton) ile iki molekül oluşturur. Ayrıca, aynı koşullar altında gerçekleştirilen farklı deneyler bile, biraz farklı miktarlarda ürün ve bunların oranını verecektir; v organik Kimya reaksiyon verimi çok nadiren tam olarak %100,00'dir.
Analizin doğru olması için, reaksiyonun tam seyrine ek olarak, reaktifin analite küçük porsiyonlarda eklenmesi (örneğin, bir damla seyreltilmiş çözelti) ve ayrıca bunun mümkün olması gerekir. reaksiyonun bittiği anı güvenilir bir şekilde belirlemek için. İkinci koşulu yerine getirmek için çeşitli göstergeler kullanılır.
Göstergeler çok farklı. Kabartma tozunun sirke ile reaksiyonunu düşünün: NaHC03 + CH3COOH = CH3COONa + CO2 + H2O. Bu denklemden, 1 mol sodanın (84 g) 60 g ile tamamen reaksiyona girdiği sonucu çıkar. asetik asit... Aynı zamanda, bir gösterge görevi görebilecek karbondioksit kabarcıkları salınır. Bilinen bir kütlenin sodyum bikarbonata sirkesi, gaz artık gelişmeyene kadar damla damla eklenirse, eklenen çözeltinin hacmi ölçülerek ve yoğunluğu bilinerek, eklenen çözeltideki saf asetik asit miktarını hesaplamak kolaydır ve sonuç olarak , sirke konsantrasyonu. Örneğin, 1.00 g soda ile tam bir reaksiyon için 10.5 g sirke gerekliyse, bu, sirkenin 60/84 = 0.714 g saf asetik aside sahip olduğu ve gücünün (0.714 / 10.5) %100 olduğu anlamına gelir. %6.8. Çok doğru hesaplamalar için kimyagerler rafine değerler kullanır atom kütleleri elementler (bu durumda sodyum bikarbonat için 84.01 ve asetik asit için 60.05).
Elbette açıklanan titrasyon deneyi sadece bir örnektir. Sonuçta, tüm kimyasal reaksiyonlarda gaz salınmaz ve özellikle gaz kısmen çözülürse ve çözelti koyu bir renge sahipse, son gaz kabarcığının fark edilmesi kolay değildir. Bu nedenle, genellikle, renk değişimi reaksiyonun sonuna ulaşıldığını gösteren özel göstergeler kullanılır - sözde eşdeğerlik noktası.
En yaygın göstergelerden biri asit-bazdır. Titrasyon sırasında, yani. reaktifin analiz edilen çözeltiye kademeli olarak eklenmesi ortamın pH'ını değiştirir. Bu, örneğin, analiz edilen alkali çözeltiye bir asit çözeltisi eklenirse (veya tam tersi) olur. Analiz edilecek çözelti, hacimce veya ağırlıkça hazırlanır (doğru bir analitik terazide, genellikle 0.1 mg'a kadar tartılır), bu, kesin olarak bilinen bir hacme sahip bir ölçülü balonda çözülür (bu tür şişelerin hacmi 10 olabilir). , 25, 50, 100, 200, 250, 500 veya 1000 ml). Analiz edilen çözeltinin küçük bir hacmi, özel hacimsel pipetler kullanılarak hacimsel bir şişeden alınır (hacimleri de yüksek doğrulukla belirlenir ve genellikle 10, 20, 25 ve 50 ml'dir) ve titrasyon için konik bir şişeye yerleştirilir. Bu şişeye sürekli karıştırarak damla damla büretten reaktif solüsyonu eşdeğerlik noktasına ulaşılana kadar ekleyin.
Tüketilen reaktif çözeltisinin hacmi, büret bölümleri ile ölçülür; hacmi 10, 25 veya 50 ml'ye eşit olabilir ve mezuniyet fiyatı 0,1 ml'dir. 0,01 ml dereceli 1 ila 5 ml kapasiteli mikroburetler de vardır. Bir musluk kullanılarak, büretten gelen çözelti, analit çözeltisine damla damla ilave edilir. Bu durumda, titrasyon her zaman birkaç kez tekrarlanır ve ortalama sonuç alınır - bu, analizin doğruluğunu ve güvenilirliğini artırır. Çözeltilerin konsantrasyonu mol / L birimlerinde ölçülürse, analitin ve reaktifin çözeltilerinin hacmi, maddenin bilinmeyen konsantrasyonunu hemen belirleyebilir. Örneğin, 25,00 ml KOH çözeltisinin titrasyonu, 0,0865 mol / L konsantrasyonda 12,55 ml HCl çözeltisine gittiyse (önceden belirlenir), o zaman alkali konsantrasyonu 0,0865 (12,55 / 25.00) = 0 , 0432 mol / l. Titrasyon için bir sülfürik asit çözeltisi kullanılmışsa, 2KOH + H 2 SO 4 = K 2 SO 4 + 2H 2 O reaksiyon denkleminde stokiyometrik katsayı 2'nin dikkate alınması gerektiği açıktır. Analitik kimyagerler, stokiyometrik katsayıları hesaba katmak için genellikle molarite çözümü yerine normalliği kullanın. Yani, 1 n. H2S04 çözeltisi, 0.05 mol / l'lik bir molar konsantrasyona karşılık gelir. O zaman çözeltinin hacim ve normallik çarpımı hem analit hem de reaktif için her zaman aynı olacaktır.
Bilinen birçok asit-baz göstergesi (yaklaşık 100) vardır ve bunların her birinin kendi uygulama alanı vardır. Bu, aşağıdaki örneklerde gösterilebilir. Güçlü bir asidi (HCl) güçlü bir alkaliyle (NaOH) titre ederken, NaCl içeren çözelti nötr olduğunda (pH = 7) tam nötralizasyon sağlanır. Bu durumda, benzer özelliklere sahip nitrazin sarısı (pH 6.0 - 7.0 aralığında renk sarıdan mavi-mora değişir) veya bromotimol mavisi gibi indikatörler kullanabilirsiniz. Güçlü bir asidi güçlü bir alkali ile titre ederken (veya tam tersi), eşdeğerlik noktasındaki pH değişikliği o kadar keskindir ki başka birçok gösterge kullanılabilir. Örneğin, bu örnekte, 0,1 mol / L'lik bir reaktif konsantrasyonunda, toplam alkalinin %99,9'u eklendikten sonra, çözeltinin pH'ı 4'tür ve %0,1 fazla alkali eklendikten sonra, pH = 10'dur. Titrasyon sırasında pH'daki keskin değişime sadece 1-2 damla reaktif neden olabilir. Bu nedenle, bu durumda metil turuncu (pH 3.1'de renk kırmızıdan pH 4'te turuncu-sarıya değişir) veya iyi bilinen fenolftalein (pH 8.2'de renk renksizden renk değiştirir) gibi indikatörlerin kullanılması yanlış olmayacaktır. pH 10.0'da ahududu kırmızısına).
Zayıf bir asidi, örneğin asetik asidi bir NaOH çözeltisi ile titre ederseniz, asidin tamamen nötrleştirilmesinden sonra titrasyonun sonunda, çözelti, hidroliz nedeniyle alkali olan sodyum asetat CH3COONa içerir. reaksiyon (pH yaklaşık 9). Bu durumda artık metil portakal kullanamazsınız, ancak fenolftalein kullanabilirsiniz. Öte yandan, zayıf bir alkali (örneğin, amonyak çözeltisi) güçlü bir asit (HCl) ile titre edildiğinde, eşdeğerlik noktasında, hidroliz nedeniyle asidik bir reaksiyona sahip olan çözeltide NH4Cl bulunur ( pH yaklaşık 5) ve burada fenolftalein değil metil portakal kullanabilirsiniz.
Özel bir durum, polibazik asitleri (örneğin, H 3 PO 4) ve ayrıca madde karışımlarını titre ederken bir gösterge seçimidir. Bu nedenle, NaOH çözeltileri, reaksiyon nedeniyle genellikle bir karbonat safsızlığı içerir. karbon dioksit hava. Na2C03 içeren bir NaOH çözeltisini fenolftalein varlığında güçlü bir asit ile titre ederseniz, tüm alkali ve kısmen karbonat nötralize edildiğinde (bu yaklaşık 8,5'lik bir pH'ta olur) çözeltinin rengi değişir. denklem
NaOH + Na2C03 + 2HCl = 2NaCl + NaHC03 + H20.
Böyle bir çözeltiye metil portakal eklenirse ve titrasyona devam edilirse, tüm bikarbonat reaksiyona girdiğinde sarı renk pembeye döner (bu, yaklaşık 3.5'lik bir pH'a karşılık gelir): NaHC03 + HCl = NaCl + H2C03 .
Böylece, iki asit-baz göstergesi kullanılarak numunedeki alkali ve karbonat içeriğini ayrı ayrı hesaplamak mümkündür.
Titrasyon sırasında bir oksidasyon-redüksiyon reaksiyonu meydana gelirse, çözeltinin redoks potansiyeline bağlı olarak rengini değiştiren özel göstergeler kullanılır. Genellikle renkli reaktifin kendisi bir gösterge işlevi görebilir. örneğin, indirgeyici ajanların bir KMn04 çözeltisi ile titrasyon yoluyla kantitatif analizinde, eşdeğerlik noktası, permanganatın pembe renginin kaybolmasıyla belirlenir. Böylece, örneğin, bir çözeltideki demir (II) içeriğini 10FeSO 4 + 2KMnO 4 + 8H 2 SO 4 = 5Fe 2 (SO 4) 3 + 2MnSO 4 + K 2 SO 4 denklemine göre belirleyebilirsiniz. + 8H 2 O. Çözelti Fe2 + iyonları içerirken, eklenen KMnO 4'ün rengi bozulur. En ufak bir permanganat fazlalığı ortaya çıkar çıkmaz çözelti pembeye döner. Bu şekilde çeşitli indirgeyici ajanlar analiz edilebilir.
Üstelik permanganatometri yardımıyla oksidanları da analiz etmek mümkün! Bunun için sözde geri titrasyon kullanılır. Bunun için, bilinen bir oksitleyici madde hacmine (örneğin potasyum dikromat) fazla miktarda bilinen bir indirgeyici madde, demir (II) ilave edilir. K 2 Cr 2 O7 + 6FeSO 4 + 7H 2 SO 4 = Cr 2 (SO 4) 3 + 3Fe 2 (SO 4) 3 + K 2 SO 4 + 7H 2 O reaksiyonu çok hızlıdır. Daha sonra permanganat ile titrasyon kullanılarak ne kadar demir (II) kaldığı belirlenir ve basit bir çıkarma ile dikromat ile ilk reaksiyonda ne kadar tüketildiği hesaplanır.
Redoks reaksiyonlarını kullanan diğer bir yaygın yöntem iyodometridir ( santimetre... IOD) Örneğin, potasyum iyodür ile reaksiyona girerek onu serbest iyodine oksitleyen oksidanları belirlemek için kullanılır, örneğin: 10KI + 2KMnO 4 + 8H 2 SO 4 = 2MnSO 4 + 5I 2 + 6K 2 SO 4 + 8H 2 O Geri titrasyon ilkesi burada da kullanılır: ilk reaksiyonda salınan iyot miktarı, sodyum tiyosülfat ile reaksiyonu kullanılarak belirlenebilir: I 2 + 2Na 2 S 2 O 3 = Na 2 S 4 O 6 + 2NaI . Bu reaksiyonun sonu, iyot renginin kaybolması ile belirlenir. Bununla birlikte, çözeltide biraz iyot kaldığında, soluk sarı rengi neredeyse görünmezdir ve çözeltinin tamamen renk değiştirdiği anı fark etmek zordur. Titrasyonun doğruluğunu artırmak için, çözeltiye sonuna yakın bir miktar nişasta çözeltisi eklenir: en küçük iyot izleri onu lekeler. Mavi renk... Bu nedenle mavi rengin kaybolması reaksiyonun tamamlandığını gösterir. Kimyagerler genellikle çok seyreltik tiyosülfat çözeltileri (örn. 0.01 mol / L) kullanırlar, bu da büyük hacimlerde çözelti daha doğru bir şekilde ölçüldüğü için tahlilin doğruluğunu büyük ölçüde artırır.
İyot, askorbik asidi (C vitamini) çok kolay ve hızlı bir şekilde oksitler. Bu nedenle, iyodometrik analiz yardımıyla, örneğin portakal suyunda bu vitaminin içeriğini (tabii ki, belirli bir doğruluk olmadan) evde bile belirlemek mümkündür. (Burada asit-baz titrasyonu kullanmak imkansızdır, çünkü meyve suyu çok daha fazla miktarda diğer organik asitleri - sitrik, malik, tartarik ve diğerleri içerdiğinden.) Analiz, 1 mol askorbik asit (176 g) gerçeğine dayanmaktadır. 1 mol iyot (254 g) ile reaksiyona girer. Titrasyon için, iyotun tükenmediğini ve tam olarak% 5 olduğunu varsayarak bir eczane iyot tentürü kullanabilirsiniz (bu, yaklaşık 0,2 mol / l'lik bir konsantrasyona karşılık gelir). Tüketilen iyot miktarı, geleneksel bir pipet kullanılarak - reaksiyonda kullanılan tentür damlalarının sayısı ile tahmin edilebilir. Meyve suyunda genellikle çok fazla askorbik asit bulunmadığından, bir kısmını titre etmek için sadece 1-2 damla tentür kullanılabilir (örneğin, 20 ml), bu da çok büyük bir analiz hatasına yol açacaktır. Sonucun daha doğru olması için ya çok fazla meyve suyu almalı ya da iyot tentürünü seyreltmelisiniz; her iki durumda da titrasyon için tüketilen iyot damlası sayısı artacak ve bu da analizi daha doğru hale getirecektir. Kimyacılar ikinci yolu tercih ederler.
Tentür kaynamış suyla (kimyacılar damıtılmış su kullanır) 40 kez seyreltilirse, böyle bir çözeltinin konsantrasyonu yaklaşık 0.005 mol / l olacaktır; Bu çözeltinin 1.0 ml'si 0.88 mg askorbik aside karşılık gelir. Damla hacmini belirlemek de gereklidir (pipet tipine ve ayrıca özel çözüme bağlıdır). Bunu yapmak için kullanmanız gerekir tıbbi şırınga 1 veya 2 ml için 1 ml seyreltilmiş iyot çözeltisi ölçün ve ardından bu hacimde kaç damla bulunduğunu hesaplayın (bu sadece birkaç dakika sürecektir). Tekniğin ilk önce standart bir askorbik asit çözeltisi üzerinde çalışması arzu edilir. Bilinen bir askorbik asit içeriğine sahip bir tabletten hazırlanabilir - örneğin, 0,1 veya 0,5 g.Tablet 0,5 litre kaynamış su içinde çözülmeli ve bu çözeltinin 25 ml'si bir eczane beheri kullanılarak alınmalıdır. bir tabletten 20 kat daha az vitamin içerir). Sonunda biraz sıvı nişasta macunu eklemeyi unutmadan bu çözeltiye seyreltilmiş bir iyot tentürü eklenir. Ve örneğin, 6.0 ml iyot çözeltisi 25 ml çözeltiyi titre etmeye gittiyse, çözeltideki askorbik asit 0.88.6 = 5.28 mg ve orijinal tablette - 20 kat daha fazla, yani. 105.6 mg. Böyle küçük bir hata, "ev" analizinin doğruluğunu gösterir.
Kimyagerler, elbette, bir pipetten damlamazlar, ancak hassas dereceli büretler kullanırlar. Ayrıca, çoğu zaman standart çözümleri kendileri bile hazırlamazlar, fabrika çözümlerini kullanırlar; Mühürlü ampullerdeki bu tür çözeltilere sabit kanallar denir - çalışma çözeltisinin konsantrasyonunu doğru bir şekilde belirlemek için sabit miktarda reaktif (genellikle 0.1 mol) içerirler. Sabit kanallar örneğin KMnO 4, K 2 Cr 2 O 7, NaCl, H 2 C 2 O 4, HCl, AgNO 3, NaOH, vb.'nin çözümleridir.
Kompleksometrik göstergeler yaygınlaştı - belirli metallerin iyonlarıyla (çoğu renksiz olan) renkli iyonlar oluşturan maddeler karmaşık bileşikler... Bir örnek eriokrom siyah T'dir; bu kompleks organik bileşiğin çözeltisi mavi bir renge sahiptir ve magnezyum, kalsiyum ve diğer bazı iyonların varlığında yoğun şarap kırmızısı renginde olan kompleksler oluşur. Analiz şu şekilde gerçekleştirilir: analiz edilen katyonları ve indikatörü içeren çözeltiye, indikatörden daha güçlü olan bir kompleks yapıcı ajan damla damla, çoğunlukla Trilon B eklenir. Trilon tüm metal katyonlarını tamamen bağlar bağlamaz , kırmızıdan maviye belirgin bir geçiş meydana gelecektir. Eklenen trilon miktarına göre, çözeltideki metal katyonlarının içeriğini hesaplamak kolaydır. Örneğin kompleksometrik analiz ile suyun toplam sertliği belirlenir.
Bir çökelti oluşumuna dayanan titrasyon yöntemleri vardır. Böylece, argentometri yardımıyla bir çözeltideki klorür ve bromürlerin içeriğini belirlemek mümkündür. Bunun için çözelti AgNO 3 çözeltisi ile titre edilir. Eşdeğerlik noktasının daha net belirlenmesi için analiz edilen çözeltiye 1-2 damla K 2 Cr 2 O 4 çözeltisi eklenir. Çözeltide fazla halojenür iyonu olduğu sürece, daha az çözünür AgCl veya AgBr oluşur. Bu iyonların tamamen çökelmesinden sonra, hemen kırmızımsı bir Ag 2 CrO 4 çökeltisi görünecektir. Çözeltideki gümüş iyonlarının belirlenmesi gerekiyorsa NaCl çözeltisi ile titre edilir.
Açıklanan teknikler, mevcut titrasyon yöntemlerini tüketmekten uzaktır. Aletler kullanılarak titrasyonun seyrinin izlendiği yöntemler de yaygınlaşmıştır. Örneğin, kondüktometrik analizde (İngilizce iletkenlik - elektriksel iletkenlikten), titrasyon sırasında değişen bir çözeltinin elektriksel iletkenliği ölçülür. Potansiyometrik yöntemde, analiz edilen çözeltiye daldırılan bir elektrotun potansiyeli ölçülür. Fotometrik analiz, bir çözeltinin renk yoğunluğu değiştiğinde ışığın absorpsiyonunun ölçülmesine dayanır. Yalnızca eşdeğerlik noktasını belirlemekle kalmayıp, aynı zamanda çalışma çözümünü otomatik olarak damla damla analiz edilene ekleyen ve bitmiş analiz sonucunu veren cihazlar geliştirilmiştir.
Bir analiz yöntemi olarak titrasyon, teknik ve ekipmanın basitliği ve yüksek doğruluk ile ayırt edilir: titrasyon kullanarak, bir çözeltideki bir maddenin konsantrasyonunu % 0.1 doğrulukla belirlemek kolaydır. Bu nedenle, titrimetrik yöntemler yaygın olarak kullanılmaktadır. bilimsel araştırma ve üretimdeki teknolojik süreçlerin kontrolünde. Bu nedenle, reaksiyonun kinetiği incelenirken, başlangıçtaki reaktifin konsantrasyonunda zamanla bir azalma veya reaksiyon ürününün konsantrasyonunda bir artış belirlenir; bu şekilde, örneğin, ikame reaksiyonlarının mekanizması üzerine klasik çalışmalar organik bileşikler... Endüstride, titratörler yaygın olarak kullanılmaktadır - titrimetrik analizlerin otomatik performansı için cihazlar. Aynı tipte kütle analizleri yapmak için çok uygundurlar (örneğin, eritme sırasında alaşımın bileşimini veya içindeki zararlı safsızlıkların içeriğini belirlemek için). Bu tür cihazlar, laboratuvar asistanının olmadığı durumlarda uzun süre çalışabilmekte, otomatik olarak numune alıp analiz sonuçlarını verebilmektedir. Bu, özellikle radyoaktif, zehirli veya patlayıcılar, tozlu odalarda vb.
Ilya Leenson
Titre edilmiş çözeltilerle çalışırken aşağıdaki kurallara uyulmalıdır.
Titre edilmiş çözeltilerle çalışırken kullanılan tüm kaplar kusursuz temiz olmalıdır.
Tüm ölçüm kaplarında, okuma menisküsün alt noktası boyunca yapılır ve gözlemcinin gözü menisküsün kenarı ile aynı seviyede olmalıdır. Menisküsün daha keskin bir taslağını elde etmek için, genellikle damarın duvarına gözlemcinin karşısındaki beyaz bir kağıt parçası uygulanır.
Ölçüm kaplarının kapasitesi ısınmaya bağlı olarak değişir, bu nedenle ısı kaynaklarından uzak tutulması gerekir.
Titre edilmiş solüsyon distile su ile yıkanan büret içerisine dökülmeden önce büret çalışma solüsyonu ile iki kez durulanır. Titrasyon sırasında sıvı damla damla dökülür ve büretin burnu o kadar dar olmalıdır ki bir damlanın hacmi 0.03 ml'den fazla olmamalıdır. Büretin burnu çok genişse, brülör alevinde hafifçe ısıtarak daraltın ve dışarı çekin. Büret burnunda hava kabarcığı veya kristal olmadığından emin olun. Büretten titrasyona her zaman belirli bir bölmeden, tercihen sıfırdan başlanmalıdır.
Titre edilmiş solüsyonu doldurmak için pipeti baş ve orta parmaklarınızla üst ucundan tutun; işaret parmağı pipetin üst açıklığını kapatmak için kullanılır. Hacim aşağıdaki gibi ölçülür. İşaretin üzerindeki sıvıyı bir pipetle toplayın, ucunu filtre kağıdı parçaları veya temiz bir bezle silin, sıvı seviyesini işarete getirin ve pipetin ucunu bir erlen duvarına dayayarak distile su ile yıkayın, sıvının boşalmasına izin verin; sonra ona kadar sayın ve ancak o zaman pipet ucunu şişe duvarından çıkarın.
Titre edilmiş çözeltiler, titrelerini değiştireceği için nem kaybından ve su ile seyreltmeden dikkatli bir şekilde korunmalıdır. Bu nedenle, titre edilmiş çözeltileri olan şişeler tıpalarla sıkıca kapatılır, ısı kaynaklarından mümkün olduğunca uzak tutulur ve doğrudan güneş ışığından korunur.
Çözelti ile birlikte şişenin üst kısmında buharlaşmış su damlaları göründüğünde, çözelti çalkalanmalıdır. Bazı çözeltiler bir çökelti oluşturur. Bu durumda solüsyon tamamen temiz kuru bir şişeye süzülmeli ve titre kontrol edilmelidir.
Bürete solüsyonu dökmek için, solüsyon şişesine bir cam üçgen ve kauçuk boru ile bağlamak en iyisidir. Büret, solüsyonun büret içine emilmesiyle veya yerçekimi ile doldurulur, bunun için solüsyonlu şişe büret üzerindeki rafa yerleştirilir ve kıskaç serbest bırakıldığında solüsyon büret içine girer.
Titrasyon için kurulum aşağıdaki gibi monte edilir. Titrasyon solüsyonlu şişe, üç delikli bir lastik tıpa ile sıkıca kapatılır. Bir delikten, bir cam tüp (dış çap 6-7 mm) neredeyse şişenin en dibine indirilir, mantarın yakınında iki yerde dik açıyla bükülür. Lastik ve cam tüpler ve bir tişört kullanarak büretin alt ucuna bağlayın. Büret musluksuz kullanılır (genellikle 50 ml kapasiteli). Üst ucu, şişenin üzerinde durduğu başlık tablosunun rafına bağlanmıştır. Büret alttan direğe tel veya kauçuk plakalarla tutturulur. Büretin üst ucu, içinden kısa bir cam tüpün geçirildiği bir tıpa ile sıkıca kapatılır.
Büret tüpüne kauçuk bir tüp ile bağlanan kısa bir cam tüp, şişeyi kapatan tıpanın ikinci deliğine geçirilir. Soda kireci ile doldurulmuş bir kalsiyum klorür tüpü (granül şeklinde bir CaO ve NaOH alaşımı), alkali çözeltisini havadan CO2 girişinden koruyan tapanın üçüncü deliğine sokulur.
Cihazdaki tapalar ve borular iyi ve sıkı bir şekilde oturmalıdır. Çözelti şişesi, titrasyon tablosu seviyesinin yaklaşık 80-90 cm yukarısına yerleştirilir.
Herhangi bir nedenle tarif edilen kurulum monte edilemezse, büret küçük bir huni kullanılarak çözelti ile doldurulur, daha önce titre edilmiş bir çözelti ile iki kez durulanır ve dolum yapıldıktan sonra büretten çıkarılır.
Titrenin ayarlanması, laboratuvar teknolojisindeki en önemli işlemlerden biridir. Analizin sonucu ayrıca titre edilen çözeltinin doğru hazırlanmasına da bağlı olacaktır. Örneğin tesiste, analiz verilerine dayalı olarak, teknolojik sürecin seyri üzerinde kontrol gerçekleştirildiğini ve yanlış bir analizin bazı komplikasyonlara yol açabileceğini unutmayın. Her analize hemen hemen her zaman bir titrasyon eşlik ettiğinden, her laboratuvar çalışanı bu işlemin tekniğine iyi hakim olmalıdır.
Titre edilmiş çözümler söz konusu olduğunda akılda tutulması gereken birkaç kural vardır.
1. Titre edilmiş çözeltiler mümkün olduğunca taze olmalıdır. Uzun süreli depolamaya izin verilmemelidir. Her çözümün kendi raf ömrü vardır.
2. Titre edilmiş çözeltiler, durduklarında titrelerini değiştirirler, bu nedenle ara sıra kontrol edilmelidirler. Özellikle kritik bir analiz yapılıyorsa, çözümün titresinin kontrol edilmesi zorunludur.
3. Işığa maruz kalan titre edilmiş çözeltiler (AgNO3 çözeltileri vb.) sarı şişelerde veya çözeltiyi ışıktan koruyacak şekilde saklanmalıdır.
4. Potasyum permanganat çözeltileri hazırlarken titre, hazırlandıktan sonra 3-4 günden daha erken olmamalıdır. Aynısı, zamanla veya hava, cam vb. ile temas ettiğinde değişebilen diğer tüm çözümler için de geçerlidir.
5. Titre edilmiş alkali çözeltilerini, içinde parafinle kaplı şişelerde saklamak ve ayrıca havadaki karbondioksitin etkisinden korumak (soda kireçli veya askaritli kalsiyum klorür tüpü),
6. Titre edilmiş çözeltileri olan tüm şişeler, maddeyi, normalliği, düzeltmeyi, çözelti üretim zamanını ve titre kontrolünün tarihini gösteren açık bir yazıya sahip olmalıdır.
7. Asidik veya alkali çözeltileri titre ederken, sözde tanık çözeltisinin kullanılması yararlıdır.
Titrasyon sırasında, muflayı sol elinizle tutun ve büret valfini sağ elinizle çalıştırarak sıvının eşit şekilde boşalmasını sağlayın. Titrasyon sırasında çok büyük önem hızına sahiptir. Bu nedenle, bir ve aynı çözeltinin tekrar titrasyonunda, büretten çözelti ekleme hızının mümkün olduğunca aynı olması gerekir, yani aynı anda belirli bir miktarda sıvı akacaktır. Titrasyon sırasında ellerin konumu Şek. 352.
Titre edilmiş çözeltiyi karıştırmak için manyetik karıştırıcıların kullanılması çok uygundur. Bu durumda titrasyon, hem geleneksel bir konik şişede hem de titrasyona uyarlanmış özel sıvılarda gerçekleştirilebilir.
Analitik çalışmalarda hesaplamalara çok dikkat edilmelidir. Çalışmanın en başından itibaren tüm hesaplamaların altında yatan kavramları, yani titre, normallik ve gram eşdeğeri kavramlarını ve aralarındaki ilişkiyi öğrenirseniz, bunlar zor görünmeyecektir.
Örneğin, gerekli maddenin tartılmış bir kısmı alınırsa, hazırlanan çözeltinin titresi T, tartılan kısma eşit olacaktır. açözeltinin hacmine (V) bölünmesi:
Pirinç. 352. Titrasyon sırasında ellerin pozisyonu.
a= T * 1000 gr
Tartılan kısım biliniyorsa normallik hesaplanabilir. a ve çözünenin gram eşdeğeri E
Çözelti 1000 ml'den daha az veya daha fazla farklı bir hacimde hazırlanırsa, tartılan kısım 1 litre için hesaplanır ve ardından normallik hesaplama formülü aşağıdaki formu alır. 
Bu formül, hacminden bağımsız olarak alınan bir numuneden bir çözeltinin normalliğini hesaplamanıza izin verir. Titre, gram eşdeğeri ve normallik arasında basit bir ilişki vardır:

Bazen, hesaplamalarda, normallik için bir düzeltme veya bir normallik katsayısı K kullanılır. Bu düzeltme, pratik T titresinin teorik (To) titresine oranıdır:

Bu düzeltme, bu çözeltinin 1 ml'sine karşılık gelen tam olarak normal çözeltinin kaç mililitresini gösterir. Titrasyon sonuçlarını (ml) bu düzeltme ile çarparken, ortaya çıkan hacim belirli bir konsantrasyona, örneğin 0.1 N'ye getirilir. çözüm.
Bununla birlikte, normallik için düzeltmeyi kullanmanın uygunluğu çok şüphelidir, çünkü tüm hesaplamalar bu düzeltme olmadan başarıyla yapılabilir, bu da sadece hesaplamayı karmaşıklaştırır.
Normal çözümlerle çalışırken, problem her zaman önce bilinmeyen bir çözümün normalliğini belirlemeye ve daha sonra çözümde bulunan bilinmeyen bir maddenin miktarını belirlemeye indirgenir. Böylece, tüm hacimsel tanımlar için ana hesaplama ve analitik formül olacaktır.

yani, reaksiyonun sonuna ulaşıldığında bilinen bir çözeltinin hacmi ile bilinen bir çözeltinin normalliğinin çarpımı, her zaman bilinmeyen bir çözeltinin normalliğinin ürünün hacminin çarpımına eşittir. Bu ürün, reaksiyona giren maddelerin eşdeğerlerinin sayısını gösterir. Buradan, şuna eşit olacak olan bilinmeyen A2 çözümünün normalliğini belirleyebiliriz.

(2)
N2 bilindiğinde başvurun Genel formülörneğin normalliğini belirlemek için (a);

(3)
Analistin görevi a Değerini belirlemek olduğundan, bu formül aşağıdakileri bulmak için kullanılır;

(4)
Veya formül (2)'deki N2 değerini değiştirerek şunu elde ederiz:

Yukarıdaki formüller, herhangi bir tamsayı veya kesirli sayı ile ifade edilebileceği varsayıldığından, normallik düzeltmeleri olmadan tüm hesaplamaların yapılmasına izin verir. Herhangi bir hesaplamada ana şey, eşdeğerlerin sayısını bulmaktır, bir gram eşdeğerinin değeri ile çarpıldığında, her zaman aradığınız madde miktarını elde edersiniz.
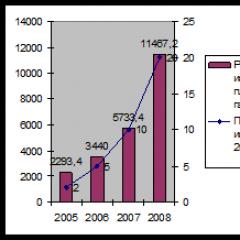
Örnek. 0,5000 g demir içeren cevher numunesi alınsın. Permangapatometri ile titrasyon için bir ölçülü balonda 100 ml'ye, elde edilen çözeltinin çözünmesi ve seyreltilmesinin ardından, analiz edilecek çözeltiden her seferinde 10 ml alınır.
KMnO4 çözeltisi - 0.0495 N. Titrasyon için: 11.2; 11.1; 11.0; 11.1 ml KMnO4 çözeltisi. Ortalama 11.1 ml alıyoruz. Çözümün normalliği 11.1 0.0495 = 10 * N2, nereden

100 ml çözeltideki Fe miktarı (bu durumda Fe'nin gram eşdeğeri 55.85'tir):
Cevherdeki demir içeriğini yüzde olarak ifade etmek için denklemin sağ tarafı JOO ile çarpılır ve alınan cevher örneğine bölünür, yani.

Titrimetrik analiz, analit ile reaksiyon için tüketilen reaktif miktarının doğru ölçümüne dayanır. Yakın zamana kadar, bir reaktif miktarını ölçmek için pratikte en yaygın yöntemin reaksiyon için tüketilen çözeltinin hacmini ölçmek olduğu gerçeğinden dolayı bu tür analize genellikle hacimsel denirdi. Günümüzde hacimsel analiz, sıvı, gaz veya katı fazların hacminin ölçülmesine dayanan bir dizi yöntem olarak anlaşılmaktadır.
Titrimetrik adı, bir çözeltinin konsantrasyonunu ifade eden titer kelimesiyle ilişkilidir. Titre, 1 ml çözelti içindeki çözünen maddenin gram sayısını gösterir.
Titre edilmiş veya standart çözelti, konsantrasyonu yüksek doğrulukla bilinen bir çözeltidir. Titrasyon - tam eşdeğer miktarı belirlemek için analiz edilen çözeltiye titre edilmiş bir çözeltinin eklenmesi. Titrasyon çözeltisine genellikle çalışma çözeltisi veya titrant denir. Örneğin, bir asit bir alkali ile titre edilirse, alkali çözeltiye titrant denir. Titre edilecek maddenin miktarına eklenen titrant miktarının kimyasal olarak eşdeğer olduğu titrasyon anına eşdeğerlik noktası denir.
Titrimetride kullanılan reaksiyonlar aşağıdaki temel gereksinimleri karşılamalıdır:
1) reaksiyon kantitatif olarak devam etmelidir, yani. reaksiyonun denge sabiti yeterince büyük olmalıdır;
2) reaksiyon devam etmelidir yüksek hız;
3) reaksiyon, yan reaksiyonların ortaya çıkmasıyla karmaşık olmamalıdır;
4) Reaksiyonun sonunu belirlemenin bir yolu olmalıdır.
Reaksiyon bu gereksinimlerden en az birini karşılamıyorsa titrimetrik analizde kullanılamaz.
Titrimetri, doğrudan, ters ve dolaylı titrasyon arasında ayrım yapar.
Doğrudan titrasyon yöntemlerinde analit, titrant ile doğrudan reaksiyona girer. Bu yöntemle analiz için bir çalışma çözümü yeterlidir.
Geri titrasyon yöntemleri (veya bunlara kalıntı titrasyon yöntemleri de denir) iki titre edilmiş çalışma çözümü kullanır: ana ve yardımcı. Örneğin, asidik çözeltilerde klorür iyonunun geri titrasyonu yaygın olarak bilinmektedir. Titre edilmiş bir gümüş nitrat çözeltisinin (ana çalışma çözeltisi) bilinen bir fazlalığı önce analiz edilen klorür çözeltisine eklenir. Bu durumda, zayıf çözünür gümüş klorür oluşumu reaksiyonu meydana gelir.
Reaksiyona girmemiş fazla miktarda AgNO3, bir amonyum tiyosiyanat çözeltisi (yardımcı çalışma çözeltisi) ile titre edilir.
Üçüncü ana titrimetrik belirleme türü, ikame edici titrasyon veya ikame titrasyonudur (dolaylı titrasyon). Bu yöntemde belirlenecek maddeye, onunla reaksiyona giren özel bir reaktif eklenir. Reaksiyon ürünlerinden biri daha sonra çalışan bir çözelti ile titre edilir. Örneğin, bakırın iyodometrik tayininde, analiz edilen çözeltiye bilinen bir fazla KI eklenir. Reaksiyon 2Cu 2+ + 4I - = 2CuI + I2'dir. Serbest kalan iyot, sodyum tiyosülfat ile titre edilir.
Standart bir reaktif çözeltisinin analiz edilen bir çözelti ile titre edildiği ters titrasyon da vardır.
Titrimetrik analiz sonuçlarının hesaplanması, hangi maddelerin birbirleriyle eşdeğer miktarlarda reaksiyona girdiğine göre eşdeğerlik ilkesine dayanmaktadır.
Herhangi bir çelişkiden kaçınmak için, tüm asit-baz etkileşim reaksiyonlarının tek bir noktaya getirilmesi tavsiye edilir. ortak temel bir hidrojen iyonu olabilir. Redoks reaksiyonlarında, belirli bir yarı reaksiyonda madde tarafından alınan veya bağışlanan elektronların sayısı ile reaktan miktarını ilişkilendirmek uygundur. Bu, aşağıdaki tanımı yapmamızı sağlar.
Bir eşdeğer, asit-baz reaksiyonlarında bir hidrojen iyonuna veya redoks reaksiyonlarında bir elektrona bağlanabilen, salabilen veya başka bir numuneye eşdeğer olabilen belirli bir gerçek veya koşullu parçacıktır.
"Eşdeğer" terimini kullanırken, her zaman hangi spesifik reaksiyona atıfta bulunduğunu belirtmek gerekir. Belirli bir maddenin eşdeğerleri sabit değerler olmayıp, katıldıkları reaksiyonun stokiyometrisine bağlıdır.
Titrimetrik analizde, çeşitli tiplerde reaksiyonlar kullanılır: - titrimetrik reaksiyonlar için gereklilikleri karşılayan asit-baz etkileşimi, kompleksleşme, vb. Titrasyon sırasında meydana gelen reaksiyon tipi, titrimetrik analiz yöntemlerinin sınıflandırılmasının temelini oluşturur. Aşağıdaki titrimetrik analiz yöntemleri genellikle ayırt edilir.
1. Asit-baz etkileşimi yöntemleri, proton transferi süreci ile ilişkilidir:
2. Kompleks oluşturma yöntemleri, koordinasyon bileşiklerinin oluşum reaksiyonlarını kullanır:
3. Yağış yöntemleri, az çözünür bileşiklerin oluşum reaksiyonlarına dayanır:
4. Oksidasyon - indirgeme yöntemleri, büyük bir redoks reaksiyonu grubunu birleştirir:
Bazı titrimetrik yöntemler, titrasyon sırasında gerçekleşen ana reaksiyonun tipine göre veya titrantın adına göre adlandırılmıştır (örneğin, arjantometrik yöntemlerde titrant, AgNO 3 çözeltisidir, permanganatometrik yöntemlerde - KMnO 4 çözeltisi vb.).
Titrasyon yöntemleri yüksek doğrulukla karakterize edilir: belirleme hatası %0,1 - %0,3'tür. Çalışma çözümleri kararlıdır. Eşdeğerlik noktasını belirtmek için çeşitli göstergeler mevcuttur. Kompleksleşme reaksiyonlarına dayalı titrimetrik yöntemlerden, en yüksek değerşelatör kullanımı ile reaksiyonları var. Komplekslerle kararlı koordinasyon bileşikleri hemen hemen tüm katyonları oluşturur; bu nedenle kompleksometrik yöntemler evrenseldir ve çok çeşitli çeşitli nesnelerin analizine uygulanabilir.
Asit-baz titrasyon yöntemi, asitler ve bazlar arasındaki etkileşimlere, yani nötralizasyon reaksiyonuna dayanır:
H + + OH - ↔ H 2 O
Yöntemin çalışma çözümleri çözümlerdir güçlü asitler(HCl, H2S, HNO3, vb.) veya kuvvetli bazlar (NaOH, KOH, Ba (OH) 2, vb.). Titranta bağlı olarak, asit-baz titrasyon yöntemi alt bölümlere ayrılır: asidimetri titrant bir asit çözeltisi ise ve alkalimetri titrant bir baz çözelti ise.
Çalışma çözeltileri genellikle ikincil standart çözeltiler olarak hazırlanır, çünkü hazırlanmaları için ilk maddeler standart değildir ve daha sonra standart maddelere veya standart çözeltilere göre standardize edilir. Örneğin: asit çözeltileri aşağıdakilere göre standardize edilebilir: standart maddeler- sodyum tetraborat Na2B407∙10H20, sodyum karbonat Na2C03∙10H20 veya standart NaOH, KOH çözeltilerine göre; ve baz çözeltileri - oksalik asit Н 2 С 2 О 4 ∙ Н 2 О, süksinik asit Н 2 С 4 Н 4 О 4 veya standart HCl, H 2 SO 4, НNО 3 çözeltilerine göre.
Eşdeğerlik noktası ve titrasyon bitiş noktası... Eşdeğerlik kuralına göre, eklenen reaktif miktarı analitin içeriğine eşit olana kadar titrasyona devam edilmelidir. Reaktifin (titrant) standart çözeltisinin miktarı teorik olarak belirli bir denkleme göre analitin miktarına kesinlikle eşdeğer olduğunda titrasyon sürecinde gelen an Kimyasal reaksiyon arandı denklik noktası .
Eşdeğerlik noktası belirlenir Farklı yollarörneğin titre edilen çözeltiye eklenen indikatörün rengini değiştirerek. Göstergenin renginde gözlenen değişikliğin meydana geldiği ana denir. titrasyonun son noktası. Çoğu zaman titrasyon bitiş noktası eşdeğerlik noktasıyla tam olarak eşleşmez. Kural olarak, titrantın 0.02-0.04 ml'den (1-2 damla) fazla olmamasıyla birbirlerinden farklıdırlar. Bu, gösterge ile etkileşime girmek için gereken titrant miktarıdır.
Tanıtım
Laboratuvar çalıştayı çalıştıktan sonra gerçekleştirilir teorik ders"Analitik kimya ve FHMA" ile kazanılan bilgilerin pekiştirilmesine ve derinleştirilmesine hizmet eder.
Nicel analizin görevi, elementlerin (iyonların), radikallerin miktarını (içeriği) belirlemektir. fonksiyonel gruplar, analiz edilen nesnedeki bileşikler veya fazlar. Bu ders, temel titrasyon (hacimsel) analiz yöntemlerini, titrasyon yöntemlerini ve bunların pratik uygulamalarını kapsar.
Bir laboratuvar çalıştayına başlamadan önce öğrencilere güvenlik konusunda talimat verilir. Öğrenci, her çalışmayı gerçekleştirmeden önce, analiz yönteminin yanı sıra öğretmenin belirttiği bölümlere göre bir kolokyumdan geçmelidir. Bu gerektirir:
1) kursun ilgili bölümünü tekrarlayın;
2) işin metodolojisi hakkında ayrıntılı bilgi sahibi olmak;
3) kimyasal analizin altında yatan kimyasal reaksiyonların denklemlerini oluşturur;
4) analizin özelliklerini güvenlik açısından inceleyin.
Çalışmanın sonuçlarına dayanarak, öğrenciler şunları belirtmesi gereken bir rapor hazırlar:
· iş unvanı;
· işin amacı;
· Yöntemin teorik temelleri: yöntemin özü, temel denklem, titrasyon eğrilerinin hesaplanması ve oluşturulması, bir gösterge seçimi;
· Çalışma sırasında kullanılan reaktifler ve ekipman;
Analiz metodu:
Birincil standartların hazırlanması;
Çalışma çözümünün hazırlanması ve standardizasyonu;
Çözeltide araştırılan maddenin içeriğinin belirlenmesi;
· Deneysel veri;
· Analiz sonuçlarının istatistiksel olarak işlenmesi;
· sonuçlar.
TİTRİMETRİK ANALİZ YÖNTEMLERİ
Titrimetrik analiz yöntemi Belirlenen madde ile kimyasal reaksiyona harcanan kesin olarak bilinen konsantrasyona (titrant) sahip bir reaktifin hacminin ölçülmesine dayanır.
Tespit prosedürü (titrasyon), eşdeğerlik noktasına ulaşılana kadar, bir titrantın, bir büretten kesin olarak bilinen bir hacimdeki bilinmeyen bir konsantrasyona sahip bir analit çözeltisine damla damla eklenmesi gerçeğinden oluşur.
nerede x- belirlenecek madde; r- titreyen, P- reaksiyonun ürünü.
Eşdeğerlik noktası (yani)- bu, eşdeğer miktarda titrant eklenmesi sırasında oluşan çözümün teorik durumudur. r analite x... Uygulamada titrasyonun bitim noktasına (c.t.t.) ulaşılıncaya kadar belirlenecek maddeye titrant eklenir, bu da çözeltiye eklenen indikatörün rengi değiştiğinde eşdeğerlik noktasının görsel olarak gösterilmesinden anlaşılır. Görsel göstergeye ek olarak, eşdeğerlik noktası enstrümantal yöntemlerle kaydedilebilir. Bu durumda titrasyonun bitiş noktası (c.t.t.) keskin bir değişim anı olarak anlaşılır. fiziksel miktar titrasyon sırasında ölçülür (akım gücü, potansiyel, elektriksel iletkenlik, vb.).
Titrimetrik analiz yöntemi, aşağıdaki kimyasal reaksiyon türlerini kullanır: nötralizasyon reaksiyonları, oksidasyon-indirgenme reaksiyonları, çökelme reaksiyonları ve kompleksleşme reaksiyonları.
Kullanılan kimyasal reaksiyonun türüne bağlı olarak, aşağıdakiler ayırt edilir: titrimetrik analiz yöntemleri:
- asit-baz titrasyonu;
- çökeltme titrasyonu;
- kompleksometrik titrasyon veya kompleksometri;
- redoks titrasyonu veya redoksimetri.
Titrimetrik analiz yönteminde kullanılan reaksiyonlar aşağıdakilerle sunulmaktadır: Gereksinimler:
· Reaksiyon, yan reaksiyonlar olmadan stokiyometrik oranlarda ilerlemelidir;
Reaksiyon pratik olarak tersinmez bir şekilde devam etmelidir (≥ %99.9), reaksiyon denge sabiti K p> 106, ortaya çıkan çökeltiler bir çözünürlüğe sahip olmalıdır. S < 10 -5 моль/дм 3 , а образующиеся комплексы – К уст > 10 -6 ;
· Reaksiyon yeterince yüksek bir hızda ilerlemelidir;
· Reaksiyon oda sıcaklığında gerçekleşmelidir;
· Eşdeğerlik noktası bir şekilde açık ve güvenilir bir şekilde kaydedilmelidir.
Titrasyon yöntemleri
Herhangi bir titrimetrik analiz yönteminde birkaç titrasyon yöntemi vardır. Ayırmak doğrudan titrasyon, geri titrasyon ve ikame titrasyonu .
Doğrudan titrasyon- titrant, eşdeğerlik noktasına ulaşılana kadar analitin çözeltisine damla damla eklenir.
Titrasyon şeması: X + R = P.
Doğrudan titrasyon için eşdeğerler yasası:
C (1 / z) X V X = C (1 / z) R V R. (2)
Test çözeltisinde bulunan analitin miktarı (kütlesi) eşdeğerler yasası kullanılarak hesaplanır (doğrudan titrasyon için)
m X = C (1 / z) R V R M (1 / z) X٠10 -3 , (3)
nerede C (1 / z) R- titrant eşdeğerinin molar konsantrasyonu, mol / dm3;
VR- titrantın hacmi, cm3;
M ( 1/ z) NS – molar kütle analitin eşdeğeri;
C (1 / z) X- analit eşdeğerinin molar konsantrasyonu, mol / dm3;
VX- analitin hacmi, cm3.
Geri titrasyon- iki titrant kullanın. Başta
ilk titrantın tam hacmi ( 1) fazla alınır. Reaksiyona girmemiş titrantın geri kalanı R1 ikinci bir titrant ile titre edilir ( R2). titrant miktarı 1 harcanan
analit ile etkileşim üzerine ( NS) titrantın eklenen hacmi arasındaki fark ile belirlenir. 1 (1) ve titrant hacmi R2 (V2) titrantın geri kalanının titrasyonuna harcanan 1.
Titrasyon şeması: x + 1 sabit fazlalık = 1 (1 kalan).
1 kalan + R2 = P2.
Geri titrasyon kullanılırken eşdeğerler yasası şu şekilde yazılır:
Geri titrasyon durumunda analitin kütlesi formülle hesaplanır.
Geri titrasyon yöntemi, doğrudan bir reaksiyon için uygun bir indikatör seçmenin imkansız olduğu veya kinetik zorluklarla (düşük kimyasal reaksiyon hızı) ilerlediği durumlarda kullanılır.
İkame titrasyonu (dolaylı titrasyon)- analitin doğrudan veya geri titrasyonunun imkansız veya zor olduğu veya uygun bir göstergenin olmadığı durumlarda kullanılır.
Belirlenecek maddeye NS herhangi bir reaktif ekleyin A fazla miktarda, eşdeğer miktarda maddenin salındığı etkileşim üzerine r... Daha sonra reaksiyon ürünü r uygun bir titrant ile titre r.
Titrasyon şeması: x + A fazla = 1.
1 + r = 2.
İkame titrasyonu için eşdeğerler yasası aşağıdaki gibi yazılır:
Analitin eşdeğerlerinin sayısı NS ve reaksiyon ürünü r aynıdır, dolaylı titrasyon durumunda analitin kütlesinin hesaplanması formülle hesaplanır
m X = C (1 / z) R V R M (1 / z) X٠10 -3 . (7)
reaktifler
1. Süksinik asit Н 2 С 4 Н 4 О 4 (reaktif derecesi) - birincil standart.
2. Molar konsantrasyonlu bir sodyum hidroksit NaOH çözeltisi
~ 2,5 mol / dm3
3. H20 damıtılmış.
Teçhizatöğrenciler kendilerini anlatır.
İş ilerleyişi:
1. Süksinik asit HOOCCH 2 CH2COOH birincil standardının hazırlanması.
Süksinik asit, molar konsantrasyon eşdeğeri ile 200.00 cm3 hacimde hazırlanır. ![]() mol / dm3.
mol / dm3.
![]() g / mol.
g / mol.
Reaksiyon denklemi:
Numune alma (tartım):
![]()
Menteşe ağırlığı
Menteşe nicel olarak bir ölçülü balona aktarılır ( ![]() cm 3), 50 - 70 cm3 saf su ekleyin, süksinik asit tamamen eriyene kadar karıştırın, saf su ile işarete getirin
cm 3), 50 - 70 cm3 saf su ekleyin, süksinik asit tamamen eriyene kadar karıştırın, saf su ile işarete getirin
ve iyice karıştırın.
güvenmek
formüle göre

reaktifler
1. Sodyum karbonat Na2CO3 (reaktif sınıfı) - birincil standart.
2. Н 2 О damıtılmış.
3. 1: 1 konsantrasyona sahip hidroklorik asit HCl (r = 1.095 g / cm3).
4. Asit-baz göstergesi (titrasyon eğrisi tarafından seçilir).
5. Karışık gösterge - metil turuncu ve metilen mavisi.
İş ilerleyişi:
1. Sodyum karbonat (Na2C03) için birincil standardın hazırlanması.
Molar konsantrasyon eşdeğeri ile 200.00 cm3 hacimli bir sodyum karbonat çözeltisi hazırlanır. ![]() mol / dm3.
mol / dm3.
Numune kütlesinin hesaplanması, g: (kütle, dördüncü ondalık basamak doğruluğu ile alınır).
Reaksiyon denklemleri:
1) Na2C03 + HCl = NaHC03 + NaCl
2) NaHC03 + HCl = NaCl + H20 + CO2
_____________________________________
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
H2C03 - zayıf asit (K a1= 10 -6,35, K a2 = 10 -10,32).
Numune alma (tartım):
Saat camının ağırlığı (cam)
Menteşeli saat camının (cam) ağırlığı ![]()
Menteşe ağırlığı
Menteşe nicel olarak bir ölçülü balona aktarılır ( ![]() cm 3), 50 - 70 cm3 saf su ekleyin, sodyum karbonat tamamen eriyene kadar karıştırın, saf su ile işarete getirin
cm 3), 50 - 70 cm3 saf su ekleyin, sodyum karbonat tamamen eriyene kadar karıştırın, saf su ile işarete getirin
ve iyice karıştırın.
Birincil standardın gerçek konsantrasyonu güvenmek
formüle göre

2. Titrantın (HCl solüsyonu) hazırlanması ve standardizasyonu
Hacmi yaklaşık 500 cm3 olan bir hidroklorik asit çözeltisi hazırlanır.
yaklaşık 0.05 ÷ 0.06 mol / dm'lik bir molar konsantrasyon eşdeğeri ile 3)
Titrant - 1: 1 (r = 1.095 g / cm3) seyreltilmiş hidroklorik asitten yaklaşık 0,05 mol / dm3 konsantrasyona sahip bir hidroklorik asit çözeltisi hazırlanır.
Çözüm standardizasyonu HCl, doğrudan titrasyon, pipetleme yoluyla birincil Na2C03 standardına göre gerçekleştirilir.
Gösterge, hidroklorik asit ile sodyum karbonatın titrasyon eğrisine göre seçilir (Şekil 4).

Pirinç. 4. 100,00 cm3 Na 2 CO 3 çözeltisinin titrasyon eğrisi İLE BİRLİKTE= 0.1000 mol / dm 3 ile HCl çözeltisi ile C1 / z= 0.1000 mol / dm3
İkinci eşdeğerlik noktasına titrasyon yapılırken, bir metil oranj indikatörü olan %0.1 sulu çözelti (pT = 4.0) kullanılır. Sarıdan turuncuya renk değişimi (çay gülü rengi). Geçiş aralığı
(pH = 3.1 - 4.4).
Şema 3. HCl çözeltisinin standardizasyonu

250 cm3 kapasiteli konik bir titrasyon şişesine, 25,00 cm3'lük bir standart Na2C03 çözeltisi (bir pipetle) koyun, 2 - 3 damla metil portakal ekleyin, su ile 50'ye seyreltin - 75 cm3 ve bir damla titranttan renk sarıdan "çay gülü" rengine dönene kadar bir hidroklorik asit çözeltisi ile titre edin. Titrasyon, bir "tanık" (bir gösterge ile Na2C03'ün ilk çözeltisi) varlığında gerçekleştirilir. Titrasyon sonuçları tabloya girilir. 4. Hidroklorik asit konsantrasyonu, eşdeğerler yasası ile belirlenir:.
Tablo 4
Hidroklorik asit çözeltisinin standardizasyon sonuçları
Görevler
1. Asit-baz reaksiyonlarında eşdeğer kavramını formüle edin. Aşağıdaki reaksiyonlarda soda ve fosforik asit eşdeğerlerinin değerini hesaplayın:
Na2C03 + HCl = NaHC03 + NaCl
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
H3PO4 + 2NaOH = Na2HP04 + H20
H3PO4 + 3NaOH = Na3P04 + 3H20
2. Hidroklorik asit, sülfürik asit, sodyum hidroksit, alüminyum hidroksit, sodyum karbonat, potasyum hidrojen karbonat arasındaki reaksiyonların denklemlerini yazın ve bu maddelerin eşdeğer kütlelerini hesaplayın.
3. Molar konsantrasyon eşdeğeri 0.1 mol / dm3 sodyum hidroksit ile 100.00 cm3 hidroklorik asit için 0.1 mol / dm3 molar konsantrasyon eşdeğeri ile bir titrasyon eğrisi çizin. Olası göstergeleri seçin
4. 100,00 cm3 akrilik asit için titrasyon eğrisini çizin (CH 2 = CHCOOH, pK a= 4.26) molar konsantrasyon eşdeğeri ile
0.1 mol / dm3 sodyum hidroksit eşdeğer molar konsantrasyona sahip
0.1 mol / dm3. Titrasyon sırasında bir çözeltinin bileşimi nasıl değişir? Olası göstergeleri seçin ve titrasyon göstergesi belirsizliğini hesaplayın.
5. Hidrazin için titrasyon eğrisini çizin (N 2 H 4 + H 2 O, pK B= 6,03)
0.1 mol / dm3 hidroklorik asit eşdeğeri bir molar konsantrasyon ile
0.1 mol / dm3'e eşdeğer bir molar konsantrasyon ile. benzerlikler nelerdir
ve zayıf bir asidin bir alkali ile titrasyon eğrisi ile karşılaştırıldığında pH hesaplamaları ile titrasyon eğrisi arasındaki fark? Olası göstergeleri seçin
ve titrasyon göstergesi hatasını hesaplayın.
6. Aktivite katsayılarını ve aktif iyon konsantrasyonlarını hesaplayın
0.001 M alüminyum sülfat, 0.05 M sodyum karbonat, 0.1 M potasyum klorür çözeltisi içinde.
7. 0.20 M metilamin çözeltisinin pH'ını, sulu çözeltideki iyonizasyonu denklemle açıklanıyorsa hesaplayın.
B + H20 = BH + + OH -, K B= 4.6 × 10 - 3, burada B tabandır.
8. 1,99 × 10 - 2 M çözelti pH = 4,5 ise, hipokloröz asit HOCl'nin ayrışma sabitini hesaplayın.
9. 6.1 g / mol glikolik asit (CH2 (OH) COOH, K içeren bir çözeltinin pH'ını hesaplayın) a= 1.5 × 10 - 4).
10. 40 ml 0.015 M hidroklorik asit çözeltisinin aşağıdakilerle karıştırılmasıyla elde edilen çözeltinin pH'ını hesaplayın:
a) 40 ml su;
b) 20 ml 0.02 M sodyum hidroksit çözeltisi;
c) 20 ml 0.02 M baryum hidroksit çözeltisi;
d) 40 ml 0.01 M hipokloröz asit çözeltisi, K a= 5.0 × 10 - 8.
11. Asetik asit çözeltisindeki asetat iyonunun konsantrasyonunu hesaplayın
% 0.1 kütle oranı ile.
12. Kütle oranı %0,1 olan amonyak çözeltisindeki amonyum iyonunun konsantrasyonunu hesaplayın.
13. 250,00 ml 0,5000 M solüsyon hazırlamak için gereken sodyum karbonat numunesinin kütlesini hesaplayın.
14. Molar konsantrasyon eşdeğeri 11 mol / l olan bir hidroklorik asit çözeltisinin hacmini ve 500 ml 0,5 M hidroklorik asit çözeltisi hazırlamak için almanız gereken su hacmini hesaplayın.
15. 300 ml %0.3 hidroklorik asit çözeltisi içinde 0.15 g metalik magnezyum çözündürüldü. Ortaya çıkan çözeltideki hidrojen, magnezyum ve klor iyonlarının molar konsantrasyonunu hesaplayın.
16. 25,00 ml sülfürik asit çözeltisinin bir baryum klorür çözeltisi ile karıştırılmasıyla 0.2917 g baryum sülfat elde edildi. Sülfürik asit çözeltisinin titresini belirleyin.
17. Reaksiyona giren kalsiyum karbonatın kütlesini hesaplayın
80.5 mmol hidroklorik asit ile.
18. Kaç gram monosodyum fosfat eklenmeli
pH = 7 olan bir çözelti elde etmek için 25,0 ml 0,15 M sodyum hidroksit çözeltisine Fosforik asit pK için a1= 2.15; pK a2= 7.21; pK a3 = 12,36.
19. Su ile iyice seyreltilmiş 1.0000 g dumanlı sülfürik asidin titrasyonu, 43.70 ml 0.4982 M sodyum hidroksit çözeltisi gerektirir. Sigara içtiği biliniyor sülfürik asit susuz sülfürik asit içinde çözülmüş sülfürik anhidrit içerir. Hesaplamak kütle kesri dumanlı sülfürik asitte sülfürik anhidrit.
20. Büret kullanarak hacim ölçümünün mutlak hatası 0,05 ml'dir. 1'deki ölçüm hacimlerindeki bağıl hatayı hesaplayın; 10 ve 20 ml.
21. 500,00 ml kapasiteli bir ölçülü balonda bir çözelti hazırlanır.
2.5000 g sodyum karbonatın tartılmış kısmından. Hesaplamak:
a) çözeltinin molar konsantrasyonu;
b) molar konsantrasyon eşdeğeri (½ Na2C03);
c) çözeltinin titresi;
d) hidroklorik asit titresi.
22. Yoğunluğu olan %10'luk bir sodyum karbonat çözeltisinin hacmi nedir?
1.105 g / cm3 yemek pişirmek için almanız gerekir:
a) Titre TNa2C03 = 0.005000 g / cm3 olan 1 litre çözelti;
b) ТNa2CO3 / HCl = 0.003000 g / cm3 ile 1 litre çözelti?
23. 1500 ml 0.2 M'lik bir çözelti hazırlamak için kütle fraksiyonu %38.32 ve yoğunluğu 1.19 g / cm3 olan hangi hidroklorik asit hacmi alınmalıdır?
24. 0.2 M'lik bir çözelti hazırlamak için 1.2 L 0.25 M HCl'ye hangi hacimde su eklenmelidir?
25. %3 sodyum karbonat ve %7 farklı safsızlıklar içeren 100 g teknik sodyum hidroksitten 1 litre çözelti hazırlandı. Sodyum karbonatın karbonik aside titre edildiğini varsayarak, elde edilen alkali çözeltinin molar konsantrasyonunu ve hidroklorik asit titresini hesaplayın.
26. NaOH, Na2C03, NaHC03 veya adı geçen bileşiklerin 0.2800 g ağırlığındaki bir karışımını içerebilen bir numune var, numune suda eritildi.
Elde edilen çözeltinin fenolftalein varlığında titrasyonu, 5.15 ml ve metil portakal varlığında - 0.1520 mol / l molar konsantrasyona sahip 21.45 ml hidroklorik asit tüketir. Numunenin bileşimini ve numunedeki bileşenlerin kütle fraksiyonunu belirleyin.
27. 100.00 cm3 0.1000 M amonyak çözeltisi 0.1000 M hidroklorik asit çözeltisi için titrasyon eğrisini çizin, gösterge seçimini doğrulayın.
28. Eşdeğerlik noktasının pH'ını hesaplayın, titrasyonun başlangıcını ve bitişini 100.00 cm3 0.1000 M malonik asit solüsyonu (HOOCCH 2 COOH) 0.1000 M sodyum hidroksit solüsyonu (pK) 1= 1.38; pK 2=5,68).
29. 0.05123 mol / dm3 eşdeğer molar konsantrasyona sahip 25.00 cm3 sodyum karbonat çözeltisinin titrasyonu, 32.10 cm3 hidroklorik aside gitti. Hidroklorik asit eşdeğerinin molar konsantrasyonunu hesaplayın.
30. Kaç ml 0.1 M amonyum klorür çözeltisi eklenmelidir
50,00 ml 0,1 M amonyak solüsyonu ile bir tampon solüsyonu elde etmek için
pH = 9.3 ile.
31. Sülfürik ve fosforik asitlerin karışımı, hacmi 250,00 cm3 olan bir ölçülü balona aktarıldı. Titrasyon için 20.00 cm3'lük iki numune alındı, biri molar konsantrasyon eşdeğeri olan bir sodyum hidroksit çözeltisi ile titre edildi.
0.09940 mol / dm 3 gösterge metil turuncu ve ikincisi fenolftalein ile. İlk durumda sodyum hidroksit tüketimi 20.50 cm3, ikinci durumda ise 36.85 cm3 idi. Karışımdaki sülfürik ve fosforik asitlerin kütlelerini belirleyin.
kompleksometride
Denklik noktasına kadar = ( C m V M - C EDTA V EDTA) / ( V M + V EDTA). (21)
Denklik noktasında = ![]() . (22)
. (22)
denklik noktasından sonra =  . (23)
. (23)
İncirde. Şekil 9, tampon çözeltilerdeki kalsiyum iyonunun titrasyon eğrilerini göstermektedir. Farklı anlamlar NS. Ca 2+ titrasyonunun sadece pH ³ 8'de mümkün olduğu görülebilir.
reaktifler
2. Н 2 О damıtılmış.
3. Molar konsantrasyonlu standart Mg (II) çözeltisi
0.0250 mol / dm3.
4. pH = 9,5 olan amonyak tamponu.
5. Kütle oranı %5 olan bir potasyum hidroksit KOH çözeltisi.
6. Eriochrome siyah T, indikatör karışımı.
7. Calcon, indikatör karışımı.
teorik temel yöntem:
Yöntem, Ca2+ ve Mg2+ iyonlarının etilendiamintetraasetik asidin disodyum tuzu (Na2H2Y2 veya Na-EDTA) ile M: L = 1 molar oranında güçlü komplekslerin oluşumu ile etkileşimine dayanmaktadır. : 1 belirli bir pH aralığında.
Calcon ve eriochrome black T. Ca 2+ ve Mg 2+ belirlemede denklik noktasını sabitlemek için kullanılır.
Ca 2+ tayini pH ≈ 12'de yapılırken Mg 2+
çözelti içinde magnezyum hidroksit çökeltisi şeklindedir ve EDTA ile titre edilmez.
Mg 2+ + 2OH - = Mg (OH) 2 ↓
Ca 2+ + Y 4- "CaY 2-
pH ≈ 10'da (amonyak tampon çözeltisi), Mg 2+ ve Ca 2+
çözelti halinde iyonlar halinde ve EDTA ilavesi ile birlikte titre edilir.
Ca 2+ + HY 3- "CaY 2- + H +
Mg 2+ + HY 3- "MgY 2- + H +
Mg 2+ titrasyonu için tüketilen EDTA hacmini belirlemek için,
pH ≈ 10'da karışımın titrasyonuna giren toplam hacimden, pH ≈ 12'de Ca2+ titrasyonuna giren hacmi çıkarın.
≈ 12'lik bir pH oluşturmak için, oluşturmak için %5'lik bir KOH çözeltisi kullanılır.
pH ≈ 10, bir amonyak tampon çözeltisi (NH3 × H20 + NH4Cl) kullanın.
İş ilerleyişi:
1. Titrantın standardizasyonu - EDTA çözeltisi (Na 2 H 2 Y)
Yaklaşık 0.025 M konsantrasyonda bir EDTA çözeltisi hazırlanır.
≈ 0.05 M solüsyondan 2 kez distile su ile seyreltilerek. EDTA'yı standardize etmek için standart bir MgSO 4 çözeltisi kullanılır.
0.02500 mol / dm3 konsantrasyonda.
Şema 5. Titrantın standardizasyonu - EDTA çözümü
 250 cm3 kapasiteli titrasyon için konik bir şişeye, 0.02500 mol / dm3 konsantrasyonlu 20.00 cm3 standart MgS04 çözeltisi koyun, ~ 70 cm3 damıtılmış su, ~ 10 cm3 bir ~ 9.5 - 10 pH'lı amonyak tampon çözeltisi ve yaklaşık 0.05 g indikatör eriochrome black T ekleyin
250 cm3 kapasiteli titrasyon için konik bir şişeye, 0.02500 mol / dm3 konsantrasyonlu 20.00 cm3 standart MgS04 çözeltisi koyun, ~ 70 cm3 damıtılmış su, ~ 10 cm3 bir ~ 9.5 - 10 pH'lı amonyak tampon çözeltisi ve yaklaşık 0.05 g indikatör eriochrome black T ekleyin
(spatulanın ucunda). Bu durumda, çözelti şarap kırmızısına döner. Şişedeki çözelti, renk şarap kırmızısından yeşile dönene kadar EDTA çözeltisi ile yavaşça titre edilir. Titrasyon sonuçları tabloya girilir. 6. EDTA konsantrasyonu, eşdeğerler yasasına göre belirlenir: ![]() .
.
Tablo 6
EDTA çözüm standardizasyon sonuçları
2. Ca 2+ içeriğinin belirlenmesi
pH = 10 ve pH = 12'de EDTA çözeltisi ile Ca 2+ titrasyon eğrileri bağımsız olarak oluşturulur.
Ölçülü balondaki problemin çözümü distile su ile işarete getirilir ve iyice karıştırılır.
Şema 6. Çözeltideki Ca 2+ içeriğinin belirlenmesi
 Kalsiyum ve magnezyum içeren 25.00 cm3'lük test çözeltisinin bir alikotu 250 cm3 kapasiteli konik bir titrasyon şişesine yerleştirilir, ~60 cm3 su, ~10 cm3 %5'lik KOH çözeltisi eklenir. Şekilsiz bir Mg (OH) 2 ↓ çökeltisinin çökeltilmesinden sonra, çözeltiye yaklaşık 0.05 g'lık bir kireç indikatörü (bir spatula ucunda) eklenir ve renk pembeden soluk renge dönene kadar bir EDTA çözeltisi ile yavaşça titre edilir. Mavi. Titrasyon sonuçları ( V 1) Tablo 7'ye girilir.
Kalsiyum ve magnezyum içeren 25.00 cm3'lük test çözeltisinin bir alikotu 250 cm3 kapasiteli konik bir titrasyon şişesine yerleştirilir, ~60 cm3 su, ~10 cm3 %5'lik KOH çözeltisi eklenir. Şekilsiz bir Mg (OH) 2 ↓ çökeltisinin çökeltilmesinden sonra, çözeltiye yaklaşık 0.05 g'lık bir kireç indikatörü (bir spatula ucunda) eklenir ve renk pembeden soluk renge dönene kadar bir EDTA çözeltisi ile yavaşça titre edilir. Mavi. Titrasyon sonuçları ( V 1) Tablo 7'ye girilir.
Tablo 7
| Deneyim numarası | EDTA hacmi, cm3 | Çözeltideki Ca 2+ içeriği, g | |
| 25,00 | |
||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
3. Mg 2+ içeriğinin belirlenmesi
pH = 10'da EDTA çözeltisi ile Mg 2+ titrasyon eğrisi bağımsız olarak oluşturulur.
Şema 7. Çözeltideki Mg 2+ içeriğinin belirlenmesi

Kalsiyum ve magnezyum içeren test çözeltisinden 25.00 cm3'lük bir kısım, 250 cm3, ~ 60 cm3 damıtılmış su, ~ 10 cm3 pH'lı bir amonyak tampon çözeltisi kapasiteli titrasyon için konik bir şişeye yerleştirilir. ~ 9.5-10 eklenir ve indikatör yaklaşık 0.05 g eriochrome black T eklenir
(spatulanın ucunda). Bu durumda, çözelti şarap kırmızısına döner. Şişedeki çözelti, renk şarap kırmızısından yeşile dönene kadar EDTA çözeltisi ile yavaşça titre edilir. Titrasyon sonuçları ( V 2) tabloya girilir. sekiz.
Tablo 8
Kalsiyum ve magnezyum içeren bir çözeltinin titrasyon sonuçları
| Deneyim numarası | Test çözeltisinin hacmi, cm3 | EDTA hacmi, V∑, cm3 | Çözeltideki Mg 2+ içeriği, g |
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 | |||
| 25,00 |
reaktifler
1. Molar konsantrasyonu ~ 0.05 mol / dm olan bir EDTA çözeltisi 3.
2. 2.00 × 10 -3 g / dm 3 titreli standart Cu (II) çözeltisi.
3. H20 damıtılmış.
4. pH ~ 8 - 8.5 olan amonyak tamponu.
5. Müreksit, indikatör karışımı.
Görevler
1. EDTA iyonizasyon sabitleri aşağıdaki gibiyse pH = 5'te EDTA için α 4'ü hesaplayın: K 1 = 1.0 · 10 -2, K 2 = 2.1 · 10 -3, K 3 = 6.9 · 10 -7 , K 4 = 5.5 · 10 -11.
2. Stabilite sabiti ise, pH = 10'da 0.010 M EDTA solüsyonu ile 25,00 ml 0.020 M nikel solüsyonu için titrasyon eğrisini çizin.
KNiY = 10 18.62. 0,00 ekledikten sonra p hesaplayın; 10.00; 25.00; 40,00; 50.00 ve 55.00 ml titrant.
3. Kalsiyum iyonları içeren 50,00 ml çözeltinin titrasyonu için
ve magnezyum, pH = 12'de 13.70 ml 0.12 M EDTA çözeltisi ve pH = 10'da 29.60 ml aldı. Çözeltideki kalsiyum ve magnezyum konsantrasyonunu mg / ml olarak ifade edin.
4. 1 litre suda analiz edildiğinde 0,2173 gr kalsiyum oksit ve 0,0927 gr magnezyum oksit bulundu. EDTA konsantrasyonunun hacmini hesaplayın 0.0500 mol / L titrasyona harcandı.
5. 0.3840 g magnezyum sülfat içeren 25.00 ml standart solüsyonun 21.40 ml Trilon B solüsyonu tükettiği titrasyonu Bu solüsyonun kalsiyum karbonat ve molar konsantrasyonu için titresini hesaplayın.
6. Aşağıda verilen metal kompleksonatların oluşum (kararlılık) sabitlerine dayanarak, pH = 2'de metal iyonlarının kompleksometrik titrasyon olasılığını değerlendirin; 5; on; 12.
7. 0.01 M Ca2+ solüsyonu pH = 10'da 0.01 M EDTA solüsyonu ile titre edildiğinde, kararlılık sabiti K CaY = 10 10.6. Titrasyonun bitiş noktasında = ise, pH = 10'da gösterge ile metal kompleksinin koşullu stabilite sabitinin ne olması gerektiğini hesaplayın.
8. Kompleksometrik titrasyonda kullanılan indikatörün asit iyonizasyon sabiti 4.8 · 10 -6'dır. Çözeltideki toplam konsantrasyonu 8.0 · 10 -5 mol / l ise, göstergenin asit ve alkali formlarının içeriğini pH = 4.9'da hesaplayın. Bir çözeltiyi titre ederken bu göstergeyi kullanma olasılığını belirleyin
pH = 4.9 ile asit formunun rengi kompleksin rengiyle eşleşirse.
9. Numunedeki alüminyum içeriğini belirlemek için, 550 mg numunenin tartılmış bir kısmı çözündürüldü ve 50.00 ml 0.05100 M'lik bir komplekson III çözeltisi ilave edildi. İkincisinin fazlası, 14.40 ml 0.04800 M çinko (II) çözeltisi ile titre edildi. Numunedeki alüminyumun kütle fraksiyonunu hesaplayın.
10. Bizmut ve iyodür iyonları içeren bir kompleks yok edildiğinde, ikincisi bir Ag (I) çözeltisi ve bizmut - bir komplekson III ile titre edilir.
550 mg numune içeren bir çözeltinin titrasyonu için, 14.50 ml 0.05000 M komplekson III çözeltisi ve 440 mg numunede bulunan bir iyodür iyonunun titrasyonu için 23.25 ml 0.1000 M Ag çözeltisi ( I) harcanır. İyodür iyonları bir ligand ise, kompleksteki bizmutun koordinasyon sayısını hesaplayın.
11.
Pb, Zn, Cu içeren 0.3280 g ağırlığındaki bir numune çözündürüldü
ve 500,00 cm3'lük bir ölçülü balona aktarıldı. Belirleme üç aşamada gerçekleştirildi:
a) Pb, Zn, Cu içeren 10.00 cm3 hacimli bir çözeltinin birinci kısmının titrasyonu, 37.50 cm3 0.0025 M EDTA çözeltisi tüketildi; b) 25.00 cm3 hacimli ikinci kısımda Cu gizlendi ve Pb ve Zn titrasyonu için 27.60 cm3 EDTA kullanıldı; c) 100,00 cm3 hacme sahip üçüncü kısımda maskeli Zn
ve Cu, Pb titrasyonu 10.80 cm3 EDTA tüketmiştir. Numunedeki Pb, Zn, Cu'nun kütle fraksiyonunu belirleyin.
Titrasyon eğrileri
Redoksmetride, titrasyon eğrileri koordinatlarda çizilir E = f(C R),
titrasyon sırasında sistem potansiyelindeki değişimi grafiksel olarak gösterirler. Eşdeğerlik noktasına kadar, sistemin potansiyeli, analitin oksitlenmiş ve indirgenmiş formlarının konsantrasyonlarının oranından hesaplanır (çünkü eşdeğerlik noktasına kadar titrant formlarından biri pratikte yoktur), eşdeğerlik noktasından sonra - titrantın oksitlenmiş ve indirgenmiş formlarının konsantrasyonu ile ilgili olarak (çünkü eşdeğerlik noktasından sonra analit neredeyse tamamen titre edilir).
Eşdeğerlik noktasındaki potansiyel formül ile belirlenir.
 , (26)
, (26)
yarı reaksiyonlara katılan elektronların sayısı nerede;
- yarı reaksiyonların standart elektrot potansiyelleri.
İncirde. Şekil 10, asidik bir ortam içinde bir potasyum permanganat KMn04 çözeltisi ile bir oksalik asit H2C204 çözeltisinin titrasyon eğrisini göstermektedir.
(= 1 mol / dm 3).

Pirinç. 10. 100,00 cm3 oksalik çözeltinin titrasyon eğrisi
asit H 2 C 2 O 4 s C1 / z= 0.1000 mol / dm 3 permanganat çözeltisi
potasyum KMnO 4 s C1 / z= 0.1000 mol / dm 3 = 1 mol / dm 3'te
MnO 4 - + 5'in yarı reaksiyon potansiyeli e+ 8H + → Mn 2+ + 4H 2 O, yarı reaksiyona hidrojen iyonları katıldığı için ortamın pH'ına bağlıdır.
Permanganatometri
Titran, güçlü bir oksitleyici ajan olan potasyum permanganat çözeltisi KMnO 4'tür. Temel Denklem:
MnO 4 - + 8H + + 5e = Mn 2+ + 4H 2 O, ![]() = + 1.51 V.
= + 1.51 V.
M1 / z (KMnO 4) = ![]() g / mol.
g / mol.
Zayıf asidik, nötr ve hafif alkali ortamlarda, düşük redoks potansiyeli nedeniyle permanganat iyonu Mn +4'e indirgenir.
MnO 4 - + 2H20 + 3e = MnO2 ¯ + 4OH -, ![]() = +0,60 V.
= +0,60 V.
M 1 / z (KMnO 4) = 158.03 / 3 = 52.68 g / mol.
V alkali ortam potasyum permanganat çözeltisi indirgenir
Mn +6'ya kadar.
MnO 4 - + 1e = MnO 4 2-, ![]() = +0.558 V.
= +0.558 V.
M1/z (KMnO 4) = 158.03 g/mol.
Yan reaksiyonları ortadan kaldırmak için, sülfürik asit ile oluşturulan asidik bir ortamda potasyum permanganat ile titrasyon yapılır. Hidroklorik asit Potasyum permanganat klorür iyonunu oksitleyebildiğinden, bir ortam oluşturmak için kullanılması tavsiye edilmez.
2Cl - - 2e = Cl2, = +1.359 V.
Çoğu zaman, potasyum permanganat bir çözelti olarak kullanılır.
~ 0.05 - 0.1 mol / dm3 eşdeğeri bir molar konsantrasyon ile. olması nedeniyle birincil standart değildir. sulu çözeltiler potasyum permanganat, içindeki suyu ve organik safsızlıkları oksitleyebilir:
4MnO 4- + 2H20 = 4MnO2 ¯ + 3O 2 + 4OH -
Potasyum permanganat çözeltilerinin ayrışması, manganez dioksit varlığında hızlanır. Manganez dioksit, permanganatın bir bozunma ürünü olduğundan, bu çökelti otokatalitik etki ayrışma süreci hakkında.
Çözeltilerin hazırlanmasında kullanılan katı potasyum permanganat, manganez dioksit ile kontamine olduğundan, doğru bir numuneden çözelti hazırlamak mümkün değildir. Yeterince kararlı bir potasyum permanganat çözeltisi elde etmek için, KMnO4'ün tartılmış bir kısmını suda çözdükten sonra, birkaç gün boyunca karanlık bir şişede bırakılır (veya kaynatılır) ve ardından MnO2 süzülerek ayrılır. bardak filtre (manganez dioksit oluşturmak üzere potasyum permanganat ile reaksiyona girdiğinden kağıt filtre kullanılamaz).
Potasyum permanganat çözeltisinin rengi çok yoğun
Bu yöntemde gösterge gerekli değildir. 100 cm3 suya gözle görülür bir pembe renk vermek için 0,02 - 0,05 cm3 KMnO 4 çözeltisi yeterlidir.
0.1 mol / dm3 (0.02 M) eşdeğer bir molar konsantrasyon ile. Potasyum permanganatın titrasyon son noktasındaki rengi kararsızdır ve fazla permanganatın etkileşiminin bir sonucu olarak yavaş yavaş renk değiştirir.
Nispeten son noktada bulunan manganez (II) iyonları ile Büyük bir sayı:
2MnO 4 - + 3Mn 2+ + 2H 2 O «5MnО 2 ¯ + 4H +
Çalışma çözümü standardizasyonu KMnO 4, sodyum oksalat veya oksalik asit (taze yeniden kristalize edilmiş ve 105 °C'de kurutulmuş) üzerinde gerçekleştirilir.
Molar konsantrasyon eşdeğeri ile birincil standartların çözümlerini kullanın İLE BİRLİKTE(½ Na 2 C 2 O 4) = 0.1000 veya 0.05000 mol / l.
C 2 O 4 2- - 2e ® 2CO 2, = -0.49 V