Кратък синопсис на Alkans. Алкани - номенклатура, производство, химични свойства
Уроците по химия в 10 клас по двучасовата програма Габриеляна О.С.
А. В. Абакумов
Урок „Природен газ. Алкани".
(лекция)
Цели на урока:разгледа основните природни източници на въглеводороди в светлината на две посоки на тяхното използване: като енергийни суровини и основа на химичния синтез. На този материал повторете, затвърдете и обобщете получените по-рано знания за свойствата и приложението на наситените въглеводороди.
Оборудване:колекции "Нефт и нефтопродукти", "Битуминозни въглища и продукти от тяхната преработка", таблици за състава на природните и свързаните газове, портрети на М.В. Ломоносов, Д.И. Менделеев, Н. Д. Зелински, В.Г. Шухов.
^ Напредък на урока.
I. Подготовка за урока(проверете готовността за урока на групи ученици, оборудване, клас; маркирайте отсъстващите ученици в дневника; информирайте темата и целта на урока).
II. Лекция.
План за лекция.
Природни газове и тяхното използване.
Концепцията за въглеводороди.
Електронна и пространствена структура на молекулата на метана.
Хомоложна серия от наситени въглеводороди.
Изомерия и номенклатура на алканите.
Методи за производство и физични свойства на алканите.
Химични свойства и приложение на алканите.
1. Природни газове и тяхното използване.
Страната ни е на първо място в света по запаси от природен газ. В Русия са открити около 200 находища на природен газ. По-голямата част от произведения газ се използва като гориво.
Предимства на газа пред другите горива:
висока калоричност (при изгаряне на 1 m 3 природен газ се отделят до 54 400 kJ);
евтиност;
екологична чистота;
лесно транспортиране през газопроводи.
По този начин природният газ днес е един от най-добрите видове гориво за битови и промишлени нужди (автомобилни, металургични, пещи за производство на стъкло и сапун и др.). Освен това природният газ служи като ценна и евтина суровина за химическата промишленост.
^
Състав на природен газ
.
Съставът на природния газ от различните находища е различен. Въпреки това, газовете от всички находища съдържат въглеводороди с ниско относително молекулно тегло.
Състав на природен газ:
80-90% метан;
2-3% от неговите хомолози (етан, пропан, бутан);
ниско съдържание на примеси (сероводород, азот, благородни газове, въглероден двуокиси водна пара).
2. Концепцията за въглеводороди.
Име на групата органични съединения, който започваме да изучаваме днес, отразява техния състав.
Въглеводородите са съединения, състоящи се само от въглеродни и водородни атоми.
Класификация на въглеводородите
Въглеводороди
![]()
Циклична (карбоциклична) Ациклична
Цикличните (карбоциклични) съединения са съединения, които съдържат един или повече пръстени, съдържащи само въглеродни атоми. Те от своя страна се делят на ароматни и неароматни.
Ацикличните въглеводороди включват органични съединения, въглеродният скелет на молекулите на които е отворена верига.
Тези вериги могат да бъдат образувани от единични връзки (алкани), съдържат една двойна връзка (алкени), две двойни връзки (диени), една тройна връзка (алкини).
3. ^
Електронна и пространствена структура на молекулата на метана
.
Днес започваме да изучаваме първия клас въглеводороди - алкани (наситени, наситени, парафинови въглеводороди).
^ Алканите са въглеводороди, в чиито молекули атомите са свързани с единични връзки и които съответстват обща формулаС н Х 2 н +2 .
[ Демонстрация на връзката на метана с разтвор на калиев перманганат и бромна вода].
Най-простият представител на този клас, метанът, е познат на хората от много дълго време. Наричаха го блатен или минен газ.
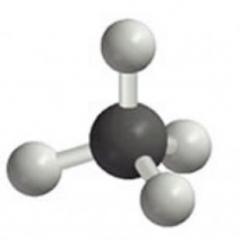
Въглеродният атом в метана е в състояние на sp3-хибридизация. В този случай въглеродът има четири еквивалентни хибридни орбитали, чиито оси са насочени към върховете на тетраедъра. Ъгълът между осите на тези орбитали е 109 ° 28 ". / Изобразете структурата на въглеродния атом в sp 3 -хибридно състояние /.
Електронната структура на въглеродния атом определя пространственото подреждане на атомите в молекулата на метана. Всичките четири C-H ковалентни връзки се образуват поради припокриването на sp3-орбиталите на въглеродния атом и s-орбиталата на водорода. Всички връзки в молекулата на метана са от σ-тип. Центровете на ядрата на водородните атоми лежат във върховете на правилен тетраедър. / Демонстрация на модела на молекулата на метан / .
Почти свободно въртене е възможно около единична връзка въглерод-въглерод, а алкановите молекули могат да придобият голямо разнообразие от форми. / Демонстрация на модел на молекула бутан / .
Въглерод-въглеродните връзки са неполярни и слабо поляризуеми. Дължината на връзката C - C в алканите е 0,154 nm. Връзката C - H е слабо полярна.
Отсъствието на полярни връзки в молекулите на наситените въглеводороди води до факта, че те са слабо разтворими във вода.
4. ^
Хомоложна серия от наситени въглеводороди
.
Наситените въглеводороди съставляват хомоложната серия от метан.
Хомоложната серия е съвкупност от органични съединения със сходна структура и свойства и различаващи се едно от друго по състав с една или повече групи - CH 2 - (хомоложна разлика).
Представителите на една хомоложна серия се наричат хомолози.
Като използвате първите четири представителя като пример, изведете общата формула за алканите:
Метан - CH 4; етан - C2H6; пропан - C3H8; Бутан - C4H10; Пентан - C 5 H 12.
(Общата формула за алканите е C n H 2 n +2).
5. ^
Изомерия и номенклатура на алканите
.
Алканите се характеризират със структурна изомерия. Структурните изомери се различават един от друг по структурата на въглеродния скелет.
Основи на номенклатурата на IUPAC.
Избор на основна верига.
Номериране на атомите на главната верига.
Образуване на името.
В зависимост от броя на радикалите, свързани с въглеродния атом, се прави разлика между първични, вторични, третични и кватернерни въглеродни атоми.
6. Методи за производство и физични свойства на алканите.
Крекинг на петролни продукти
Хидрогениране на алкени
Пиролиза на сол карбоксилни киселини
Реакция на Вюрц
1). Реакция на горене.
Многобройни химична реакциятекат както около човека, така и в него. Понякога просто не обръщаме внимание на тях химични явления... Когато запалим газ в кухнята или запалим запалка, караме кола или гледаме по телевизията трагичните последици от експлозия в мина, ставаме свидетели на реакцията на изгаряне на алкани [Демонстрация на горящ метан].
Като повечето органична материя, наситените въглеводороди по време на горенето образуват водна пара и въглероден диоксид:
CH 4 + 2O 2 → CO 2 + 2H 2 O
При изгаряне се отделят наситени въглеводороди голям бройтоплина, което предопределя използването им като гориво.
2). ^
Реакция на заместване
.
Спомнете си структурата на метана. Въглеродните атоми са изчерпали напълно своите валентни възможности. За да получите друго вещество от метан, трябва да разкъсате връзките C - H и да замените водорода с друг атом или група от атоми. По този начин реакциите на заместване са характерни за алканите.
׀ ׀
H − C − H + Cl − Cl → H − C − Cl + H − Cl
При достатъчно количество халоген, реакцията продължава, докато се образуват многократно заместени продукти.
Само хлор и бром могат да се използват като халоген в такива реакции. Реакцията с флуор протича с експлозия и води до разрушаване на молекулата на алкана, а йодът, като по-малко активен халоген, не е способен на такава трансформация.
3). ^
Реакция на разлагане
.
Когато алканите се нагряват без достъп до въздух, с тях възникват различни трансформации, използвани в индустрията. Когато метанът се нагрява до 1000 ° C, започва пиролиза на метан - разлагане на прости вещества.
CH 4  C + 2H 2
C + 2H 2
2CH 4  ^ CH≡CH + 3H 2
^ CH≡CH + 3H 2
Така от парафини могат да се получат въглеводороди с двойни и тройни връзки.
4). Реакция на дехидрогениране.
Друг практически важен процес е възможен за хомолозите на метан: реакцията на дехидрогениране. Тази трансформация протича в присъствието на катализатор при повишени температури и води до образуването на етиленови въглеводороди.
Н − С − С − Н  H − C = C − H + H − H
H − C = C − H + H − H
׀ ׀
Трябва да се отбележи, че при стайна температура наситените въглеводороди са много инертни съединения, които не взаимодействат с агресивни вещества. Реакциите на радикално заместване (халогениране, нитриране) са най-характерни за алканите.
Точно както структурата на веществото определя неговата реактивност, така и свойствата до голяма степен определят областта на приложение на съединенията.
Газообразните алкани са не само битови и промишлени горива, но и суровини за химическата промишленост. От тях се получават халогенни производни, включително напълно флуорирани въглеводороди (фреони), които са хладилни агенти за битови и промишлени хладилници и климатици. Произвеждат етан и пропан ненаситени въглеводородии други полимерни материали. Течните въглеводороди са преди всичко гориво за двигатели от различни видове (свръхзвуков самолет консумира до 100 литра керосин в минута!), Разтворители, суровини за производство на алкени.
III. Домашна задача:§ 3 упражнение. 4
Резюме на урока по темата "Алкани" учител
Целта на урока: запознаване на учениците с алканите (структурата на молекулите на алканите, запознаване с изомерията на наситените въглеводороди, номенклатурата на алканите, техните физични и химични свойства, основните методи на производство) и идентифициране на важната им роля в промишлеността.
Цели на урока:
Образователни : разгледайте хомоложната серия от наситени въглеводороди, структура, физически и Химични свойства, методите за тяхното производство при преработката на природен газ, възможността за производството им от природни източници: природни и свързани нефтени газове, нефт и въглища. Развиващи се : да развие концепцията за пространствената структура на алканите; развитие на познавателни интереси, творчески и интелектуални способности, развитие на самостоятелност при усвояване на нови знания с помощта на нови технологии. Образователни : да покаже единството на материалния свят чрез примера на генетичната връзка на въглеводороди от различни хомоложни серии, получени при преработката на природни и свързани нефтени газове, нефт и въглища.Знания, способности, умения:Актуализират понятията: "алкани", "обща формула на алканите", "хомолози", "изомери". Те ще придобият знания за химичните понятия: "въглероден скелет", "метан", "етан", ще характеризират структурата и химичните свойства на метана, етана, ще обяснят зависимостта на свойствата на метана и етана от техния състав и структура, най- важни приложения на метан и етан. Те ще засилят способността за назоваване на веществата според международната номенклатура, ще определят принадлежността на органичните вещества към класа на алканите, ще обяснят зависимостта на свойствата на веществата от техния състав и структура.
Оборудване: компютър, мултимедиен проектор, екран, презентация, маса.
аз Организиране на времето... (Съобщете целта и темата на урока).
II. Научи нов материал.
Тема на урока: "Алкани".
План за изследване на алканите.
Определение. Обща формула за класа въглеводороди. Хомологични серии. Изомерия на алканите. Структурата на алканите. Физически свойства. Методи за получаване. Химични свойства. Приложение.
1. Определение. Обща формула за клас.
Въпрос към класа "Какво са въглеводородите?"
"Това са органични съединения, съставени от два елемента - въглерод и водород."
алкани. (Наситени въглеводороди. Парафини. Наситени въглеводороди.)
Алканите са въглеводороди, в молекули на които всички въглеродни атоми са свързани с единични връзки (-) и имат общата формула: CnH2n + 2.
Упражнение... Изведете формулата на алкана, ако n = 3, 5, 7.
2. Хомологични редове.
Въпрос към класа "Какво са хомолозите?"
- "Хомолозите са вещества, които са сходни по структура и свойства и се различават по една или повече CH2 групи."
Най-простият представител на алканите е CH4 метанът. Следващият хомолог е етан C2H6.
Мислено добавяйки CH2 групата към етан, кажете формулите на хомолозите, които ги следват.
Така че имаме хомоложна серия от алкани. Както можете да видите, наставката "an" е обща за всички алкани и като се започне от петия хомолог, името на алкана се образува от гръцката цифра, показваща броя на въглеродните атоми в молекулата и наставката "an".
Таблица "Хомологични редове на алкани".
Ако умствено извадите един водороден атом от формулите на наситените въглеводороди, ще получите формулите за групи от атоми с несдвоени електрони, които се наричат радикали.
Упражнение... Назовете следните въглеводороди според систематичната номенклатура.
3. Изомерия на алканите.
Въпрос към класа "Какво е изомерия?"
„Изомерията е явление, при което веществата имат същото химичен състав, но различна структура и свойства."
Първите три члена на хомоложната серия алкани - метан, етан, пропан - нямат изомери. Четвъртият член, бутан C4H10, се различава по това, че има два изомера: нормален бутан с права верига и изобутан с разклонена верига.
CH3 – CH2 – CH2 – CH3 (бутан ) CH 3 -CH – CH 3 (2- метилпропан)
Типът изомерия, при който веществата се различават едно от друго по реда на свързване на атомите в молекулата, се нарича структурна изомерия или изомерия на въглеродния скелет.
Упражнение... Запишете полуструктурните формули на всички възможни изомери на пентан.
4. Структурата на алканите.
Въпрос към класа "Какъв тип химични връзки присъстват във въглеводородните молекули?"
"Химическите връзки, образувани в резултат на припокриване на орбитали по линията, свързваща центровете на ядрата на два атома, се наричат сигма връзки."
„Химическите връзки, образувани в резултат на припокриването на орбитали в два региона, тоест извън линията, свързваща центровете на ядрата на атомите, се наричат пи-връзки.
Въглеродният атом във всички органични вещества е във "възбудено" състояние, тоест има четири несдвоени електрона на външно ниво. В образованието химическа връзкаУчастват 1 s и 3 p електронни орбитали. В резултат на тяхното сливане се образуват 4 хибридни облака (sp3 - хибридизация). Хибридните облаци са разположени в пространството, образувайки пространствена тетраедрична форма.
5. Физични свойства.
Таблица „Зависимост на точките на кипене и топене на алканите от молекулно тегло».
Хомолозите се различават по молекулно тегло и следователно физически характеристики... С увеличаване на броя на въглеродните атоми в алканова молекула (с увеличаване на молекулното тегло), в хомоложната серия, естествена промяна във физическите свойства на хомолозите(преход от количество към качество): температурата на кипене и топене се повишава, плътността се увеличава.
Алкани от СН4 до С4Н10 - газове, от С5Н12 до С17Н36 - течности, след това - твърди вещества.
6. Получаване.
В промишлеността алканите се изолират от природни източници (природни и свързани газове, нефт, въглища).
В лабораторията алканите се получават чрез сливане на натриев ацетат с твърд натриев хидроксид.
1. CH3COONa + NaOH ¾® CH4 + Na2CO3
По-сложните алкани се получават при взаимодействието на халогенирани наситени въглеводороди с метален натрий.
2,2CH3Cl + 2Na ¾® CH3-CH3 + 2NaCl (реакция на Вурц)
7. Химични свойства.
Химичните свойства на всяко съединение се определят от неговата структура, тоест от естеството на съставните му атоми и естеството на връзките между тях.
1. Наситените въглеводороди изгарят при нагряване:
CH4 + 2O2 → CO2 + 2H2O
смес от метан и кислород (1: 2) експлодира при запалване
2. Разлага се при нагряване при 1000 ºС до прости вещества:
CH4 → C + 2H2
при нагряване до 1500С от метан се получава ацетилен
2CH4 → C2H2 + 3H2
3. Хлориране на метан:
1 сценаCH4 + Cl2® CH3Cl + HCl
2 сценаCH3Cl + Cl2® CH2Cl2 + HCl
3 сценаCH2Cl2 + Cl2® CHCl3 + HCL
4 сценаCHCl3 + Cl2® CCL4 + HCL
4. Реакциите на изомеризация протичат при нагряване и в присъствието на катализатор. Пентанова изомеризация (с алуминиев хлорид)
8. Приложение.
Метанът и неговите производни имат голям практическа употреба: като гориво те са суровини за производство на органични вещества, разтворители, гориво за дизелови и турбореактивни двигатели.
III. Закотвяне.
Тест по темата АЛКАНА
1. Съставът на алканите отразява общата формула. ... ...
a) CnH2n b) CnH2n + 2 c) CnH2n-2 d) CnH2n-6
Опции за отговор (изберете правилния):
Отговор_1: формула а
Отговор_2: формула b
Отговор_3: формула в
Отговор_4: формула g
2. Кои съединения принадлежат към хомоложната серия на метана:
а) C2H4 b) C3H8 c) C4H10 d) C5H12 e) C7H14?
Отговор_1: съединения a, c, d
Отговор_2: съединения b, d, e
Отговор_3: съединения b, c, d
Отговор_4: съединения d, d
3. Кое от съединенията ще се получи при нагряване на метан без достъп на въздух при температура 1500О
Отговор_1: етилен
Отговор_2: ацетилен
Отговор_3: въглероден двуокис
Отговор_4: сажди
4. С какви реагенти могат да взаимодействат алканите:
а) Br2 (разтвор); б) Br2, t°; в) H2SO4 (25°C);
d) HNO3 (разреден), t°; д) KMnO4 (25 °C); е) NaOH?
Отговор_1: а, б, г, д
Отговор_2: б, в, е
Отговор_3: а, г
Отговор_4: б, г
5. Какъв тип е реакцията на взаимодействие на хлора с метана (на светлина)?
Отговор_1: окисление
Отговор_2: изомеризация
Отговор_3: замествания
Отговор_4: връзки
6. Какъв халогениран алкан е необходим за получаване
2,5-диметилхексан чрез реакция на Würz без странични продукти?
Отговор_1: 2-бромо-2-метилпропан
Отговор_2: 2-бромпропан + 1-бромо-3-метилбутан
Отговор_3: 1-бромо-2-метилпропан
Отговор_4: бромоетан + 1-бромобутан
IV. Домашна работа:
Учебник "Химия-10" Рудзитис, Фелдман.
Страници 21-27, упражнение. 9.11 (стр. 27)
алкани- наситени (наситени) въглеводороди. метан ( CH 4). Всички следващи наситени въглеводороди се различават по CH 2- група, която се нарича хомоложна група, а съединенията се наричат хомолози.
Обща формула - СнХ 2 н +2 .
Структурата на алканите.
Всеки въглероден атом е вътре sp 3- хибридизация, форми 4 σ - връзки (1 C-Cи 3 C-H). Молекулата е под формата на тетраедър с ъгъл 109,5°.
Връзката се образува от припокриващи се хибридни орбитали, като максималната област на припокриване лежи в пространството върху правата линия, свързваща атомните ядра. Това е най-ефективното припокриване, така че σ връзката се счита за най-силна.
Изомерия на алканите.
За алканиизомерията на въглеродния скелет е присъща. Ограничените връзки могат да приемат различни геометрични фигурикато се запази ъгълът между връзките. Например,

Различните позиции във въглеродната верига се наричат конформации. При нормални условия, конформациите на алканите свободно се трансформират една в друга, използвайки въртене C-Cвръзки, поради което често се наричат ротационни изомери. Има 2 основни конформации - "инхибирани" и "замъглени":

Изомерия на въглеродния скелет на алканите.
Броят на изомерите се увеличава с нарастването на въглеродната верига. Например, бутанът има 2 известни изомера:

За пентан - 3, за хептан - 9 и т.н.
Ако молекулата алканизвадете един протон (водороден атом), ще получите радикал:
Физични свойства на алканите.
При нормални условия - С1-С4- газове , C 5 -C 17- течности, а въглеводородите с повече от 18 въглеродни атома са твърди вещества.
С нарастването на веригата точката на кипене и точката на топене се увеличават. Разклонените алкани имат по-ниски точки на кипене от нормалните.
алканинеразтворим във вода, но лесно разтворим в неполярни органични разтворители. Лесно се смесват един с друг.
Получаване на алкани.
Синтетични методи за производство на алкани:
1. От ненаситени въглеводороди - реакцията на "хидрогениране" протича под въздействието на катализатор (никел, платина) и при температура:

2. От халогенни производни - Реакция на Wurtz: взаимодействие на монохалогеноалкани с метален натрий, което води до алкани с удвоен брой въглеродни атоми във веригата:
3. От соли на карбоксилни киселини. Когато солта взаимодейства с алкали, се получават алкани, които съдържат 1 въглероден атом по-малко от оригиналната карбоксилна киселина:
4. Получаване на метан. В електрическа дъга във водородна атмосфера:
C + 2H 2 = CH 4.
В лабораторията метанът се получава, както следва:
Al 4 C 3 + 12H 2 O = 3CH 4 + 4Al (OH) 3.
Химични свойства на алканите.
При нормални условия алканите са химически инертни съединения; те не реагират с концентрирана сярна и азотна киселина, с концентрирана основа или с калиев перманганат.
Стабилността се обяснява със силата на връзките и тяхната неполярност.
Съединенията не са склонни към реакции на разцепване на връзките (реакция на присъединяване), те се характеризират със заместване.
1. Халогениране на алкани. Под въздействието на квант светлина започва радикално заместване (хлориране) на алкана. Обща схема:
Реакцията протича по верижен механизъм, в който те се разграничават:
А) Иницииране на веригата:

Б) Растеж на веригата:

В) Отворена верига:
Като цяло може да се представи като:

2. Нитриране (реакция на Коновалов) на алкани. Тази реакция протича при 140 ° С:
Реакцията протича най-лесно с третичен въглероден атом, отколкото с първичен и вторичен.
3. Изомризация на алкани. При специфични условия алканите с нормална структура могат да се превърнат в разклонени:

4. Крекингалкани. Когато са изложени на високи температури и катализатори, висшите алкани могат да разрушат връзките си, образувайки по-ниски алкени и алкани:

5. Окисление на алкани. При различни условия и с различни катализатори, окисляването на алкани може да доведе до образуването на алкохол, алдехид (кетон) и оцетна киселина... В условия пълно окислениереакцията протича до края - до образуването на вода и въглероден диоксид:

Използването на алкани.
Алканите се използват широко в промишлеността, при синтеза на нефт, гориво и др.
Аз одобрявам:
Заместник директор
Г. Г. Исмагулова
Група: 5 Дата: 23.01.2017г
Тема: Алкани. Хомоложни серии, изомери. Алканова номенклатура. Структурата на алканите. Пребиваване в природата и получаване на алкани. Свойства на алканите.
цели:
- да формира способност за съставяне на структурни формули на органични съединения, използвайки строителен алгоритъм, за установяване на причинно-следствени връзки между състава, структурата и употребата на веществата;
Да се подобри уменията за използване на номенклатурата на IUPAC по отношение на алканите;
За запознаване на учениците с изомерията на пределния НС, тех физични свойстваи основните методи за получаване.
Тип урок:урок по усвояване на нови знания.
Оборудване и реактиви: топчести и обемни модели на алканови молекули, парафинови проби, течни алкани (пентан, хексан) бензин,
По време на занятията
І. Организиране на времето.
ІІ. Актуализиране на знания и умения. Проверка на домашната работа.
Фронтален преглед на класа по теория на структурата на органичната материя A.M. Butlerov
Веществата са разделени на две големи групи. Който? (органични и неорганични)
Съставът на органичните съединения включва ли атом? (въглерод)
Органичната химия е ………… ..? (химия на въглеводородите и техните производни)
Източници на органична материя? (разделени на две големи групи - естествени и синтетични)
Какво представляват естествените органични съединения и синтетичните органични вещества? (природен газ, нефт, въглища, торф, шисти, озокерит, горски продукти, памук, селскостопански продукти и др.), (получени изкуствено, чрез органичен синтез)
Основните положения на теорията на химическата структура A.M. Butlerov.
Какво се наричат изомери?
Прародител на всички органични съединения са? (въглеводороди)
Какви съединения се наричат въглеводороди и какви видове от тях познавате?
Алифатните въглеводороди биват наситени и ненаситени. Какво представляват наситените и ненаситените въглеводороди?
III... Изучаване на нов материал.
Алкани - наситени въглеводороди, в чиито молекули въглеродните атоми са свързани помежду си само с единична сигма връзка и които имат общата формула: CnH2n + 2.
Алканите се наричат парафини или въглеводороди от метановия ред. Първият член на алканите е метанът, поради което те се наричат метанови въглеводороди.
Алканите са наситени въглеводороди и съдържат възможно най-много водородни атоми. Всеки въглероден атом в алкановите молекули е в състояние на sp3-хибридизация - всичките 4 хибридни орбитали на C атома са еднакви по форма и енергия, 4 електронни облака са насочени към върховете на тетраедъра под ъгли от 109°28". до единични връзки между С атомите, свободно въртене около въглеродната връзка Тип въглеродна връзка - σ-връзка, връзките са с ниска полярност и слабо поляризуеми Дължина на въглеродната връзка - 0,154 nm.
Най-простият представител на класа е метанът (CH4).


Съгласно номенклатурата на IUPAC, имената на алканите се образуват с помощта на наставката -анкато се добави към съответния корен от името на въглеводорода. Най-дългата неразклонена въглеводородна верига е избрана така, че най-голямото числодепутатите бяха минималният брой във веригата. В името на съединението числото показва номера на въглеродния атом, при който се намира заместващата група или хетероатом, след това името на групата или хетероатома и името на основната верига. Ако групите се повтарят, тогава се изброяват числата, показващи тяхната позиция, а броят на идентичните групи се обозначава с префиксите di-, tri-, tetra-. Ако групите не са еднакви, тогава имената им са изброени по азбучен ред.
Имена на алкани.
Думата "алкан" е от същия произход като "алкохол". Остарял термин"Парафин" идва от латинското parum - малко, малко и affinis - свързан; парафините имат малко реактивноствъв връзка с повечето химикали. Много парафини са хомоложни; в хомоложната серия от алкани всеки следващ член се различава от предишния с една метиленова група CH 2. Терминът идва от гръцкия homologos – подходящ, подобен.
Хомолози- вещества с една и съща обща формула, сходни по химични свойства, но различаващи се едно от друго по молекулен състав с една или повече групи от СН2 атоми, които се наричат хомоложна разлика.
Изомерия на алканите.
изомеризъм- вещества със същия молекулен състав (т.е молекулярна формула), но с различна химическа структура и следователно притежаващи различни свойства. Такива съединения се наричат изомери.
Характерна е структурната изомерия.
Във формулата на молекулата на алкана се избира главната верига - най-дългата.
H3C-CH2-CH2-CH-CH2-CH3
2) След това тази верига се номерира от края, до който заместителят (радикалът) е разположен по-близо. Ако има няколко заместителя, продължете така, че числата, показващи тяхната позиция, да са най-малките. Заместителите са изброени по азбучен ред.
H3C-CH-CH2-CH-CH2-CH3
Въглеводородът се нарича в този ред: първо се посочва местоположението на заместителя (в брой), след това се нарича този заместител (радикал) и в края се добавя името на основната (най-дългата) верига. Така въглеводородът може да бъде наречен: 2-метил-4-етилхептан (но не и 6-метил-4-етилхептан).
Имената на радикалите са получени от имената на съответните въглеводороди чрез замяна на наставката - an с - il.

Получаване
Методи за извличането им от естествени суровини.
| Природни източнициалкани | Методи за получаване |
| 2. Нефтен газ Природен газ въглища | Фракционна дестилация. 1) ректификационни газове (C 3 H 8, C 4 H 10) 2) бензинова фракция (C 5 H 12 до C 11 H 24) 3) нафта фракция (C 8 H 18 до C 14 H 30) 4) керосинова фракция (C 12 H 26 до C 18 H 38) 5) дизелово гориво (C 13 N 28 до C 19 N 36) 6) мазут (C 18 H 38 - C 25 H 52, C 28 H 58 - C 38 H 78) Термичен; Каталитичен Дробно деление газ бензин смес пропан-бутан сух газ Коксуване коксов газ каменовъглен катран вода със свръх смола |
"Синтетични методи за производство на алкани"
| получаване | Реакционна химия |
| Изомеризация |
|
| Хидрогениране | |
| Вюрц синтез | |
| Декарбоксилиране | |
| Хидролиза на карбиди |
Физически свойства

Първите четири члена на алканите са газове, вариращи от пентан до пентадекан (C 15 H 32) - течности, алкани с високо молекулно тегло, които съдържат 16 или повече въглеродни атома, - твърди вещества. При нормални температури и с повишаване на налягането могат да се намерят пропан и бутан течно състояние... Точките на кипене и топене на нормалните алкани са по-високи от точките на кипене и топене на съответните разклонени алкани. Алканите са неполярни съединения. Те са по-леки от водата, не се смесват с вода (не се разтварят във вода) и не се разтварят в други полярни разтворители. Течните алкани са добри разтворители и се използват като разтворители за много органични вещества. Метанът и етанът, както и високомолекулните алкани са без мирис, но някои средно големи представители имат особена миризма. Алканите са запалими съединения.
Химични свойства
Реакция на заместване: Халогениране: CH 4 + Cl 2 → CH 3 Cl + HCl (хлорометан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорометан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорометан)
CHCl 3 + Cl 2 → CCl 4 + HCl (въглероден тетрахлорид).
Реакция на нитриране: C 2 H 6 + HNO 3 → C 2 H 5 NO 2 + H 2 O
Реакции на разлагане: CH 4 → C + 2H 2, 2CH 4 → C 2 H 2 + 3H 2
Реакции на окисление: СН 4 + 2О 2 → СО 2 + 2Н 2 О
2СН 4 + О 2 → 2СО + 4Н 2
Каталитично окисление метанводи до образуването на важни кислород-съдържащи органични съединения.
2CH 4 + O 2 = 2CH 3 OH
Приложение

IV. Закачане на тема
Запишете формулите на алканите от формулите на въглеводородите по-долу: C 2 H 4, C 3 H 8, C 4 H 6, C 5 H 12, C 6 H 6, C 7 H 16. Назовете ги. (Страница 57 задача 3)
Напишете, допълвайки въглеродния скелет с водородни атоми, пълните структурни формули на следните въглеводороди. Назовете ги. (стр. 57 отзад 6)
Запишете структурните формули на следните алкани: а) n - пентан; б) 2 - метилбутан; в) 2,4 - диметилпентан; г) 3 - метил - 4 - етилхексан; д) триметилметан (стр. 57, задача 9)
Запишете структурните формули на следните вещества:
а) 2,3 - диметилбутан,
б) 2,4 - диметил - 3 - етилпентан
в) n - пентан
V. Резюме на урока
Какво ново в научения урок?
Какво беше интересно?
VІ ... Домашна работа
Параграф 2.1, 2.2, 2.3, 2.4 напишете мини-доклад за метана и етана
Въглеводороди, в молекулите на които атомите са свързани с единични връзки и които отговарят на общата формула C n H 2 n +2.
В алкановите молекули всички въглеродни атоми са в състояние на sp3-хибридизация. Това означава, че и четирите хибридни орбитали на въглеродния атом са еднакви по форма, енергия и са насочени към ъглите на равностранна триъгълна пирамида - тетраедър. Ъглите между орбиталите са 109 ° 28 ′.
Почти свободно въртене е възможно около единична връзка въглерод-въглерод, а алкановите молекули могат да придобият голямо разнообразие от форми с ъгли при въглеродни атоми, близки до тетраедрични (109 ° 28 ′), например в молекула н-пентан.

Особено си струва да си припомним връзките в алкановите молекули. Всички връзки в молекулите на наситените въглеводороди са единични. Припокриването се случва по оста,
свързващи ядрата на атомите, тоест това са σ-връзки. Въглерод-въглеродните връзки са неполярни и слабо поляризуеми. Дължина C-C връзкав алканите е 0,154 nm (1,54 10 - 10 m). СН връзките са малко по-къси. Електронната плътност е леко отклонена към по-електроотрицателния въглероден атом, т.е. C-H връзкае слабо полярен.
Отсъствието на полярни връзки в молекулите на наситените въглеводороди води до факта, че те са слабо разтворими във вода и не взаимодействат със заредени частици (йони). Най-типичните реакции за алканите са реакции, включващи свободни радикали.
Хомоложна серия от метан
Хомолози- вещества, сходни по структура и свойства и различаващи се по една или повече CH 2 групи.

Изомерия и номенклатура
Така наречената структурна изомерия е характерна за алканите. Структурните изомери се различават един от друг по структурата на въглеродния скелет. Най-простият алкан със структурни изомери е бутанът. 
Основи на номенклатурата
1. Избор на главната верига.Образуването на името на въглеводород започва с дефиницията на главната верига - най-дългата верига от въглеродни атоми в молекулата, която е като че ли нейната основа.
2. Номериране на атомите на главната верига.На атомите в главната верига се приписват номера. Номерирането на атомите на главната верига започва от края, до който е по-близо заместителят (структури A, B). Ако заместителите са на еднакво разстояние от края на веригата, то номерирането започва от края, в който има повече от тях (структура B). Ако различни заместители са на еднакво разстояние от краищата на веригата, тогава номерирането започва от края, до който по-старият е по-близо (структура D). Предимството на въглеводородните заместители се определя от реда, в който следва буквата, с която името им започва в азбуката: метил (-CH 3), след това етил (-CH 2 -CH 3), пропил (-CH 2 -CH 2 -CH 3 ) и др.
Моля, имайте предвид, че името на заместителя се образува чрез замяна на наставката -an с наставката - тиняна името на съответния алкан.
3. Формиране на име... В началото на името те посочват числа - броят на въглеродните атоми, при които са разположени заместителите. Ако има няколко заместителя на даден атом, тогава съответното число в името се повтаря два пъти, разделено със запетаи (2,2-). След числото, броят на заместителите се обозначава с тире ( ди- две, три- три, тетра- четири, пента- пет) и името на заместителя (метил, етил, пропил). След това, без интервали или тирета, името на основната верига. Основната верига се нарича въглеводород - член на хомоложната серия от метан ( метан CH 4, етан C2H6, пропан C 3 H 8, C 4 H 10, пентан C 5 H 12, хексан C 6 H 14, хептан C 7 H 16, октан C 8 H 18, нонан C 9 H 20, декан C10H22).

Физични свойства на алканите
Първите четири представители на хомоложната серия метан са газове. Най-простият от тях - метан - газ без цвят, вкус и мирис (миризмата на "газ", усещайки която, трябва да се обадите на 04, се определя от миризмата на меркаптани - съдържащи сяра съединения, специално добавени към метана използвани в домакински и промишлени газови уреди, така че хората в близост до тях да усещат миризмата на теча).
Въглеводороди със състав от C 4 H 12 до C 15 H 32 - течности; по-тежките въглеводороди са твърди вещества. Точките на кипене и топене на алканите постепенно се увеличават с увеличаване на дължината на въглеродната верига. Всички въглеводороди са слабо разтворими във вода, течните въглеводороди са обикновени органични разтворители.
Химични свойства на алканите
Реакции на заместване.
Най-типичните реакции за алканите са реакции на заместване със свободни радикали, по време на които водороден атом се заменя с халогенен атом или някаква група. Нека представим уравненията на характерните реакции халогениране: 
В случай на излишък от халоген, хлорирането може да продължи, до пълната замяна на всички водородни атоми с хлор: 
Получените вещества се използват широко като разтворители и изходни материали в органичния синтез.
Реакция на дехидрогениране(водородна абстракция).
В хода на преминаване на алкани върху катализатора (Pt, Ni, A1 2 0 3, Cr 2 0 3) при висока температура (400-600 ° C) се елиминира водородна молекула и се образува алкен:
Реакции, придружени от разрушаване на въглеродната верига.
Всички наситени въглеводороди изгарят, за да образуват въглероден диоксид и вода. Газообразните въглеводороди, смесени с въздуха в определени пропорции, могат да експлодират.
1. Изгаряне на наситени въглеводородие екзотермична реакция на свободните радикали, която има много голямо значениепри използване на алкани като гориво:
V общ изгледреакцията на горене на алканите може да се запише по следния начин:
2. Термично разлагане на въглеводороди.
Процесът протича по механизъм на свободните радикали. Повишаването на температурата води до хомолитично разкъсване на връзката въглерод-въглерод и образуване на свободни радикали.
Тези радикали взаимодействат помежду си, обменяйки водороден атом, с образуването на молекула алкан и алкенова молекула:
Реакциите на термично разцепване са в основата на индустриалния процес - крекинг на въглеводороди. Този процес е най-важният етап в рафинирането на петрол.
3. Пиролиза... Когато метанът се нагрява до температура от 1000 ° C, започва пиролизата на метан - разлагане на прости вещества: ![]()
При нагряване до температура от 1500 ° C е възможно образуването на ацетилен:
4. Изомеризация... Когато линейните въглеводороди се нагряват с изомеризационен катализатор (алуминиев хлорид), се образуват вещества с разклонен въглероден скелет: 
5. Ароматизация... Алканите с шест или повече въглеродни атома във веригата в присъствието на катализатор циклизират, за да образуват бензол и неговите производни: 
Алканите влизат в реакции, протичащи по механизъм на свободните радикали, тъй като всички въглеродни атоми в алкановите молекули са в sp3-хибридизационно състояние. Молекулите на тези вещества са изградени с помощта на ковалентни неполярни C-C (въглерод-въглерод) връзки и слабо полярни C-H (въглерод-водород) връзки. Те не съдържат области с повишена и намалена електронна плътност, лесно поляризуеми връзки, т.е. такива връзки, в които електронната плътност може да се измести под въздействието на външни фактори (електростатични полета на йони). Следователно, алканите няма да реагират със заредени частици, тъй като връзките в алкановите молекули не се прекъсват по хетеролитичен механизъм.